Гистология саркомы мягких тканей
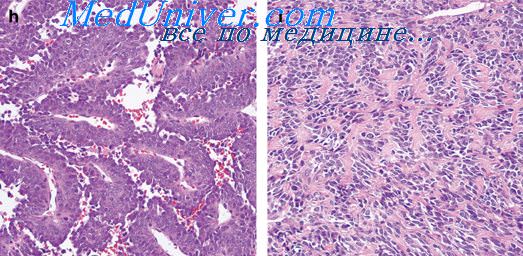
Микроскопически опухоль характеризуется пестротой структуры, различной даже в разных участках одного узла. Содержимое щелей, полостей содержит кислые гликозоаминогликаны, оно ШИК-положительио, дает позитивную реакцию при окраске альциаиовым синим. Отмечается, что щели и полости в опухоли могут быть выстланы синовиоцитами различной формы иногда они уплощены и трудно отличимы от клеток эндотелия, иногда напоминают призматический эпителий, «то создает структуры, трудно отличимые от аденокарциномы, особенно тогда, когда при такой выстилке щели превращаются в аденоподобные трубочки, четко отграниченные от бедной клетками саркомоподобной стромы, которая часто бывает скудной. Важно подчеркнуть в этих случаях отсутствие истинных базальных мембран. Эпителиоидные клетки не всегда только выстилают щели, но могут образовывать солидные пласты, гирляндоподобные структуры, также заключенные в саркомоподобвую строму. Как и в истинном эпителии, в подобных солидных образованиях волокнистые структуры между клетками отсутствуют. Однако между эпителиоидными и саркомоподобными клетками и в этих случаях можно найти переходные элементы.
Подчеркивают обилие в некоторых опухолях гигантских клеток, напоминающих остеокласты, которые особенно часто граничат со щелями или вступают в состав выстилающих их эпителиоподобных клеток О. Geiler (1961), Т. П. Виноградова (1976) подобные опухоли выделяли в особый тип синовиальных сарком. Этой же точки зрения придерживались и мы в 1-м и 2-м изданиях данного руководства.
В настоящее время большинство исследователей отказались от этой точки зрения, считая, что гигантские клетки в синовиальных саркомах не служат показателем особых свойств этих опухолей по сравнению с остальными их типами, являясь аналогом изменений синовиальных клеток в нормальных условиях. Наличие в опухолях гемосидероза, липофагов, миксоматозных, хондроидных, остеогенных очагов является свидетельством происхождения синовиальных сарком из плюрипотентного мезенхимного матрикса. Подчеркивают частоту образования в опухолях и отложения извести, что является одним из диагностических признаков синовиальной саркомы.
Гистологический диагноз синовиальной саркомы и дифференциация ее от других сарком часто очень сложны. Особенно это касается маленьких фрагментов ткани, удаляемых при биопсии,— в этих случаях, не имея данных о структуре опухоли в других участках, часто устанавливают диагноз фибросаркомы, недифференцированной саркомы и даже железистого рака. По тем же соображениям игловая и трепанобиопсия могут не дать точного заключения.
Синовиальную саркому следует дифференцировать от доброкачественной синовиомы, элителноидной саркомы, светлоклеточиой саркомы сухожилий, альвеолярной саркомы мягких тканей, мезотелиомы гемангиоперицнтомы, гемангиоэндотелиомы, фибросаркомы. Подчеркивают относительную диагностическую ценность электронно-микроскопического исследования, необходимость учета гистохимических исследований гомогенных масс секрета, выполняющего щели и полости в опухоли (см выше), а также значение иммуногистохимических данных о структуре цитоскелета со специфическими антисыворотками. Имеет также значение н выявление кератина, который обнаруживается только в эпителиоидных клетках синовиальной саркомы и иногда в некоторых клетках монофазной веретеноклеточной саркомы; в саркомах другого генеза кератин не обнаруживают в соответствии с приведенной выше классификацией Canoso среди злокачественных опухолей синовиальных структур в разделе опухолей спорного и неясного генеза описывает адамантиному длинных трубчатых костей, светлоклеточную саркому сухожилий и апоневрозов и эпителиоидную саркому. Эти опухоли мы опишем в соответствии с их местом в Международной классификации опухолей ВОЗ.
Иной точки зрения придерживается G Gailer (1961, 1984) и некоторые другие исследователи, которые настаивают на существовании доброкачественных сииовиом и, исходя нз классификации Canoso, выделяют две их разновидности доброкачественную синовиому, свободную от гигантских клеток, и доброкачественную гигантоклеточную синовиому, которая в классификации опухолей мягких тканей ВОЗ расценивается как нодулярный теносиновит и не относится к бластомам.
В связи с дискуссионностью вопроса целесообразно отойти от принятого нами принципа точного следования классификации опухолей ВОЗ и рассмотреть данный вопрос в главе, посвященной опухолям.
А. Р. Stout и R. Lattes (1967) включили в одно из своих последних изданий доброкачественную синовиому (синоним — фиброэндотелиома сустава) с оговоркой, что, возможно, это образование не является истинной бластомой.
Саркомами называют опухоли, которые развиваются из клеток предшественниц соединительной ткани — мезодермы. Как и рак, они представляют собой злокачественные новообразования, но с той разницей, что источником раковой опухоли является эпителий, выстилающий внутренние органы и тело человека. Поэтому эти опухоли имеют привязку к конкретному органу, например, рак предстательной железы, рак молочной железы и др. Саркомы же развиваются из соединительной ткани и могут возникнуть в любом органе, где есть такие клетки, то есть фактически везде.
- Виды сарком мягких тканей
- Стадии развития
- Факторы риска
- Симптомы саркомы мягких тканей
- Диагностика саркомы мягких тканей
- Лечение саркомы мягких тканей
- Прогноз выживаемости при саркоме мягких тканей
Виды сарком мягких тканей
Саркома мягких тканей — это собирательный термин, который объединяет большое количество злокачественных опухолей, среди которых наиболее часто встречаются следующие:
- Лейомиосаркома — опухоль из гладкомышечных клеток.
- Рабдомиосаркома — опухоль из поперечно-полосатой мускулатуры.
- Липосаркома — злокачественная опухоль из жировой ткани.
- Ангиосаркома — злокачественное новообразование, произрастающее из ткани кровеносных сосудов.
- Фибросаркома — опухоль из фиброзной ткани.
Также саркомы мягких тканей принято разделять по степени злокачественности. Низкозлокачественные новообразования редко метастазируют, но склонны к упорному рецидивированию. Высокозлокачественные опухоли склонны давать метастазы гематогенным путем (с током крови), лимфатические узлы поражаются реже.
Стадии развития
Стадия саркомы мягких тканей определяется степенью злокачественности опухоли, ее размером и наличием метастазов.
- К 1 А стадии относят новообразования низкой степени злокачественности, размером менее 5 см, без метастазов в регионарных лимфатических узлы и отдаленных органах.
- 1 В стадия — опухоли низкой степени злокачественности, более 5 см без метастазов.
- 2А стадия — новообразования средней степени злокачественности, менее 5 см без метастазов.
- 2В стадия — новообразования средней степени злокачественности, более 5 см в наибольшем измерении, без метастазов.
- 3А стадия — саркомы высокой степени злокачественности, менее 5 см без поражения лимфатических узлов и внутренних органов.
- 3В стадия — саркомы высокой степени злокачественности, более 5 см без метастазов.
- 4 стадия — саркома любой степени злокачественности, любого размера при наличии поражения лимфатических узлов или метастазов во внутренних органах.

Факторы риска
В большинстве случаев, саркомы мягких тканей развиваются спонтанно, т. е. без видимых причин. Однако есть определенные обстоятельства, которые увеличивают вероятность развития данного заболевания:
- Воздействие химических канцерогенов, в частности гербицидов, хрорфенолов.
- Генетическая предрасположенность — нейрофиброматоз, синдром Ли-Фраумени, синдром Гарднера.
- Воздействие ионизирующего излучения, например, прохождение лучевой терапии.
- Иммунодефицитные состояния — иммуносупрессия после трансплантации органов, прохождение химиотерапии, СПИД.
- Некоторые виды сарком мягких тканей могут развиваться на фоне лимфостаза конечности.
Симптомы саркомы мягких тканей
На начальных этапах, саркома мягких тканей проявляется как безболезненная опухоль, которая медленно увеличивается в размерах. Может иметь капсулу, которая, впрочем, не мешает метастазированию. Также опухоль может иметь инфильтративный рост, в этом случае определить ее края проблематично.
При дальнейшем росте, симптоматика будет зависеть от локализации опухоли. Например, при саркомах матки будут кровотечения, при поверхностной локализации опухоль вызывает отечность и боли, при этом нарушается функция пораженного органа, например, руки или ноги.
Диагностика саркомы мягких тканей
В рамках диагностики саркомы мягких тканей проводится физикальное обследование, используются методы медицинской визуализации с последующим проведением биопсии и морфологического исследования полученного материала.
Обязательно проводится КТ или МРТ пораженной области. Во-первых, исследование помогает обнаружить опухоль, а во-вторых проконтролировать радикальность излечения.
Для постановки диагноза обязательно проводится морфологическое исследование фрагмента опухоли. Чтобы его получить, выполняют трепанбиопсию с помощью специальной толстой иглы под контролем УЗИ, или инцизионную биопсию, которая подразумевает хирургическое иссечение фрагмента новообразования. В ряде случаев, для уточнения типа саркомы необходимо более детальное исследование, тогда проводят иммуногистохимические и молекулярно-генетические анализы.
Для того чтобы установить степень распространения опухоли, проводят КТ грудной клетки, брюшной полости, а также ультразвуковое исследование лимфатических узлов.
Лечение саркомы мягких тканей
Выбор метода лечения саркомы определяется степенью ее злокачественности, местом расположения и наличием метастазов. Для лечения низкозлокачественных опухолей, лечение преимущественно хирургическое, в остальных случаях используются комбинированные методы, включающие облучение и химиотерапию.
При хирургическом лечении сарком используются следующие виды операций:
- Широкая местная резекция. Таким способом удаляются низкозлокачественные небольшие новообразования, располагающиеся в коже и подкожной клетчатке.
- Широкое иссечение. При таком вмешательстве саркома удаляется в пределах анатомической зоны, отступая от края новообразования не менее чем на 4-6 см.
- Радикальная органосохраняющая операция. При таком объеме вмешательства удаляется опухоль совместно с мышечными фасциями и неизмененными мышцами, которые отсекаются в месте их прикрепления. При вовлечении в процесс кровеносных сосудов, нервных стволов и костей, производят их резекцию с одномоментной пластикой кожным или кожно-мышечным лоскутом.
- Ампутации или экзартикуляции — удаление конечности или ее вычленение по линии суставной щели. Такие вмешательства проводятся при обширных местно-распространенных высокозлокачественных процессах с вовлечением магистральных кровеносных и нервных стволов на большом протяжении, а также костных структур и мышц.
Во время операции обязательно проводится интраоперационное срочное гистологическое исследование. При наличии злокачественных клеток в краях отсечения и при потенциальной возможности радикального удаления опухоли, выполняют реоперацию.
Лучевая терапия применяется в рамках комбинированного лечения в предоперационном и/или послеоперационном этапе. В первом случае преследуется цель — уменьшение размера саркомы и создание условий для проведения радикального вмешательства. Во втором — уничтожение оставшихся злокачественных клеток. Чтобы воздействие на опухоль было равномерным, используются многопольные методики облучения.
Предоперационная лучевая терапия
При предоперационной ЛТ, границы полей облучения (ПО) должны выходить за размеры ткани опухоли минимум на 3-4 см. Если опухоль имеет большие размеры, производят облучение в пределах 10 см от ее края до достижения суммарной очаговой дозы 45-50Гр. Затем ПО сокращают до размеров новообразования.
Если опухоль располагается на конечности, есть вероятность развития остеолучевого некроза, мышечных контрактур и отеков. Чтобы этого избежать, рекомендуется облучать не более 2/3 окружности конечности, если это возможно. Минимальная толщина необлучаемых тканей в зоне предплечья составляет 2 см, на бедре 4 см, и на голени — 3 см.
Послеоперационная лучевая терапия
Послеоперационная лучевая терапия показана в следующих случаях:
- Высокая степень злокачественности саркомы по данным гистологического исследования.
- Нерадикально проведенная операция — наличие злокачественных клеток в краях отсечения при невозможности проведения реоперации.
- Вскрытие капсулы саркомы во время хирургического вмешательства.
Послеоперационную ЛТ начинают выполнять не позднее, чем через 4 недели после окончания хирургического лечения.
Если предоперацинная ЛТ не выполнялась, поля облучения включают в себя следующие области:
- Ложе опухоли.
- Ткани, которые располагаются на расстоянии 2 см от удаленной опухоли.
- Послеоперационный рубец.
Облучение проводят в суммарной очаговой дозе 60 Гр. Если была проведена нерадикальная операция, дозу увеличивают до 70 Гр. В аналогичном режиме проводят лучевую терапию при невозможности оперативного лечения.
Химиотерапия широко используется для лечения высокозлокачественных сарком мягких тканей. Как и при лучевой терапии, ее могут назначать на дооперационном и/или послеоперационном этапе. Неоадъювантная (предоперационная) ХТ призвана воздействовать на очаг опухоли, уничтожать микрометастазы и создать условия для органосохраняющего хирургического лечения. С этой целью проводят 2-3 курса химиотерапии с перерывом в 3-4 недели.
Послеоперационная ХТ может проводиться для уничтожения микрометастазов или уже визуализируемых метастазов. С этой целью выполняют 3-4 курса лечения. При химиотерапевтическом лечении сарком применяют различные комбинации следующих препаратов:
- Доксорубицин.
- Этопозид.
- Винкристин.
- Ифосфамид.
- Дакарбазин.
- Цисплатин и др.
Схема химиотерапии будет определяться морфологическим вариантом опухоли и ее чувствительностью к ранее проводимому лечению.
Прогноз выживаемости при саркоме мягких тканей
Прогноз выживаемости зависит от многих факторов:
- Степень злокачественности саркомы. Наиболее благоприятное течение у низкозлокачественных сарком без метастазов во внутренних органах и лимфоузлах.
- Размеры опухоли.
- Возможность проведения радикального лечения.
- Возраст больного. Наиболее благоприятные прогнозы у детей. У них полного выздоровления удается достичь в 60% случаев. Наименее благоприятные прогнозы у людей старше 60 лет.
При своевременном лечении начальных стадий низкозлокачественных сарком мягких тканей, удается достичь 5-летней выживаемости у половины больных. При 4 стадии процесса, этот показатель не превышает 10%.
Эффективных методов профилактики саркомы мягких тканей нет. Общие рекомендации являются стандартными — отказ от вредных привычек, ведение здорового образа жизни.
СМОТРЕТЬ ДРУГИЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
Год утверждения 2018
Профессиональные ассоциации
- Ассоциация онкологов России Восточно-европейская группа по изучению сарком Российское общество клинической онкологии
Оглавление
1. Краткая информация
Саркомы мягких тканей – редкая группа злокачественных опухолей, развивающихся из разных типов соединительной ткани.
- предшествующая лучевая терапия
- состояние иммунодефицита
У большинства пациентов специфических этиологических факторов не выявляется.
В России заболеваемость 1,81 случая на 100 тыс. населения.
C49 - Злокачественное новообразование других типов соединительной и мягких тканей
Саркомы мягких тканей
C49.0 - Соединительной и мягких тканей головы, лица и шеи
C49.1 - Соединительной и мягких тканей верхней конечности, включая область плечевого пояса
C49.2 - Соединительной и мягких тканей нижней конечности, включая тазобедренную область
C49.3 - Соединительной и мягких тканей грудной клетки
C49.4 - Соединительной и мягких тканей живота
C49.5 - Соединительной и мягких тканей таза
C49.6 - Соединительной и мягких тканей туловища неуточненной локализации
C49.8 - Поражение соединительной и мягких тканей, выходящее за пределы одной и более вышеуказанных локализаций
C49.9 - Соединительной и мягких тканей неуточненной локализации
8714/3 ПЕКома, БДУ, злокачественная
8825/3 Миофибробластическая саркома низкой степени злокачественности
9137/3 Интимальная саркома
9542/3 Эпителиоидная злокачественная опухоль оболочек периферических нервов
2. Диагностика
Сбор анамнеза у пациента, родителей, родственников.
- начало развития заболевания,
- наличие болевого синдрома,
- изменения функции,
- оценивается влияние клинических проявлений на качество жизни больного.
При подозрении на саркому мягких тканей пациента направляют в специализированное лечебное учреждение онкологического профиля.
- Оценка состояния пораженной области
- Проверка функционирования сустава
- Исключение риска развития патологического перелома
- Оценка периферических лимфоузлов
Гистологическое и ИГХ исследование биопсийного материала определяет тактику лечения и прогноз.
Гистологическое исследование удаленного при хирургическом этапе лечения:
- оценка края резекции,
- лечебный патоморфоз после неоадъювантной ХТ.
Неспецифическая лабораторная диагностика:
- общий анализ мочи,
- общий анализ крови,
- биохимический анализ крови (белок, билирубин, мочевина, креатинин, АСT, AЛТ, ЛДГ, ЩФ, Na+, K+, Са+, Cl-, расширенная коагулограмма.
Рентгенография области поражения и близлежащего сустава в двух проекциях с линейкой.
УЗИ области поражения для оценки объема мягкотканого компонента и связи с магистральными сосудами.
Сцинтиграфия костей с 99Tc для исключения метастатического поражения скелета.
МРТ пораженного отдела скелета оценивает:
- мягкотканый компонент опухоли,
- поражение мышц,
- вовлечение сосудов и нервов,
- распространенность опухолевого процесса.
КТ органов грудной клетки для исключения патологии.
УЗИ органов брюшной полости, забрюшинного пространства, периферических л/у для исключения метастазов и патологии.
При подозрении на диссеминированную саркому кости расширенное обследование:
- Рентгенография костей по очагам накопления 99Tc;
- Цитология пунктата костного мозга из 2-х точек по 3 образца из каждой.
На первом этапе диагностики и лечения - биопсия опухоли:
- до начала лечения выполняется при всех опухолях T2;
- гистологическое исследование саркомы T1 после радикального (R0) удаления;
- проводится под контролем сертифицированного онкоортопеда или радиолога;
- предпочтительна толстоигольная биопсия;
- при невозможности толстоигольной выполняется открытая (инцизионная) биопсия;
- возможно использование эндоскопической техники при процессах в тазу, грудной клетке, брюшной полости.
Консультация кардиолога и невролога:
- перед инструментальной диагностикой под наркозом;
- при подготовке к оперативному вмешательству.
Консультация стоматолога, ЛОР-врача:
- для исключения очагов инфекции;
- для санации перед высокодозной ХТ;
- по показаниям.
Дифференциальная диагностика сарком мягких тканей:
- доброкачественные опухоли;
- метастатические опухоли;
- посттравматические изменения;
- дегенеративно-дистрофические изменения мягких тканей.
3. Лечение
Тактика лечения зависит от:
- возраста пациента
- стадии заболевания
- размера и локализации опухоли
- морфологии и степени дифференцировки опухоли
Комплексное лечение с привлечением:
- морфолога
- лучевого диагноста
- хирурга
- радиолога
- химиотерапевта
- педиатра (при необходимости)
Лечение в крупных онкологических центрах, где рутинно занимаются этой патологией.
- при местно-распространенных саркомах мягких тканей низкой степени злокачественности;
- опухолей G2-3 размером
- обязательный этапом многокомпонентной терапии высокозлокачественных местно-распространенных саркомах.
Стандарт - широкое иссечение опухоли в пределах здоровых тканей:
- с учетом принципов футлярности и зональности;
- минимальный отступ от новообразования 1см;
- удаление опухоли в мышечной фасции или муфте с краем >1-5см;
- минимальный край при стойком анатомическом барьере (мышечная фасция, надкостница, сухожильный конец мышцы);
- краевое иссечение в исключительных случаях.
- основной метод оценки качества хирургического пособия;
- определяются совместно хирургом и гистологом;
- зона и тракт биопсии необходимо включать в объем окончательной хирургии;
- обязательное изучение микроскопического края резекции;
- микроскопически положительный край - показание для реиссечение и/или лучевой терапии;
- разметка ложа опухоли хирургом для определения полей радиотерапии.
Хорошие результаты широких органосохраняющих операций с пред- и/или послеоперационной ЛТ при высокодифференцированных саркомах конечностей.
В отдельных случаях целесообразна интраоперационная ЛТ.
Калечащие операции только при технической невозможности радикальности R0 (R1).
Планирование объема предстоящего хирургического вмешательства с участием:
- онкоортопеда
- нейрохирурга
- пластического хирурга
- микрохирурга
- абдоминального хирурга
- торакального хирурга
- радиолога
- химиотерапевта
Радикальная хирургия первичных сарком мягких тканей до 15% снижает локальный рецидив.
Требования к радикальной хирургии:
- удаление одного или двух мышечно-фасциальных футляров
- резекция магистрального сосудистого пучка
- резекция костных структур
- обширные резекции грудной и брюшной стенки
- резекции структур позвоночного столба
- резекции костей таза и т.д.
Весь объем онкоортопедического хирургического пособия возможен только в крупных саркомных центрах.
Лучевая терапия
Обоснование предоперационного облучения:
Низкозлокачественные саркомы мягких тканей в ранних стадиях:
- Послеоперационная ДГТ, предпочтительны 3-D и интенсивно модулированная (IMRT) ЛТ на ложе удаленной опухоли.
- Отступ от краев 2-3см РОД=2 Гр, СОД=50 Гр.
- При положительном крае удаленной опухоли СОД=65-70Гр.
Высокозлокачественные операбельные саркомы мягких тканей в ранних стадиях:
- Послеоперационная ДГТ, предпочтительно конформная и интенсивно модулированная (IMRT) ЛТ на ложе удаленной опухоли.
- Отступ от краев опухоли 5см РОД=2Гр, СОД=50Гр.
- Продолжение локально на ложе до СОД=60Гр.
- При положительном крае резекции СОД=70Гр.
Интраоперационная ЛТ максимально эффективно подводит необходимую дозу на отдельные зоны операционной раны, особенно у ранее облученных пациентов.
Предоперационная терморадио– или терморадиохимиотерапия при высокозлокачественных условно операбельных или неоперабельных саркомах мягких тканей:
- по схеме ХТ + локальная гипертермия + ДГТ;
- локальная гипертермия СВЧ–, УВЧ– и ВЧ–радиоволны 2 раза в неделю по 60 мин +41-45ºС перед ЛТ;
- предпочтительнее дистанционная конформная и IMRT ЛТ 5 раз в неделю РОД=2Гр, СОД=50Гр;
- после перерыва в 4 недели и положительном эффекте – радикальная операция;
- при полной резорбции, отказе или невозможности операции продолжается терморадио– или терморадиохимиотерапия в том же режиме до СОД=65-70Гр при ЛТ 5 раз в неделю;
- интервал между этапами лечения не более 4 недель;
- при неэффективности, невозможности органосберегающего операции или отказе пациента лечение по схеме 2 этапов терморадио или терморадиохимиотерапии.
При невозможности локальной гипертермии и/или конформной или IMRT ЛТ выполняется конвенциональная 2D ЛТ в тех же режимах.
Химиотерапия
Преимущества предоперационной ХТ при локализованном процессе:
- позволяет уменьшить объем хирургического вмешательства;
- тест чувствительности опухоли к проводимому лечению.
Регионарная гипертермия в дополнение к системной ХТ обеспечивает преимущество в локальном контроле и безрецидивной выживаемости.
- адъювантная ХТ для достижения явного преимущества комбинированного лечения;
- пред- и послеоперационная ХТ за исключением малочувствительных и нечувствительных гистологических подтипов;
- ХТ и/или ЛТ при неоперабельных опухолях;
- изолированная гипертермическая перфузия мелфаланом или регионарная гипертермия с ХТ при опухоли конечности;
- регионарная изолированная гипертермическая перфузия мелфаланом и фактором некроза опухоли - методом выбора при местно-распространенных неоперабельных и/или требующих калечащих вмешательств;
- при местных рецидивах подходы аналогичны местно-распространенному процессу за исключением более широкого использования пред- и послеоперационной химио- и лучевой терапии.
Распространенный опухолевый процесс
ХТ - основной метод лечения.
Стандарт 1 линии ХТ диссеминированных сарком мягких тканей - доксорубицин + ифосфамид.
Для пациентов старше 65 лет метод выбора - монотерапия антрациклинами.
При общем хорошем состоянии комбинированная ХТ предпочтительнее при ожидании выраженного эффекта.
Альтернативная терапия при поверхностных ангиосаркомах - таксаны.
Паклитаксел эффективен при местно-распространенных ангиосаркомах, в том числе ассоциированных с синдромом Стюарта-Тривса.
Трабектедин во 2-й линии и далее:
- липосаркома,
- лейомиосаркома,
- синовиальная саркома,
- экстраоссальная форма саркомы Юинга.
Пазопаниб:
- в 1-й линии химиорезистентных гистотипов альвеолярная, светлоклеточная саркома, солитарная фиброзная опухоль/гемангиоэндотелиом;
- во 2-й линии и далее при большинстве гистологических подтипов;
- не эффективен при липосаркоме и GIST.
Эрибулин при липосаркоме.
Гемцитабин + доцетаксел эффективны во 2-й линии ХТ сарком мягких тканей.
Гемцитабин эффективен при лейомиосаркоме.
Дакарбазин используется во 2-й линии ХТ, более всего в лечении лейомиосаркомы.
Пегилированный доксорубицин эффективен при распространенной саркоме Капоши.
Иматиниб:
- стандарт при дерматофибросаркоме, не подлежащей хирургии или с метастазами;
- мультицентричная форма агрессивного фиброматоза с экспрессией PDGF альфа или бета.
При метастатическом поражении легких целесообразно обсудить возможность оперативного вмешательства:
- метастазэктомия
- повторная торакотомия в комплексе с ХТ
- полное хирургическое удаление метастазов может обеспечить 40% 3-летней выживаемости.
Режимы химиотерапии сарком мягких тканей
Рекомендуемые режимы химиотерапии при лечении больных саркомами мягких тканей [6]
Монотерапия
- Доксорубицин 25 мг/м2 в/в 1 день 1 раз в 4 недели (только для пегилированного).
- Доксорубицин 30 мг/м2 в/в 1-3 дни 1 раз в 3 недели.
- Доксорубицин 60–75 мг/м2 в/в 1 раз в 3 недели.
- Ифосфамид 1,6–2,5 г/м2/сут 5 дней одновременно с месной из расчета 20 % + 100 % от дозы ифосфамида.
- Гемцитабин 1200 мг/м² за ≥ 120 мин 1 и 8 дни каждые 21 день с фиксированной скоростью (только для лейомиосарком матки при невозможности GemTax).
- Трабектедин 1,5 мг/м2 в/в 24-часовой инфузии 1 раз в 21 день при 2-й линии липосарком, лейомиосарком, синовиальных сарком и экстрооссальной формы семейства Юинга.
- Сунитиниб 37,5 мг ежедневно во 2-й линии СМТ, контроль эффективности через 2 месяца.
- Сорафениб 400 мг ежедневно во 2-й линии СМТ, контроль эффективности через 2 месяца.
- Пазопаниб 800 мг ежедневно во 2-й линии СМТ, контроль эффективности через 2 месяца.
- Эрибулин 1,4 мг/м2 в/в 1 и 8 дни интервал 21 день при неоперабельной липосаркоме.
Полихимиотерапия
HD AI длительность цикла 3 недели:
- доксорубицин 75 г/м2 в/в 72-часовая инфузия 1-й день
- ифосфамид 2500 мг/м2 в/в на фоне месны 1000 мг/м² 3 раза в день в 1 – 4 дни
- филграстим 300мкг п/к 5-16 дни.
GemTax длительность цикла 3 недели:
- гемцитабин 900 мг/м2 в/в 90-минутной инфузии 1, 8 дни
- доцетаксел 100 мг/м2 в/в 8 день
- филграстим 300 мкг п/к 9 – 18 дни или до восстановления нейтрофилов.
У ранее леченных ХТ редукция гемцитабина до 675 мг/м2 и доцетаксела до 75 мг/м2.
MAID длительность цикла 4 недели:
- доксорубицин 60 мг/м2 72-часовая в/в инфузия
- ифосфамид 6000 мг/м2 72-часовая инфузия или 2000 мг/м2 в/в 4-часовая инфузия 1 – 3 дни
- месна ОД 7200 мг/м2 96-часовая инфузия
- дакарбазин 900 мг/м2 72-часовая инфузии, растворенный вместе с доксорубицином.
ADIC длительность цикла 4 недели:
- доксорубицин 90 мг/м2 96-часовая инфузия
- дакарбазин 900 мг/м2 96-часовая инфузия, растворенный вместе с доксорубицином
- филграстим 300 мкг 5-14-й дни
Режимы химиотерапии при рабдомиосаркоме
Рекомендуемые режимы химиотерапии при лечении больных рабдомиосаркомой [6]
HD VAI длительность цикла 21 день:
- винкристин ОД 2 мг 1 день
- доксорубицин 75 мг/м2 72-часовая инфузия
- ифосфамид 2,5 гр/м2 в/в 3-часовая инфузия 1– 4 дни на фоне месны 3000 мг/м² в/в 1 – 4 дни;
- филграстим 300 мкг п/к 5 – 14 дни или до восстановления уровня нейтрофилов.
VAC длительность цикла 21 день:
- винкристин 2 мг/м2 в/в 1 день
- доксорубицин 75 мг/м2 в/в 1 день
- циклофосфамид 1200 мг/м2 в/в 1 день
- филграстим 300 мкг п/к 5 – 12 дни или до восстановления уровня нейтрофилов.
IE длительность цикла – 3 недели.
- ифосфамид 1800 мг/м2 в/в 1 – 5 дни на фоне месны 2160 мг/м² в/в 1 – 5 дни
- этопозид 100 мг/м2 1 – 5 дни
ТI интервал 4 недели:
- темозоломид 100 мг/м² 1-5 дни
- иринотекан 250 мг/м² 6-й день.
Таргетные препараты:
- иматиниб 400 мг в день внутрь постоянно при дерматофибросаркоме и агрессивном фиброматозе
- пазопаниб 800 мг ежедневно во 2-й линии СМТ, за исключением липосарком и GIST, контроль эффективности через 2 месяца
- сунитиниб 37,5 мг ежедневно во 2-й линии СМТ, контроль эффективности через 2 месяца.
- сорафениб 400 мг ежедневно во 2-й линии СМТ, контроль эффективности через 2 месяца.
Лечение диссеминированных форм
ХТ - стандарт лечения внелегочных проявлений заболевания.
После эффективной ХТ хирургическое пособие (VAT, торакотомия) при единичных и солитарных очагах увеличивает выживаемость больных.
Возможен хирургический этап при множественных метастазах после длительного положительного эффекта ХТ для дифференциальной диагностики остаточной опухоли и посттерапевтическоого фиброза.
4. Реабилитация
- экзопротезирование после калечащих операций;
- курсы ранней и отсроченной реабилитации после органосохраняющего лечения в специализированных стационарах и центрах реабилитации.
5. Профилактика
Наблюдение после комбинированного лечения:
- каждые 3 месяца в течение первых 2 лет,
- далее раз в 6 месяцев до 5 лет.
- КТ грудной клетки,
- УЗИ области послеоперационного рубца.
Задача наблюдения - раннее выявление прогрессирования заболевания.
6. Дополнительная информация, влияющая на течение и исход заболевания
Неблагоприятные факторы, влияющие на исход лечения:
- инфекционные осложнения;
- патологический перелом;
- развитие анемического, тромбоцитопенического синдромов, требующих трансфузий;
- удлинение интервалов между введениями химиопрепаратов;
- редукция доз химиопрепаратов;
- несоблюдение пациентом рекомендаций.
Критерии оценки качества медицинской помощи
Читайте также:

