Гистологическое заключение рака простаты
- English
- Русский







































Главное меню
- Редакционная коллегия
- Редакционный совет журнала
- Архив
- База авторов
- Порядок рецензирования статей
- Информация для авторов
- Информация для рекламодателей
- Издательский дом
- Политика редакции
- Обратная связь
Главное меню
- Редакционная коллегия
- Редакционный совет журнала
- Архив
- База авторов
- Порядок рецензирования статей
- Информация для авторов
- Информация для рекламодателей
- Издательский дом
- Политика редакции
- Обратная связь
В настоящее время золотым стандартом диагностики рака предстательной железы (РПЖ) является гистологическая оценка биоптатов, полученных при трансректальной тонкоигольной мультифокальной биопсии предстательной железы (ПЖ) под контролем ультразвукового исследования [1,2,3]. Биоптаты ПЖ являются одним из самых сложных материалов для гистологической оценки. Морфологическая идентификация минимального фокуса аденокарциномы представляет значительную сложность в связи с необходимостью дифференциальной диагностики микрофокуса аденокарциномы с большим количеством доброкачественных состояний.
В настоящее время широко распространена биопсия из 10-14 точек [4,5]. В ряде случаев при наличии в анамнезе пациента простатической интраэпителиальной неоплазии или атипической мелкоацинарной пролиферации выполняется сатурационная биопсия ПЖ. Несмотря на то, что накоплен немалый опыт выполнения биопсии ПЖ в некоторых учреждениях биоптаты из левой и правой долей погружаются в два, отдельно маркированных, контейнера. Соответственно, при работе с гистологическим материалом в лаборатории биоптаты из одной доли помещаются в один блок и, таким образом, на микропрепарате оказывается несколько (от 3 и больше) фрагментов ткани ПЖ. Множество столбиков в одной кассете приводит к неравномерной заливке парафином биопсийного столбика и может вызвать потерю значительного количества материала для гистологического исследования и к большому количеству артефактов. Европейской и Американской ассоциациями патологов рекомендовано размещение на микропрепарате не более одного столбика ткани. Это не только позволяет сохранить длину биоптата и свести к минимуму количество артефактов, но и помогает спланировать постановку игл при брахи- и (или) криотерапии, решить вопрос об объеме предстоящей операции или спланировать ход повторных биопсий с прицельным забором большего количества фрагментов 8.
Следующим этапом работы с биопсийным материалом является макроскопическое описание столбиков тканей с последующим формированием патологоанатомического заключения. В мире приняты следующие диагнозы для оценки биоптатов ПЖ [6,7]:
- Аденокарцинома предстательной железы;
- Фокус, подозрительный в отношении аденокарциномы предстательной железы (атипическая мелко-ацинарная пролиферация);
- Простатическая интраэпители-альная неоплазия высокой степени;
- Нет данных за злокачественное образование.
В большинстве случаев злокачественные новообразования ПЖ представляют собой ацинарную аденокарциному. При формировании патологоанатомического заключения описывается длина каждого биоптата и процент протяженности опухоли в каждом из биоптатов; степень дифферен-цировки опухоли по системе градации Глисона; общее количество биоптатов с аденокарциномой; локализация опухоли, согласно схеме, предоставленной урологами; наличие опухоли в пери-простатической жировой ткани; наличие периневральной инвазии.
Протяженность опухолевой ткани в биоптатах подсчитывается в процентах. Расчет заключается в делении общей протяженности пораженной ткани биоптата на общую длину биоптата за исключением длины перипростатической ткани.
В биоптат ПЖ может попасть перипростатическая ткань и ткань семенных пузырьков, что позволяет патологу диагностировать экстрапрос-тическую инвазию и инвазию в семенные пузырьки.
Степень дифференцировки аденокарциномы ПЖ производится согласно шкале Глисона. Основным принципом данной шкалы является просмотр биоптатов под малым увеличением (объективы 4х-10х) с преимущественной оценкой тканевой атипии 14. За редким исключением РПЖ имеет неоднородную структуру [12,13,16,17]. Поэтому для того, чтобы подсчитать показатель Глисона при исследовании ткани ПЖ после биопсии суммируют две наиболее высоких градации, с указанием их процентного соотношения. Полученное число баллов служит важным прогностическим критерием, позволяющим предположить более быстрое прогрессирование заболевания, метастази-рование и снижение выживаемости.
Классификация Глисона остается стандартным подходом в гистологической градации аденокарциномы предстательной железы. Изменения, внесенные в классификацию Глисона в 2004 году, так же учтены и в классификации 2016 года. Существенным дополнением классификации 2016 года явилась рекомендация указывать процент 4 балла в случае суммы баллов 7, а так же введены так называемые прогностические группы.
В 2014 году, международное общество уропатологов (ISUP) модифицировало классификацию Глисона. Основные выводы следующие:
- решетчатые (крибриформные) структуры должны быть отнесены к баллу 4;
- железы с гломеруляциями должны быть отнесены к баллу 4;
- оценка муцинозной аденокарциномы ПЖ должна быть основана на ее основном характере роста.
В прошлом в некоторых случаях крибриформная аденокарцинома была оценена как балл 3, в соответствии с классификацией ВОЗ 2004 года редкие решетчатые железы могли быть оценены как балл 3. Однако последние данные показали, что крибриформная аденокарцинома является независимым фактором прогноза биохимического рецидива после радикальной простатэктомии (РПЭ), метастазирования после РПЭ и раковоспецифической выживаемости 18. Поэтому все крибриформные структуры принято относить к 4 баллу. Еще одним изменением в классификации ВОЗ 2004 года является то, что плохо сформированные железы относятся к баллу 4. В настоящее время балл 4 включает: решетчатые железы, сливающие железы, плохо сформированные железы, железы с гломеруляциями. В рекомендациях 2016 года требуется указывать процент балла 4 при сумме баллов 7 в патологических ответах биопсии ПЖ и в патологических заключениях после РПЭ, в рекомендациях ВОЗ 2004 года, патологические заключения, указывающие балл 4/5, не часто встречались в клинической практике. Указание процента 4 балла может иметь решающее значение в планировании дальнейшего лечения. Так, например, некоторым пациентам с суммой баллов 3+4=7, при низком проценте 4 балла, может быть предложено активное наблюдение. Множество данных, позволяет предположить, что указание процента аденокарциномы таких высоких грейдов как 4 и 5, является важным прогностическим показателем. Однако, метод, который необходимо использовать для определения процентного соотношения, не уточняется.
Недавно был разработан перечень прогностических групп. На конгрессе международного общества уропатологов в 2014 году состоялся консенсус с участием широкого круга патологов и клиницистов, на котором была предложен новый взгляд на использование шкалы Глисона, подразумевающий создание прогностических групп от 1 до 5 на основании суммы баллов градации Глисона и прогноза для пациента:
Группа 1: Сумма баллов, согласно градации Глисона 3+3=6;
Группа 2: Сумма баллов, согласно градации Глисона 3+4=7;
Группа 3: Сумма баллов, согласно градации Глисона 4+3=7;
Группа 4: Сумма баллов, согласно градации Глисона 4+4=8, 3+5=8, 5+3=8;
Группа 5: Сумма баллов, согласно градации Глисона 9-10.
Есть несколько оснований для создания групп: сумма баллов 2 и 5 не используется или используется крайне редко, баллы шкалы Глисона были сформированы достаточно давно с использованием других механизмов, определяющих факторы прогноза. Кроме того, группа 1 обозначает для клинициста и пациента, что сумма баллов 6 является минимально возможной из 6 групп, а не указывает на некую среднюю сумму баллов от 1 до 10. Данное положение является критическим и информирует все заинтересованные стороны, о том, что аденокарцинома ПЖ балл 1 имеет благоприятный прогноз. Таким образом, пациенты из группы 1 с учетом клинических данных (уровень ПСА сыворотки крови, клиническая стадия заболевания, количество опухоли в ткани всех биоптатов ткани ПЖ) могут быть кандидатами на активное наблюдение. Прогностическая значимость пяти групп была подтверждена в крупном исследовании с участием множества институтов. Было исследовано более 20 000 случаев РПЭ, более 16 000 случаев тонкоигольных биопсий ПЖ и более 5000 биопсий с последующей лучевой терапией [21]. Интересно так же, что существуют геномные корреляции в поддержку формирования данной групповой оценки прогноза заболевания [22]. В связи с чем, согласно рекомендациям ВОЗ 2016 г., прогностический балл в патологоанатомическом ответе необходимо указывать наряду с общепринятой градацией по шкале Глисона с учетом ее изменений в 2014 году.
ВЫВОДЫ
1. При выявлении атипической мелкоацинарной пролиферации рекомендовано выполнение повторной биопсии.
2. Сумма баллов по системе градации Глисона 2-4 всегда является заниженной и некорректной. Под этим диагнозом может скрываться аденокарцинома с суммой баллов 6 или аденоз (атипическая аденоматозная гиперплазия). Сумма баллов 5, практически всегда является заниженной и будет выше после радикальной простатэктомии.
3. При нескольких позитивных биоптатах, содержащих различные степени дифференцировки по системе градации Глисона, суммируются две наиболее высокие градации.
4. Средняя длина столбика ПЖ на микропрепарате должна составлять не менее 1 см.
5. Частота диагностики атипической мелкоацинарной пролиферации не должна превышать 5%.
6. Рекомендовано выполнять забор биопсийных столбиков согласно карте биопсии ПЖ, когда каждый биопсийный столбик погружается в отдельный маркированный контейнер.
7. Рекомендовано размещать на одном микропрепарате не более одного столбика ткани.
8. В патологоанатомическом ответе необходимо указывать прогностический балл наряду с общепринятой градацией по шкале Глисона с учетом ее изменений в 2014 году.
Работа выполнена при поддержке РНФ, соглашение № 14-15-01120.
ЛИТЕРАТУРА
1. Rogatsch H, Moser P, Volgger H. Diagnostic effect of an improved preembedding method of prostate needle biopsy specimens. Hum Pathol 2000; 31(9):1102-1107.
2. Delahunt B, Nacey JN. Broadsheet number 45: thin core biopsyof prostate. Pathol 1998; 30:247-256.
3. Ohori M, Kattan M, Scardinio PT. Radical Prostatectomy for carcinoma of the prostate. Mod Pathol 2004; 17(3):349-359.
4. Srigley JR, Jones B, Kapusta L. The effect of specimen submission protocols on the detection rate of histologic abnormalities in sextant prostate biopsies (abstract). Mod Pathol 2001; 14:123.
5. Lane RB, Lane CG, Mangold KA. Needle biopsy of prostate. What constitutes adequate histologic sampling? Arch Pathol Lab Med 1998; 122:833-835.
6. Murthy WM, Ramsey J, Soloway MS. A better nuclear fixative for diagnostic bladder and prostate biopsies. J Urol Pathol 1993; 1:79-87.
7. Boccon-Gibod L, van der Kwast TH, Montironi R, Boccon-Gibod L, Bono A. Handling and reporting of prostate biopsies. Eur Urol 2004; 46(2):177-181.
8. Reyes AJ, Humphrey PA. Diagnostic effect of complete histologic sampling of prostate needle biopsy specimens. Am J Clin Pathol 1998; 109:416-422.
9. Kao J, Upton M, Zhang P, Rosen S. Individual prostate biopsy core (Bc) embedding facilitates maximal tissue representation. J Urol 2002; 168(2):496-499.
10. Brat DJ, Wills ML, Lecksell KL, Epstein JI. How often are diagnostic feartures missed less extensive sampling of prostate needle biopsy specimens? Am J Surg Pathol 1999; 23:257-262.
11. Humphrey P. A. Prostate pathology. Chicago. 2007, 556 p.
12. Coard KS, Freeman VL. Gleason grading of prostate cancer: : level of concordance between pathologists at the University Hospital of the West Indies. Am J Clin Pathol 2004; 122:373-376.
13. Gleason DF. Histologic grading of prostate cancer: a perspective. Hum Pathol 1992; 23:273-279.
14. Cangiano TG, Litwin MS, Naitoh J, Dorey F, deKernion JB. Intraoperative frozen section monitoring of nerve sparing radical retropubic prostatectomy. J Urol 1999; 162(3 Pt 1):655-658.
15. Epstein JI. Pathologic assessment of the surgical specimen. Urol Clin North Am 2001; 28(3):567-594.
16. Humphrey PA. Gleason grading and prognostic factors in carcinoma of the prostate. Mod Pathol 2004; 17:292-306.
17. Gleason DF, Mellinger GT. Prediction of prognosis for prostatic adenocarcinoma by combined histological grading and clinical staging. J Urol 1974; 111 (1):59-64.
18. Kir G, Sarbay BC, Giimiij E, Topal CS. The association of the cribriform pattern with outcome for prostatic adenocarcinomas. Pathol Res Pract 2014;210(10):640-644. doi: 10.1016/j.prp.2014.06.002
19. Dong F, Yang P, Wang C, Wu S, Xiao Y, McDougal WS, et al. Architectural heterogeneity and cribriform pattern predict adverse clinical outcome for Gleason grade 4 prostatic adenocarcinoma. Am J Surg Pathol 2013; 37(12):1855-1861. doi: 10.1097/PAS.0b013e3182a02169.
20. Kweldam CF, Wildhagen MF, Steyerberg EW, Bangma CH, van der Kwast TH, van Leen-ders GJ. Cribriform growth is highly predictive for postoperative metastasis and disease-specific death in Gleason score 7 prostate cancer. Mod Pathol 2015; 28(3):457-464. doi: 10.1038/mod-pathol.2014.116.
21. Epstein JI, Zelefsky MJ, Sjoberg DD, Nelson JB, Egevad L, Magi-Galluzzi C, et al. A contemporary prostate cancer grading system: a validated alternative to the Gleason score. Eur Urol 2016; 69(3):428-435. doi: 10.1016/j.eururo.2015.06.046
22. Rubin MA, Girelli G, Demichelis F. Genomic correlates to the newly proposed grading prognostic groups for prostate cancer. Eur Urol 2016;69(4):557-560. doi: 10.1016/ j.eururo.2015.10.040.
Работа выполнена при поддержке РНФ, соглашение № 14-15-01120.


Результаты гистопатологического исследования позволяют врачу не только подтвердить или исключить рак простаты, но и установить распространенность рака, стадию злокачественного процесса, выбрать тактику лечения и оценить прогноз заболевания. Урологу важно знать точное расположение и распространенность патологического процесса. Эта информация может помочь в принятии решения об объеме оперативного вмешательства на предстательной железе или же определить место биопсии для повторной сайт-специфической биопсии.
Патологические аспекты: число, локализация и длина столбиков ткани простаты Многочисленные исследования, проводимые в США и Европе, подтверждают факт того, что секстантная биопсия простаты нередко дает ложно-отрицательные результаты. Согласно рекомендациям европейской ассоциации урологов в настоящее время проводится биопсия не менее чем из 8 точек, дополнительно проводят забор столбиков ткани из обнаруженных при ультразвуковом исследовании гипоэхогенных зон, расположенных на периферии предстательной железы. Таким образом, при биопсии простаты получают 10 столбиков ткани (секстантная биопсия + по 2 столбика ткани с периферической зоны каждой стороны предстательной железы).

Длина и диаметр столбиков ткани важны для обеспечения достаточного количества биопсийного материала для гистопатологического исследования. Длина и диаметр кусочков ткани напрямую зависят от типа используемых игл и умений оперирующего уролога, тем не менее, минимальная длина столбика ткани должна составлять 15 мм, а диаметр - 2 мм.
Полученный при биопсии материал попадает в лабораторию для гистопатологического исследования. Согласно рекомендациям европейской ассоциации урологов, полученные кусочки ткани с разных участков простаты направляются в лабораторию в отдельных пробирках.
Биопсийный материал подвергается специальной обработке (фиксация, нарезка, окраска), после чего рассматривается врачом-гистологом под микроскопом.

Диагноз
Риск рака простаты
ПИН низкой степени
Согласно рекомендациям европейской ассоциации урологов выделяют:
Риск рака простаты
ПИН высокой степени

Если установлен диагноз аденокарцинома, то должен быть указан гистопатологический тип опухоли (мелкоацинарный, паппилярный и др.), также для клинициста будет важно знать, сколько позитивных столбиков ткани было обнаружено при исследовании и их локализацию. Гистолог должен в миллиметрах указать протяженность и процент (%) опухоли в каждом столбике ткани, что позволит оценить распространенность злокачественного процесса, выбрать тактику лечения и определить прогноз. Согласно данным европейской ассоциации урологов протяженность и процент опухоли, обнаруженной в биопсийном материале, имеют одинаковую прогностическую ценность.
Для интерпретации результатов биопсии простаты рекомендовано использовать индекс Глисона. Шкала Глисона предназначена для стадирования аденокарциномы предстательной железы по результатам гистопатологического исследования. Преимуществом индекса Глисона является то, что он находит распространенное применение во всем мире и обладает высокой точностью и прогностической ценностью, позволяет оценить насколько агрессивно злокачественное новообразование. Клетки рака простаты могут быть высоко-, средне- и низко дифференцированными. Клеточная дифференцировка – термин, обозначающий, насколько раковые клетки отличаются по строению от нормальных клеток при микроскопическом исследовании. Высокодифференцированные раковые клетки – клетки морфологически практически не отличающиеся от нормальных клеток. Опухоли, состоящие из таких клеток, не склонны к быстрому росту и метастазированию. Низко дифференцированные клетки под микроскопом выглядят аномально, а опухоли из таких клеток склонны к быстрому росту и раннему метастазированию.

Патолог при гистопатологическом исследовании оценивает столбики ткани по 5-ти бальной системе от 1 до 5. Низший балл 1 – обозначает наименее агрессивную опухоль, а 5 – наиболее агрессивную. Индекс Глисона получают при сложении баллов двух наиболее распространенных по объему измененных тканей простаты.
Таким образом, результат оценки биопсийного материала по шкале Глисона может выглядеть так:
3+4=7 или 4+5=9 или 5+4=9
Необходимо понимать, что последовательность цифр имеет большое значение и может влиять на выбор и исход лечения. Первая цифра – обозначает превалирующий балл, т.е. изменения ткани предстательной железы, соответствующие данному баллу, занимают более 51% объема морфологического материала. Второй балл характеризует изменения тканей предстательной железы, занимающие от 5% до 50% биопсийного материала. Европейской ассоциацией урологов рекомендовано, не включать в индекс Глисона балл, характеризующий участок опухоли менее 5%. Теперь понятно, что сумма 4+5=9 и 5+4=9 имеют разное значение, и пациенты с индексом Глисона 4+3=7 имеют более агрессивное новообразование.
Таким образом, индекс Глисона варьирует от 2 до 10:
- Индекс Глисона от 2 до 6 означает медленнорастущую высокодифференцированную опухоль, не склонную к быстрому росту и раннему метастазированию.
- Индекс Глисона более 7 характеризует средне дифференцированную аденокарциному.
- 8-10 по шкале Глисона обозначает низко дифференцированную опухоль, характеризующуюся быстрым ростом и ранним метастазированием.
Индекс Глисона менее 4 в заключении по биопсии простаты не указывается.
Реже может использоваться следующая шкала стадирования опухолевого процесса:
GX: стадия не может быть установлена
G1: высокодифференцированные нормальные клетки опухоли (Индекс Глисона от 2 до 4)
G2: средне дифференцированные нормальные клетки опухоли (Индекс Глисона от 5 до 7)
G3: низко дифференцированные опухолевые клетки ( 8-10 по шкале Глисона).
Иммуногистохимия не является рутинным методом исследования и применяется в случае необходимости дифференциальной диагностики. Таким образом, иммуногистохимическое исследование применяется:
- При дифференциальной диагностике аденокарциномы и доброкачественного новообразования имитирующего рак.
- При дифференциальной диагностике низкодифференцированной аденокарциномы и переходно-клеточного рака или рака толстой кишки и др.
Результаты биопсии простаты излагаются врачом-гистологом в специальном заключении гистологического исследования. Европейской ассоциацией урологов разработана специальная сводная таблица, которая должна заполняться врачом при составлении заключения гистопатологического исследования биопсийного материала. Если выявлено злокачественное новообразование, в таблице указывается следующая информация:
- Гистопатологический тип аденокарциномы
- Индекс Глисона
- Локализация и распространенность опухоли
- Состояние хирургического края (край может быть положительным или отрицательным) влияет на вероятность биохимического рецидива опухоли
- Наличие экстрапростратического распространения, его степень и локализация.
- Кроме того указывается наличие лимфоваскулярной или периневральной инвазии.
Для патоморфологического стадирования опухолевого процесса используется система TNM (T-tumor – первичный опухолевый процесс; N – nodes – вовлеченность лимфатических узлов, M – metastasis – наличие метастазов). Упрощенную систему TNM для стадирования рака простаты можно представить следующим образом:

Т1 – опухоль не обнаруживается при ректальном пальцевом исследовании или визуализирующих методах исследований (ультрасонография, компьютерная томография), но при гистологическом исследовании биопсийного материала обнаруживаются раковые клетки;
Т2 – опухоль обнаруживается при пальцевом исследовании и может занимать от одной доли простаты до вовлечения в патологический процесс обеих долей простаты;
Т3 – опухоль прорастает капсулу простаты и/или семенные пузырьки
Т4 – опухоль распространяется на рядом расположенные ткани (но не семенные пузырьки)
N0 – регионарные лимфатические узлы не поражены
N1 – опухолевый процесс захватывает один регионарный лимфоузел, узел в диаметре не более 2 см
N2 – опухоль распространяется на один или более лимфатических узлов, узлы достигают размеров от 2 до 5 см.
N3 – опухолевый процесс поражает регионарные лимфатические узлы, которые достигают размеров более 5 см.
М0 – опухолевый процесс не распространяется за пределы регионарных лимфатических узлов
М1 – наличие метастазов в не регионарных лимфатических узлах, костях, легких, печени или головном мозге.
Таким образом, полученные при гистопатологическом исследовании результаты биопсии простаты позволяют:
- Подтвердить или исключить диагноз рака предстательной железы
- Решить вопрос о назначении повторной биопсии простаты
- В случае диагноза аденокарциномы определить локализацию, распространенность и стадию опухолевого процесса и выбрать тактику лечения
- Составить прогноз заболевания и др.
Для того, чтобы понять, чем чреват для представителя мужского пола рак простаты, целесообразно для начала изучить сам орган и его функции.
Простата или, иначе, предстательная железа, располагается в нижней части таза, ниже мочевого пузыря. Она окружает мочеиспускательный канал, поэтому увеличение размеров при раке простаты почти всегда сказывается на качестве мочеиспускания.
В норме железа имеет округлую форму и размер порядка 3-4 см. В простате выделяют три доли – правую, левую и среднюю.
В мужском организме предстательная железа участвует в продуцировании сперматозоидов и поддерживает их жизнеспособность, помогает выводить сперму, доводит консистенцию эякулята до нужной консистенции за счет собственного секрета, блокирует выход из мочевого пузыря при эрекции.
К сожалению, с возрастом ткань этого органа может качественно меняться. При некоторых сопутствующих обстоятельствах возникает риск развития рака простаты.
Рак предстательной железы
Согласно статистике, рак простаты является одной из наиболее распространенных мужских онкологических патологий. Он находится на четвертом месте после злокачественных новообразований в легких, желудке и на коже.
Подвержены данному заболеванию преимущественно представители негроидной расы. За ними идут европеоиды. А вот азиаты болеют раком простаты намного реже – они в статистике находятся на последнем месте.
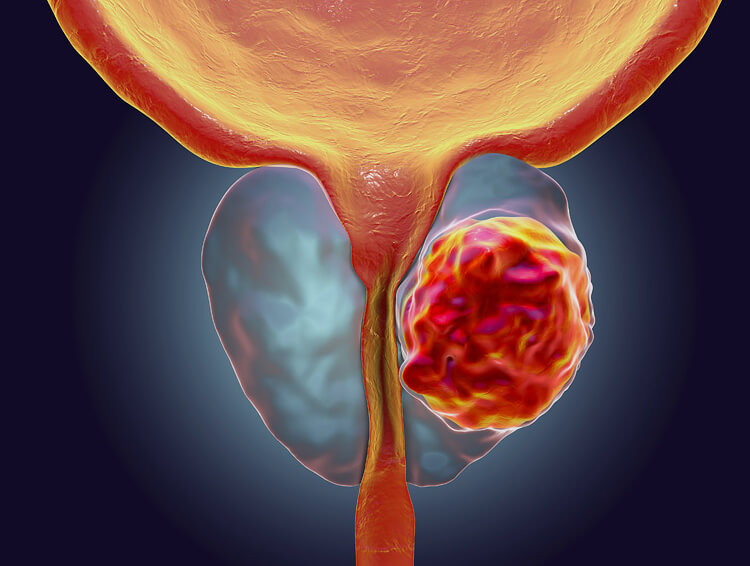
Чаще всего опухоль простаты встречается среди пациентов пожилого возраста – старше 60 лет. В этом возрасте болезнь обнаруживается у каждого сотого представителя мужского пола. Нередко заболевание диагностируют у мужчин в возрасте от 40 до 60 лет – примерно у 1 из 10 тысяч. Результаты обследований пациентов младше 40 лет не выявляют значительного количества заболевших в этой возрастной категории. А вот среди мужчин старше 75 лет рак простаты находят у каждого восьмого.
В международном классификаторе болезней МКБ-10 рак предстательной железы кодируется как С61.
Как возникает рак предстательной железы? В норме жизнеспособные клетки растут и по мере необходимости делятся, образуя дочерние. Постепенно они отживают свое и отмирают. Новые подросшие клетки заменяют старые изношенные. Такой процесс проходит в организме непрерывно, обеспечивая безотказное выполнение органом возложенных на него функций. Процесс отмирания и распада называют апоптозом.
Иногда клетки, из которых состоит ткань простаты, начинают размножаться бесконтрольно и при этом утрачивают способность к апоптозу. Постепенно они могут проникать в другие органы и ткани, нарушая процессы жизнедеятельности организма. При обнаружении этого состояния у пациента можно говорить о раке предстательной железы, конечно, после проведения тщательной диагностики и исключения других заболеваний, обладающих сходной симптоматикой.
Поскольку рак простаты является злокачественным новообразованием, прогнозы и последствия в отношении этой патологии схожи с прогнозами и последствиями для других онкологических процессов. Это, в частности:
- ухудшение качества жизни пациента;
- вероятность рецидива – повторного роста опухоли простаты после ее удаления;
- проникновение клеток в соседние органы и ткани, а также в кровеносную и лимфатическую системы. Такой процесс называется метастазированием;
- риск летального исхода. Хотя онкология простаты считается медленно растущей и не всегда бывает агрессивной, рано или поздно она может привести к смерти больного.
На сегодняшний день причины возникновения рака простаты достоверно не известны. По результатам научных исследований можно выделить лишь определенные факторы риска. При неблагоприятном стечении обстоятельств заболевание с большей вероятностью возникнет у пациентов с такими факторами, нежели у представителей сильного пола, не обремененных ими.
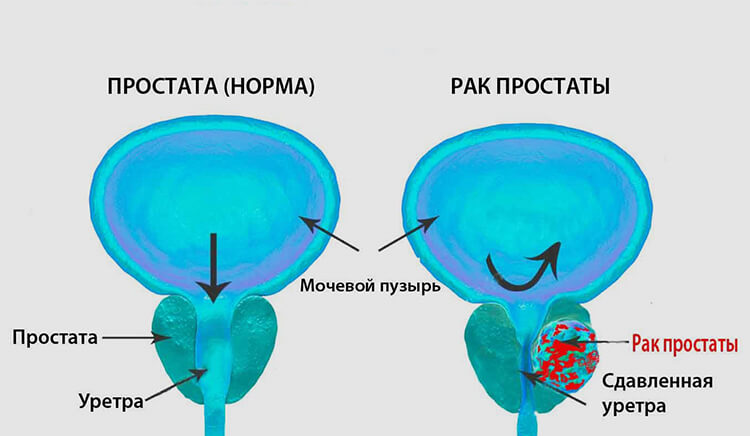
Итак, условными причинами рака простаты у мужчин считаются:
- возраст. Как уже было сказано ранее, вероятность онкологии простаты возрастает по мере увеличение возраста;
- наследственность. Отмечена некоторая взаимосвязь в этом направлении. Если в семейном анамнезе у близких родственников (отца, деда, брата) подобный диагноз присутствовал, мужчине следует быть особенно внимательным к состоянию своей предстательной железы;
- рацион питания. Отмечено, что рак простаты чаще возникает у пациентов, предпочитающий животные жиры и красное мясо, нежели у тех, кто значительную долю своего меню оставляет под фрукты, овощи, цельные крупы и жиры растительного происхождения;
- эндокринное происхождение рака предстательной железы, связанное с физиологическим возрастным снижением интенсивности синтеза мужских половых гормонов, поддерживается рядом специалистов;
- нерегулярная половая жизнь. Она провоцирует застойные явления в тазовой области и может со временем привести к возникновению неконтролируемого клеточного процесса, а значит, и рака простаты. К подобным последствиям приводит и многолетний малоподвижный образ жизни;
- некоторые инфекции. Ретровирус, цитомегаловирус, герпес второго типа могут спровоцировать развитие онкологического процесса в предстательной железе.
Кроме того, хоть и не являются непосредственными причинами рака простаты у мужчин, но относятся к факторам риска: инфекции, передающиеся половым путем, курение и злоупотребление алкоголем, интоксикация кадмием на вредных производствах, стрессы и хронические патологические процессы в организме, приводящие к снижению иммунитета, а также простатит и аденома простаты, особенно, не леченные должным образом.
Чтобы определить форму опухоли простаты, при диагностике специалисты часто пользуются гистологической классификацией В. Л. Бялика. Согласно этой классификации, рак простаты подразделяют на:
- полиморфноклеточное озлокачествление, при котором обнаруживается значительное количество делящихся клеток разных форм и размеров;
- анапластическую аденокарценому – при таком раке простаты меняется внутриклеточная структура, а сами клетки приобретают атипичные формы;
- солидный рак – характеризуется наличием целых пластов видоизмененных клеток. Эти пласты разделяются между собой тонкими прослойками соединительной ткани;
- скиррозную форму, при которой в опухоли присутствует больше соединительной ткани, нежели злокачественных клеток, что обуславливает ее фиброзную консистенцию;
- аденокарционму – рак предстательной железы, сформировавшийся из железистого эпителия. Аденокарцинома является наиболее часто встречающейся онкопатологией простаты – до 95% всех диагностированных случаев;
- плоскоклеточный рак, развивающийся из плоского эпителия;
- тубулярный – стартовавший из узких каналов;
- альвеолярный – образовавшийся в концевых отделах желез.
Чаще всего рак простаты у мужчин возникает в периферических долях предстательной железы. На среднюю долю приходится не более 10% всех выявленных случаев.
Дабы грамотно выстроить эффективную стратегию лечения, важно во время обследования правильно определить стадию рака простаты пациента. При ее установлении учитываются размер новообразования, наличие и степень распространенности на другие органы и ткани, а также уровень простат-специфического антигена (ПСА) в крови больного.
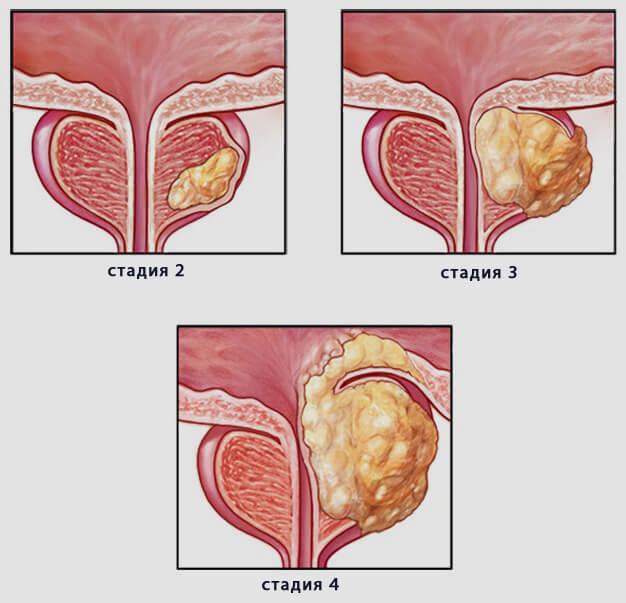
Исходя из вышесказанного, выделяют следующие стадии рака предстательной железы:
- стадия I. Опухоль небольшого размера, сложно прощупывается при ректальном исследовании, локализована исключительно в пределах простаты. Уровень ПСА – менее 10 нг/мг;
- стадия II. Образование более крупное, его можно выявить в процессе ректального исследования. На этом этапе опухоль простаты все еще не выходит за пределы предстательной железы. Уровень ПСА в крови превышает 10 нг/мг, но не достигает 20 нг/мг;
- стадия III. Рак простаты распространяется на соседние доли железы и за его пределы, на ближайшие органы – мочевой пузырь, прямую кишку, семенные пузырьки. Уровень ПСА на этой стадии – более 20 нг/мг. Верхнего предела не существует;
- стадия IV. Опухоль простаты затрагивает лимфоузлы, может распространиться на отдаленные органы, кровеносную и костную системы. Эта стадия характеризуется неконтролируемым уровнем ПСА. Кроме того, именно на четвертой стадии пациент начинает ощущать выраженную симптоматику заболевания.
Первые две стадии рака простаты относят к ранним, третью и четвертую – к поздним. С учетом этого разработается и тактика дальнейших действий. Для ранних стадий она, в зависимости от обстоятельств, может быть выжидательной либо лояльной. Поздние же стадии рака предстательной железы требуют интенсивной терапии, а иногда – и оперативного вмешательства.
Существует и другая система стадирования заболевания – более подробная. При определении стадии рака простаты классификация ТНМ предлагает ориентироваться на три фактора, отраженные в аббревиатуре названия.
Т – tumor: опухоль, новообразование, его размер по отношению к предстательной железе, месторасположение и степень распространения.
N – nodus: лимфатические узлы и их уровень поражения раком простаты.
M — metastasis – метастазы: отсутствие, наличие, количество и месторасположение метастаз в органах и тканях.
Для максимально точной диагностики рака предстательной железы рекомендуется использовать одновременно несколько методик.
Читайте также:

