Гиперхромные ядра при раке
Саркома молочной железы
Помимо листовидной цистосаркомы в молочной железе могут возникать и другие виды саркомы: ангиосаркома, стромальная саркома, липосаркома, лимфосаркома и пр.
Неинфильтрирующий дольковый (альвеолярный, ацинарный, carcinoma in situ) рак молочной железы
При цитологическом исследовании пунктата или отпечатка удаленной доброкачественной опухоли обнаруживаются крупные атипичные клетки округлой формы с большим светлым или гиперхромным ядром и умеренно широкой цитоплазмой. Располагаются клетки раздельно и небольшими группами.
Неинфильтрирующий внутрипротоковый рак молочной железы
Неинфильтрирующий внутрипротоковый рак характеризуется наличием умеренно полиморфных клеток средней величины с крупным гиперхромным ядром. Располагаются клетки раздельно, скоплениями в виде сосочковидных образований с нарушением полярности клеток.
Инфильтрирующий рак молочной железы
Гистологически различают три степени злокачественности инфильтрирующего рака.
Инфильтрирующий рак I степени злокачественности в большинстве случаев представляет собой аденокарциному.
Микроскопически пунктат опухоли характеризуется наличием сравнительно однотипных круглых клеток преимущественно среднего размера с крупными, эксцентрически расположенными гиперхромными ядрами. Цитоплазма клеток мелкозернистая либо с более крупными гранулами, напоминающими таковые в апокринных клетках. Располагаются клетки раздельно, большими скоплениями, а также группами в виде железистоподобных и сосочковидных структур.
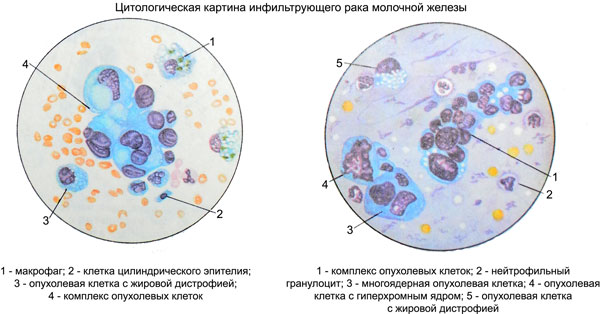
Клетки в цитологических препаратах разные по размеру, полиморфные, с большими гиперхромными, часто пузырьковидными ядрами, содержащими крупные нуклеолы. Цитоплазма клеток сравнительно широкая, негомогенная, нередко с признаками секреторной активности, не всегда четко контурированными краями.
При фиброзном раке (скирре) в цитологических препаратах обнаруживаются небольшие опухолевые клетки с крупным гиперхромным ядром без ядрышек и узким ободком базофильной цитоплазмы. Признаки секреции отсутствуют. Располагаются клетки раздельно, в виде небольших групп и в тканевых клочках.
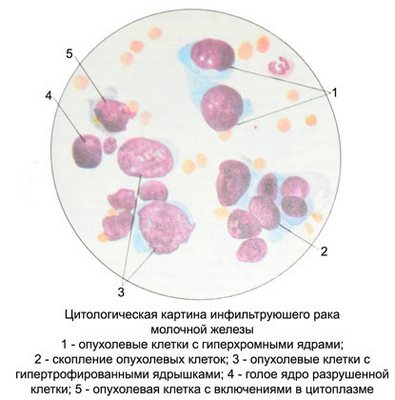
В цитологических препаратах обнаруживаются клетки с резко выраженными признаками злокачественности. Величина и форма клеток различны, часто встречаются крупные и даже гигантские клетки с большими светлыми или гиперхромными, неправильной формы ядрами, содержащими значительное количество крупных ядрышек. Возможно наличие двух- и многоядерных клеток. Много клеток в состоянии патологического митоза. Цитоплазма клеток различной ширины, часто обильная, гомогенная или мелкозернистая.
Располагаются клетки раздельно, скоплениями, группами, иногда в виде синцитиев и симпластов.
В случаях инфильтрирующего рака молочной железы всех степеней злокачественности отмечается лимфоид- ная и плазмоклеточная инфильтрация, наиболее выраженная при раке III степени злокачественности.
Особые гистологические варианты рака молочной железы
Соскоб и пунктат обильные, отпечатки опухоли сочные. Цитологическая картина мономорфная. Преобладают атипичные полиморфные клетки эпителия округлой формы с круглым ядром, расположенным центрально или эксцентрически. Хроматин ядер мелкозернистый или тяжистый, равномерный.
Гиперхромия ядер не выражена, ядрышки небольшие, единичные или множественные. Цитоплазма эпителиоцитов имеет вид узкого ободка с неровными контурами. Располагаются клетки разрозненно, но густо, многоклеточных структур не образуют. Встречаются скопления с беспорядочным нагромождением клеток, многочисленные клетки в состоянии митоза, единичные макрофаги, фибробласты, фиброциты, лимфоциты.
Большое количество лимфоцитов наблюдается при опухолях с лимфоидной стромой, характеризующихся более благоприятным прогнозом. Однако при пункции игла может попасть в лимфатический узел, и в этом случае лимфоциты в препарате не имеют отношения к опухоли.
Пунктат опухоли серозно-кровянистый, с мелкими сероватыми клочками. На фоне бесструктурных масс, фрагментов ядер и цитоплазмы разрушенных клеток, среди макрофагов, гистиоцитов, нейтрофильных гранулоцитов и лимфоцитов обнаруживаются мономорфные атипичные клетки (небольшие, средние, изредка большие) с интенсивно окрашенными полиморфными ядрами, имеющими неровные контуры. Ядрышки не просматриваются. Цитоплазма базофильна. Располагаются клетки преимущественно в виде сосочковидных комплексов, нередко имеющих причудливую форму, и разрозненно. В клетках, расположенных разрозненно и по периферии комплексов, выражены жировая дистрофия и вакуолизация.
Аспирационный материал и соскоб опухоли слизистого характера. При микроскопическом исследовании на фоне бледноокрашенных (по Паппенгейму) в синевато-серый цвет слизистых масс обнаруживаются однородные по структуре, атипичные мелкие, средние и большие клетки эпителия с эксцентрично расположенным, преимущественно бобовидной и серповидной формы, ядром и обильной цитоплазмой. Такие клетки напоминают пролиферирующий эпителий.
Они интенсивно окрашиваются, границы между ядром и цитоплазмой у них часто смазываются. Границы между клетками нечеткие. Располагаются атипичные клетки разрозненно, в виде небольших скоплений и железистоподобных групп. В небольшом количестве встречаются низкодифференцированные атипичные клетки, лимфоциты, иногда обрывки капилляров.
Соскоб и пунктат, как правило, слизистого характера. При микроскопическом исследовании на фоне слизистых масс (иногда слизь отсутствует) обнаруживаются однородные атипичные клетки больших и средних размеров, округлой формы. Эксцентрично расположенные ядра бобовидной, овальной и иногда круглой формы имеют вогнутость, окрашиваются гиперхромно.
Цитоплазма обширная, бледная, базофильная, окрашена неравномерно, границы ее часто нечеткие. Наружный слой цитоплазмы более светлый, незаметно сливается с фоном препарата. Преобладают атипичные перстневидные клетки с ядром, смещенным к периферии, и обширной бесцветной цитоплазмой, заполненной вакуолью. В перстневидных клетках, выделяющих слизь, иногда можно обнаружить отторжение части цитоплазмы. Располагаются перстневидные клетки разрозненно и скоплениями, нередко в виде тяжей.
Исследованию подвергаются соскобы, взятые с поверхности экземоподобноизмененной кожи соска молочной железы, представляющие собой хлопьевидные или пластинчатые суховатые тканевые клочки. Иногда исследуются пунктаты из уплотненных участков соска или околососкового кружка, отпечатки с эрозированной или язвенной поверхности соска и выделения из соска, которые появляются при более значительном распространении опухолевого процесса в глубь железы.
Пунктаты, как правило, кровянистого характера, с сероватыми тканевыми клочками, а выделения различные: серозные, кровянистые, гнойные.
При микроскопическом исследовании на фоне нейтрофильных гранулоцитов, лимфоцитов, плазматических клеток, гистиоцитов, макрофагов, полибластов, фибробластов, фиброцитов и мелкозернистого детрита (при сопутствующем воспалении), а также клеток многослойного плоского эпителия с укрупненными ядрами обнаруживаются светлые однотипные атипичные большие и гигантские клетки плоского эпителия неправильно-округлой, овальной, полигональной формы с четкими контурами.
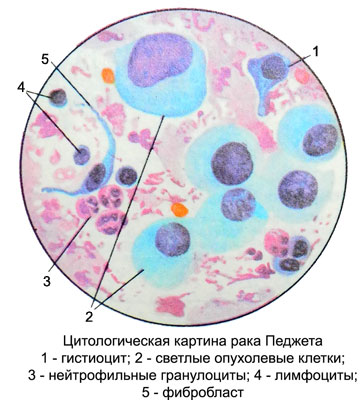
Ядра крупные, светлые, круглые или овальные, располагаются в клетке центрально или эксцентрично. Хроматин мелкоточечный, распределен равномерно. В большей части ядер имеется по 2—3 гипертрофированных ядрышка. Цитоплазма умеренно выраженная или обильная, светлая, бледная, базофильная, мелкозернистая. Часто вокруг ядра она окрашена интенсивнее, чем по периферии клетки. Контуры цитоплазмы волнистые, нередко нечеткие. Иногда в ней наблюдаются явления дистрофии (жировой, вакуольной). Располагаются клетки раздельно и небольшими пластами.
В выделениях из соска и в пунктатах опухоли молочной железы, чаще всего кровянистого характера с мельчайшими тканевыми клочками, могут быть выявлены элементы плоскоклеточного рака всех трех степеней зрелости (высокодифференцированного, умеренно дифференцированного и низкодифференцированного). Атипичные клетки плоскоклеточного рака молочной железы не отличаются от клеток плоскоклеточного рака другой локализации.
Для плоскоклеточного рака часто характерны выраженные дистрофические изменения (вакуолизация, жировое перерождение, распад клеток). Нередко фон препарата составляют элементы крови (эритроциты, нейтрофильные гранулоциты, лимфоциты), а также клетки стромы (гистиоциты, фиброциты, фибробласты и пр.), мелкозернистый детрит.
Апокринный рак относится к опухолям высокой степени злокачественности с низкой дифференциацией клеток паренхимы, сохраняющих способность к апокринизации, по которой он сравнительно легко распознается. В выделениях или пунктатах молочной железы на фоне зернистых бесструктурных масс распадающихся клеток обнаруживаются атипичные, светлые, крупные клетки эпителия округлой, призматической или кубической формы.
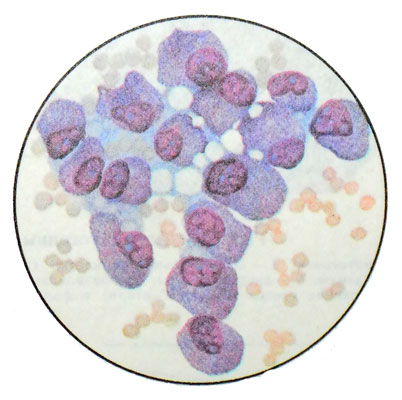
Ядра различной величины, преимущественно округлые или полиморфные, с грубым глыбчатым хроматином, расположены в клетке эксцентрически и занимают большую ее часть. Они содержат гипертрофированные полиморфные ядрышки. Цитоплазма клеток обильная, светлая, неравномерно окрашенная, со светло-голубыми, сиреневато-серыми и розовыми участками, содержит азурофильные гранулы, которые распределяются в цитоплазме неравномерно или собраны в апикальной части. Могут быть клетки без гранул. Границы клеток нечеткие, часто сливаются с фоном препарата. Встречаются клетки с отторгающейся апикальной частью цитоплазмы.
В молочную железу нередко метастазируют самые разнообразные опухоли, цитограммы которых мало отличаются от цитограмм первичных опухолей молочной железы. Происхождение метастазов можно установить в тех случаях, когда метастазирующая опухоль (пигментная меланома, первичный рак печени, рак почки, семинома, высокодифференцированный рак щитовидной железы и др.) сохраняет секреторную активность или другие признаки, позволяющие ее дифференцировать.
Если метастатической опухоли сопутствуют воспалительные или гиперпластические процессы в молочной железе, то цитологический диагноз значительно усложняется, так как в препаратах появляется большое количество элементов воспаления и измененных клеток эпителия молочной железы в состоянии пролиферации, метаплазии и дистрофии, с которыми не всегда легко дифференцировать клетки рака.
Гистологическая дифференцировка рака молочной железы
Гистологическую градацию рака молочной железы (РМЖ) впервые ввел R.B. Greenough из Бостона, который в 1925 г. опубликовал анализ 73 случаев РМЖ.
Несмотря на то что прошло много времени и опубликовано большое количество работ о применении гистологической градации рака молочной железы, ничего существенного не добавлено в перечень морфологических критериев, которые определяют группы РМЖ, имеющие клиническое значение.
Работа R.B. Greenough актуальна и сегодня, он сформулировал прогностически значимые категории инвазивного рака молочной железы низкой, средней и высокой степени злокачественности.
Это деление базируется на 5 признаках:
1) тканевой (гистологической) организации опухоли, то есть способности образовывать дольки, протоки и железистоподобные структуры;
2) степени секреторной активности, которая подтверждается цитоплазматическими вакуолями, капельками муцина в просвете желез;
3) клеточной атипии, то есть единообразии или вариации размеров и формы клеток, соотношении размеров ядра и цитоплазмы;
4) наличии гиперхромных ядер;
5) наличии ядерной атипии и количества митотических фигур.
В соответствии с градациями по Greenough типы рака высокой степени злокачественности имеют клетки и ядра неправильной формы и различного размера, без секреторной функции, клетки расположены столбцами, отмечают гиперхроматоз ядер и большое количество атипичных митозов.
И наоборот, опухоли, состоящие из желез, построенных из единообразных по размеру и строению клеток без гиперхроматоза, с малым количеством митозов, следует относить к РМЖ низкой степени злокачественности.
По данным R.B. Greenough, после радикальной мастэктомии пациентки с раком низкой степени злокачественности были излечены в 68%, умеренной — в 33% случаев и нулевым был результат при высокой.
В 1928 г. Patey и Scarff из Лондона опубликовали анализ 50 случаев рака молочной железы. Они изучили корреляцию между гистологической градацией по Greenough, статусом лимфатических узлов и выживаемостью пациенток. Выявлено, что пациентки с раком низкой степени злокачественности после радикальной мастэктомии излечивались в 85%, средней степени — в 45% и высокой — в 23% случаев.
Кроме того, авторы отметили, что прогноз течения заболевания всегда хороший при отсутствии метастазов в лимфатических узлах, изъязвления опухоли и распространения ее на фасции независимо от гистологической степени злокачественности по Greenough.
Они также сделали заключение, что в случаях нераспространенного РМЖ более продолжительный период ремиссии, то есть период до появления метастазов или рецидивов после радикальной мастэктомии, у пациенток с опухолью низкой степени злокачественности по Greenough, а в случаях распространенного рака — более эффективна паллиативная терапия.
Последующая работа H.J.C. Bloom из Лондона, опубликованная в 1950 г., подтвердила выводы Patey и Scarff. В классическом труде Bloom-Richardson, опубликованном в 1957 г., окончательно сформулированы критерии гистологической градации РМЖ. В своей работе они проанализировали течение болезни 1409 пациенток, из которых 359 прожили более 15 лет.
Подобно R.B. Greenough, исследователи разделили рак молочной железы (РМЖ) на 3 категории, базируясь на трех показателях:
1) относительном количестве тубулярных структур;
2) наличии вариаций размеров клеток рака;
3) количестве гиперхромных ядер и фигур митоза.
Каждый из этих показателей авторы оценили в баллах (1, 2 или 3 балла). Суммируя количество баллов, получим возможные комбинации от 3 до 9. Наименьшее количество баллов соответствует наиболее низкой степени злокачественности рака молочной железы.
Авторы разделили шкалу злокачественности на три части: 3, 4 или 5 суммарных баллов — низкая степень злокачественности (grade 1); 6 или 7 суммарных баллов — средняя (grade 2); 8 или 9 — высокая (grade 3). Эта схема стала наиболее популярной в мире и называется схема градации РМЖ по Bloom-Richardson или технология Scarff-Bloom-Richardson, хотя должна была называться техникой градации по Greenough, в честь человека, впервые опубликовавшего эту градацию в 1925 г.
Bloom и Richardson установили, что 26% из 1409 исследованных случаев РМЖ имели 1-ю степень гистологической злокачественности, 45% — 2-ю, 29% — 3-ю. Результаты сравнения гистологических степеней злокачественности первичной опухоли и метастазов в аксиллярных лимфатических узлах показали, что в 82% степени совпадали.
В 12% случаев степень злокачественности была выше, а в 6% — ниже в метастазе, чем в первичной опухоли. Авторы выявили, что степень гистологической злокачественности, как и статус регионарных лимфатических узлов, дает независимую прогностическую информацию (табл. 2).
Таблица 2. Выживаемость пациенток с РМЖ в соответствии с градационной схемой Bloom-Richardson (исследованы 1409 пациенток). 
Bloom и Richardson пришли к выводу, что степень гистологической злокачественности рака молочной железы отражает предполагаемое клиническое течение заболевания и вероятность развития метастазов в дальнейшем, что стало в свое время очень прогрессивным учением.
Очевидно, что степень гистологической дифференцировки имеет корреляцию с темпами роста опухоли и соответственно показателями S-фазы митотического цикла (ЗН-тимидина, Ki67), показателями анеуплоидии, экспрессией С-егВ-2, рецепторов эстрогена и прогестерона.
Важность этого показателя очевидна, однако в ряде публикаций гистологическое стадирование подвергается жесткой критике из-за трудности, возникающей при его воспроизводимости. Отмечают, что процент расхождения в оценке гистологической дифференцировки иногда составляет 50-60%.
Однако когда критерии оценки гистологической степени злокачественности оценивают профессионально и тщательно, совпадение результатов этой оценки составляет 90%.
H.F. Frierson и соавторы прорецензировали патологоанатомические заключения 7 патологоанатомов, проводивших исследование 75 случаев инвазивного протокового РМЖ. Совпадение при оценке гистологической структуры составило 71%, тубулярных структур — 81%, полиморфизма ядер — 64%, митозов — 67%.
C.W. Elston рекомендует проводить двойное исслeдoвание. Это возможно при проведении исследования двумя патологами или одним патологом дважды на разных образцах.
Следующим недостатком предложенной Bloom и Richardson системы градаций РМЖ стало то, что большая часть пациентов относится к 2-й и 3-й степени градации. С .W. Elston, используя модифицированную систему гистологической градации Bloom и Richardson, исследовал рак молочной железы у 1831 пациентки с периодом наблюдения 16 лет и диагностировал 1-ю степень гистологической дифференцировки рака в 18%, 2-ю — в 34%, 3-ю — в 47% случаев.
Автором отмечена очень выраженная корреляция с клиническим прогнозом. У пациенток с раком 1-й степени злокачественности значительно лучшая выживаемость, чем со 2-й и 3-й степенью (р
План лечения составляют с учётом стадии опухолевого процесса, морфологической структуры опухоли, возраста больной, сопутствующих заболеваний, общего состояния пациентки. Применяют следующие методы лечения: хирургический, комбинированный (сочетание операции с лучевой или лекарственной терапией) и ком.
По данным многочисленных публикаций, этиология и патогенез РМЖ сложны и определяются сочетанием многих факторов. Гормональная регуляция функции молочных желез значительно сложнее, чем эндометрия. Помимо эстрогенов и прогесторона, развитие молочных желез в пубертатном периоде, их функция во время бер.
Гистологическую градацию рака молочной железы впервые ввел R.B. Greenough из Бостона, который в 1925 г. опубликовал анализ 73 случаев рака молочной железы. Несмотря на то что прошло много времени и опубликовано большое количество работ о применении гистологической градации рака молочной железы, ниче.
При анализе данных, получаемых с помощью ультразвукового исследования, целесообразно выделить ряд диагностических задач, решение которых позволит получить полный комплекс эхографических признаков рака молочной железы и метастатических лимфатических узлов, по которым в дальнейшем будет производиться .
Патологические процессы в молочной железе отличаются многообразными клиническими проявлениями, что норой создает серьезные дифференциально-диагностические трудности. Для гипеколога важнее всего заметить (не пропустить!) патологию молочных желез, что приведет в движение систему методов уточня.
Доброкачественные изменения молочных желез относятся к наиболее распространенным заболеваниям и включают различные по клиническим, морфологическим и этиологическим признакам процессы. Отличительной особенностью молочной железы является сложность четкой дифференцировки физиологических и патологически.
Рак молочной железы развивается из эпителия млечных протоков и альвеол. Патоморофологическая характеристика рака молочной железы включает такие параметры, как размер первичного очага, его локализацию в молочной железе, тип роста, морфологическое строение, степень дифференцировки, наличие регионарных.
Учебная медицинская литература, онлайн-библиотека для учащихся в ВУЗах и для медицинских работников
Злокачественная опухоль — новообразование, характеризующееся агрессивным течением, общим неблагоприятным влиянием на обменные процессы в организме, способностью рецидивировать и давать метастазы.
Классификация.
По степени дифференцировки различают злокачественные опухоли:
- высокодифференцированные, то есть максимально приближающиеся по гистологической картине к строению нормальной ткани,
- среднедифференцированные,
- низкодифференцированные.
Злокачественные опухоли бывают:
- солидными (с наличием опухолевого узла),
- диффузными, к каковым относятся лейкозы.
Чем ниже дифференцировка, тем хуже прогноз. Опухоли, клетки которых утрачивают всякое сходство с теми или иными нормальными клетками, в результате чего при световой микроскопии невозможно определить ткань, из которой они происходят, называются анапластическими.
В отношении конкретной злокачественной опухоли клиницистов интересуют два аспекта: степень ее злокачественности по гистологическим признакам (grade) и ее стадия по распространенности за пределы первичного узла (stage).
Злокачественные эпителиальные опухоли обозначают термином “рак” (син.-карцинома). Злокачественные опухоли из тканей мезенхимального происхождения обозначают термином “саркома”.
Раки делятся на:
- неинвазивные (син.- рак на месте, carcinoma in situ),
- не прорастающие за пределы базальной мембраны,
- инвазивные, то есть с разрушением базальной мембраны.
Если лечение начинается, когда рак уже оказывается инвазивным, прогноз значительно хуже.
По соотношению эпителиального и стромального компонентов раки также делятся на
- мягкие (син.- медуллярный рак, рак-мозговик), в которых строма развита слабо, и
- плотные (син. — скиррозные), в которых строма преобладает над собственно опухолевой тканью.
Встречаемость.
Злокачественные опухоли, к сожалению, — явление распространенное. Вероятность их возникновения в организме резко увеличивается с возрастом. Частота тех или иных злокачественных опухолей сильно варьирует не только в разных странах, но даже в разных районах одной и той же области.
Условия возникновения.
Условием развития злокачественных опухолей является утрата организмом контроля за постоянством антигенного состава и его неспособность элиминировать и предотвращать размножение атипичных клеток-мутантов.
Механизмы возникновения.
Иммунитет — это не только невосприимчивость к инфекции, как это рассматривалось раньше, но более широкое понятие, включающее контроль за антигенным постоянством внутренней среды организма. В процессе деления клеток постоянно возникают в небольших количествах чужеродные в антигенном отношении несвойственные организму клетки-мутанты, которые распознаются иммунной системой и уничтожаются.
Под действием ряда факторов — некоторых вирусов, химических канцерогенов, лучевых и других воздействий — увеличивается, с одной стороны, количество клеток-мутантов, а с другой стороны, возникает недостаточность иммунной системы, при которой она оказывается неспособной распознавать и уничтожать чужеродные, не соответствующие генетической программе организма клетки. Эти клетки начинают бесконтрольно размножаться, образуя злокачественную опухоль.
Макроскопическая картина.
Микроскопическая картина.
Помимо свойственного для всех типов опухолей тканевого атипизма, для злокачественных характерен еще и клеточный атипизм. В это понятие входят:
- Клеточный полиморфизм — наличие в опухоли клеток разной величины и формы. Реже, например, при гемобластозах, в многослойном плоском эпителии, признаком клеточного атипизма является их мономорфизм — несвойственное ткани однообразие клеток.
- Ядерный полиморфизм — наличие в клетках ядер различной величины и формы.
- Гиперхромия ядер — более интенсивное их окрашивание ядерными красителями.
- Увеличение ядерно-цитоплазматического соотношения — основная функция злокачественной опухолевой клетки — размножение, поэтому ядро занимает больший удельный объем;
- Многочисленные митозы.
- Атипичные митозы.
- Гистохимический атипизм — появление в цитоплазме опухолевой клетки нетипичного в обычных условиях вещества, например, слизи.
Помимо перечисленных, выявляемых при световой микроскопии признаков, существуют и другие признаки клеточного атипизма:
- ультраструктурный атипизм,
- биохимический атипизм,
- антигенный атипизм.
Характерной микроскопической картиной, отражающей злокачественный характер опухоли, является ее врастание в сосуды и в соседние ткани.
- Сопровождаются так называемой раковой кахексией, основной чертой которой является истощение, связанное с активизацией процессов катаболизма жиров и белков, поскольку опухоли для ее жизнедеятельности нужны пластические материалы и энергетический субстрат.
- Сопровождаются паранеопластической анемией, связанной с подавлением эритропоэза биологически активными веществами, циркулирующими в крови в высоких концентрациях.
- Замещение опухолевой тканью большей части органа ведет к недостаточности его функции.
- Сдавление опухолью прилежащих тканей, может вызвать в них ишемию и некроз.
- Разъедание опухолью крупных сосудов проявляется кровотечениями.
- Разрастание злокачественной опухоли в стенке полого органа может привести к его разрыву.
Наиболее частыми непосредственными причинами смерти при злокачественных опухолях бывают: острая пневмония, анемия, кахексия, поражение метастазами жизненноважных органов, сердечная недостаточность.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Принято считать, это следует подчеркнуть, что чем более резко выражен клеточный полиморфизм, тем злокачественнее опухоль и хуже прогноз. Однако полного соответствия между этими признаками нет, н нередко как раз наиболее злокачественные новообразования отличаются мономорфностью.
Для новообразований также характерно значительное варьирование формы, размеров и плотности ядер опухолевых клеток, высокое ядерно-цитоплазматическое отношение. Нередко ядра бывают крупные, резко полиморфные, гиперхромные. Они могут содержать несколько ядрышек, иногда гипертрофированных.
Изменения хроматина в опухолевых клетках могут характеризоваться нарастанием процесса его гетерохроматизации, при этом интенсивно окрашивающийся гетерохроматин имеет мелко- или круиноглыбчатое строение, занимает периферические или центральные участки ядра или распределяется диффузно по нему. Соответственно варьируют светлоокрашенные участки, содержащие эухроматин. Следует сказать, что соотношение в ядрах гетерохроматина, являющегося более инертной (конденсированной) частью хроматина, и эухроматяна, содержащего основную массу активно функционирующих генов, значительно варьирует от опухоли к опухоли н от одной клетки к другой в одном и том же новообразовании, отражая степень дифференцнровки ядра. На гистологических препаратах, окрашенных гематоксилином и эозином, степень гиперхромиости ядер обусловлена выраженностью в них гетерохроматизации.
Каждая конкретная опухоль обычно представляет собой популяцию клеток с изменчивым числом хромосом, т. е. неравномерным содержанием ДНК. Однако в опухоли при этом можно обычно выделить одну, две или несколько модальных линий со стабильно повышенным содержанием ДНК, соответствующим определенной плоидности числа хромосом. Гистограммы, построенные на основании цитоспектрометрни, цитоспектрофлуориметрии, импульсной цитофотометрии или иных способов, отражают модальную линию или линии и все варианты содержания ДНК в данной опухоли. Их анализ может иметь важное практическое значение для дифференциальной диагностики предопухолевых и опухолевых процессов, так как при последних количество ДНК увеличено.
Морфологическая катаплазия опухолевых клеток значительно варьирует от новообразования к новообразованию, в связи с чем делались многочисленные попытки найти корреляцию между ее выраженностью и степенью злокачественности опухоли.
Распространение получило исследование степени злокачественности плоскоклеточного рака гортани на основании определения различных сторон клеточной катаплазии (расположения клеток, степени их кератинизации, ядерного полиморфизма, митозов и др. ).
Разбирая значение клеточной катаплазии в определении степени злокачественности опухоли с точки зрения ее прогноза, следует подчеркнуть два обстоятельства. Во-первых, использование электронной микроскопии в диагностике опухолей человека позволяет, как никогда раньше, объективно оценивать степень дифференцировки опухолевых клеток и их гистогенетическую (точнее цитогенетическую) принадлежность, о чем подробнее будет изложено в следующем разделе. Во-вторых, важным является определение не одного, а суммы факторов (признаков), определяющих в своей совокупности степень злокачественности и прогноз для конкретного вида опухоли, в связи с чем наибольшие перспективы имеет многофакторный анализ с использованием электронно-вычислительной техники.
В определении степени злокачественности опухоли и ее прогноза важное значение имеют не только признаки клеточной катаплазни, но и другие факторы, как, например, состояние стромы, лимфоидная инфильтрация, глубина инвазии и многие иные клинико-анатомические проявления опухолевого роста, которых мы в рамках данной статьи не касаемся, но учитывать которые необходимо.
Цитологический анализ включает: обработку присланного материала, приготовление препарата, окраску, микроскопию, трактовку цитологической картины, заключение, в котором дается оценка полученного материала, определяется характер процесса (доброкачественный или злокачественный), при возможности устанавливается нозологическая единица согласно принятым морфологическим классификациям.
Основной задачей указанного метода при исследовании различных органов является установление характера патологического процесса, a также доказательства существования рака при клиническом подозрении на патологию такого характера. Более того, задачей специалиста является достижение такого уровня знаний, когда возможно диагностировать тип опухоли с высокой степенью точности. Отрицательный результат цитологического исследования не исключает наличие рака. Существенную роль для правильного заключения играют быстрота получения, хорошая фиксация и окраска исследуемого материала.
Поскольку методы лечения онкологических заболеваний могут быть весьма агрессивными, при отсутствии убедительных признаков опухоли необходим тщательный контроль в целях предотвращения гипердиагностики. Некоторые сложные спорные случаи требуют гистологического подтверждения диагноза. Следует изучать также и неполноценные препараты, но отрицательное заключение не должно категорически отрицать наличие опухоли.
Цитологическое исследование препаратов должно состоять из подробного описания морфологической картины и заключения, по возможности c указанием характера процесса (доброкачественный или злокачественный) при наличии опухоли, определении тканевой принадлежности, гистологической формы и степени дифференцировки опухоли. Описание цитологической картины должно проводиться по одной схеме и включать осмотр при малом увеличении (обзор) и при иммерсии.
Основу цитологической диагностики составляет изучение клеток, изменения расположения, структуры, строения.
В цитологической диагностике специалист, исследуя препараты под микроскопом, анализирует клеточный и неклеточный состав на основании известных ему критериев цитологической диагностики: количества клеток, присутствия клеток разного типа, их расположения в структурах и разрозненно, характера структур, размера и формы клеток и ядер, структуры ядра и цитоплазмы, ядерно-цитоплазматического соотношения, наличия или отсутствия клеточного и ядерного полиморфизма и других параметров клеток.
О характере патологического процесса судят по степени выраженности отклонения от нормального клеточного состава. Учитывают при этом также фон препарата (элементы крови, бесструктурное вещество, коллоид, жир и пр.).
Расположение клеток, образование комплексов или структур является одним из важных диагностических признаков. Так, для рака характерно образование самых различных комплексов, наряду с разрозненно расположенными клетками. В саркомах клетки располагаются иногда в виде пучков. Розеткоподобные структуры могут определяться в самых различных новообразованиях (опухоль Юинга, аденокарцинома, хемодектома, синовиальная саркома и др.).
Разрозненное расположение означает, что клетки лежат в препаратах поодиночке, отдельно друг от друга; расположение в скоплениях клетки прилегают друг к другу, но достаточно свободно, не образуя структур; расположение в структурах – клетки связаны между собой в образования определенного вида:
• Сосочколодобные (папиллярные) структуры (клетки обволакивают друг друга).
• Железистоподобные структуры (структуры округлые, ядра раслоложены эксцентрически, в центре – секрет, бесструктурное вещество).
• Фолликулярные (фолликулоподобные) – клетки располагаются по периферии, в центре структуры – секрет.
• В виде розеток (однослойная структура, основная часть клеток образует круг, несколько клеток располагаются в центре).
Для доброкачественных поражений характерно правильное, упорядоченное расположение клеток, примерно одинаковое расстояние между ними, сходные размеры клеток и ядер, образующих структуру.
Для злокачественных новообразований характерны структуры, которые называются комплексами (встречаются при раке, опухоли из эпителиальной ткани) или пучками (встречаются при саркоме, опухоли из неэпителиальной ткани – соединительной, мышечной, нервной). Клетки в комплексах нагромождаются друг на друга, отсутствует упорядоченность их расположения.
Размеры клеток обычно оценивают в сравнении с размерами нормальных клеток того же типа. Так, размер зрелой клетки плоского эпителия примерно в 10 раз больше клетки эпителия желудка или молочной или щитовидной железы. Размеры ядер обычно сравнивают с размером эритроцита (в норме достаточно стабильным, приблизительно 7 мкм). Если размер ядер меньше эритроцита, они считаются мелкими, если в 1–1,5–2 раза больше эритроцита - средними, 3–6 – крупными, 7 и более – гигантскими.
Соотношение размера ядра и цитоплазмы (ядерно-цитоплазматическое соотношение) также весьма различно в разных клетках, и при оценке его учитывают степень отклонения соотношения от этого параметра клетки того же типа.
Форма – округлая, овальная, полигональная (неправильная), вытянутая (веретенообразная), бобовидная, в виде перекрученного жгута, булавовидная и др.
Размеры – мелкие (примерно размеры лимфоцита), средних размеров, крупные, гигантские.
Окрашиваемость – гипохромия, гиперхромия.
Сдвиг ядерно-цитоплазматического соотношения в пользу ядра и цитоплазмы.
Строение хроматина – равномерное, регулярное, хроматин тонкодисперсный, мелкозернистый, грубозернистый, глыбчатый (в виде грубых глыбок), конденсация хроматина по краю ядерной мембраны, распределен неравномерно, равномерно, разряжен.
Строение ядерной мембраны – мембрана сохранена, четкие контуры, нечетко очерчена, имеются разрывы, не на всем протяжении прослеживается.
Ядрышки – просматриваются, определяются, не просматриваются, количество, форма – округлая, неправильная, разнообразные по форме и размерам, четкость границ.
Цитоплазма – обильная, умеренная, скудная, цвет голубой, серо-голубой, розовый, розово-фиолетовый и др., окрашена равномерно, неравномерно, стекловидная, включения (зерна, пылевидная зернистость, пенистая цитоплазма и др.), признаки секреции, четкость границ (четкие, неровные, сливаются с фоном), вакуолизация. Существенным признаком является характер цитоплазмы, наличие включений в ней.
Кератоз цитоплазмы значительного количества клеток позволяет думать о плоскоклеточном с ороговением раке, наличие гранул меланина - о меланоме.
Фон препарата часто имеет большое диагностическое значение. Фоном препарата могут быть элементы периферической крови или воспаления, сопровождающего опухолевый процесс, клеточный детрит, межуточное вещество. Фон препарата в виде межуточного вещества может иметь диагностическое значение при определении тканевой принадлежности опухоли (например, хрящеобразующие опухоли) или гистологической формы (например, слизеобразующие аденокарциномы).
Основное назначение цитологического анализа – получить ответ на вопрос о наличии или отсутствии злокачественного новообразования (онкоцитология). В процессе дифференциальной диагностики определяется характер патологического процесса и устанавливаются воспалительные, реактивные, пролиферативные или предраковые поражения, а также доброкачественные опухоли.
Роль морфологических исследований при диагностике опухолей неуклонно возрастает, так как детальная морфологическая характеристика новообразования позволяет более обоснованно выбрать метод лечения (хирургическое, лучевое, химиотерапевтическое и их комбинацию), поскольку опухоли различного строения, происхождения и степени атипии клеток по-разному реагируют на лечение.
КРИТЕРИИ ДОБРОКАЧЕСТВЕННЫХ И ЗЛОКАЧЕСТВЕННЫХ ПОРАЖЕНИЙ
Наиболее часто в цитологической диагностике имеют дело с клетками эпителия. Эпителий – ткань, выстилающая поверхности (кожа, слизистые оболочки внутренних органов, серозные оболочки). Эпителий составляет также основную часть желез. Клетки эпителия при: различных патологических процессах могут претерпевать различные изменения. Это реактивные изменения (при воспалении, гормональных, механических воздействиях и т.п.), фоновые процессы (гиперплазия). Существуют так называемые пограничные состояния (предопухолевые процессы, дисплазии), при которых изменения в клетках достаточно сильно выражены и их трудно отличить от злокачественных. Наиболее отличаются от нормальных клетки злокачественных опухолей.
При реактивных и фоновых поражениях чаще всего увеличивается число клеток (пролиферация), размер ядер, ядра окрашиваются более интенсивно (гиперхромия ядер). Хроматин распределен сравнительно равномерно. В некоторых ядрах, что особенно характерно для железистого эпителия, увеличиваются ядрышки. При некоторых состояниях увеличивается или уменьшается размер клеток, изменяется характер окрашивания цитоплазмы.
При пограничных процессах (состояниях, близких к злокачественным) размер ядер увеличивается значительно, меняется форма ядер, их контуры становятся неровными, ядерная мембрана может неравномерно утолщаться. Хроматин распределен неравномерно, мелкие участки уплотнения чередуются с крупными. Могут увеличиваться ядрышки или появляются множественные мелкие ядрышки. Иногда встречаются многоядерные клетки. Однако, в отличие от злокачественных опухолей, изменения в разных клетках сравнительно одинаковы (мономорфны).
При злокачественных поражениях отмечаются следующие изменения в клеточном составе мазка:
1. Клеточный и ядерный полиморфизм – различие характеристик разных клеток:
• Увеличение и уменьшение размеров клеток (анизоцитоз).
• Увеличение и уменьшение размеров ядер (анизокариоз).
• Изменение формы ядер.
• Неровные контуры ядерной мембраны.
• Неравномерное распределение хроматина.
• Изменение структуры хроматина (грубые глыбки, гранулы разных размеров, нагромождения хроматина, тяжистый, петлистый хроматин, борозды).
• Отличие характера распределения хроматина от распределения в соответствующих доброкачественных клетках.
• Наличие многоядерных клеток, фигур деления (атипичные митозы).
• Изменение характера окрашивания цитоплазмы (неравномерное окрашивание разных участков).
2. Образование комплексов из клеток – структур, отличных от нормальных:
• Разное расстояние между клетками.
• Потеря полярности – ядра клеток ориентированы в разных направлениях.
Читайте также:

