Генетика рака молочной железы
Рак молочной железы — частое заболевание. Эпидемиологические популяционные исследования показывают, что рак груди в течение жизни развивается примерно у 9% всех женщин в Северной Америке и Западной Европе. Рак груди долгое время считали имеющим достоверный генетический компонент; риск его развития у женщины возрастает в 3 раза, если есть один больной родственник первой степени родства, и до 10 раз, если более одного родственника. Этот семейный риск повышается еще больше, если болезнь проявилась у родственников до 40-летнего возраста.
Хотя не менее 20% всех случаев рака груди имеют значимый вклад генетического компонента как часть полигенного или многофакторного типа наследования, только небольшая часть случаев — следствие унаследованного доминантного менделирующего предрасположения к раку груди. Эти семьи имеют характерные признаки семейного рака (по сравнению со спорадическими случаями): значительное число больных в семье, ранний возраст начала, частое двустороннее поражение и развитие опухолей в других тканях, например яичниках или простате.
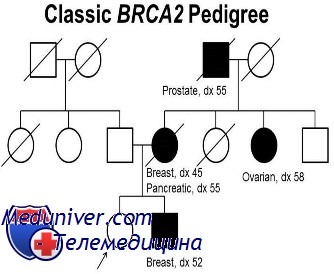
Исследования генетического сцепления в семьях с семейным раком груди с ранним началом привели к открытию мутаций в двух генах, увеличивающих восприимчивость к раку груди, BRCA1 в хромосоме 17q21 и BRCA2 в хромосоме 13ql2.3. Вместе эти два локуса дают половину и третью часть всех случаев аутосомно-доминантного семейного рака груди, соответственно, но менее 5% всего рака груди в популяции.
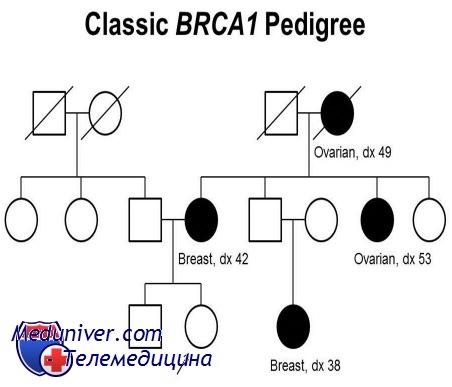
Большинство мутантных аллелей обоих генов в настоящее время каталогизированы. Мутации в генах BRCA1 и BRCA2 также связаны со значимым увеличением риска рака яичников у женщин-гетерозигот; мутации в BRCA2 (но не BRCA1) также наблюдают при 10-20% всех случаев рака груди у мужчин, поражающего почти 0,1% мужчин.
Продукты генов BRCA1 и BRCA2 — ядерные белки, содержащиеся в пределах одного и того же мультибелкового комплекса. Этот комплекс участвует в клеточном ответе на двойные разрывы ДНК, встречающиеся в норме в ходе гомологичной рекомбинации или при патологии в результате поломок ДНК. Как и следовало ожидать при любых нарушениях генов-супрессоров опухолевого роста, в раковых тканях гетерозигот по мутациям в генах BRCA1 и BRCA2 часто обнаруживают потерю гетерозиготности с утратой нормального аллеля.
Пресимптоматическое обнаружение женщин с риском развития рака груди в результате мутации любого из этих генов — одна из главных целей современных исследований семейных и все в возрастающем количестве спорадических случаев. Для лечения и консультирования чрезвычайно полезно знать риск развития рака груди у пациентов, несущих конкретные мутации в генах BRCA1 и BRCA2, по сравнению с общепопуляционным риском.
Первые исследования показали более чем 80% риск развития рака груди к 70 годам у женщин, гетерозиготных по мутациям в генах BRCA1 или BRCA2. Эти оценки относятся к риску развития рака у родственников женского пола в семьях с многократно встречавшимся раком груди; т.е. там, где мутации в генах BRCA1 или BRCA2 были высокопенетрантны у носителей.
Тем не менее, когда аналогичные оценки риска были сделаны на базе популяционных исследований, когда женщин-носительниц мутаций в генах BRCA1 и BRCA2 не выбирали по членству в семьях с большим числом случаев рака груди, риски оказались более низкими и колебались от 45 до 60% к 70-летнему возрасту.
Несоответствие между пенетрантностью мутантных аллелей BRCA1/2 в семьях с многочисленными случаями рака груди и пенетрантностью, наблюдаемой у женщин, выявленных при популяционном скрининге без семейной истории, указывает, что в окончательной пенетрантности мутаций BRCA1 и BRCA2 у гетерозиготных по ним женщин должны играть роль другие генетические факторы, или факторы влияния окружающей среды.
Уже давным-давно было замечено, что определенные болезни распространяются в рамках истории одной семьи, передаваясь от предков к потомкам. Ярким примером таких болезней может служить рак молочной железы. Примерно 10 процентов случаев рака молочной железы объясняются генетической предрасположенностью индивидуума к данному заболеванию. Ученые давно определили, что с раком молочной железы связаны две группы генов – BRCA1 и BRCA2. Но что это за гены такие и как они влияют на развитие болезни у тех людей, которые являются носителями данных групп генов? На самом деле, ответственными за развитие рака молочной железы могут быть и другие гены, но, большей частью, к данному заболеванию приводят мутации, произошедшие именно в генах группы BRCA1 и BRCA2. Эти мутации сейчас довольно легко выявить посредством проведения простого анализа крови. Но каким образом подобные изменения вызывают предрасположенность к данному виду рака?
Как известно, гены группы BRCA1 являются частью 17-ой хромосомы генома человека, а гены группы BRCA2 – частью 13-ой хромосомы. Обе группы генов действуют, как супрессоры развития раковой опухоли вообще. Иными словами, если индивидуум унаследовал мутировавшую (измененную) копию этих генов, которые утратили функцию супрессора рака, у такого человека не существует физических возможностей как-то предотвратить неконтролируемый рост раковой опухоли. К сожалению, точный механизм действия этих двух генов неизвестен, как и неизвестно то, каким образом их мутировавшие копии приводят к развитию рака молочный железы и раку яичника. По всей видимости, гены группы BRCA1 подавляют развитие рака яичника и рака молочной железы, в то время как гены обеих групп – BRCA1 и BRCA2 – принимают участие в механизме производства молекул дезоксирибонуклеиновой кислоты (ДНК) и их восстановлении.
Насколько высок риск развития рака молочной железы у тех индивидуумов, которые унаследовали мутировавшие гены? Как уже говорилось выше, большинство случаев унаследованного рака молочной железы связаны именно с мутацией генов группы BRCA1 и BRCA2. Выяснить эту взаимосвязь удалось ученым после того, как они изучили истории болезни целых поколений семей, в которых многие женщины страдали от рака молочной железы и рака яичника, развившегося еще в их молодом возрасте. Сообщается, что у женщин, которые унаследовали гены группы BRCA1, риск развития рака молочной железы выше на 55-85 процентов, по сравнению с риском в 12,5 процентов у всех остальных представительниц слабого пола планеты. Также, такие женщины заболевали раком в достаточно молодом возрасте. У более чем 50-ти процентов носителей мутировавших генов данное заболевание развилось еще до того, как им исполнилось 50 лет. Кроме того, у таких женщин гораздо выше шанс развития рака обеих молочных желез в течение их жизни. Более ранние исследования дали ученым почву сделать вывод, что оперативное вмешательство при лечении этого заболевания является не самым лучшим решением для этих женщин, так как при этом увеличивается риск развития рака в оставшейся части молочной железы.
У женщин, которые являются носителями группы генов BRCA1, также выше риск развития рака яичников: от 15-ти до 60-ти процентов женщин в возрасте до 70-ти лет оказываются подверженными этому заболеванию, в сравнении с двумя процентами для всех остальных женщин. У носителей мутировавшего гена BRCA1, у которых развился рак молочной железы, шанс развития рака яичников в возрасте до 70-ти лет составляет 44 процента. При этом, этот же риск у всех остальных женщин, которые страдают от случайного, не унаследованного, а приобретенного рака молочной железы, составляет только три процента. Кроме того, отмечается наличие других видов раковых опухолей, которые также связаны с мутацией в группе генов BRCA1. Известно, что мужчины, которые являются носителями этой же группы мутировавших генов, находятся в группе риска по развитию рака простаты, хотя явных доказательств того, что этот риск выше, чем в целом у всей мужской популяции, нет. Также, возможна связь с увеличенным риском развития рака кишечника. Вполне возможно, что современные исследования в этой области дадут нам более конкретные результаты и цифры.
Ученым также удалось обнаружить, что мутации в группе генов BRCA2 связаны с увеличенным риском развития рака молочной железы у обоих полов. Риск развития этого заболевания у женщин составляет порядка 55-ти-85-ти процентов, а у мужчин – около шести процентов. Правда, необходимо отметить, что случаи рака молочной железы у мужчин встречаются крайне редко: к примеру, в Соединенных Штатах Америки ежегодно регистрируется не боле 1600 подобных заболеваний. В то же время, учеными не было найдено такой же явной зависимости между мутациями генов группы BRCA2 и раком яичников, как между этим же заболеванием и мутациями генов группы BRCA1. Однако риск, все же, существует и составляет, по различным данным, от 15-ти до 27-ми процентов. Кроме того, с мутациями генов BRCA2 ученые связывают повышенный риск развития рака простаты и рака поджелудочной железы.

Наследственный рак молочной железы – онкологическое заболевание, обусловленное генетической мутацией и проявляющееся повышенным риском развития злокачественных опухолей молочной железы у кровных родственников. Отличается от спорадических неоплазий более ранним началом, большим количеством двухсторонних поражений и частыми сочетаниями с новообразованиями других органов. Диагностируется с учетом семейной истории, данных молекулярно-генетического анализа и инструментальных исследований. При наличии предрасположенности проводятся регулярные осмотры, по показаниям осуществляется профилактическая мастэктомия. Лечение – операции, химиотерапия, радиотерапия.
- Причины наследственного рака молочной железы
- Симптомы наследственного рака молочной железы
- Диагностика и лечение наследственного рака молочной железы
- Цены на лечение
Общие сведения
Наследственный рак молочной железы – заболевание, сопровождающееся повышением вероятности возникновения злокачественных новообразований молочной железы вследствие генетической мутации, передающейся из поколения в поколение. Является одной из наиболее распространенных наследственных форм рака. Составляет от 5 до 10% от общего количества неоплазий молочной железы. Характеризуется частым ранним началом (в возрасте до 50 лет). Распространенность двухсторонних поражений при разных мутациях колеблется от 5-20 до 60%.
При наследственном раке молочной железы существует высокая вероятность развития других опухолей, в том числе – рака яичников, эндометрия, толстого кишечника, желудка, поджелудочной железы и мочевого пузыря, а также меланомы кожи. При наличии одной близкой родственницы, страдавшей данным заболеванием, риск неоплазии увеличивается в два раза, при двух случаях рака молочной железы в семье – в пять раз. Вероятность развития новообразования еще больше возрастает, если у одной или более родственницы симптомы болезни появились в возрасте младше 50 лет. Лечение проводят специалисты в сфере онкологии и маммологии.

Причины наследственного рака молочной железы
Специалистам известен целый ряд генетических мутаций, увеличивающих вероятность возникновения рака молочной железы. В литературе чаще всего упоминаются мутации генов-супрессоров BRCA1 и BRCA2. Связь этих генов с опухолями данного органа была достоверно установлена в 1994 году. Проведенные исследования позволили повысить уровень ранней диагностики наследственного рака молочной железы и стали основой для последующих изысканий в этой области. В последующем ученым удалось обнаружить, что перечисленные гены выявляются всего у 20-30% больных с семейными случаями рака молочной железы и рака яичников.
У остальных пациенток заболевание провоцируется другими мутациями, при этом в разных регионах планеты преобладают различные генетические аномалии. Наряду с повышенной вероятностью развития наследственного рака молочной железы дефектные гены могут увеличивать риск возникновения других злокачественных новообразований, чаще всего – уже упомянутого выше рака яичников. Несколько реже у пациенток возникают опухоли эндометрия, еще реже – неоплазии органов, не являющихся частью женской репродуктивной системы.
Существует ряд факторов риска, провоцирующих наследственный рак молочной железы у носительниц дефектного гена. В числе таких факторов – раннее менархе (частое явление при данной патологии), позднее начало климакса, отсутствие беременностей и родов, длительный прием гормональных препаратов, сахарный диабет, ожирение, гипертоническая болезнь, курение, злоупотребление алкоголем, наличие доброкачественных пролиферативных изменений ткани молочной железы и некоторых заболеваний женских половых органов.
Симптомы наследственного рака молочной железы
На ранних стадиях наследственный рак молочной железы протекает бессимптомно. Иногда первыми признаками становятся болезненность в молочных железах (при наличии мастопатии) и интенсивные боли во время менструаций. Как правило, опухоль обнаруживают до возникновения развернутой клинической картины. Возможно как самостоятельное выявление узла (случайное или в процессе самоосмотра), так и возникновение подозрений на онкологическое заболевание при проведении очередного обследования.
Отмечаются различия в течении наследственного рака молочной железы, вызываемого разными генетическими мутациями. Новообразования, выявляемые у женщин-носительниц гена BRCA1, характеризуются высокой степенью злокачественности. Рак, ассоциированный с мутациями BRCA2, протекает более благоприятно по сравнению со спорадическими случаями заболевания. Отличительной особенностью всех форм наследственного рака молочной железы является высокая вероятность возникновения контрлатеральных поражений и рецидивов опухоли в той же молочной железе после проведения органосохраняющих операций. Для сравнения: средняя частота местных рецидивных неоплазий при спорадическом раке составляет 1-1,5% в течение года. При наследственном раке молочной железы контрлатеральные новообразования выявляются у 42%, ипсилатеральные – у 49% больных.
Диагностика и лечение наследственного рака молочной железы
Диагноз устанавливается с учетом семейного анамнеза, результатов молекулярно-генетических исследований и данных дополнительного обследования. Генетический анализ выполняют после выявления семейно-анамнестических признаков наследственного рака молочной железы (наличия заболевания у близких родственников, раннего начала, высокой частоты двухсторонних поражений). При положительном результате анализа регулярно назначают маммографию. При образовании узла осуществляют УЗИ молочной железы, дуктографию, МРТ и другие диагностические процедуры. При подозрении на наличие отдаленных метастазов проводят рентгенографию грудной клетки, сцинтиграфию всего скелета, УЗИ печени, МРТ головного мозга и другие исследования.
Традиционно при наследственном раке молочной железы применяли стандартные схемы, составленные с учетом более высокой вероятности рецидивирования. Однако в последние годы в литературе все чаще встречаются указания на необходимость использования специальных лечебных программ, составленных с учетом чувствительности наследственного рака молочной железы, ассоциированного с различными генетическими аномалиями. Так, пациенткам с дефектом BRCA1 из-за низкой эффективности не рекомендуют назначать средства из группы таксанов. При наследственном раке молочной железы с мутацией BRCA2 успешно применяют цисплатин – препарат, не входящий в стандартную схему лечения рака молочной железы, но успешно используемый при лечении опухолей других локализаций. Для снижения частоты рецидивов даже на начальных стадиях выполняют радикальную мастэктомию, а не органосохраняющие операции.
Меры по предотвращению и своевременному выявлению наследственного рака молочной железы включают в себя отказ от вредных привычек, регулярные самоосмотры и осмотры специалиста. Основной инструментальной методикой, используемой при проведении профилактических обследований, является маммография, однако в последние годы при наличии возможностей ее все чаще заменяют ЯМР, исключающим облучение пациентки. При высоком риске развития наследственного рака молочной железы (более 25%) осуществляют профилактическую двухстороннюю мастэктомию, иногда – в сочетании с оофорэктомией.
Всегда ли виновата мутация генов
Что способно наносить ущерб нашим генам
В зависимости от того, какой ген подвергся ущербу и насколько важна его функция, можно наблюдать либо отсутствие существенных перемен в состоянии здоровья человека, либо нарастание какого-то патологического процесса, который невозможно остановить никаким другим способом, кроме воздействия на генетическую программу. Можно блокировать сигналы гормонов, можно удалять повреждённые ткани хирургически, но если клетки настроены на абсолютно новую генетическую задачу, то они будут непрерывно делиться, а заболевание — прогрессировать.
Что способно изменять активность генов
Исследования в области эпигенетики показали, что только 5% генных мутаций, связанных с болезнями, являются необратимыми, остальные 95% не затрагивают структуру ДНК и могут регулироваться факторами внутренней и внешней среды. К ним относятся:
- особенности питания;
- вредные привычки;
- стрессовые состояния;
- лекарственная терапия;
- психоэмоциональные стимулы и т. д.
Молитва, музыка, которую мы слушаем, способны менять активность генов. Отношения с людьми и даже ваши мысли тоже являются весомыми факторами, влияющими на работу генов, и эти изменения регистрируются в лабораторных исследованиях.
Здоровый образ жизни позволяет изменить активность от 4000 до 5000 различных генов. И если такое воздействие продолжается долгое время, то эти изменения закрепляются в клетке и способны передаваться трём-четырём следующим поколениям. В школе нас учили, что клетки передают по наследству только свой геном, но это больше не отвечает научной действительности. На самом деле клетки наследуют и эпигенетические модификации.
Стоит ещё раз подчеркнуть принципиальное отличие эпигенетической модели от так называемой классической генетики, полагающей, что если ген повреждён, то это необратимо. С эпигенетическими изменениями дело обстоит намного проще: они более пластично влияют на геном и поэтому потенциально обратимы. Значит, есть возможность вернуть клетке здоровую программу, в том числе с помощью определённых препаратов. Если подавлять в клетке активность ферментов, которые могут нанести ей ущерб, то в ее потомстве ген может восстановить свои функции.
Как лишить опухоль возможности развивать химио- и радиорезистентность
Все злокачественные новообразования в органах репродуктивной и других систем начинаются с накопления критической массы изменений. Опухоль обладает двумя свойствами: неоднородностью (гетерогенностью) и колоссальным потенциалом изменений. Установлено также, что ее неоднородность затрагивает фенотипические, генетические и эпигенетические признаки. В процессе роста опухоли её клетки претерпевают ряд модификаций, которые обеспечивают новообразованию возможность приспособиться к огромному количеству изменений внешней среды.
Как только начинается химиотерапия, опухоль мгновенно меняется. Вся современная химиотерапия — это мощнейший индуктор эпигенетических изменений. Да, назначается препарат, и новообразование уменьшается, но погибает его самая нетуморогенная часть, которая почти безвредна. А туморогенная часть (корневая система опухоли) проходит переадаптацию, что делает последующую химиотерапию бесполезной.
Если параллельно с химиотерапией назначаются препараты, подавляющие эпигенетические механизмы, опухоль лишается возможности к адаптации и практически превращается в доброкачественную. Такое новообразование уже не сможет развить химио- и радиорезистентность.
Для профилактики и лечения рака можно дополнительно обратиться к современным лекарственными средствам. Надо сказать, что в США к настоящему времени уже зарегистрированы два препарата (Вайдаза, Дакоген) эпигенетического характера, которые способны подавлять активность ферментов. Их эффективность доказана при некоторых видах рака крови. Однако, наряду с доказанной терапевтической активностью, они продемонстрировали токсичность, являющуюся частой причиной серьёзных осложнений и побочных эффектов. Поэтому среди основных требований к эпигенетическим препаратам нового поколения не только высокая эффективность, но и минимизация токсичности.
В связи с этим в последнее время большое внимание и интерес исследователей привлекают вещества природного происхождения, обладающие опухолеспецифической эпигенетической активностью. Среди нетоксичных веществ с эпигенетической активностью в настоящее время одними из самых перспективных являются флавоноид эпигаллокатехин‑3-галлат (EGCG) и индолы, в частности, индол‑3-карбинол (I3C).
Маркер связан с особенностями восстановления ДНК при повреждениях, участвует в поддержании стабильности генома. Исследуется для выявления наследственной предрасположенности к раку молочной железы и яичников.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Венозную кровь, буккальный (щечный) эпителий.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Локализация гена на хромосоме – 17q21.31
Ген BRCA1 кодирует белок BRCA1 (breast cancer 1), участвующий в репарации (восстановлении) ДНК, регуляции клеточного цикла и поддержании генетической стабильности.
Мутация гена BRCA1
Мутация заключается в делеции (выпадении) четырех нуклеотидов GTCT (гуанина, двух тиминов и цитозина) в позиции 3875 последовательности ДНК гена BRCA1 и обозначается как 3875delGTCT. В результате синтезируется белок BRCA1 с нарушенной функцией.
3875delGTCT (del) – обозначение мутации
Возможные генотипы
- N/N
- N/del
Ассоциация маркера с заболеваниями
- Рак молочной железы
- Рак яичников
Общая информация об исследовании
BRCA1 играет важную роль в репарации (восстановлении) ДНК, регуляции клеточного цикла и поддержании стабильности генома. Ген BRCA1, кодирующий белок BRCA1, локализован в 17-й хромосоме в локусе q21.31 и является геном-супрессором опухоли, в норме защищающим клетку от злокачественного перерождения. При возникновении мутации в этом гене значительно повышается вероятность развития рака молочной железы (РМЖ) и яичников (РЯ).
BRCA1 имеет множество мутантных аллелей. Данная мутация заключается в делеции (выпадении) четырех нуклеотидов GTCT (гуанина, двух тиминов и цитозина) в позиции 3875, в результате синтезируется белок BRCA1 с нарушенной функцией, что в итоге может увеличивать вероятность развития РЯ и РМЖ.
Рак молочной железы и яичников – одни из самых распространенных онкологических заболеваний. Присутствие мутаций в гене BRCA1 может увеличить вероятность рака молочной железы более чем в 5 раз, а рака яичников – в 10-28 раз. Средний возраст развития заболевания при этом снижается до 25-30 лет. Чем старше человек, тем выше у него вероятность рака.
Выявленные семейные случаи заболевания в первую очередь свидетельствуют о наследственной природе рака и требуют генетического анализа. Ген BRCA1 участвует в защите организма от спонтанных повреждений ДНК, поэтому нарушение его работы позволяет накапливаться мутациям и приводит к онкологическим заболеваниям, и в первую очередь – к раку молочной железы и яичников. Известно, что рак, ассоциированный с генетическими маркерами BRCA, характеризуется высокой степенью злокачественности и выраженной лимфоидной инфильтрацией.
Популяционная частота этой мутации – не более 1 %. Но при этом риск заболеть раком молочной железы или раком яичников в течение жизни для женщин, имеющих генетическую предрасположенность к ним, достигает 80 %.
Анализ можно проводить в любом возрасте, и при своевременном выявлении нарушений по указанному маркеру лечение будет начато своевременно. Для успешного лечения онкологических заболеваний очень важно обнаружить опухоль на ранней стадии, еще до появления симптомов. Поэтому генетическая предрасположенность к раку молочной железы и яичников – очень серьезное показание к регулярному обследованию в целях выявления заболевания на ранней стадии.
- N/N – популяционный риск развития рака молочной железы и яичников
- N/del – высокий риск развития рака молочной железы и яичников
Интерпретация результатов исследования должна проводиться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Поскольку данный ген может иметь несколько мутантных вариантов, необходимо оценивать его работу одновременно по нескольким маркерам.
Изолированное исследование мутации 3875delGTCT рекомендуется только при выявлении данного маркера у родственников первой степени родства.
Генетический маркер входит в исследование:
Рак часто наблюдается у членов одной семьи, объективно подтверждена наследственная природа некоторых злокачественных опухолей. Есть точка зрения, что наследственная предрасположенность — самая вероятная причина всех онкологических заболеваний, и только дело времени, чтобы наука точно установила, мутация какого гена за какой конкретный рак отвечает. Но уже сейчас наследственную передачу рака можно прервать.
Если у человека возникло онкологическое заболевание, очень важно выяснить, есть ли в его роду другие случаи злокачественных новообразований. Семьям, в которых имеется более одного такого случая, нужно пройти консультацию врача-генетика, чтобы понять, есть ли в семейной истории основания для подозрений на наследственный характер патологии. Особенно настораживающим признаком будет онкологическое заболевание в нескольких поколениях семьи. Одним из основных методов работы врача-генетика является составление родословных. Другая важная часть медико-генетической консультации — осмотр и опрос пациента: наследственные заболевания нередко проявляются специфическими признаками.
Принципиальным отличием наследственного рака является возможность его прогнозировать путем выявления патогенных мутаций. На первом этапе семьям, в которых имеется более одного случая развития рака, рекомендуется пройти консультацию врача-генетика, по результатам которого можно будет понять, есть ли в семейной истории основания для подозрения на наследственный характер патологии.
Если в процессе консультации возникают подозрения на наследственную природу заболевания, то следующий этап — целенаправленное генетическое тестирование, поиск мутаций, которые могут вызывать конкретное заболевание. Одни исследования позволяют обнаружить изменения в самом гене, другие — в белке, который кодируется измененным геном. Один ген может претерпеть до 300 мутаций.
В последние годы найдены мутации, ответственные за возникновение и развитие рака молочной железы, яичников, толстой кишки и др. Цель генетического тестирования, или скрининга,— выявить риск возникновения заболевания до появления симптомов. Это дает возможность в одних случаях провести своевременное лечение, в других — рекомендовать меры, позволяющие избежать передачи наследственного заболевания потомству. Мутации генов найдены для нескольких видов рака, тесты на некоторые из них уже используют в клинике — например, тесты на рак груди и кишечника.
От предков или не от предков
Все онкологические заболевания имеют генетическую природу, поскольку при раке гены, отвечающие за правильное деление клетки, повреждены. Но в одних случаях имеют место наследственные мутации, а в других — приобретенные. Результатом повреждения (мутации) гена во всех случаях является бесконтрольное неограниченное деление клеток, что и является сутью ракового процесса.
Несмотря на то что онкологические заболевания имеют генетическую природу, только 10–15% из них передаются по наследству. Почему важно знать, наследственный или ненаследственный рак? Потому что если установлена его наследственная природа, то есть выявлена мутация, вызвавшая его, то известен прогноз и понятна тактика в отношении самого больного и его родственников. Особенно отчетливо наследование мутации прослеживается в случаях так называемого семейного рака молочной железы и яичников, при семейном аденоматозном полипозе и различных опухолевых синдромах (Линча — рак толстой кишки, Ли-Фраумени — разнообразные саркомы и др.). Многие люди, сами будучи здоровыми, являются носителями мутаций, приводящих к наследственным заболеваниям. Если носители одной и той же мутации — оба родителя, заболевание становится неизбежным. Генетическое тестирование позволяет это выявить.
Следует подчеркнуть, что наличие мутации не означает заболевания. Мутация может сидеть в гене много лет до того, как начнет развиваться опухоль. Но, зная про мутацию, врачи могут назначить рациональный режим обследования и профилактического лечения.
Например, у женщин—носительниц гена BRCA1 в 95% случаев в течение жизни разовьется рак груди и в 65% — рак яичников, причем часто рак развивается в молодом возрасте, до 50 лет. Это означает, что носительница должна все время находиться под наблюдением, а в некоторых случаях целесообразно ставить вопрос о профилактическом удалении груди и (или) яичников. У всех на слуху история Анджелины Джоли, которая настояла на удалении обеих молочных желез, поскольку у нее обнаружили мутацию гена BRCA1.
Специалисты знают результаты исследования ткани удаленных молочных желез у 54 шведских женщин—носительниц этого гена в возрасте до 51 года. Ни у одной из них обследование не показывало опухоли груди до операции, но гистологическое изучение удаленной ткани выявило наличие раковых клеток у пяти (10%!) из них.
К профилактической хирургии прибегают и при семейном аденоматозном полипозе, при котором вероятность развития рака толстой кишки после 40 лет достигает 100%, и при других онкологических заболеваниях, если установлена онкогенная мутация.
Понятно, что женщины с отрицательным результатом теста на мутации генов BRCA1 и BRCA2 не застрахованы от спорадического рака груди и яичников. Однако вероятность его возникновения несопоставимо ниже, чем у женщин с положительным тестом.
Женщине следует заподозрить у себя предрасположенность к наследственному раку груди, пройти консультацию врача и генетика и генетическое тестирование, если в семье:
— было более одного случая рака груди или яичников по женской линии (у матери, бабушки, тетки, сестер и т. д.);
— заболевание было диагностировано в молодом возрасте (до наступления климакса);
— были случаи рака груди у мужчины;
— были больные c множественными опухолями (например, у одного человека — рак груди, толстой кишки, матки, рак поджелудочной железы и т. д.);
— были случаи двустороннего рака обеих молочных желез или обоих яичников.
Тестирование и его последствия
Генетическое тестирование имеет несколько преимуществ. Отрицательный результат может принести человеку облегчение, избавить от страха ожидания тяжелой болезни, от которой, возможно, погибли его близкие, а также от регулярных обследований, которые должны быть обязательны в семьях с высоким онкологическим риском. Положительный результат дает человеку возможность принимать обдуманные решения о будущем своем и своего потомства.
Сегодня возможна профилактика наследственного рака, то есть возможность не передать от родителей потомству ген, несущий опасную мутацию. Метод, который позволяет это сделать, называется преимплантационная генетическая диагностика (ПГД). Он заключается в следующем: для пары выполняют ЭКО, проводят генетическую диагностику полученных эмбрионов и переносят в матку женщины только те из них, в которых нет онкогенных мутаций. У родившегося ребенка их не будет, а значит, не будет и наследственного рака.
Открытое письмо Анджелины Джоли, New York Times, 14 мая 2013 года
ПГД проводится не на всем эмбрионе, а на нескольких клетках, которые получают путем его биопсии. Доказано, что биопсия не оказывает влияния на здоровье и состояние ребенка. Другими словами, ПГД не снижает частоту наступления беременности и безопасна для будущего ребенка.
Кроме мутаций, отвечающих за развитие рака груди и яичников, установлены мутации, несущие предрасположенность к меланоме, раку желудка, матки, предстательной, поджелудочной и щитовидной железы, толстой и прямой кишки. Если мутация определена и в семье есть люди, которые хотят иметь ребенка, важно, чтобы они знали о возможности предотвратить передачу следующим поколениям этой мутации и связанного с ней рака с помощью ЭКО и ПГД.
Читайте также:

