Генетические поломки при лейкозе
Острый лимфобластный лейкоз (ОЛЛ) — гетерогенная группа гемобластозов, развивающихся из самых молодых клеток лимфатического ряда. Эта группа состоит из отдельных подгрупп, каждая из которых в свою очередь гетерогенна.
Клоны клеток с хромосомными аномалиями обнаруживают примерно у 70—80 % пациентов, причем более чем в 30 % случаев это гипердиплоидные клоны, в 10 % — гиподиплоидные, в остальных — псевдодиплоидные.
Острый лимфобластный лейкоз (ОЛЛ) гораздо чаще наблюдается у детей и лиц молодого возраста, чем у пожилых. Средний возраст взрослых пациентов составляет около 30 лет. Мужчины болеют чаще, чем женщины.
Прогноз острого лимфобластного лейкоза у взрослых значительно хуже, чем у детей. Это коррелирует с возрастными различиями в частоте характерных аномалий кариотипа, т. е. при остром лимфобластном лейкозе у детей значительно чаще, чем у взрослых, встречаются хромосомные изменения, более благоприятные в прогностическом отношении, и наоборот — реже наблюдаются нарушения кариотипа, ассоциированные с плохим прогнозом. Особенно ярко возрастные различия проявляются при сравнении особенностей кариотипа острого лимфобластного лейкоза у детей и взрослых старше 60 лет.
Определенные особенности кариотипа важны для уточнения диагноза и прогнозирования ответа на терапию.
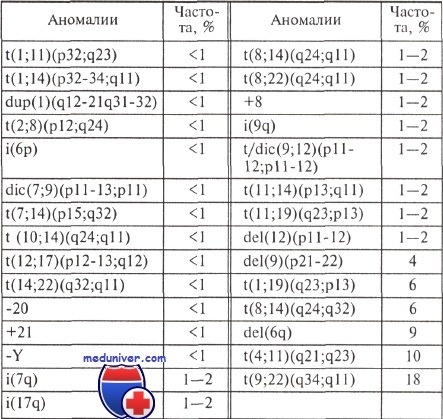
Хромосомные нарушения, наиболее характерные для острого лимфобластного лейкоза, представлены в таблице. Их частота вычислена S. Heim и F. Mitelman после объединения данных, полученных в разных цитогенетических лабораториях мира — всего около 6000 наблюдений. В таблице приведены не все, а только самые распространенные хромосомные аномалии, обнаруженные при остром лимфобластном лейкозе, но и они демонстрируют выраженную цитогенетическую гетерогенность этого заболевания. Большинство повторяющихся (неслучайных) аномалий наблюдается редко.
Необходимо отметить, что отдельные изменения кариотипа обнаруживают как при остром лимфобластном лейкозе, так и при других лимфоидных опухолях, другие изменения — исключительно при остром лимфобластном лейкозе. К первым относятся, в частности, перестройки хромосомных районов 14q11, 14q32, делеции длинного плеча хромосомы 6 и короткого плеча хромосом 9, 12 и 17. С другой стороны, t(9;22)(q34;q11), t(4;11)(q21;q23), t(1;19)(q23;p13) характерны для ОЛЛ, но не для других лимфопролиферативных заболеваний.
Еще одно общее замечание: В-клеточные лейкозы (в том числе и острые), а также лимфомы отличаются от Т-клеточных по спектру хромосомных изменений. Так, для новообразований В-клеточной природы характерны перестройки, затрагивающие локусы иммуноглобулиновых генов: гена Н-цепей иммуноглобулинов (14q32), L-цепей к (2р12) и h (2q11). В новообразованиях из Т-клеток нередко наблюдаются перестройки, затрагивающие гены Т-клеточных рецепторов (хромосомные участки 14q11, 7р15, 7q34).
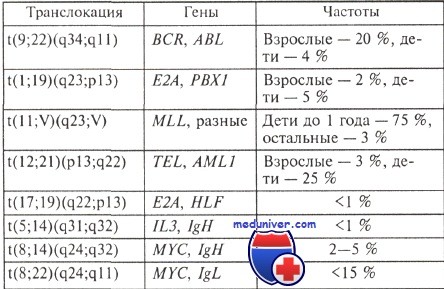
Частоты основных хромосомных перестроек, характерных именно для В- или Т-клеточных острых лимфобластных лейкозах, а также гены, вовлеченные в эти перестройки, приведены в таблицах.
Уже отмечалось, что частота отдельных характерных нарушений кариотипа различается при остром лимфобластном лейкозе у детей и взрослых. Это подтверждают данные таблице. Приведем конкретные примеры сначала по структурным изменениям, а затем по числовым.
Структурные аномалии: t(9;22) значительно чаще наблюдается у взрослых, a t(12;21) — у детей, причем первая крайне неблагоприятна в прогностическом отношении, а вторая — наоборот, предвещает хороший ответ на лечение в подавляющем большинстве случаев. Такие структурные аномалии, как перестройки хромосомного района 11q23, ассоциированные нередко с плохим прогнозом, часто наблюдаются у детей до 6 мес, их частота с возрастом понижается; у пожилых людей они редки.
Числовые изменения: клоны клеток с числом хромосом более 50 прогностически благоприятные, встречаются у детей значительно чаще, чем у взрослых: 25—30 и 5 % соответственно.
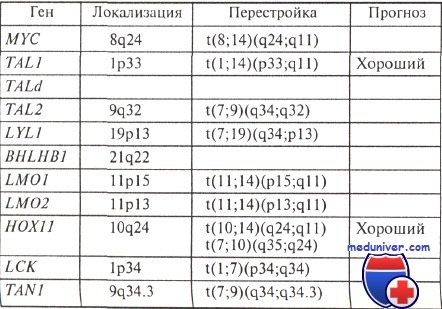
Числовые изменения кариотипа имеют большое значение для прогнозирования острого лимфобластного лейкоза. Уже отмечалось, что вариант острого лимфобластного лейкоза со значительным увеличением числа хромосом (более 50) имеет относительно благоприятный прогноз: 80—90 % больных переживает пятилетний срок с момента постановки диагноза, однако выявление некторых структурных перестроек в клетках лейкозного клона с такими числовыми нарушениями может ухудшить прогноз.
В отличие от острого лимфобластного лейкоза с гипердиплоидными клонами лейкозы, ассоциированные с гиподиплоией, имеют обычно плохой прогноз: только 30 % больных остается в живых по истечении 2 лет от момента постановки диагноза. Еще более неблагоприятен прогноз при острых лейкозах с так называемым окологаплоидным числом хромосом, при которых каждая клетка содержит 26—28 хромосом. В таких клетках вместо большинства хромосомных пар остается по одному гомологу; сохранено по два гомолога только в 10-й, 14-й, 18-й и 21-й парах.
Неблагоприятен прогноз и в случаях с околотетраплоидными клонами. Следует отметить, что окологаплоидный и околотетраплоидные клоны клеток редко наблюдаются при остром лимфобластном лейкозе — не более 1—2 % случаев.
Остановимся на отдельных структурных аномалиях кариотипа, характерных для острого лимфобластного лейкоза.








ЦИТОГЕНЕТИЧЕСКИЕ АНОМАЛИИ ПРИ ОСТРОМ ЛИМФОБЛАСТНОМ ЛЕЙКОЗЕ
Актуальность. В последнее время отмечается тенденция к росту злокачественной патологии, как взрослого населения, так и детей. В педиатрической онкологии острый лимфобластный лейкоз (ОЛЛ) является одним из самых распространённых заболеваний гемопоэтической ткани и составляет до 30% всех опухолей, до 75% всех гемобластозов [1]. Стандартный цитогенетический метод исследования является необходимым в проведении диагностики у пациента с подозрением на ОЛ. Выявление количественных и структурных изменений хромосом позволяет установить прогностическое значение данного заболевания.
Цель. Изучить структуру острых лейкозов, выявленных с помощью цитогенетического исследования и прогноз часто встречающихся цитогенетических нарушений при ОЛЛ.
Цитогенетический метод заключается в микрокопировании структуры хромосом и их количества на основании исследования клеток периферической крови . Под микроскопом могут обнаруживаться лишь хромосомные и геномные мутации. Данный метод исследования стали широко применять в генетике с 1956 года, когда шведские ученые Дж. Тийо и А. Леван предложили новый способ изучения хромосом, установив верный кариотип. Впервые прямая связь между конкретной хромосомной перестройкой и определенным типом злокачественно заболевания была установлена в 1960 году Новеллом и Хунгерфордом. Современный этап в применении цитогенетического метода связан с разработкой дифференциального окрашивания хромосом Т. Касперсоном в 1969 г. Это позволило расширить возможности цитогенетического анализа и точно идентифицировать хромосомы по характеру распределения в них окрашиваемых сегментов. Сейчас известно множество примеров хромосомных перестроек, которые определяют склонность к развитию онкологических заболеваний или являются самой причиной.
Стандартный цитогенетический метод входит в список обязательных диагностических процедур, проводимых у больных с подозрением на ОЛ. Кариотип пациента исследуется по клеткам периферической крови. Для того, чтобы считать кариотип достоверным, необходимо провести исследование не менее 20 метафаз. К основным типам генетических аномалий при ОЛЛ относятся количественные аномалии, т.е. нарушения плоидности, и структурные аномалии, к которым относятся транслокации, инверсии, делеции, дупликации и точковые мутации. К количественным хромосомным аномалиям относятся гипер- и гипоплоидия. Гиперплоидия характеризуется приобретением дополнительных хромосом с их увеличением больше 46 в одной клетке. Она обнаруживается в 5-15 % случаев ОЛЛ у взрослых, что снижает вероятность благоприятного прогноза, нежели при ОЛЛ у детей, когда гиперплоидность обнаруживается приблизительно в трети случаев. Гипоплоидия, наоборот, является следствием снижения количества хромосом меньше 46. Она обнаруживается в 2-8% случаев ОЛЛ и ассоциируется с неблагоприятным исходом [1]. Качественные (структурные) хромосомные аномалии при ОЛЛ обнаруживаются чаще. Хромосомные транслокации являются, как правило, первичными генетическими событиями, формирующимися на ранних этапах лейкемогенеза в то время как точковые мутации, делеции чаще оказываются вторичными аномалиями, приобретенными в результате клональной эволюции [4]. Структурные перестройки обычно представлены транслокациями. Идентифицировано более 30 неслучайных транслокаций. Cпецифические хромосомные перестройки являются независимыми диагностическими и прогностическими маркерами, и служат в выборе тактики терапии [1].
В таблице 1 приведён перечень основных молекулярно-генетических аномалий, которые были идентифицированы при ОЛЛ у взрослых и детей и используемых в настоящее время при молекулярной диагностике [1].
В лечении лейкоза была одержана самая крупная до сих пор медицинская победа с начала ХХI века. Один из видов этого рака у детей сейчас полностью излечивается в 75% случаев. До конца первого десятилетия нынешнего столетия — это рекордный результат среди всех опухолевых болезней человека! И большинству российских пациентов уже доступны ее плоды.
Вот что рассказала об этом MedPulse заведующая онкологическим отделением Московского областного онкологического диспансера, к. м. н. Евгения Инюшкина.
-Из-за чего вообще начинается эта болезнь?
-Сначала дают сбой те клетки костного мозга, которые обеспечивают противоопухолевый иммунитет, то есть выслеживают и уничтожают появляющиеся здесь кроветворные клетки-мутанты. Из-за заболеваний их генов эти уродцы не могут дозреть в нормальные кровяные клетки лейкоциты и начинают безостановочно делиться. Так организм становится беззащитным против воспалительных и инфекционных болезней. Ведь лейкоциты, которых поражает эта опухолевая болезнь, заняты розыском и уничтожением микробов.
Установлено, что риск лейкоза (другие названия — лейкемия, белокровие, рак крови) повышается у людей, живущих вблизи мощных источников электромагнитных полей. Поэтому, если ваш дом или дачный участок расположен вблизи высоковольтных линий электропередач или вовсе под ними, то необходимо делать анализ крови не реже раза в год. И на выходных старайтесь хотя бы ненадолго уйти с такого участка, например, в лес, на рыбалку, чтобы организм отдохнул от воздействия мощного поля.
Рентгеновское облучение повышает риск лейкоза у детей, чьи матери за год до беременности делали рентгеновские обследования органов малого таза и брюшной полости. Поэтому женщинам, планирующим роды, в течение года перед ними надо избегать такого облучения.
Повышен риск белокровия и у детей, чьи матери во время беременности потребляют слишком много нитратов вместе с консервированными продуктами. Значит во время беременности надо питаться только свежеприготовенными продуктами.
И сразу запомним очень важное. Рак крови — это четыре различных недуга: острый лимфолейкоз, острый миелолейкоз, хронический лимфолейкоз, хронический миелолейкоз.
У всех четырех лейкозов набор внешних симптомов сходен. Но по картине крови, а также тому, как во времени разворачиваются все проявления недуга, их лечению и прогнозу — это болезни разные!
-Как же могут быть самостоятельными заболеваниями острые и хронические лейкозы?
-А тут и заключается главная необычность рака крови среди других болезней человека.
Судите сами. Острые и хронические лейкозы никогда не переходя друг в друга! В течение максимум двух лет мы боремся за жизнь больного острым лейкозом. Затем человек либо полностью выздоравливает, либо погибает. С хроническими же лейкозами, благодаря современным лекарствам, больные могут жить 20 и более лет. У детей 85% всех лейкозов — острые, а у взрослых — 55%.
И еще характерная особенность. У лейкоза нет стадий I — IV, которые есть у всех остальных видов рака и зависят от того, как далеко от первичной опухоли расселяются метастазы. Эта болезнь 6 месяцев развивается скрытно, без внешних симптомов. А затем белокровие считается сразу раком IV стадии. Ведь кровь разносит опухолевые клетки в каждую точку организма. Отсюда — важнейший симптом этой болезни: увеличение лимфоузлов, причем сначала шейных, околоушных, подключичных.
-Слышал, что начало любого лейкоза больному кажется какой-то упорной, затянувшейся простудой.
-Верно, но тут надо добавить. К скачкам температуры до 38 градусов сначала прибавляется ломота в костях и бледность кожи, затем увеличение лимфоузлов, а на коже — синяки и точечные кровоизлияния. При первой атаке острых лейкозов в уже течение 2-3 недель увеличиваются селезенка и печень. Но при хронических видах рака крови эти симптомы, как и все другие, разворачиваются гораздо медленнее, за 2-3 месяца.
-Как же самому больному не пропустить первую атаку рака крови?
— Если простуда с температурой, а тем более не поддающаяся лекарствам против микробов и вирусов, затянулась свыше 3-х дней, обязательно сделайте общий анализ крови. Кстати, это поможет обнаружить первые проявления не только рака крови, но и других болезней, более серьезных, чем грипп и ОРЗ. "Раковые признаки" на этом анализе обычно настолько заметны (ведь лейкоз уже развивается минимум полгода!), что большинство участковых терапевтов их не пропускают. И направляют больного к специалисту гематоонкологу.
-Каковы общие принципы лечения лейкозов?
-Оно ведется по так называемым протоколам, то есть строжайшим правилам, оговаривающим каждое врачебное действие, каждое назначение лекарств. Их описывает книга объемом в несколько сотен страниц.
И лечат по ней в зависимости от ответа на три вопроса.
-Каков вид лейкоза?
-На какой он фазе своего развития?
-Какие в этом случае особенности клеток? (На этот вопрос можно ответить, только изучив хромосомно-генетические поломки внутри раковой клетки).
Итак, при текущей диагностике любого лейкоза решающее значение имеют не внешние симптомы, а три анализа, которые на эти три вопросы отвечают. Это, во-первых, исследование под микроскопом клеток, полученных пункцией, то есть уколом, прямо из костного мозга. Во-вторых, это иммунологический, а в-третьих, генетический тесты.
Теперь запомните очень важное. Лечить лейкозы в точности по протоколам можно лишь при условии, что сделан генетический тест. Если же вам делают только микроскопический и иммунологический анализ, пренебрегая генетическим, то риск врачебной ошибки резко возрастает. Но еще бывают просто возмутительные случаи, когда в отделении проводят всего лишь одно микроскопическое исследование клеток. От такого лечения бегите без оглядки!
— Так категорично…
-Да, потому что протоколы лечения лейкозов описывают применение примерно 15 лекарств-цитостатиков, которые при одном ваприанте лейкоза могут спасти пациенту жизнь, а при другом — только навредить. И препараты эти убивают не только кровяные, но любые быстроделящиеся клетки организма. К тому же их дозы при острых лейкозах и бластных кризах лейкозов хронических крайне высоки. Любая врачебная ошибка здесь чревата гибелью больного! Чтобы ее избежать и существуют протоколы.
— А пересадки костного мозга?
-Их сейчас применяют в основном при остром миелолейкозе, и лишь тогда, когда не помогают никакие лекарства. В Московской области ежегодно такие пересадки (стоимость каждой до 3,6 млн. рублей) нужны 10-15 детям. Средства на это выделяет областной бюджет. В других регионах России ситуация — где лучше, где хуже, но проблема решается в принципе также. А вот для взрослых ситуация сложнее. В поиске клиники для проведения трансплантации и средств для ее оплаты больному следует обратиться в областные, краевые, республиканские органы управления здравоохранением. И напомню тем, кто решился на такую операцию. Она необычайно опасна! При ее выполнении даже в лучших российских и иностранных клиниках погибает до 30% пациентов.
— Главные правила здорового образа жизни при лейкозах — это…
— Полное доверие и беспрекословное выполнение всех рекомендаций вашего лечащего врача.
Необходимо избегать любые инфекционные заболевания! Для это надо сократить до минимума контакты с окружающими. Детям — только домашний режим (школа, увы, исключена!), возможно общение лишь с ближайшими родственниками. Взрослым столь же жесткие ограничения нужны только на интенсивных этапах лечения. При хроническом лейкозе эти пациенты даже могут работать, но в периоды эпидемий гриппа и других инфекционных заболеваний придется остаться дома.
Пища должна быть богата животными белками. Поэтому надо есть мысо, рыбу, творог. Все продукты должны быть термически обработанными. Консервированная и жареная пища запрещена. В том числе и для больных лейкозами с повышенной потребностью в животных белках продаются специальные лечебные продукты, обогащенные кроме незаменимых аминокислот, минералами и витаминами.
Лейкозы — это большая группа заболеваний, при которой происходит поражение системы кроветворения (гемопоэза). Чтобы лучше понять, что происходит с организмом при лейкозе, сначала нужно понимать, как организована система гемопоэза.
ГСК может пойти развиваться по двум направлениям:
- Миелопоэтическому, при котором образуются миелоидные клетки. Они названы так из-за того, что основную дифференцировку проходят в костном мозге (myelos — мозг, отсюда и название). В эту группу входят эритроциты, гранулоциты (нейтрофилы, базофилы и эозинофилы), моноциты и тромбоциты.
- Лимфопоэтическому, при котором образуются лимфоидные клетки. В процессе развития, они помимо костного мозга проходят дифференцировку в лимфатических узлах, селезенке и тимусе.
Итак, ГСК в процессе развития проходит несколько стадий:
В зависимости от того, на каком этапе развития происходит сбой, выделяют острые и хронические лейкозы. При острых лейкозах сбой происходит на уровне незрелых клеток — бластов. Поэтому их еще называют бластными лейкозами. Они имеют агрессивное течение, поскольку опухолевые клетки не могут выполнять свои функции, что без лечения быстро приводит к гибели больного. При хронических лейкозах сбой дифференцировки происходит уже на стадии зрелых клеток, поэтому они имеют более доброкачественное течение.
В зависимости от того, какой росток кроветворения поврежден, выделяют следующие виды острых лейкозов:
- Острый миелобластный лейкоз — опухоль из миелоидного ростка кроветворения. Более характерен для пожилых людей, но может встречаться и у молодых пациентов.
- Острый промиелоцитарный лейкоз — это особый тип миелобластного лейкоза, при котором сбой происходит на уровне незрелых гранулоцитов — промиелобластов. Раньше это была фатальная форма лейкоза, при которой пациенты погибали в течение нескольких недель после постановки диагноза. Но сейчас, при появлении трансретиноевой кислоты, лечение этой формы патологии достигло колоссальных успехов.
- Острый монобластный лейкоз — поражается моноцитарная линии кроветворения.
- Эритромиелоз — поражается красный росток кроветворения — эритроцитарный.
- Острый мегакариобластный лейкоз — очень редкая форма миелоцитарного лейкоза. При нем происходит поражение тромбоцитарного ростка.
- Острый лимфобластный лейкоз — это форма лимфопоэтичекого лейкоза. При нем поражается лимфоцитарный росток кроветворения. Заболевание в больше мере характерно для детского возраста.
Причины возникновения острого лейкоза
Лейкозы возникают из-за мутации ГСК. При этом разные мутации проявляются на разных этапах гемопоэза. Следует сказать, что одного факта наличия мутации недостаточно. Вообще генетические поломки в клетках, в том числе и гемопоэтических, возникают регулярно, но существуют механизмы, которые либо уничтожают такие клетки, либо блокируют ее дальнейшее развитие. Чтобы развился лейкоз, нужны особые обстоятельства:
- Повторные мутации в уже мутировавшей ГСК.
- Ослабление иммунной защиты, при которой мутировавшая клетка остается нераспознанной и начинает активно размножаться. Такие промахи иммунитета могут возникнуть как в период внутриутробного развития, так и в процессе жизни взрослого человека.
Таким образом, к факторам риска развития острого лейкоза относят следующие:
- Наследственная предрасположенность.
- Вторичные и первичные иммунодефициты.
- Воздействие ионизирующего излучения — рентген, лучевая терапия и др.
- Некоторые химикаты.
- Некоторые лекарственные препараты, например, цитостатики, которые применяются для лечения злокачественных новообразований.
- Вирусы. В частности, доказана этиологическая роль вируса Эпштейна-Барр.
Методы лечения острых лейкозов
Лечение острых лейкозов проводится в соответствии с утвержденными протоколами и проходит в несколько стадий. Целью лечения является достижение стойкой полной ремиссии. В среднем, полный курс лечения занимает около 2-х лет. При развитии осложнений этот срок может увеличиваться.

Для подбора оптимальной схемы терапии, необходимо знать вид острого лейкоза, его молекулярно-генетический профиль и группу риска для пациента. При стандартной группе риска, лечение проводится в соответствии со следующей схемой:
В ряде случаев при неблагоприятном прогнозе или возникновении рецидива, обычных курсов химиотерапии бывает недостаточно. В связи с этим, используются дополнительные методы лечения.
Профилактика нейролейкоза — поражение головного и спинного мозга лейкозными клетками. С этой целью в спинномозговой канал вводят цитостатики и проводят лучевую терапию на область головного мозга.
Трансплантация гемопоэтических стволовых клеток. В ряде случае пациентам требуется проведение высокодозной полихимиотерапии. Ее назначают для преодоления опухолевой резистентности, при возникновении многократных рецидивов и др. Такое лечение очень мощное и позволяет уничтожить даже устойчивые опухолевые клетки. Однако такая терапия опустошает костный мозг (фабрику кровяных клеток), и он не может в быстрые сроки полноценно восстановить кроветворение. Чтобы преодолеть это состояние, производят трансплантацию гемопоэтических стволовых клеток. Их могут взять у пациента после этапа индукции или консолидации ремиссии. В этом случает трансплантация называется аутологичной. Если стволовые клетки берутся от донора, это называется аллогенной трансплантацией. В этом случае пациент получает иммунитет другого, здорового человека. Иммунные клетки будут атаковать оставшиеся опухолевые клетки, оказывая дополнительный лечебный эффект. Недостатком аллогенной трансплантации является риск развития реакции трансплантат против хозяина, когда иммунные клетки начинают атаковать организм реципиента, приводя к развитию различных осложнений.
Последствия (ремиссия и рецидив)
Еще несколько десятилетий назад острые лейкозы приводили к смерти пациента в течение 2-3 месяцев после постановки диагноза. На сегодняшний день ситуация кардинально изменилась благодаря появлению новых препаратов для лечения.
На данный момент в клинике острых лейкозов выделяют следующие стадии:
- Первая атака — в этот период происходит активное размножение опухолевых клеток в костном мозге и выход их в кровь. Именно на данном этапе происходит постановка диагноза. Симптомы заболевания будут определяться тем, какой кроветворный росток поражен. Как правило, это упорные инфекции, анемии, общая слабость, увеличение лимфатических узлов и др.
- Период ремиссии. Если острый лейкоз ответил на химиотерапию, опухолевые клетки уничтожаются, и кроветворение восстанавливается. Количество бластов в костном мозге приходит в норму и не превышает 5% от общего количества клеток. Выделяют несколько видов ремиссии, в зависимости от того, насколько полно подавлен опухолевый клон. В настоящее время целью лечения является достижение полной ремиссии в течение 5 лет. По истечении этого срока, пациент считается полностью здоровым.
- Рецидив. У некоторых пациентов возникает рецидив, при котором опять увеличивается количество бластов. Они опять выходят в кровоток и могут образовывать внекостномозговые очаги инфильтрации. Рецидивов может быть несколько, и с каждым разом их все сложнее ввести в ремиссию. Тем не менее, у многих пациентов удается добиться полной пятилетней ремиссии, даже после нескольких рецидивов.
- Терминальная стадия. О ней говорят, когда все используемые методы лечения острых лейкозов теряют свою эффективность и сдерживать опухолевый рост уже невозможно. Происходит полное угнетение кроветворной системы организма.
Паллиативная помощь
Для терапии острого лейкоза имеется большое количество методов лечения. Это может быть химиотерапия, таргетная терапия, иммунотерапия. Все эти методы могут привести к ремиссии даже после многократных рецидивов. Поэтому как таковая, паллиативная терапия назначается редко и, как правило, у возрастных пациентов, которые не могут перенести тяжелое лечение.
В этом случае используется химиотерапия, медикаментозная терапия и лучевая терапия.
Химиотерапия при паллиативном лечении проводится не с целью достижения ремиссии, а для удержания опухолевого клона от стремительного размножения. На этом этапе могут применяться стандартные цитостатические препараты в меньших дозировках, иммунотерапия, таргетная терапия и другие методы противоопухолевого лечения.

Лучевая терапия может применяться для облегчения болевого синдрома при сильном поражении костей, а также при наличии внекостномозговых очагов.
Устранение болевого синдрома
Для помощи пациентам с болевым синдромом применяют различные обезболивающие препараты, начиная от нестероидных противовоспалительных препаратов (тот же ибупрофен) и заканчивая легкими и/или тяжелыми наркотическими средствами. Уменьшить выраженность болевого синдрома помогает и лучевая терапия.
Профилактика инфекций
На терминальных стадиях у больных серьезно нарушено кроветворение, и, как следствие, нет полноценной защиты от всех видов инфекций — бактериальной, грибковой, вирусной, что может привести к гибели пациента. Инфекционные осложнения являются одной из ведущих причин смерти при терминальных стадиях лейкозов.
Для предотвращения заражения, рекомендуется тщательно соблюдать принципы гигиены — уход за полостью рта, антисептическая обработка рук как самого больного, так и ухаживающего персонала, назначение профилактических антибактериальных и противогрибковых препаратов.
Трансфузионная поддержка
При сильном угнетении кроветворения, развивается тяжелая анемия и тромбоцитопения. Для купирования этих состояний могут применяться трансфузии эритроцитарной и тромбоцитарной массы.
Раньше тромбомассу переливали при снижении количества тромбоцитов ниже 20*109/л. Но потом появились рекомендации, согласно которым тромбоцитарные трансфузии проводят при падении уровня тромбоцитов ниже 10*109/л. При более высоких цифрах назначение тромбомассы не приводит к снижению риска развития кровотечения.
При появлении признаков геморрагического синдрома, тромбоцитарную трансфузию начинают немедленно и при необходимости увеличивают ее объем. Признаки геморрагического синдрома:
- Наличие петехиальных высыпаний, особенно в полости рта и других слизистых.
- Повышение температуры при отсутствии очагов инфекции.
- Наличие кровотечения.
- Возникновение инфекции.
Трансфузии эритроцит-содержащих сред
У терминальных больных желательно поддерживать целевой уровень гемоглобина не ниже 80 г/л. Особое внимание уделяется пациентам с тромбоцитопениями. При развитии тяжелых анемий показано переливание эритромассы до достижения целевого уровня.
В настоящее время во всем мире принят принцип — если больного нельзя вылечить, это не значит, что ему нельзя помочь!
15 декабря 2015
- 1172
- 1,0
- 0
- 4
![]()
Юлия Кондратенко
- Генная инженерия
- Генная терапия
- Иммунология
- Онкология
Генетическую инженерию иммунных клеток успешно применили для борьбы с лейкозом. В этой статье рассказывается, какие генетические технологии помогут бороться с тяжелыми болезнями, если общество проникнется к передовым методикам бόльшим доверием.
В начале ноября 2015 года каждое уважающее себя издание написало об успешном излечении от лейкоза годовалой девочки Лейлы Ричардс [1–3]. Острый лимфобластный лейкоз плохо поддается лечению у таких маленьких детей, и обычная химиотерапия помогает им лишь в 25% случаев. Когда стало ясно, что химиотерапия не справилась, родители девочки начали настаивать, чтобы врачи не ограничивались стандартными методиками, а попробовали все возможные способы для ее спасения. Доктора связались с учеными, разработавшими экспериментальную терапию лейкоза, основанную на генетической модификации иммунных клеток. Технология мало того что применяла генную инженерию, к которой с таким опасением относится общественность, так еще и была опробована только на мышах. Членам комиссий по биоэтике и в страшном сне не может присниться одобрение такой методики для массового применения. Но случай Лейлы был исключением, потому что отработанными методами помочь ей уже точно не получалось. Девочке уже нечего было бы терять, и, если бы новый метод не помог ей резко пойти на поправку, мы бы никогда не услышали ее историю, как не слышим истории сотен тысяч других больных раком, которым не помогли никакие методы лечения.
И терапия сработала. Иммунные клетки донора модифицировали таким образом, чтобы они, во-первых, активно атаковали опухолевые клетки того типа рака, что диагностировали у Лейлы, а во-вторых, не причиняли вреда ее здоровым клеткам. Кроме того, модификации генома сделали донорские клетки устойчивыми к лекарствам, которые пациентка для страховки продолжала принимать, хотя они и не действовали на нее достаточно эффективно. Модифицированные иммуноциты донора помогли уничтожить опухолевые клетки и при этом не нанесли вреда здоровым тканям*. Когда все признаки присутствия опухоли пропали, Лейле пересадили подходящий донорский костный мозг, который начал производить новые клетки иммунной системы, сходные с ее собственными. Вновь заработавшая иммунная система уничтожила генетически модифицированные клетки, выполнившие свою задачу.
Этот случай — не первый, когда генное редактирование применяли у людей. Подобные технологии уже использовали в прошлом году, чтобы повысить устойчивость к вирусу иммунодефицита у нескольких ВИЧ-инфицированных [4]. Тот эксперимент тоже оказался удачным и улучшил показатели иммунитета пациентов. Тем не менее первый эпизод не вызвал такого общественного резонанса, как излечение Лейлы. Вероятно, здесь сыграла роль история маленькой больной девочки, которую терапия спасла от смерти буквально в последний момент. В первом же случае не было риска скорой смерти пациентов, которые к тому же были взрослыми.
Можно долго обсуждать, какие компоненты необходимы, чтобы привлечь к истории внимание публики, но в любом случае громкий успех генетической инженерии человеческих клеток очень важен для исследователей, разрабатывающих новые технологии. Благодаря этой счастливой истории, человечество еще на шаг приблизилось к медицине из фантастических романов. Самое интересное, что многие из технологий медицины будущего уже разработаны, но далеко не везде разрешены правительствами, одобрены комиссиями по этике или хотя бы вызывают доверие у простых граждан.
Компания Cellectis, создавшая клетки, которые вылечили острый лимфобластный лейкоз Лейлы, разрабатывает и другие полезные клеточные линии. Каждая из них нацелена на молекулы, характерные для определенного типа рака — к примеру, острого миелоидного лейкоза и миеломной болезни [5]. Сегодня мало кто верит, что возможно создать лекарство от всех видов рака, но Cellectis планирует выпустить целый арсенал иммунных клеток, подходящих для лечения различных его типов. Клеточные линии Cellectis — это наиболее мягкий вариант генно-инженерной терапии человеческих патологий, поскольку такие клетки применяются только для того, чтобы разобраться с проблемой, а затем уничтожаются иммуноцитами пересаженного костного мозга. В этом смысле первый эксперимент по применению генной терапии к ВИЧ-инфицированным выглядит более радикальным: тогда изменяли собственные клетки крови пациентов, которые после модификации и возвращения в кровоток не планировалось оттуда удалять [6]. На самом деле ученые даже рассчитывали, что модифицированные клетки в теле испытуемых размножатся, поскольку будут устойчивы к ВИЧ. Эти ожидания оправдались. Компания Sangamo, разработавшая терапию против ВИЧ, сообщает, что половина из дюжины участников первого эксперимента уже прекратили принимать противовирусные препараты, при этом их уровень Т-клеток, которые раньше атаковал вирус, остается высоким. Сейчас Sangamo дополнительно проверяет свою технологию еще на 70 пациентах [3].
По сравнению с применением модифицированных клеток крови, которые при необходимости можно убрать из организма (что и произошло с модифицированными иммуноцитами после того, как они справились с лейкозом Лейлы), модифицировать клетки в составе органов намного рискованнее. Во-первых, крайне трудно гарантировать, что вирусные векторы, используемые для доставки систем модификации генов, не проникнут куда-то еще, кроме клеток-мишеней. В некоторых случаях модификация лишних клеток может быть опасной: к примеру, если целью являются клетки опухоли, которые нужно заставить прекратить деления, а модифицируются заодно и стволовые клетки, деления которых очень важны для здоровья организма. Другой важный момент — способность вирусных векторов долго оставаться в состоянии боевой готовности. В теории такие модифицирующие агенты могут сохранять активность годами, что не всегда полезно. Наконец, системы генетической модификации, не похожие на родные белки организма, могут вызывать иммунный ответ, что в сочетании с долгим сроком жизни агентов доставки ДНК может привести к хроническому воспалению и другим неприятным патологиям иммунитета.
В общем, биоинженерам еще есть над чем работать, но каждый удачный эксперимент, особенно на людях, повышает доверие общественности к их разработкам, и стимулирует ученых тянуть наш мир в будущее еще активнее.
Читайте также:


