Генетическая теория рака ретротранспозоны
Рак – генетическая болезнь. Существует 3 основные компоненты:
Современная теория рака – теория онкогенов.
В 1970 году была открыта обратная транскриптаза – фермент катализирующий синтез ДНК на матрице РНК. Когда вирус попадает в клетку хозяина, обратная транскриптаза (= РНК зависимая ДНК полимераза, = ревертаза) обеспечивает синтез комплементарной ДНК на матрице вирусной РНК, подготавливая её для интеграции в геном клетки инфицированного организма. Ретровирусы содержат 2 копии одноцепочечных молекул РНК генома, т.е. вирусы этого типа являются единственной разновидностью диплоидных вирусов. Впервые такой вирус был описан Раусом в 1911 году, обнаружившим инфекционную саркому у кур. ДНК копии ретровирусного генома встраиваются в ДНК хромосом клеток инфицированного хозяина в виде провируса. В 1970 году были получены данные, что вирус саркомы Рауса содержит гены (онкогены), транскрипция которых вызывает злокачественные перерождения инфицированных клеток.
Первый онкоген из саркомы кур src – ген вируса который может проникать даже без участия вируса, был выделен в 1981 году. Введение его в клетку без вируса вызывало трансформацию клетки. Т.е. вирусы вызывали опухоль не сами по себе, а внося в генетический аппарат онкоген и закрепляя его а геноме. Изменённые свойства опухолевых клеток наследуются т.к. провирус реплицируется вместе с хромосомой клетки хозяина. На ДНК-копии ретровирусов строится РНК-копия, которая в дальнейшем включается в вирион (вирусная частица) или служит промежуточной стадией для перемещения вируса в новую точку локализации. Мигрируя некоторые вирусы могут переносить гены хозяина не только в новое место в геноме, но и в другой организм. Это явление – горизонтальный перенос генов. Побывав в геноме вируса, прежде нормальные гены хозяинапреобретают трансформирующую возможность, т.е. становятся онкогенами. Методами молекулярной биологии было показано, что онкогены имеют сходное строение с нормальными генами человека и животных. Т.о. современная теория рака – теория онкогенов.
Мутагенез и канцерогенез – это сопряженные представления. Кроме ДНК – РНК вирусы способны вызывать раковые опухоли, перемещаясь по гену с помощью обратной транскрипции. В эволюции сформировались механизмы защиты от трансформации злокачественных клеток – гену супрессоры опухоли (P53).
18. Подкласс Lamiidae, Asteridae: краткая характеристика основных семейств (представители, распространение, жизненные формы, особенности вегетативных органов, строение цветка, тип плода, значение).
Семейство Solonaceae – Паслёновые
Травянистые растения, полукустарники или кустарники. В тропиках – деревья. Листья простые, цельные или более менее глубоко расчлененный, без прилистников, в основном очередные, но наблюдается попарное и даже супротивное расположение листьев. Такое расположение листьев сопряжено с внепазушным расположением боковых побегов. Соцветия паслёновых цимозные, обычно завитки. Цветки правильные или более менее зигоморфные. Чашечка, венчик и андроцей 5 членные. Тычинки расположены между лепестками. Гинецей из 2 плодолистиков. Завязь верхняя двугнёздная. Плод ягода или коробочка.
Косое положение плодолистиков – отличие от норичниковых.
Solanum tuberosum L.
Картофель клубненосный. Листья очередные, непарноперисто раздельные, чашечка сростнолистная, глубокораздельная, венчик спайнолепестный, тычиночные нити короткие, прикреплённые к трубке венчика, пыльники конусовидно сложены, плод ягода.
Hyoscyamus niger L. Белена чёрная. Крупные грязно – белые цветки с тёмными жилками, косоворонковидный венчик, плод двугнёздная коробочка, вскрывающаяся крышечкой. Ядовит.
Lycopersicon esculentum Mill. Томат. Плод ягода.
Nicotiana rustica L. Табак-мохорка, плод коробочка.
Phisalis sp. Плод красная сочная ягода, заключённое в шаровидную разрастающуюся чашечку.
Atropa belladonna – лекарственное растение.
Семейство Scrophulariaceae Норичниковые
Травянистые растения или полукустарники, реже кустарники, ещё реже деревья или лианы. Листья простые, без прилистников, очередные или супротивные, иногда мутовчатые. Завязь верхняя, двугнёздная с плацентами, связанными с перегородкой, разделяющей гнёзда. Семяпочки многочисленные. У основания завязи имеется медоотделительный диск, кольцевидный или иногда односторонний. Плод коробочка или ягода. Медиальное расположение плодолистиков у норичниковых – отличие от паслёновых. Распространены повсеместно, главным образом в пределах умеренных широт. Большого практического значения не имеют, но некоторые используются в медицине и как декоративные.
Verbascum thapciforme Schad. Коровяк высокий. Листья простые, без прилистников, цветки слабозигоморфные, тычиночные нити неодинаковые, тёмноокрашенные, плод – округло-яйцевидная коробочка.
Подсемейство Scorophularioideae Норичниковые
Linaria vulgaris Mill. Льнянка обыкновенная (листья очередные, ланцетные, цветки в кистевидных соцветиях, резко зигоморфные, тычинки двусильные, есть шпорец, плод коробочка).
Veronica chamaedrys L. Норичник шишковатый (цветки буровато-зелёные, зигоморфные, андроцей четырёхчленный, пятая тычинка превращена в стаминодий).
Digitalis sp. Наперстнянка (широколанцетные листья собраны в розетку, стебель заканчивается односторонним соцветием из крупных колокольчатых жёлтых цветков, венчик 4-х лопастной, плод коробочка).
Подсемейство Rhinanthoideae Погремковые
Rhinanthus serotinus Onobry. Погремок поздний (полупаразит, слабо ветвящийся стебель, супротивные листья, венчик жёлтый; чашечка вздутая, остающаяся при плоде, плод коробочка сжатая с боков).
Семейство Labiatae Губоцветные
Одной из характерных особенностей губоцветных является опушение железистыми волосками, биохимически они характеризуются как эфиромасличные растения.
Подсемейство Lamioideae Яснотковые
Lamium purpureum L. Яснотка пурпурная (четырёхгранный стебель, супротивные листья, листовые пластинки с зубчатым краем; цветки обоеполые, собраны в ложные мутовки, зигоморфные, двугубые; тычинки двусильные; плод ценобий).
Mentha spp. Слабо зигоморфный четырёхраздельный венчик, тычинки одинаковой длины.
Salvia spp. Шалфей (двугубый венчик, только 2 тычинки).
Подсемейство Ajugoideae Живучковые
Ajuga genevensis L. Живучка женевская (венчик с короткой недоразвитой верхней губой).
Семейство Boraginaceae Бурачниковые
Borago officinalis L. Бурачник лекарственный. Листья простые, очередные, покрыты жёсткими одноклеточными волосками, крупные синие цветки собраны в соцветие завиток, плод дробный четырёхорешек – ценобий.
Sumphytum officinale L. Окопник лекарственный. Цветки буроватые с колокольчатым венчиком, в зеве которого видны крупные белые чешуйки.
Pulmonaria obscura Dum. Медуница неясная. Прикорневые листья грубоопушённые, внезапно суженные в черешок, стебель с соцветиями в начале из розовых, впоследствии синеющих цветков.
Подкласс Asteridae Астериды
Семейство Asteraceae Астровые (сложноцветные)
Подсемейство Asteraceae Астровые
Leucanthemum vulgare Lam. Нивяник обыкновенный. Ортотропный побег покрыт простыми цельными листьями с зубчатым краем, созвездие – гетерогамная корзинка, краевой цветок ложноязычковый, срединный – трубчатый, завязь нижняя, плод семянка.
Helianthus annuus L. Подсолнечник. Краевой цветок – ложноязычковый, срединный – трубчатый.
Centaurea cyanus L. Василёк синий. Краевой воронковидный бесполый цветок
Tanacetum vulgare L. Пижма обыкновенная. Гомогамные корзинки, состоящие только из трубчатых цветков.
Artemisia spp. Полынь. Соцветия – только изтрубчатых цветков, собраны в метельчатые соцветия.
Подсемейство Cichorioideae Цикориевые
Taraxacum officinale Wigg. Одуванчик лекарственный. Корзинки одиночные на верхушках безлистных стеблей. Все листья прикорневые, есть млечники, язычковый обоеполый цветок, плод – семянка с паппусом (хохолком).
Cichorium intybus L. Листья очередные, корзинки гомогамные, все цветки язычковые.
Онкологические заболевания – это процессы, связанные с развитием раковых опухолей в различных тканях. Обычно раковые опухоли развиваются в тех тканях, в которых клетки интенсивно делятся. Известно около 100 типов раковых опухолей, из них наиболее часты встречающиеся: раки легких, молочной железы, толстой кишки, простаты и матки. Смертность от рака составляет 20% смертности в развитых странах.
Раковые опухоли – это скопления интенсивно делящихся клеток. Процесс развития раковой опухоли называется канцерогенез. Начинается канцерогенез с нарушений клеточного цикла одной-единственной клетки, которая начинает интенсивно делиться (пролиферировать). К моменту обнаружения раковой опухоли путем рентгеноскопии в ее состав входит около 10 миллионов клеток (диаметр опухоли
1 мм), к моменту обнаружения путем пальпирования
миллиард клеток (диаметр опухоли
10 мм), при достижении опухолью размера 10 см (
триллиард клеток) наступает летальный исход.
Достаточно условно все раковые опухоли подразделяются на доброкачественные и злокачественные. Доброкачественные опухоли развиваются медленно, и образующие их клетки располагаются компактно. Одной из основных особенностей злокачественных опухолей является относительная автономность раковых клеток, их способность к неограниченному числу делений, обособление и способность метастазировать (разноситься по всему организму). Раковые клетки не подчиняются контрольным механизмам, регулирующим жизнедеятельность нормальных клеток.
Раковые заболевания вызывают самые разнообразные факторы – канцерогены. С помощью близнецового метода показано, что в развитии раковых заболеваний человека значение внешних факторов исключительно велико.
К физическим канцерогенам относятся: ионизирующее излучение, ультрафиолет, температурные и механические воздействия. При облучении покровов организма развивается рак кожи, при общем облучении – лейкозы, опухоли костей, рак щитовидной железы, при вдыхании радиоактивной пыли – рак легких.
К химическим канцерогенам относятся самые разнообразные органические вещества: от четыреххлористого углерода до сложных полициклических и гетероциклических соединений. Например, смолы табачного дыма провоцируют рак легких (плоскоклеточную карциному), причем заболевание интенсивно развивается у курильщиков с 10…20-летним стажем.
К биологическим канцерогенам относятся вирусы и их производные (провирусы). В клетках позвоночных животных присутствуют десятки встроенных в хромосомы геномов ДНК-содержащих опухолеродных вирусов (провирусов). Доказана вирусная природа рака молочной железы у мышей. Считается, что вирусы могут провоцировать раковые заболевания у человека (например, вирус гепатита – рак печени), однако это положение не доказано.
Заметим, что часто канцерогенами являются известные мутагены.
В то же время, рак – это генетическое заболевание. Злокачественность, т.е. способность одной или многих клеток приводить к развитию опухолей и метастазированию, передается в ряду соматических клеток. Известны случаи семейных раков (опухоли желудка, молочной железы, легких, матки и т. д.). Однако по наследству передается не сам рак, а лишь предрасположенности к раковым заболеваниям. В некоторых популяциях частота отдельных раковых заболеваний значительно ниже средней (в окрестностях Бомбея в 200 раз реже встречается рак кожи, в Нигерии – в 300 раз реже рак пищевода, в Англии – в 100 раз реже рак печени). К эндогенным генетическим факторам канцерогенеза относятся мобильные элементы генома: эндогенные провирусы, транспозоны и ретротранспозоны.
Генетические причины раковых заболеваний могут быть самыми различными, поэтому существует несколько генетических теорий рака.
В начале XX в. Бовери предложил, что рак обусловлен нарушениями в ядре клетки. Вскоре Де Фриз обосновал мутационную теорию рака, в которой подчеркивалась роль генных и хромосомных соматических мутаций в этиологии рака. В середине XX в. российский вирусолог Л. А. Зильбер сформулировал вирусо-генетическую теорию, согласно которой генетический материал онкогенных вирусов встраивается в хромосому клетки. Такое изменение генома, точнее отдельных, немногих локусов, нарушает биохимический механизм клеток, они приобретают автономность и начинают усиленно делиться.
В 1980-1990-е гг. мутационная и вирусо-генетическая теории развития опухолей были объединены. Согласно синтетической генетической теории причиной рака являются самые разнообразные повреждения в генах, отвечающих за деление и дифференцировку клеток. Выявлено три группы таких генов.
1 группа – онкогены. В состав генома входят гены, активирующие деление клеток на ранних этапах эмбриогенеза – протоонкогены. У сформировавшегося организма эти гены находятся в функционально неактивном состоянии либо очень слабоактивны. Однако под воздействием внешних факторов (канцерогенов) или спонтанной перестройки структуры регулирующих участков ДНК (например, за счет инсерционного мутагенеза – вставки мобильных генетических элементов) экспрессия этих генов резко усиливается, и протоонкогены превращаются в онкогены.
2 группа – гены-супрессоры клеточных делений. В норме эти гены нормально функционируют, и их продукты ограничивают число клеточных делений. Однако под влиянием перечисленных факторов гены-супрессоры выключаются, и клетки начинают неограниченно делиться.
3 группа – гены, контролирующие упорядоченность структуры ДНК, например, гены репарации ДНК. Нарушения их функциональной активности приводит к повреждениям регуляторных последовательностей.
В настоящее время продолжается изучение причин раковых заболеваний и разработка мер по их профилактике.
Вирус - фактор генетического воздействия, наделяющий клетку способностью к безграничному размножению.


Изучение этиологии онкологических заболеваний длится уже много десятилетий. В результате этих исследований были обнаружены онкогенные вирусы. Их роль в возникновении онкологических заболеваний была продемонстрирована на многих моделях: саркоме Рауса у кур, папилломе и раке кожи у кроликов, лимфоме у цыплят. Однако еще в прежние времена у всех исследователей возникал вопрос: куда исчезает вирус после злокачественного перерождения клетки?. Ни один метод не мог его обнаружить в раковой клетке.
Противоречие удалось объяснить русскому ученому Л.А. Зильберу - создателю вирусно-генетической теории происхождения злокачественных опухолей.
Для трансформации нормальной клетки в опухолевую необходимо взаимодействие генома вируса и клетки, в результате которого образуется новый комплексный геном и вирус "исчезает" из клетки, оставаясь в ее ядре в виде провируса. Было выявлено, что процесс злокачественного перерождения зависит как от вируса, так и от клетки-хозяина.
Благодаря развитию молекулярной биологии установлено, что в нормальных клетках существует семейство генов- протоонкогенов. Эти гены необходимы для регуляции и размножения клеток. Их продуктами являются различные протеокиназы и факторы транскрипции. Различные внешние факторы могут воздействовать на протоонкоген клетки и вызывать его превращение в онкоген. Под их влиянием включается генетический механизм перерождения нормальной клетки в злокачественную.
Одним из факторов генетического воздействия на геном клетки могут быть вирусы, которые могут содержать (onc+) или не содержать онкоген (onc-). Вирус onc+, интегрируясь в хромосому клетки, одновременно вносит в нее онкоген со всеми вытекающими последствиями для клетки. Онкоген вируса, соединившись с хромосомой клетки, наделяет ее способностью к безграничному размножению.
Вирус onc-, проникнув в клетку на первом этапе взаимодействия генома с геном клетки-хозяина, не вызывает ее трансформации. Однако развитие событий зависит от локализации этого контакта. Если вирус onc- интегрируется в хромосому рядом с одним из протоонкогенов, он подчиняет его работу своему промотору. Выходя из хромосомы, вирусный геном захватывает с собой протоонкоген, который становится его составной частью и превращает вирус onc- в вирус onc+. Клеточный онкоген выходит из-под контроля материнской клетки. Интегрируясь в хромосому другой клетки, вновь образованный вирус onc+ одновременно вносит в нее онкоген и активирует трансформацию клетки в злокачественную.
В дальнейшем оказалось, что онкогенез вирусов зависит от реакции клетки. Гены p53 и Rb кодируют опухоль-супрессирующие белки. Ген р53 является супрессором опухолевого роста. В результате его деятельности происходить ограничение размножения клеток. Rb- ген кодирует белок, контролирующий клеточную пролиферацию. В результате его деятельности замедляется клеточная пролиферация.
Против вирусно-генетической теории может свидетельствовать наличие онкогенных свойств не только у ДНК-содержащих, но и у РНК-содержащих вирусов, что исключает включение РНК-генома вируса в ДНК-геном клетки хозяина. Однако это противоречие было устранено после открытия РНК-зависимой ДНК-полимеразы, которая на базе вирионных РНК синтезирует ДНК-копию, способную к интеграции с ДНК-геномом клетки. Механизм онкогенеза реализуется в результате активации протоонкогена включением в геном клетки ДНК- провируса. Роль вируса в злокачественном перерождении клеток сводится к пусковому механизму онкогенеза.
Рак — одна из наиболее частых и серьезных болезней, наблюдаемых в клинической медицине. Статистика показывает, что некоторые формы рака встречаются у более чем одной трети людей, вызывая более 20% всех смертей, и в развитых странах требуют более 10% общих расходов на медицинское обслуживание. Раковые опухоли при отсутствии лечения всегда приводят к летальному исходу.
Ранняя диагностика и раннее лечение жизненно необходимы, и немаловажная цель исследования рака — выявление людей с повышенным риском раковых опухолей до их развития.
В дальнейших статьях на нашем сайте МедУнивер попробуем разобраться, каким образом молекулярно-генетические исследования показывают, что рак — в основном генетическая болезнь. Во-первых, опишем типы генов, вовлеченных в развитие рака, и механизмы, благодаря которым дисфункция этих генов может заканчиваться болезнью.
Во-вторых, рассмотрим множество наследуемых онкологических синдромов и покажем, как понимание их патогенеза высветило основу более частых спорадических форм рака. Мы также изучим некоторые специальные проблемы, возникающие в медицинской генетике и генетическом консультировании в связи с наследуемыми синдромами.
В-третьих, покажем, как генетика и геномика изменили наши представления о причинах рака и методах его диагностики и лечения. Геномика за счет идентификации конкретных делеций и дупликаций сегментов генома раковых клеток и полного анализа экспрессии генов и мутаций в раковых клетках действительно изменила диагностику и лечение рака.
Рак — не одно заболевание, это название используют для обозначения злокачественных новообразований, характеризующихся неконтролируемым клеточным ростом, приводящим к их развитию. Новообразование, чтобы быть раком, должно также быть злокачественным.
Это означает, что его рост больше не контролируется, и опухоль способна прорастать смежные ткани или распространяться (метастазировать) в более отдаленные участки, или и то, и другое одновременно. Опухоли, не способные к прорастанию или метастазированию, не относятся к раковым и называются доброкачественными опухолями, хотя их размер и расположение могут вызывать беспокойство, но в целом они благоприятны для пациента.
Существует три основных формы злокачественных новоообразований: саркомы, когда опухоль возникает в мезенхимальной ткани, например в костях, мышцах, соединительной ткани или в тканях нервной системы; карциномы, возникающие в эпителиальной ткани, скажем, в эпителии клеток кишечника, бронхов или протоках грудной железы; и злокачественные неоплазии гемопоэтической и лимфоидной ткани, например лейкозы и лимфомы, захватывающие костный мозг, лимфатическую систему и периферическую кровь.
В пределах каждой из этих основных групп опухоли классифицируются по их расположению, типу ткани, гистологическим проявлениям и степени злокачественности.
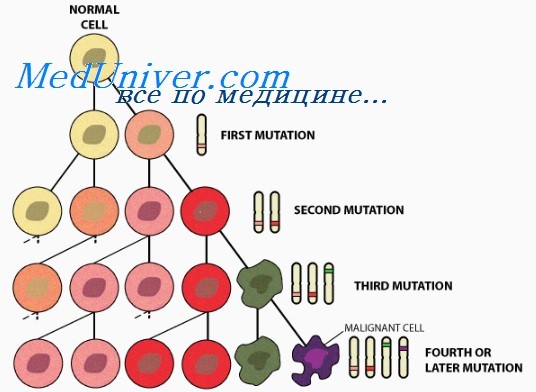
• Независимо от того, появился рак спорадически, в результате соматической мутации или у многих членов одной семьи как наследственный признак, это генетическое заболевание.
• Онкоген — мутантный аллель протоонкогена, класса нормальных генов, кодирующих белки клетки, обеспечивающие рост и выживание клеток. Онкогены облегчают злокачественное перерождение, стимулируя пролиферацию или тормозя апоптоз. Онкогены кодируют такие белки, как:
- белки сигнальных путей пролиферации клеток;
- факторы транскрипции, управляющие экспрессией обеспечивающих рост генов;
- ингибиторы механизмов программируемой смерти клетки.
• Развитие опухоли. После появления рак развивается, накапливая генетические поломки, благодаря мутациям или эпигенетическому подавлению генов ХКЦ, кодирующих механизмы репарации поврежденной ДНК и поддерживающих цитогенетически нормальное состояние. Другое последствие генетических дефектов — изменение экспрессии генов, приводящее к васкуляризации и распространению опухоли инвазивным ростом и метастазированием.
Наиболее опасным ретротранспозоном геномов млекопитающих является длинный диспергированный ядерный элемент-1 (LINE-1, или L1). Длина L1 ретротранспозонов немного больше 6 килобаз (тысяч нуклеотидов, т.н.), при этом они кодируют РНК-связывающий белок и фермент эндонуклеазу с активностью обратной транскриптазы, обеспечивающий возможность автономной репликации в геноме хозяина через синтез промежуточной молекулы РНК. Геном человека содержит более 500 000 копий L1 ретротранспозонов. Несмотря на то, что подавляющая их часть инактивирована в результате укорочения, мутации или внутренней реорганизации, по оценкам специалистов, репликационную активность сохраняют примерно 100 копий L1 ретротранспозонов на ядерный геном. Однако, несмотря на свою многочисленность, L1 ретротранспозоны не так уж безобидны. Напротив, их активность и даже само их присутствие таит реальную угрозу для хозяина, повышая риск повреждения ДНК, а также развития рака и других заболеваний. Учитывая последствия активности L1 ретротранспозонов, совсем неудивительно, что геномы затрачивают значительные усилия на ее подавление. Каждому из этапов жизненного цикла L1 ретротранспозонов препятствуют какие-либо обусловленные активностью генома-хозяина факторы, такие как подавление экспрессии генов, механизмы защиты от вирусов, малые РНК и аутофагия.
Количество фактов, свидетельствующих в пользу этой идеи, постоянно увеличивается. Для стареющих тканей характерно увеличение частоты повреждений ДНК и мутагенеза, тогда как известно, что результатом этого является повышение активности L1 элементов. Помимо этого результаты небольшого количества исследований свидетельствуют о том, что гиперэкспрессия L1 ретротранспозонов может приводить к физиологическому старению клеток, являющемуся характерным признаком стареющих тканей. Роль L1 элементов в запуске ассоциированных с возрастом процессов на сегодняшний день является вопросом, требующим детального изучения.
Подавление экспрессии L1 ретротранспозонов
Наиболее очевидной угрозой, которую кроют в себе L1 ретротранспозоны, является риск появления мутагенных вставок. В зависимости от того, в какое место генома он встраивается, ретротранспозон может, например, сделать клетку предрасположенной к злокачественному перерождению. Фактически увеличенное количество копий и повышенная активность L1 ретротранспозонов является характерным признаком злокачественности генома. Более того, установлено, что множество генетических заболеваний человека возникают в результате обусловленного L1 ретротранспозонами мутагенеза. Однако L1 ретротранспозоны располагают еще целым арсеналом механизмов разрушения генома хозяина. Кодируемая ими эндонуклеаза может вызывать одноцепочечные разрывы ДНК, например, нетранслируемая область L1 ретротранспозонов 5’ (5’ UTR) способна нарушать транскрипцию смежных с ней генов хозяина, а наличие обширных регионов, представленных исключительно ДНК L1 ретротранспозонов, может приводить к ошибкам рекомбинации. Так как нестабильность генома и повреждения ДНК являются ключевыми характеристиками старения, совсем не трудно предположить, какая роль в молекулярной этиологии процесса старения может принадлежать L1 ретротранспозонам.
Возможно, наиболее наглядным доказательством вовлеченности ретротранспозонов в процесс старения является существование взаимосвязи между активностью гена долголетия SIRT6 и подавлением активности L1 ретротранспозонов в соматических тканях. SIRT6 кодирует необходимый для предупреждения старения фермент, поддерживающий длину теломер, способствующий восстановлению повреждений ДНК, регулирующий метаболизм, препятствующий онкогенезу и подавляющий воспаление. Все эти механизмы ассоциированы с предотвращением возрастного угасания организма. Не имеющие гена SIRT6 мыши страдают от синдрома выраженного преждевременного старения, тогда как мыши с гиперэкспрессией SIRT6 отличаются долголетием. Совсем недавно было установлено, что SIRT6 играет ключевую роль в поддержании неактивного состояния L1 ретротранспозонов в тканях молодых мышей и не вступивших в фазу физиологического старения человеческих клеток посредством упаковки ретротранспозонов в недоступный для транскрипции хроматин [1]. Для этого SIRT6 связывается с областью 5’ UTR L1 элемента и запускает сборку белков гетерохроматина в регионе промотора ретротранспозона. По окончании сборки этот механизм подавления активности генов насыщает 5’ UTR регион L1 элемента и ассоциированный с ним хроматин эпигенетическими модификациями, предотвращающими запуск экспрессии ретротранспозона
Лишенный возможности экспрессироваться L1 ретротранспозон не способен синтезировать паразитические механизмы, необходимые для запуска его собственной репликации. Это защищает клетку-хозяина от появления новых мутаций. Кроме того, гетерохроматинизация ограничивает способность L1 ретротранспозона изменять экспрессию генов хозяина и индуцировать ошибки рекомбинации. При удалении гена SIRT6 из клеток мышей или его нокаутировании в клетках человека 5’ UTR регион L1 элементов избегает гетерохроматинизации, что приводит к выраженному усилению транскрипции L1 ретротранспозонов и появлению новых вставок этих элементов в ДНК.
Интересен тот факт, что с возрастом механизм, посредством которого SIRT6 подавляет активность L1 ретротранспозонов, утрачивает эффективность. В процессе старения SIRT6 исчезает из 5’ UTR регионов L1 ретротранспозонов, что приводит к де-гетерохроматинизации этих генетических элементов (см. рисунок).

Исчезновение подавляющего активность хроматина возвращает L1 ретротранспозонам способность к транскрипции во многих тканях стареющих мышей, а также в человеческих клетках, вступивших в фазу физиологического старения. Однако что именно из происходящего в процессе старения лишает SIRT6 способности эффективно защищать стареющие клетки от опасных геномных паразитов?
Одно из объяснений этой несостоятельности может быть связано с ключевой ролью, принадлежащей SIRT6 в восстановлении повреждений ДНК. Результаты нескольких исследований свидетельствуют о том, что SIRT6 катализирует восстановление многих типов повреждений ДНК, в том числе одно- и двухцепочечных разрывов. Характерным признаком стареющих клеток является увеличение количества повреждений ДНК. Возможно, что в нормальных условиях SIRT6 остается связанным с промотором L1 ретротранспозона для подавления активности геномного паразита, однако при возникновении повреждения ДНК этот фермент покидает последовательность L1 элемента для того, чтобы облегчить процесс восстановления ДНК в зоне повреждения. Это предоставляет L1 ретротранспозонам возможность реплицироваться. Данная модель подтверждается наблюдениями, согласно которым при воздействии на клетки повреждающими ДНК агентами, такими как пероксид водорода или гербицид паракват, SIRT6 исчезает из последовательностей L1 ретротранспозонов, что сопровождается увеличением его концентрации в зонах повреждений.
Еще несколько факторов потенциально могут снижать способность SIRT6 подавлять активность L1 ретротранспозонов в стареющих клетках. Например, SIRT6 не может проявлять свою ферментативную активность в отсутствие субстрата, известного как NAD+. Уровень этого метаболита снижается в стареющих клетках, что, возможно, приводит к уменьшению эффективности функционирования SIRT6. Более того, уровень экспрессии SIRT6 в различных типах клеток и тканей снижается с возрастом. Меньшая доступность этого белка также может усугублять возрастное снижение уровня подавления активности L1 элементов.
Вовлеченность в процесс старения
Происходящее в подверженных стрессу или стареющих клетках изменение локализации SIRT6 созвучно с теорией старения, известной как теория изменения локализации модификаторов хроматина. Эта теория была изначально предложена в 1998 году японскими исследователями Хироаки Китано (Hiroaki Kitano) и Шиничиро Имаи (Shinichiro Imai) [2] и окончательно сформулирована десятилетие спустя Филиппом Обердерффером (Philipp Oberdoerffer) и Дэвидом Синклером (David Sinclair) из медицинской школы Гарвардского университета [3]. Согласно этой теории, тогда как мобилизация модифицирующих хроматин белков, таких как SIRT6, происходящая в ответ на стрессовые воздействия, полезна для молодых организмов, перераспределение этих элементов может запускать губительные возрастные изменения. С этой точки зрения мобилизация SIRT6 в зоны повреждения ДНК и последующее высвобождение L1 ретротранспозонов может приводить к манифестации возрастных фенотипов и патологий. Например, повышенная активность L1 ретротранспозонов может способствовать появлению нестабильности генома, являющейся ключевым фенотипом стареющих клеток. Это является результатом мутагенеза ДНК, проявляющегося появлением новых вставок, и запуска процесса повреждения ДНК, опосредуемого экспрессией эндонуклеазы L1 ретротранспозонов. Более того, вызываемый повреждениями ДНК выход SIRT6 из L1 элементов запускает порочный круг: индуцируемые L1 ретротранспозонами повреждения ДНК заставляют SIRT6 покидать все новые L1 элементы, что еще больше усиливает активность L1 ретротранспозонов и, соответственно, приводит к появлению новых повреждений ДНК. Аналогичным образом L1 ретротранспозоны могут нарушать гомеостаз клетки посредством индукции процесса дисрегуляции генной экспрессии или блокирования транскрипционных механизмов клетки-хозяина. Это подтверждается наблюдениями, согласно которым гиперэкспрессии экзогенных L1 ретротранспозонов достаточно для запуска вступления человеческих фибробластов и стволовых клеток в индуцированную стрессом фазу физиологического старения [4].
Предположение, согласно которому восстановление активности L1 ретротранспозонов может способствовать развитию возрастных патологий, выглядит особенно правдоподобным, если принимать во внимание тот факт, что для тканей головного мозга (в особенности гиппокампа и полосатого тела), печени и скелетной мускулатуры особенно характерно возрастное усиление активности L1 элементов. Каждая из этих тканей играет важную роль в поддержании гомеостаза организма на уровне множества сигнальных путей и демонстрирует выраженное угасание функций по мере его старения. Например, весьма привлекательным выглядит предположение, что повышенная активность L1 ретротранспозонов и ассоциированные с ней повреждения ДНК, воспаление и нарушение работы механизмов транскрипции способствуют развитию атрофии и нечувствительности к опосредуемым инсулином сигналам, характерным для скелетной мускулатуры стареющего организма. Схожим образом L1 ретротранспозиция в клетках стареющего мозга может быть еще одним любопытным, но малоизученным механизмом, который может объяснить множество проявлений, ассоциированных со старением нервной системы.
Результаты ряда исследований указывают на то, что новые вставки ретротранспозонов в нервной системе преимущественно поражают активно транскрибируемые гены в клетках головного мозга, в особенности гены допаминовых рецепторов, переносчиков аминокислот и гены, регулирующие синаптическую передачу. Рассматривая этот факт в комплексе с оценочными данными, согласно которым количество новых вставок L1 ретротранспозонов на нервную клетку в определенных регионах мозга может достигать от 80 до 800 [5], можно говорить о существовании мощного механизма, посредством которого эти ретротранспозоны способны модулировать неврологическую активность и способствовать возрастному угасанию неврологических функций. В соответствии с этой идеей для целого ряда неврологических заболеваний, в том числе синдрома Ретта, синдрома Смита-Магениса и шизофрении, характерна повышенная активность L1 ретротранспозонов [6]. С учетом наблюдения, согласно которому активность L1 элементов повышена в стареющем мозге, напрашивается предположение, что восстановление активности L1 ретротранспозонов может способствовать развитию возрастных патологий нервной системы, начиная от рака и заканчивая нейродегенеративными заболеваниями, в особенности различными видами ассоциированного со старением слабоумия.
В целом вырисовываются две четки картины, описывающие биологию L1 ретротранспозонов. Во-первых, L1 элементы вне всякого сомнения активны в соматических тканях. Поскольку исторически они игнорировались в соматическом контексте, спектр их активности требует проведения серьезных исследований, посвященных изучению биологической важности данных генетических элементов. Во-вторых, активность L1 ретротранспозонов может иметь исключительную важность в контексте биологии старения. Повышенная активность L1 элементов ассоциирована со старением множества тканей, а открытие того факта, что SIRT6 является связующим звеном между L1 ретротранспозонами и старением, предоставляет исследователям платформу для дальнейшего изучения относительного вклада активности L1 ретротранспозонов в механизмы старения.
Существует несколько терапевтических векторов, позволяющих исследователям ослаблять активность L1 ретротранспозонов и, возможно, замедлять развитие вызываемых ими патологий, ассоциированных со старением. Например, при проведении серии экспериментов исследователи установили, что гиперэкспрессии SIRT6 достаточно для подавления активности L1 ретротранспозонов и их возвращения в неактивное состояние в клетках, уже вступивших в фазу физиологического старения. Тогда как добиться гиперэкспрессии SIRT6 в терапевтическом контексте может быть не так уж легко, активность этого гена можно повысить с помощью низкокалорийной диеты, снижения употребления глюкозы или повышения биодоступности NAD+. Все эти вмешательства уже продемонстрировали свой потенциал в увеличении продолжительности жизни животных моделей. Подобные вмешательства также демонстрируют потенциал в замедлении прогресса некоторых возрастных нейродегенеративных заболеваний (см. статью “Nourishing the Aging Brain” ). Результаты одного из исследований свидетельствуют о том, что низкокалорийной диеты достаточно для подавления возрастного повышения активности L1 ретротранспозонов [7]. Еще одна весьма интересная идея подразумевает использование ингибиторов обратной транскриптазы. В отсутствие этого фермента L1 ретротранспозоны не могут осуществлять самокопирование; в то же время на рынке уже есть целый ряд мощных ингибиторов обратной транскриптазы, эффективно подавляющих активность L1 ретротранспозонов. Оценка масштабов вклада, вносимого L1 ретротранспозонами в старение, а также поиск методов блокирования их активности на ближайшие годы являются важными задачами для занимающихся изучением вопросов старения исследователей.
Ссылки на публикации в научных журналах см. в оригинале статьи.
Читайте также:

