Гемангиома хориоидеи глаза что это такое
В сосудистой оболочке могут развиваться несколько видов опухолей. Наибольшее значение из них имеет гемангиома хориоидеи, которая может принимать форму четко отграниченного новообразования или диффузной опухоли у пациентов с различными вариантами синдрома Стерджа-Вебера.
Этиология четко отграниченных гемангиом хориоидеи остается неизвестной, как правило, они диагностируются во взрослом возрасте, когда у больного возникают жалобы.
Считается, что некоторые из этих опухолей могут быть врожденными или развиваться в раннем детстве. Четко отграниченная гемангиома хориоидеи обычно характеризуется типичными симптомами.
а) Клиническая картина. Четко отграниченная гемангиома хориоидеи почти всегда развивается на одном глазу. Она представляет собой плохо различимое красно-оранжевое образование задней части хориоидеи. Опухоль может вызывать ухудшение зрения из-за локализации в субфовеальной зоне или из-за вторичной отслойки сетчатки, захватывающей fovea (1-6).
Также она может вызывать гиперплазию и фиброзную метаплазию покрывающего ее пигментного эпителия сетчатки. Кроме отслойки сетчатки зачастую наблюдается ретиношизис покрывающей опухоль или прилегающей к ней сетчатки. Иногда развивается неоваскулярная глаукома, особенно при полной отслойке сетчатки, сопутствующие боли могут стать поводом к энуклеации (1,3,23,54).
В большинстве случаев характерный оранжевый цвет четко отграниченной меланомы хориоидеи с высокой вероятностью указывает на диагноз.
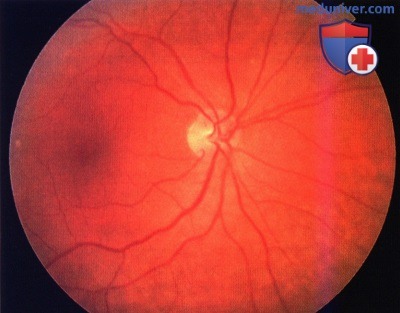
Малозаметная гемангиома хориоидеи, не вызывающая жалоб, локализующаяся с носовой стороны от диска зрительного нерва, у пациентки 69 лет. Поскольку гемангиома имеет ту же окраску, что и окружающее ее глазное дно, зачастую ее бывает трудно различить на фото, но при бинокулярной прямой офтальмоскопии видно, что она выступает в стекловидную полость. 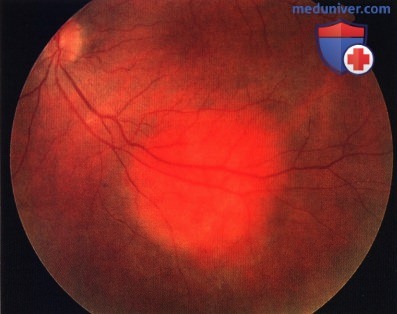
Гемангиома хориоидеи снизу от fovea у женщины 47 лет. 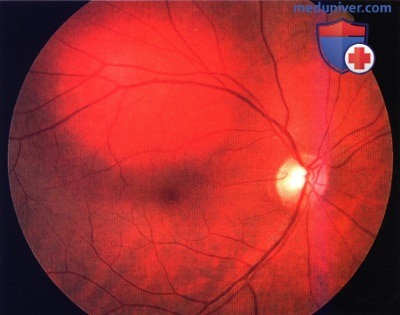
Гемангиома хориоидеи сверху от fovea у пациента 46 лет. 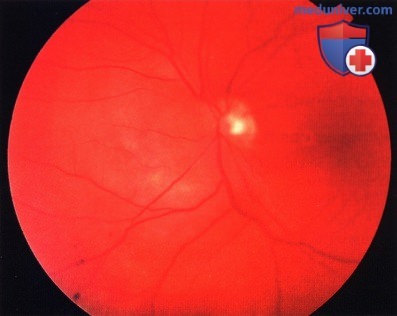
Гемангиома хориоидеи с носовой стороны от диска зрительного нерва, немного нависшая над ним, у женщины 39 лет. 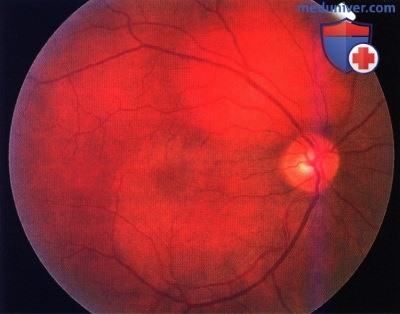
Гемангиома хориоидеи сверху от диска зрительного нерва, вызвавшая ухудшение зрения вследствие вторичной серозной отслойки сетчатки, распространяющейся на область центральной ямки. 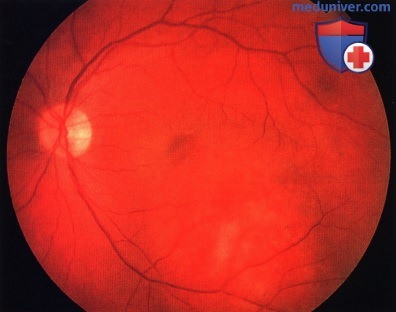
Гемангиома хориоидеи снизу от fovea, вызвавшая ухудшение зрения вследствие распространения опухоли под fovea.
б) Диагностика. При флюоресцентной ангиографии, как правило, в пре-артериальную фазу наблюдается гиперфлюоресценция кровеносных сосудов опухоли, а в поздние фазы исследования - диффузное прокрашивание образования (8-10).
Иногда при ультразвуковом исследовании на поверхности опухоли определяется высокоэхогенная бляшка, соответствующая фиброзной или костной метаплазии пигментного эпителия, покрывающего опухоль.
Недавние исследования с использованием ОКТ с увеличенной глубиной сканирования (EDI-OCT) показали, что обычно опухоль имеет куполообразную форму и не вызывает сдавления слоя хориокапилляров (16, 17).
Гемангиома хориоидеи также визуализируется при компьютерной и магнитной резонансной томографии, но результаты этих исследований не всегда диагностически значимы.
При МРТ гемангиома хориоидеи обычно отличается от других внутриглазных опухолей тем, что ее ткань гиперинтенсивна по сравнению со стекловидным телом на Т1-взвешенных томограммах и изоинтенсивна на Т2-взвешенных томограммах. Большинство других внутриглазных опухолей гипоинтенсивны на Т2-взвешенных томограммах.
в) Патологическая анатомия. Макроскопически четко отграниченная гемангиома хориоидеи представляет собой плакоидную или овоидную опухоль хориоидеи красно-оранжевого цвета. Микроскопически она обычно образована крупными застойными кровеносными сосудами, разделенными тонкими межсосудистыми перегородками. Кистозный отек или ретиношизис покрывающей опухоль сетчатки-типичные гистологические изменения, сопутствующие гемангиомам хориоидеи (1).
г) Лечение. Лечению четко отграниченных гемангиом хориоидеи посвящены многочисленные публикации. При отсутствии у больного жалоб никакого лечения не требуется. При ухудшении зрения из-за серозной отслойки сетчатки в зоне fovea, традиционно проводится лазерокоагуляция поверхности опухоли с целью стимуляции резорбции субретинальной жидкости (18-20).
При далекозашедших отслойках сетчатки возможно проведение лучевой терапии с применением аппликатора или методом внешнего облучения (21-30). Лучевая терапия с применением аппликатора оказалась эффективной при лечении гемангиомы хориоидеи с тотальной отслойкой сетчатки, в результате проведенного лечения сетчатка прилегла (24).
Внешнее облучение в дозе около 2000 сГр на весь глаз приводило к уменьшению толщины опухоли и разрешению отслойки сетчатки и при четко отграниченных, и при диффузных гемангиомах хориоидеи.
Недавно были получены обнадеживающие результаты применения других методов лечения. Некоторого эффекта удавалось добиться с помощью транспупиллярной термотерапии (31-38). В последние годы несколько авторов описали хорошие результаты фотодинамической термотерапии, они использовали методики, аналогичные применяемым при лечении возрастной макулярной дегенерации (39-52).
Нас впечатлили результаты применения ФДТ, наблюдалось уменьшение толщины опухоли, резорбция субретинальной жидкости и улучшение зрительных функций. Наличие кистозного макулярного отека и субретинальной жидкости до и после применения ФДТ регистрировалось с помощью оптической когерентной томографии.
Мы наблюдали выраженный регресс этих изменений и значительное улучшение зрительных функций у многих пациентов, получавших ФДТ. В редких случаях болящая неоваскулярная глаукома требовала выполнения энуклеации (58).
д) Список использованной литературы:
1. Witschel Н, Font RL. Hemangioma of the choroid. A clinicopathologic study of 71 cases and a review of the literature. Surv Ophthalmol 1976;20:415-431.
2. Anand R, Augsburger JJ, Shields JA. Circumscribed choroidal hemangiomas. Arch Ophthalmol 1989;107:1338-1342.
3. Shields CL, Honavar SG, Shields JA, et al. Circumscribed choroidal hemangioma: clinical manifestations and factors predictive of visual outcome in 200 consecutive cases. Ophthalmology 2001;108:2237-2248.
4. Mashayekhi A, Shields CL. Circumscribed choroidal hemangioma. Curr Opin Ophthalmol 2003;14:142-149.
5. Shields JA, Mashayekhi A, Ra S, et al. Pseudomelanomas of the posterior uveal tract. The 2006 Taylor Smith Lecture. Retina 2005;25:767-771.
6. Heimann H, Damato B. Congenital vascular malformations of the retina and choroid. Eye (Lond) 2010;24(3):459-467.
7. Shields JA, Shields CL, Materin MA, et al. Changing concepts in management of circumscribed choroidal hemangioma. The 2003 J. Howard Stokes Lecture, part 1. Ophthalmic Surg Lasers 2004;35:383-393.
8. Norton EWD, Gutman F. Fluorescein angiography of hemangiomas of the choroid. Arch Ophthalmol 1967;78:121-125.
9. Lanning R, Shields JA. Comparison of radioactive phosphorus (32P) uptake test in comparable sized choroidal melanomas and hemangiomas. Am J Ophthalmol 1979;87: 769-772.
10. Jarrett WH 2nd, Hagler WS, Larose JH, et al. Clinical experience with presumed hemangioma of the choroid: radioactive phosphorus uptake studies as an aid in differential diagnosis. Trans Sect Ophthalmol Am Acad Ophthalmol Otolaryngol 1976;81: 862-870.
11. Shields JA. The expanding role of laser photocoagulation for intraocular tumors. The 1993 H. Christian Zweng Memorial Lecture. Retina 1994;14:310-322.
12. Arevalo JF, Shields CL, Shields JA, et al. Circumscribed choroidal hemangioma: characteristic features with indocyanine green videoangiography. Ophthalmology 2000;107:344-350.
13. Ramasubramanian A, Shields CL, Harmon SA, Shields JA. Autofluorescence of choroidal hemangioma in 34 consecutive eyes. Retina 2010;30(l):16-22.
14. Torres VL, Brugnoni N, Kaiser PK, Singh AD. Optical coherence tomography enhanced depth imaging of choroidal tumors. Am J Ophthalmol 2011; 151 (4):586-593.
15. Liu W, Zhang Y, Xu G, et al. Optical coherence tomography for evaluation of photodynamic therapy in symptomatic circumscribed choroidal hemangioma. Retina 2011;31(2):336-343.
16. Shields CL, Pellegrini M, Ferenczy SR, et al. Enhanced depth imaging optical coherence tomography (EDI-OCT) of intraocular tumors. From placid to seasick to rock and rolling topography. The 2013 Francesco Orzalesi Lecture. Retina 2014;34(8): 1495-1512.
17. Rojanaporn D, Kaliki S, Ferenczy SR, et al. Enhanced depth imaging optical coherence tomography of circumscribed choroidal hemangioma in 10 consecutive cases. MEAJO 2015;22(2): 192—197.
18. Augsburger JJ, Shields JA, Moffat KP. Circumscribed choroidal hemangiomas: longterm visual prognosis. Retina 1981;1:56-61.
19. Sanborn GE, Augsburger JJ, Shields JA. Treatment of circumscribed choroidal hemangiomas. Ophthalmology 1982;89:1374-1380.
20. Shields CL, Shields JA, De Potter P. Patterns of indocyanine green angiography of choroidal tumors. Br J Ophthalmol 1995;79:237-245.
21. Zografos L, Bercher L, Chamot L, et al. Cobalt-60 treatment of choroidal hemangiomas. Am J Ophthalmol 1996;121:190-199.
22. Shields JA. Radiotherapy of circumscribed choroidal hemangiomas. Ophthalmology 1997; 104:1784.
23. Hannouche D, Frau E, Desjardins L, et al. Efficacy of proton therapy in circumscribed choroidal hemangiomas associated with serous retinal detachment. Ophthalmology 1997;104:100-103.
24. Chao AN, Shields CL, Shields JA, et al. Plaque radiotherapy for choroidal hemangioma with total retinal detachment and iris neovascularization. Retina 2001;21:682-684.
25. Kivela T, Tenhunen M, Joensuu T, et al. Stereotactic radiotherapy of symptomatic circumscribed choroidal hemangiomas. Ophthalmology 2003;110:1977-1982.
26. Aizman A, Finger PT, Shabto U, et al. Palladium 103 (103 Pd) plaque radiation therapy for circumscribed choroidal hemangioma with retinal detachment. Arch Ophthalmol 2004;122:1652-1656.
27. Frau E, Rumen F, Noel G, et al. Low-dose proton beam therapy for circumscribed choroidal hemangiomas. Arch Ophthalmol 2004;122:1471-1475.
28. Levy-Gabriel C, Rouic LL, Plancher C, et al. Long-term results of low-dose proton beam therapy for circumscribed choroidal hemangiomas. Retina 2009;29(2): 170-175.
29. Lypez-Caballero C, Saornil MA, De Frutos J, et al. High-dose iodine-125 episcleral brachytherapy for circumscribed choroidal haemangioma. Br J Ophthalmol 2010; 94(4):470-473.
30. Arepalli S, Shields CL, Kaliki S, Komarnicky L, Shields JA. Diffuse choroidal hemangioma management with plaque radiotherapy in 5 cases. Ophthalmology 2013;120:2358-2359.
31. Othmane IS, Shields CL, Shields JA, et al. Circumscribed choroidal hemangioma managed by transpupillary thermotherapy. Arch Ophthalmol 1999;117:136-137.
32. Kamal A, Watts, AR, Rennie IG. Indocyanine green enhanced transpupillary of circumscribed choroidal haemangioma. Eye 2000;14:701-705.
33. Garcia-Arumi J, Ramsay LS, Guraya BC. Transpupillary thermotherapy for circumscribed choroidal hemangiomas. Ophthalmology 2000;107:351-356.
34. Shields CL. Discussion: transpupillary thermotherapy for circumscribed choroidal hemangiomas. Ophthalmology 2000; 107:357.
35. Vianna RN, Fernandes L, Muralha A, et al. Transpupillary thermotherapy in the treatment of circumscribed choroidal hemangiomas. Int Ophthalmol 2004;25: 117-121.
36. Gunduz K. Transpupillary thermotherapy in the management of circumscribed choroidal hemangioma. Surv Ophthalmol 2004;49:316-327.
37. Rishi P, Sharma T, Chhablani J. Transpupillary thermotherapy for circumscribed choroidal hemangioma. Indian J Ophthalmol 2008;56(1):84—85.
38. Sharma T, Krishnan T, Gopal L, et al. Transpupillary thermotherapy for circumscribed choroidal hemangioma: clinical profile and treatment outcome. Ophthalmic Surg Lasers Imaging 2011;42(5):360-368.
39. Madreperla SA. Choroidal hemangioma treated with photodynamic therapy using verteporfin. Arch Ophthalmol 2001 ;119:1606-1610.
40. Schmidt-Erfurth UM, Michels S, Kusserow C, et al. Photodynamic therapy for symptomatic choroidal hemangioma: visual and anatomic results. Ophthalmology 2002;109:2284-2294.
41. Shields CL, Materin MA, Marr BP, et al. Resolution of advanced cystoid macular edema following photodynamic therapy of choroidal hemangioma. Ophthalmic Surg Lasers Imaging 2005;36:237-239.
42. Porrini G, Giovannini A, Amato G, et al. Photodynamic therapy of circumscribed choroidal hemangioma. Ophthalmology 2003; 110:674-680.
43. Scott IU, Gorscak J, Gass JD, et al. Anatomic and visual acuity outcomes following thermal laser photocoagulation or photodynamic therapy for symptomatic circumscribed choroidal hemangioma with associated serous retinal detachment. Ophthalmic Surg Lasers Imaging 2004;35:281-291.
44. Bains H, Gunduz K. Transpupillary thermotherapy in the management of circumscribed choroidal hemangioma. Surv Ophthalmol 2004;49:316-327.
45. Shields CL, Materin MA, Marr BP, et al. Resolution of advanced cystoid macular edema following photodynamic therapy of choroidal hemangioma. Ophthalmic Surg Lasers Imaging 2005;36:237-239.
46. Boixadera A, GarcHa-Аштн J, MartHnez-Castillo V, et al. Prospective clinical trial evaluating the efficacy of photodynamic therapy for symptomatic circumscribed choroidal hemangioma. Ophthalmology 2009;116(1): 100-105.
47. Chan RV, Yonekawa Y, Lane AM, et al. Proton beam irradiation using a light-field technique for the treatment of choroidal hemangiomas. Ophthalmologica 2010; 224(4):209-216.
48. Zhang Y, Liu W, Fang Y, et al. Photodynamic therapy for symptomatic circumscribed macular choroidal hemangioma in Chinese patients. Am J Ophthalmol 2010; 150(5):710-715.
49. Blasi MA, Tiberti AC, Scupola A, et al. Photodynamic therapy with verteporfin for symptomatic circumscribed choroidal hemangioma: five-year outcomes. Ophthalmology 2010;117(8):1630-1637.
50. Kwon HJ, Kim M, Lee CS, Lee SC. Treatment of serous macular detachment associated with circumscribed choroidal hemangioma. Am J Ophthalmol 2012; 154(1): 137-145.
51. Elizalde J, Vasquez L, Iyo F, Abengoechea S. Photodynamic therapy in the management of circumscribed choroidal hemangioma. Can J Ophthalmol 2012;47(l):16-20.
52. Bazin L, Gambrelle J. [Combined treatment with photodynamic therapy and intravitreal dexamethasone implant (Ozurdex®) for circumscribed choroidal hemangioma]. / Fr Ophtalmol 2012;35(10):798-802.
53. Querques G, Forte R, Querques L, Souied EH. Intravitreal ranibizumab for choroidal neovascularization associated with circumscribed choroidal haemangioma. Clin Experiment Ophthalmol 2011;39(9):916—918.
54. Mandal S, Naithani P, Venkatesh P, Garg S. Intravitreal bevacizumab (avastin) for circumscribed choroidal hemangioma. Indian J Ophthalmol 2011;59(3):248-251.
55. Arevalo JF, Arias JD, Serrano MA. Oral propranolol for exudative retinal detachment in diffuse choroidal hemangioma. Arch Ophthalmol 2011;129:1373-1375.
56. Sanz-Marco E, Gallego R, Siaz-Liopis M. Oral propranolol for circumscribed choroidal hemangioma. Case Rep Ophthalmol 2011 ;2:84-90.
57. Tanabe H, Sahashi K, Kitano T, et al. Effects of oral propranolol on circumscribed choroidal hemangioma: a pilot study. JAMA Ophthalmol 2013;131:1617-1622.
58. Shields JA, Stephens RF, Eagle RC Jr, et al. Progressive enlargement of a circumscribed choroidal hemangioma. A clinicopathologic correlation. Arch Ophthalmol 1992;110: 1276-1278.
59. Cohen VM, Rundle PA, Rennie IG. Choroidal hemangiomas with exudative retinal detachments during pregnancy. Arch Ophthalmol 2002;120:862-864.
60. Amirikia A, Scott IU, Capo H, et al. Increasing hyperopia and esotropia as the presenting signs of bilateral diffuse choroidal hemangiomas in a patient with Sturge-Weber syndrome. / Pediatr Ophthalmol Strabismus 2002;39:121-122.
61. Li H, Wen F, Wu D. Polypoidal choroidal vasculopathy in a patient with circumscribed choroidal hemangioma. Retina 2004;24:629-631.
62. Verbraak FD, Schlingemann RO, Keunen JE, et al. Longstanding symptomatic choroidal hemangioma managed with limited PDT as initial or salvage therapy. Graefes Arch Clin Exp Ophthalmol 2003;241:891 -898.
63. Shields JA, Eagle RC Jr, Shields CL, et al. Total blindness from circumscribed choroidal hemangioma in a child. Am J Ophthalmol 2005; 139:1113-1114.
64. Tuncer S, Demirci H, Shields CL, Shields JA. Polypoidal choroidal vasculopathy following photodynamic therapy for choroidal hemangioma. Eur J Ophthalmol 2009; 19(1): 159-162.
Редактор: Искандер Милевски. Дата публикации: 13.6.2020

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Доброкачественные опухоли хориоидеи возникают редко, представлены гемангиомой, остеомой и фиброзной гистиоцитомой.

[1], [2], [3], [4]
Гемангиома хориоидеи
Гемангиома хориоидеи - редкая врожденная опухоль, относится к гамартомам. Обнаруживают ее случайно либо при нарушении зрительных функций. Снижение зрения - один из ранних симптомов растущей гемангиомы у взрослых, в детском возрасте прежде всего обращает на себя внимание косоглазие. В хориоидее гемангиома почти всегда имеет вид изолированного узла с достаточно четкими границами, округлой или овальной формы, максимальный диаметр опухоли 3-15 мм. Проминенция опухоли варьирует от 1 до 6 мм. Обычно цвет опухоли бледно-серый или желтовато-розовый, может быть интенсивно-красным. Вторичная отслойка сетчатки, ее складчатость наблюдаются практически у всех больных, при больших опухолях она становится пузыревидной. Калибр ретинальных сосудов в отличие от такового при хориоидальной меланоме не изменяется, но на поверхности опухоли могут образовываться мелкие геморрагии. При слабовыраженном субретинальном экссудате кистевидная дистрофия сетчатки создает картину "ажурности" опухоли.
Диагностика кавернозной гемангиомы хориоидеи затруднена. Расхождение клинических данных и результатов гистологического исследования отмечаются в 18,5 % случаев. В последние годы диагноз стал более достоверным благодаря использованию флюоресцентной ангиографии. Лечение долгое время считали бесперспективным. В настоящее время используют лазеркоагуляцию или брахитерапию (контактное облучение с помощью радиоактивных офтальмо-аппликаторов). Резорбция субретинальной жидкости способствует уменьшению отслойки сетчатки и повышению остроты зрения. Прогноз для жизни благоприятный, но зрение при нелеченой гемангиоме или отсутствии эффекта от лечения может быть потеряно безвозвратно в результате тотальной отслойки сетчатки. В ряде случаев тотальная отслойка заканчивается вторичной глаукомой.
Пигментные опухоли хориоидеи
Источником развития пигментных опухолей служат меланоциты (клетки, продуцирующие пигмент), которые распространены в строме радужки и цилиарного тела, а также в хориоидее. Степень пигментации меланоцитов различна. Увеальные меланоциты начинают продуцировать пигмент в поздней стадии эмбрионального развития.
Невус хориоидеи
Невус хориоидеи - наиболее часто встречающаяся доброкачественная внутриглазная опухоль, почти в 90 % случаев локализуется в заднем отделе глазного дна. При офтальмоскопии невусы выявляют у 1-2 % взрослого населения. Есть основание полагать, что частота невусов в действительности значительно выше, так как часть их не содержит пигмента. Большинство невусов врожденные, но пигментация их появляется значительно позже, и обнаруживают эти опухоли случайно после 30 лет. На глазном дне они имеют вид плоских или слегка проминирующих очагов (высотой до 1 мм) светло-серого или серо-зеленого цвета с перистыми, но четкими границами, диаметр их колеблется от 1 до 6 мм. Беспигментные невусы имеют овальную или округлую форму, границы их более ровные, но менее четкие в связи с отсутствием пигмента. У 80 % пациентов обнаруживают единичные друзы стекловидной пластинки. По мере увеличения невуса увеличиваются дистрофические изменения в пигментном эпителии, что приводит к появлению большего количества друз стекловидной пластинки и субретинального экссудата, вокруг невуса возникает желтоватый ореол. Окраска невуса становится более интенсивной, границы - менее четкими. Описанная картина свидетельствует о прогрессировании невуса.
Больным со стационарными невусами не требуется лечение, но они нуждаются в диспансерном наблюдении, так как в процессе жизни опухоли могут расти, переходя в стадию прогрессирующего невуса и даже начальной меланомы. Прогрессирующие невусы с учетом потенциальной возможности их перерождения и перехода в меланому подлежат лечению. Наиболее эффективный метод разрушения прогрессирующего невуса - лазеркоагуляция. При стационарном невусе прогноз как для зрения, так и для жизни хороший. Прогрессирующий невус следует рассматривать как потенциально злокачественную опухоль. Существует мнение, что 1,6 % невусов обязательно перерождаются в меланому. Как правило, озлокачествляются до 10 % невусов, диаметр которых более 6,5 мм и высота более 3 мм.
Меланоцитома хориоидеи
Меланоцитома хориоидеи - крупноклеточный невус с доброкачественным течением, обычно локализуется на диске зрительного нерва, но может располагаться и в других отделах сосудистой оболочки. Опухоль бессимптомна, и у 90 % больных ее выявляют случайно. При больших меланоцитомах могут отмечаться небольшие нарушения зрения и увеличение слепого пятна. Опухоль представлена одиночным узлом, она плоская или слегка проминирующая (1-2 мм), границы достаточно четкие. Размеры и локализация различны, но чаще меланоцитома расположена у диска зрительного нерва, прикрывая один его квадрант. Цвет опухоли у большинства больных интенсивно-черный, на поверхности могут быть светлые очажки - друзы стекловидной пластинки.
Лечение не требуется, но пациенты должны находиться под систематическим наблюдением офтальмолога. При стационарном состоянии опухоли прогноз для зрения и жизни хороший.
Опухоли хориоидеи – это группа патологических образований сосудистой стенки, которая включает в себя невус, увеальную меланому и гемангиому. В течение длительного промежутка времени клинические симптомы отсутствуют. Снижение остроты зрения и страбизм возникают только при увеличении диаметра новообразования. Диагностика опухолей хориоидеи основывается на проведении офтальмоскопии, визометрии, ФАГ, биомикроскопии, ОКТ, УЗД. В зависимости от формы заболевания тактика лечения сводится к проведению лазерной коагуляции, криотерапии, брахитерапии, фотодинамической терапии, транспупиллярной термотерапии. При отсутствии эффекта или большом размере опухоли хориоидеи показана энуклеация.
- Причины опухолей хориоидеи
- Симптомы опухолей хориоидеи
- Диагностика опухолей хориоидеи
- Лечение опухолей хориоидеи
- Прогноз и профилактика опухолей хориоидеи
- Цены на лечение
Общие сведения
Опухоли хориоидеи – это доброкачественные или злокачественные новообразования сосудистой оболочки глазного яблока. Невус – наиболее распространённое доброкачественное образование органа зрения. Частота его выявления при офтальмоскопии составляет 2%. В тоже время, при аутопсии данную патологию диагностируют у 6,5-20% пациентов. У лиц женского и мужского пола невусы определяются в равной степени. Распространенность увеальной меланомы среди всех патологий глаз составляет 5%. Риск образования этой опухоли хориоидеи существенно увеличивается с возрастом больного и после 69 лет с каждым годом возрастает на 50 случаев (из расчета на 1 млн. населения). Общая заболеваемость гемангиомой глаза среди общего числа интраорбитальных патологических новообразований составляет 0,76%. Данный вид опухоли хориоидеи встречается во всех возрастных группах, но чаще диагностируется после 10 и до 60 лет.

Причины опухолей хориоидеи
Гемангиома относится к числу гамартом. Причина образования – тканевая аномалия развития. Состав новообразования имеет те же компоненты, что и окружающие ткани, но степень его дифференциации и строение резко нарушены. Риск развития опухолей хориоидеи возрастает при длительном контакте с ультрафиолетовым излучением или на фоне солнечных ожогов глаз. В популяции заболевание чаще встречается среди лиц, в фенотипе которых присутствуют голубые глаза, светлая кожа и волосы, множественные невусы (более 50).
Симптомы опухолей хориоидеи
С клинической точки зрения выделяют сосудистые и пигментные опухоли хориоидеи. Также различают доброкачественные и злокачественные новообразования. К пигментным формам относят невусы (стационарные и прогрессирующие). В большинстве случаев это врожденный вид опухолей хориоидеи, но интенсивность пигментной окраски усиливается после 30-летнего возраста. Их выявляют в заднем полюсе глазного яблока, реже в экваториальной области или перед ней. Описаны случаи бинокулярного поражения органа зрения. Как правило, течение заболевания бессимптомное. Увеличение в размере прогрессирующего невуса в редких случаях приводит к снижению остроты зрения.
Гемангиома относится к группе доброкачественных опухолей хориоидеи. Для нее характерен быстропрогрессирующий рост, который очень часто приводит к полной отслойке сетчатки. Первый симптом заболевания у взрослых – нарушение зрительных функций. В детском возрасте данная опухоль хориоидеи становится причиной страбизма. С клинической точки зрения выделяют ограниченную и диффузную формы. При ограниченном варианте формируется небольшой узел с четко очерченными краями. Клинические проявления мало выражены. При диффузном распространении опухолевого процесса, заболевание осложняется энцефалофациальным ангиоматозом (синдром Стерджа-Вебера).
Диагностика опухолей хориоидеи
Диагностика опухолей хориоидеи основывается на результатах офтальмоскопии, визометрии, флуоресцентной ангиографии, биомикроскопии, оптической когерентной томографии (ОКТ), ультразвукового исследования (УЗД) в В-режиме. При офтальмоскопии невусы имеют вид плоских, приподнятых над уровнем окружающих тканей образований размером до 0,1 см. В зависимости от выраженности пигментации их цвет варьирует от сероватого до серо-коричневого. Границы зачастую неровные, но с четкими очертаниями. Неровность контуров обусловлена прилежащими сосудами. Для невусов, лишенных пигмента, характерна овальная или округлая форма с ровными, но менее очерченными контурами. В отличие от прогрессирующих невусов, на поверхности стационарных присутствуют друзы. Для их дифференциальной диагностики проводится офтальмоскопия с цветными фильтрами. Красная окраска фильтра позволяет визуализировать данный тип опухоли хориоидеи, при зеленой патологическое образование не определяется.
Методом флуоресцентной ангиографии при стационарной форме выявляется снижение флуоресценции на протяжении всего обследования. При этом в окружающей сосудистой оболочке изменения не выявляются. Об изменениях хориоидеи свидетельствует пропотевание и яркое свечение красителя. При офтальмоскопии увеальной меланомы обнаруживается небольшой узелок с постэкваториальной локализацией. Опухоль хориоидеи – желто-коричневой или аспидной окраски с друзами на поверхности или в окружающих тканях. Методом ОКТ устанавливается точная локализация, размеры, степень распространения на окружающие ткани. У большинства пациентом при визометрии диагностируется снижение остроты зрения.
При проведении офтальмоскопии отграниченная гемангиома имеет вид небольшого узелка округлой формы с ровными контурами диаметром 0,3-1,5 см. Средняя толщина патологического образования составляет 0,3-0,4 см. Цвет данной формы опухоли хориоидеи – от светло-серого до темно-красного. Для дифференциальной диагностики гемангиомы от меланомы следует провести флуоресцентную ангиографию. При гемангиоме средний диаметр сосудов опухоли соответствует таковому сосудов хориоидеи, также на ее поверхности могут появляться небольшие очаги кровоизлияния. Из-за прогрессирующего ангиогенеза при меланоме новообразованные капилляры имеют меньший калибр и более извитой ход. На УЗД опухоли хориоидеи определяется ток крови и характерная пульсация сосудов, что позволяет подтвердить диагноз. Наружный осмотр проводится для выявления типичной симптоматики страбизма.
Лечение опухолей хориоидеи
Тактика лечения при опухолях хориоидеи зависит от формы заболевания. При появлении признаков, свидетельствующих о трансформации стационарного невуса в прогрессирующий, показана лазерная коагуляция. При обнаружении увеальной меланомы большого размера следует провести энуклеацию глазного яблока. Если диаметр патологического новообразования незначительный, а опухоль не распространяется за пределы первичного очага, рекомендована контактная лучевая терапия (брахитерапия глаза). Преимущество данного метода лечения опухолей хориоидеи – местное воздействие на меланому максимальной дозой лучевой терапии. При этом на окружающие ткани и критические органы излучение не влияет. Альтернативный вариант – транспупиллярная диод-лазерная термотерапия. Данный метод относится к числу малоинвазивных техник. При этом вся процедура проводится под визуальным контролем.
Выявление гемангиомы – это показание к проведению оперативного вмешательства, что обусловлено большим риском экссудативной отслойки сетчатки и снижения зрительных функций. В лечении отграниченной формы опухоли хориоидеи используется криотерапия, брахитерапия, фотодинамическая терапия и транспупиллярная диод-лазерная термотерапия. Высокой эффективностью обладает лазерокоагуляция в желтом спектре излучения. Тактика лечения сводится к облитерации кровеносных сосудов. Преимущество этой методики – ликвидация выпота экссудата из новообразованных сосудов за счет адгезии пигментного слоя и сенсорной сетчатки. Субретинальная жидкость при этом резорбируется.
Прогноз и профилактика опухолей хориоидеи
Специфических мер по профилактике опухолей хориоидеи в офтальмологии не разработано. Все пациенты с установленным диагнозом доброкачественного или злокачественного новообразования сосудистой оболочки должны находиться на диспансерном учете у офтальмолога. После проведения оперативного лечения периодически необходимо проходить профилактическое обследование у специалиста, ограничить пребывание на солнце, избегать работы при высокой температуре окружающей среды.
Прогноз для жизни и трудоспособности при стационарной форме невуса благоприятный. Прогрессирующий вариант следует рассматривать как предраковое состояние. Наиболее злокачественная среди опухолей хориоидеи – меланома, прогноз для жизни определяется стадией развития. Гемангиома сосудистой оболочки – прогностически благоприятное заболевание, однако у отдельных больных возможна полная потеря зрения.
Читайте также:

