Формулы соединений фосфора с хлором

Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронная конфигурация фосфора в основном состоянии :

Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:

При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5.
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.


Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Красный фосфор – это модификация с атомной кристаллической решеткой . Формула красного фосфора Pn, это полимер со сложной структурой. Твердое вещество без запаха, красно-бурого цвета, не ядовитое. Это гораздо более устойчивая модификация, чем белый фосфор. В темноте не светится. Образуется из белого фосфора при t=250-300 о С без доступа воздуха.


Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.

Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор , который очень хорошо проводит электрический ток.

В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Типичные соединения фосфора:
ортофосфорная кислота H3PO4
Фосфор (греч. phos - свет + phoros - несущий) - химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество, легко воспламеняющееся и светящееся.

При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.

В природе фосфор встречается в виде следующих соединений:
- 3Ca3(PO4)2*CaCO3*SiO2 - фосфорит
- 3Ca3(PO4)2*Ca(F,Cl,OH)2 - апатит

В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до P2.
-
Реакции с неметаллами
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
Схожим образом происходит взаимодействие фосфора и хлора.
2P + 3Cl2 → 2PCl3 (недостаток хлора)
2P + 5Cl2 → 2PCl5 (избыток хлора)
Реакции с водородом крайне затруднена. Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ - фосфин - боевое отравляющее вещество.

2P + 3Ca → Ca3P2 (фосфид кальция)
Реакция с водой
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество является и окислителем, и восстановителем).
Реакция с щелочами
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования.
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя.

Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту.
Реагирует с основными оксидами и основаниями, образуя соли фосфорной кислоты. Какая именно получится соль - определяет соотношение основного оксида/основания и кислотного оксида.
6KOH + P2O5 = 2K3PO4 + 3H2O (фосфат калия, избыток щелочи - соотношение 6:1)
4KOH + P2O5 = 2K2HPO4 + H2O (гидрофосфат калия, незначительный избыток кислотного оксида - соотношение 4:1)
2KOH + P2O5 = 2KH2PO4 + H2O (дигидрофосфат калия, избыток кислотного оксида - соотношение 2:1)

Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
Существует несколько кислородсодержащих фосфорных кислот:
- Ортофосфорная кислота - H3PO4 (соли - фосфаты PO4 3- )
- Метафосфорная кислота - HPO3 (соли - метафосфаты PO3 - )
- Фосфористая - H3PO3 (соли - фосфиты PO3 3- )
- Фосфорноватистая - H3PO2 (соли гипофосфиты - PO2 3- )
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора, взаимодействия оксида фосфора V с водой.
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:

За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные соли (фосфаты, гидрофосфаты и дигидрофосфаты).
Реакции с солями
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок желтого цвета - фосфат серебра - образуется в результате реакции с нитратом серебра.
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
Реакции с металлами
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые:
- Фосфоритная мука - Ca3(PO4)2
- Простой суперфосфат - смесь Ca(H2PO4)2*H2O и CaSO4
- Двойной суперфосфат - Ca(H2PO4)2*H2O
- Преципитат - CaHPO4*2H2O
- Костная мука - продукт переработки костей домашних животных Ca3(PO4)2
- Аммофос - в основном состоит из моноаммонийфосфата - NH4H2PO4

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
--> -->Форма входа -->
--> -->Категории раздела -->
-->| Логика в химии [438] |
| Киберхимия [56] |
| Бинарные химические соединения [841] |
--> -->Поиск -->
--> -->Мини-чат -->
--> -->Друзья сайта -->
--> -->Статистика -->
Галоидные соединения фосфора образуются путем взаимодействия элементов, протекающего, как правило, весьма энергично. Галогениды типов РГ3 и РГ5 (кроме Р I 5) известны для всех галоидов, однако практическое значение из них имеют почти исключительно производные хлора.
Трихлорид PCl 3 – бесцветная жидкость (Тпл = - 90,34 0 С, ∆Н 0 обр= - 289,5 кДж/моль, Ткип = 75,3 0 С).
PCl 3 дымит во влажном воздухе (из-за гидролиза с выделением HCl ), энергично взаимодействует с водой, образуя фосфористую и соляную кислоты
PCl 3 + 3 H 2 O = H 3 PO 3 + 3 HCl
При действии на PCl 3 избытка хлора образуется пятихлористый фосфор
PCl 3 + Cl 2 = PCl 5 + 31 ккал
Эта реакция обратима. При обычных условиях равновесие ее смещено вправо, выше 300 0 С – влево.
В качестве частного проявления ненасыщенного характера PCl 3 можно рассматривать окисление его кислородом воздуха до P О Cl 3
2 PCl 3 + О2 = 2 P О Cl 3
При обычных условиях реакция эта идет крайне медленно, но может быть значительно ускорена, если кислород заменить озоном или проводить ее в присутствии нагретого катализатора (платиновой черни).
PCl 3 + PBr 3 = PCl 2 Br + PClBr 2
Получают PCl 3 пропусканием Cl 2 в раствор белого фосфора в сероуглероде или сжиганием фосфора в атмосфере сухого хлора.
Применяют PCl 3 для получения PCl 5, POCl 3, PSCl 3, фосфорорганических соединений, в производстве краситилей, лекарственных средств, инсектицидов и ПАВ.
Пентахлорид PCl 5 –бесцветные зеленоватые кристаллы (Тпл = 160 0 С, ∆Н 0 обр= - 376 кДж/моль).
В парах выше 300 0 С PCl 5 полностью разлагается на PCl 3 и Cl 2. Гидролизуется водой сначала до POCl 3, затем до H 3 PO 4. Пятихлористый фосфор PCl 5 нацело разлагается водой, реакция проходит в две стадии (вторая медленнее первой)
PCl 5 + H 2 O = POCl 3 + 2 HCl
POCl 3 + 3 H 2 O = H 3 PO 4 + 3 HCl
При взаимодействии PCl 5 с NH 4 Cl получается фосфонитрилхлорид PNCl 2.
Для получения POCl 3 может быть использована протекающая при нагревании реакция
3 PCl 5 + P 2 O 5 = 5 POCl 3
Взаимодействием сероуглерода С S 2 с PCl 5 в запаянной трубке при 100 0 С по реакции
С S 2 + PCl 5 = CSCl 2 + PSCl 3
может быть получен тиофосген CSCl 2.
Получают PCl 5 взаимодействием PCl 3 с избытком хлора, а также пропусканием Cl 2 в раствор PCl 3 в CS 2.
Используется PCl 5 как хлоририрующий агент, его используют при получении хлорангидридов фосфорных кислот, в производстве лекарственных средств и красителей.
P 2 Cl 4 – бесцветная жидкость (Тпл = - 28 0 С с разложением).
Пентахлор́ид фо́сфора (хлорид фосфора(V), хлорангидрид фо́сфорной кислоты, пятихлористый фосфор) — соединение фосфора и хлора с формулой PCl 5.
Молекула PCl 5 в газообразном или жидком состояниях имеет конфигурацию тригональной бипирамиды с атомомфосфора в основании. Твёрдый пентахлорид фосфора состоит из тетраэдрических ионов [PCl 4] + и октаэдрических ионов [РCl 6] − (d P—Cl в тетраэдре 0,197 нм, в октаэдре 0,204 нм (экваториальные) и 0,208 нм (апикальные)).
Свойства
При нагревании выше 300 °C полностью разлагается на PCl 3 и Cl 2.
Пентахлорид фосфора типичное кислотное соединение. Он энергично реагирует с водой, образуя по первой стадии оксохлорид фосфора (V):

В горячей воде гидролиз протекает полностью, до образования ортофосфорной кислоты:

Для РCl 5 характерны реакции окислительного хлорирования:


При нагревании РCl 5 и NH 4Cl происходит реакция образования полимера фосфонитрилхлорида:

Получение
Получают действием избытка хлора на хлорид фосфора(III):

Применение
PCl 5 — сильный хлорирующий агент, его используют при получении хлорангидридов фосфорных и фосфоновых кислот из олефинов, в производстве лекарственных средств и красителей.
Хлорид фосфора(III) PCl 3 — химическое соединение фосфора и хлора. Является наиболее важным из трёх известных хлоридов фосфора; ценное химическое сырьё для производства разнообразных фосфорсодержащих органических соединений.
Физические свойства
При нормальных условиях трихлорид фосфора — бесцветная, дымящая во влажной среде жидкость с резким неприятным запахом. Обладает слезоточивыми свойствами.
Химические свойства
Фосфор в PCl 3 находится в степени окисления +3, а хлор — в степени −1. Многие из свойств соединения обусловлены именно этими обстоятельствами. В присутствии воды — дымит и разлагается.
PCl 3 — базовый продукт для других производных фосфора, получаемых из него при окислении до пентахлорида(PCl 5), тиофосфорилхлорида (PSCl 3) или оксихлорида (POCl 3).
Если пропустить электрический разряд через смесь пара PCl 3 и газообразного водорода, образуется редкий сложный хлорид фосфора с формулой P 2Cl 4.
Известно большое число сходных реакций замещения, в том числе и с органическими веществами — спиртами и фенолами:

Спирты реагируют сходным образом:


[1]
Наличие неподелённой электронной пары у атомов фосфора обуславливает способность трихлорида проявлять донорные свойства, образуя электронейтральные комплексы, например, [Ni(PCl 3) 4] По химической природе трихлорид фосфора является хлорангидридом фосфористой кислоты. Гидролиз её приводит к образованию двух кислот, а взаимодействие со щелочами — двух солей:
Соединения фосфора:
Содержание фосфора в земной коре составляет 0,08% по массе - это один из самых распространенных химических элементов на нашей планете. По причине своей высокой активности, фосфор в свободном состоянии в природе не встречается, но входит в состав почти 200 минералов, самыми распространенными из которых являются апатит Ca5(PO4)3(OH) и фосфорит Ca3(PO4)2.
Фосфор играет немаловажную роль в жизни животных, растений и человека - он входит в состав такого биологического соединения, как фосфолипид, также присутствует в белковых и других таких важнейших органических соединениях, как ДНК и АТФ.
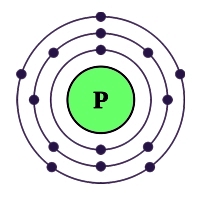
Рис. Строение атома фосфора.
Атом фосфора содержит 15 электронов, и имеет схожую с азотом электронную конфигурацию внешнего валентного уровня (3s 2 3p 3 ), но у фосфора по сравнению с азотом менее выражены неметаллические свойства, что объясняется наличием свободной d-орбитали, большим радиусом атома и меньшей энергией ионизации.
Вступая в реакции с другими химическими элементами, атом фосфора может проявлять степень окисления от +5 до -3 (наиболее характерна степень окисления +5, остальные встречаются достаточно редко).
- +5 - оксид фосфора P2O5(V); фосфорная кислота (H3PO4); фосфаты, галогениды, сульфиды фосфора V (соли фосфорной кислоты);
- +3 - P2O3(III); фосфористая кислота (H3PO3); фосфиты, галогениды, сульфиды фосфора III (соли фосфористой кислоты);
- 0 - P;
- -3 - фосфин PH3; фосфиды металлов.
В основном (невозбужденном) состоянии у атома фосфора на внешнем энергетическом уровне находится два спаренных электрона на s-подуровне + 3 неспаренных электрона на p-орбиталях (d-орбиталь свободна). В возбужденном состоянии один электрон с s-подуровня переходит на d-орбиталь, что расширяет валентные возможности атома фосфора.
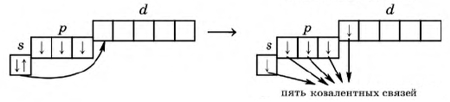
Рис. Переход атома фосфора в возбужденное состояние.
Два атома фосфора объединяются в молекулу P2 при температуре порядка 1000°C.
При более низких температурах фосфор существует в четырехатомных молекулах P4, а также в более устойчивых полимерных молекулах P∞.
Аллотропные модификации фосфора:
- Белый фосфор - чрезвычайно ядовитое (летальная доза белого фосфора для взрослого человека составляет 0,05—0,15 г) воскоподобное вещество с запахом чеснока, без цвета, люминисцирующее в темноте (процесс медленного окисления в P4O6); высокая реакционная способность белого фосфора объясняется некрепкими связями Р-Р (у белого фосфора молекулярная кристаллическая решетка с формулой P4, в узлах которой расположены атомы фосфора), которые достаточно легко разрываются, в результате чего белый фосфор при нагревании или в процессе длительного хранения переходит в более устойчивые полимерные модификации: красный и черный фосфор. По этим причинам белый фосфор хранят без доступа воздуха под слоем очищенной воды или в специальных инертных средах.
- Желтый фосфор - огнеопасное, сильно ядовитое вещество, в воде не растворяется, легко окисляется на воздухе и самовозгорается, при этом горит ярко-зеленым ослепительным пламенем с выделением густого белого дыма.
- Красный фосфор - полимерное, нерастворимое в воде вещество со сложной структурой, обладающее наименее реакционной способностью. Красный фосфор широко применяется в промышленном производстве, т. к. не так сильной ядовит. Поскольку на открытом воздухе красный фосфор, впитывая влагу, постепенно окисляется с образованием гигроскопичного оксида ("отсыревает"), образует вязкую фосфорную кислоту, поэтому, красный фосфор хранится в герметически закрытой таре. В случае отмокания красный фосфор очищают от остатков фосфорной кислоты путем промывания водой, затем высушивают и используют по назначению.
- Черный фосфор - жирное на ощупь графитоподобное вещество серо-черного цвета, обладающее полупроводниковыми свойствами - наиболее устойчивая модификация фосфора со средней реакционной способностью.
- Металлический фосфор получают из черного фосфора под высоким давлением. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства фосфора
Из всех аллотропных модификаций фосфора самой активной является белый фосфор (P4). Зачастую в уравнении химических реакций пишут просто P, а не P4. Поскольку, фосфор, как и азот, имеет много вариантов степеней окисления, то в одних реакциях он является окислителем, в других - восстановителем, в зависимости от веществ, с которыми он взаимодействует.
Окислительные свойства фосфор проявляет в реакциях с металлами, которые протекают при нагревании с образованием фосфидов:
3Mg + 2P = Mg3P2.
Фосфор является восстановителем в реакциях:
- с более электроотрицательными неметаллами (кислородом, серой, галогенами):
- соединения фосфора (III) образуются при недостатке окислителя
4P + 3O2 = 2P2O3 - соединения фосфора (V) - при избытке: кислорода (воздуха)
4P + 5O2 = 2P2O5
- соединения фосфора (III) образуются при недостатке окислителя
- с галогенами и серой фосфор образует галогениды и сульфид 3-х или 5-ти валентного фосфора, в зависимости от соотношения реагентов, которые берутся в недостатке или избытке:
- 2P+3Cl2(нед.) = 2PCl3 - хлорид фосфора (III)
- 2P+3S(нед.) = P2S3 - сульфид фосфора (III)
- 2P+5Cl2(изб.) = 2PCl5 - хлорид фосфора (V)
- 2P+5S(изб.) = P2S5 - сульфид фосфора (V)
- с концентрированной серной кислотой:
2P+5H2SO4 = 2H3PO4+5SO2↑+2H2O - с конецнтрированной азотной кислотой:
P+5HNO3 = H3PO4+5NO2↑+H2O - с разбавленной азотной кислотой:
3P+5HNO3+2H2O = 3H3PO4+5NO↑
Фосфор выступает одновременно и окислителем, и восстановителем в реакциях диспропорционирования с водными растворами щелочей при нагревании, образуя (кроме фосфина) гипофосфиты (соли фосфорноватистой кислоты), в которых проявляет нехарактерную для себя степень окисления +1:
4P 0 +3KOH+3H2O = P -3 H3↑+3KH2P +1 O2
НАДО ЗАПОМНИТЬ: с другими кислотами, кроме указанных выше реакций, фосфор не реагирует.
Получение и применение фосфора
Промышленным способом фосфор получают путем его восстановления коксом из фосфоритов (фторапататиов), в состав которых входит фосфат кальция, прокаливая в электропечах при температуре 1600°C с добавлением кварцевого песка:
Ca3(PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 2P + 5CO.
На первом этапе реакции под действием высокой температуры оксид кремния (IV) вытесняет оксид фосфора (V) из фосфата:
Ca3(PO4)2 + 3SiO2 = 3CaSiO3 + P2O5.
Затем оксид фосфора (V) восстанавливается углём до свободного фосфора:
P2O5+5C = 2P+5CO.
Применение фосфора:
- производство удобрений;
- ядохимикатов;
- спичек;
- моющих средств;
- красок;
- полупроводников.
Если вам понравился сайт, будем благодарны за его популяризацию :) Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:


- Интерактивное изображение
- 24819
- 0EX753TYDU
Пентахлорид фосфора является химическим соединением с формулой PCl 5 . Это одна из наиболее важных хлориды фосфора, другие являются PCl 3 и POCl 3 . PCl 5 , может быть использована в качестве хлорирующего реагента. Это бесцветная, чувствительные к влаге и влага твердого вещества , хотя коммерческие образцы могут быть желтоватыми и загрязнены хлористым водородом .
содержание
- 1 Структура
- 1.1 Родственные пентахлориды
- 2 Получение
- 3 Реакции
- 3,1 Гидролиз
- 3.2 Хлорирование органических соединений
- 3.3 Сравнение с соответствующими реагентами
- 3.4 Хлорирование неорганических соединений
- 4 Безопасность
- 5 История
- 6 Смотрите также
- 7 Ссылки
- 8 Внешние ссылки
Состав
Структуры хлоридов фосфора неизменно соответствуют VSEPR теории. Структура PCl 5 зависит от его окружающей среды. Газообразный и расплавленный PCl 5 является нейтральной молекулой с тригональной бипирамидальной геометрией и ( D 3h ) симметрией . Гипервалентная природа этого вида (а также для PCl -
6 , см ниже) можно объяснить с включением не-связывающими молекулярных орбиталей ( теории молекулярных орбиталей ) или резонансом ( валентность теории связей ). Это тригональной бипирамидальная структура сохраняется в неполярных растворителях, таких как CS 2 и CCl 4 . В твердом состоянии PCl 5 представляет собой ионное соединение , сформулированный PCl +
4 PCl -
6 .

В растворах полярных растворителях, PCl 5 подвергается само- ионизации . Разбавленные растворы диссоциируют в соответствии со следующим равновесием:
При более высоких концентрациях, второе равновесие становится все более распространенным:
Катион PCl +
- и анион PCl -
6 является тетраэдрическими и октаэдрическим , соответственно. В свое время, PCl 5 в растворе считалось , чтобы сформировать димерный структуру, P 2 Cl 10 , но это предположение не подтверждается спектроскопических комбинационных измерений.
AsCl 5 и SbCl 5 также принимают тригональные бипирамидальные структуры. Соответствующие длины связей являются 211 м (В-Cl экв ), 221 м (Ас-Cl ах ), 227 ч (Sb-Cl экв ), и 233,3 мкм (Sb-Cl ах ). При низких температурах, SbCl 5 обращенных к димеру, диоктаэдрического Sb 2 Cl 10 , структурно связан с пентахлоридом ниоби .
подготовка
PCl 5 получают путем хлорирования из PCl 3 . Эта реакция используется для производства около 10000 тонн PCl 5 в год (по состоянию на 2000 г.).
PCl 3 + Cl- 2 ⇌ PCl 5 (Δ Н = -124 кДж / моль)
PCl 5 существует в равновесии с PCl 3 и хлора , а также при 180 ° C степень диссоциации составляет около 40%. Из - за это равновесие, образцы PCl - часто содержат хлор, который придает зеленоватый цвет.
Реакции
В своей наиболее характерной реакции, PCl 5 реагирует при контакте с водой , чтобы выпустить хлористый водород и оксиды фосфора дают. Первым продуктом гидролиза является оксихлорид фосфора :
В горячей воде, гидролиз полностью переходит к ортофосфорной кислоте :
В синтетической химии, два класс хлорирования, как правило , представляет интерес: окислительные chlorinations и замещающих chlorinations. Окислительное chlorinations влечет за собой передачу Cl 2 от реагента к субстрату. Субститутивный chlorinations влечет за собой замену О или ОН - группах с хлоридом. PCl 5 может использоваться для обоих процессов.
После обработки с PCl 5 , карбоновые кислоты преобразовать в соответствующий хлорангидрид . Был предложен следующий механизм:

Он также преобразует спирты в алкилхлориды . Тионилхлорид чаще используется в лаборатории , поскольку полученный в результате диоксид серы более легко отделяются от органических продуктов , чем POCl 3 .
PCl 5 реагирует с третичной амидой, такие как диметилформамид (ДМФА), с получением хлорида dimethylchloromethyleneammonium, которая называется реагент Вильсмайера , [(CH 3 ) 2 N = CClH] Cl. Более типично, соль , связанные генерируется из реакции ДМФ и POCl 3 . Такие реагенты могут быть использованы при получении производных бензальдегида формилированием и для превращения С-ОН - групп в С-Cl групп.
Он особенно известен для конверсии C = O групп к CCl 2 групп. Так , например, бензофенон и пентахлорид фосфора реагируют с получением дифенилдихлорметана :
Электрофильный характер PCl 5 подсвечивается его реакции с стирола с получением, после гидролиза , фосфоновой кислоты производных.
Оба PCl 3 и PCl 5 конвертировать R - COH группы в хлорангидриде R 3 CCl. Пентахлорид однако источник хлора во многих реакциях. Это chlorinates аллильные и бензильные CH связей. PCl 5 имеет большее сходство с SO 2 Cl 2 , также является источником Cl 2 . Для окислительных chlorinations на лабораторном масштабе, сульфурилхлорид часто предпочтительнее , чем PCl 5 , так как газообразный SO 2 побочный продукт легко отделяется.
Что касается реакции с органическими соединениями, использование PCl 5 было заменено SO 2 Cl 2 . Реакция пятиокиси фосфора и PCl 5 производит POCl 3 :
PCl 5 chlorinates диоксида азота с образованием нестабильного хлорида нитрил :
PCl 5 является предшественником гексафторфосфата лития , LiPF 6 , электролита в литий - ионных батарей . LiPF
6 получают путем реакции PCl
5 сфторида лития, схлоридом литиякачестве побочного продукта:
PCl 5 + 6 LiF → LiPF 6 + 5 LiCl
безопасности
PCl 5 является опасным веществом , как он бурно реагирует с водой.
история
Фосфор пятихлористый был первым подготовлен в 1808 году английским химиком Хэмфри Дэви . Анализ Дэви пентахлорида фосфора неточно; первый точный анализ был представлен в 1816 году французский химик Пьер Луи Дюлонга .
Читайте также:

