Формула воды с хлором
Определение и формула хлорной воды
Получение хлорной воды соответствует следующему уравнению:
Хлорная вода является сильным окислителем. Растворяет золото.
Химическая формула хлорной воды
По сути хлорная вода представляет собой смесь веществ, находящихся в растворе, поэтому укажем химические формулы каждого из них. Химическая формула молекулярного хлора Cl2, хлорной кислоты HClO, хлороводородной (соляной) кислоты HCl. Химическая формула показывает качественные и количественный состав молекулы (сколько и каких атомов присутствует в ней). По химической формуле можно вычислить молекулярную массу вещества:
Mr(HClO) = Ar(H) + Ar(Cl) + Ar(O);
Mr(HClO) = 1 + 35,5 + 16 =52,5
Mr(HCl) = Ar(H) + Ar(Cl);
Mr(HCl) = 1 + 35,5 = 36,5
Структурная (графическая) формула хлорной воды
Структурная (графическая) формула вещества является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы. Укажем структурные формулы каждого из соединений, водящих в состав хлорной воды.
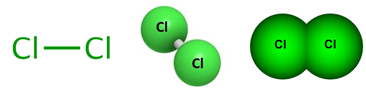
Рис. 1. Структурная формула хлора.
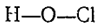
Рис. 2. Структурная формула хлорной кислоты.
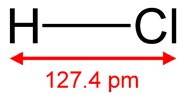
Рис. 3. Структурная формула хлороводородной кислоты.
Хлороводородная и хлорная кислоты являются электролитами, т.е. способны диссоциировать на ионы в водном растворе согласно следующим уравнениям реакций:
Электронная формула хлора, показывающая распределение электронов в атоме по энергетическим подуровням показана ниже:
17Cl 1s 2 2s 2 2p 6 3s 2 3p 5
Она также показывает, что хлор относится к элементам р-семейства, а также число валентных электронов — на внешнем энергетическом уровне находится 7 электронов (3s 2 3p 5 ).
Электронная формула хлороводородной кислоты показана ниже (рис. 4):
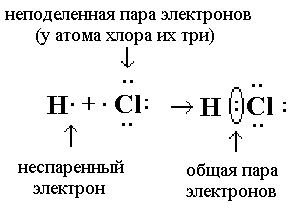
Рис. 4. Электронная формула хлороводородной кислоты.
Примеры решения задач
| Задание | Элементарный состав вещества следующий: массовая доля элемента железа 0,7241 (или 72,41%), массовая доля кислорода 0,2759 (или 27,59%). Выведите химическую формулу. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%
Найдем соответствующие относительные атомные массы элементов железа и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(Fe) = 56; Ar(O) = 16
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
x:y= 72,41/56 : 27,59/16;
Наименьшее число примем за единицу (т.е. все числа разделим на наименьшее число 1,29):
Следовательно, простейшая формула соединения железа с кислородом имеет вид Fe2O3.
| Задание | Найдите химическую формулу вещества, в состав которого входит 9 массовых частей алюминия и 8 массовых частей кислорода. |
| Решение | Для того, чтобы узнать, в каких отношениях находятся химические элементы в составе молекулы необходимо найти их количество вещества. Известно, что для нахождения количества вещества следует использовать формулу: |
Найдем молярные массы алюминия и кислорода (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Известно, что M = Mr, значит M(Al)= 27 г/моль, а М(O) = 16 г/моль.
Тогда, количество вещества этих элементов равно:
n (Al) = m (Al) / M (Al);
n (Al) = 9 / 27 = 0,33моль
n (O) = 8 / 16 = 0,5 моль
Найдем мольное отношение:
n(Al) :n(O) = 0,33 : 0,5= 1 : 1,5 = 2 : 3,
т.е. формула соединения алюминия с кислородом имеет вид Al2O3.
С помощью этого элемента повсеместно очищают питье, что позволяет решить многочисленные проблемы с ее качеством. Он помогает избавиться практически ото всех известных вирусов и бактерий, оказывающих пагубное влияние на человеческий организм. На сегодняшний день не существует другого средства, способствующего столь эффективной дезинфекции. Поэтому в нашей статье мы поговорим о хлорной воде: что это такое, состав, химическая формула, применение.
Что собой представляет
По сути, это растворенный в H2O хлор. В растворе, помимо молекул Cl, содержатся также хлорноватистая и хлороводородная кислоты.
Почти во всех водопроводных системах жидкость, предназначенная для питья, подлежит хлорированию. Объясняется это присутствием большого количества вредоносных микроорганизмов, способных спровоцировать возникновение тяжелейших заболеваний. Уничтожить опасные для человека примеси можно еще тремя способами: облучением, окислением или кипячением. Однако кипятить и облучать довольно нерационально, а окислять — опасно.
Существует и четвертая методика очистки — озонирование, но и в этом случае возникающие проблемы не позволяют эффективно применять ее на практике. Озон почти мгновенно улетучивается. Поэтому в момент, когда чистое питье достигнет водопроводных кранов в квартирах и домах, результат обработки окажется ничтожным.
Характеристики хлоридсодержащих жидкостей
В природной среде элемент находится в связанной форме (хлорид). Его присутствие зафиксировано в ряде минералов, к ним относятся: галит, карналлит и сильвит. Соединение вода плюс хлор возникает там, где подземные потоки проходят через пласты хлорсодержащих отложений. Также образование возможно в морях и некоторых озерах.
Большая часть веществ без проблем растворяется при контакте с H2O. Так образуются свободные подвижные ионы, благодаря которым солевые растворы обладают гораздо большей электропроводностью по сравнению с продуктом дистилляции.
Проводя анализ качественного состава в каком-либо водоеме, в первую очередь учитывают концентрацию хлоридных объединений. Так, в регионах с холодными климатическими условиями количество хлоридов в наземных и подземных потоках может равняться 10 мг/л. В южных зонах показатель способен достигать 100 мг/л. Большую угрозу экологии и здоровью человека представляют несанкционированно организованные или оборудованные ненадлежащим образом свалки. При сгорании хлорсоединения выделяют не меньше вредных соединений, чем при растворении.
Использование хлора для очистки воды сейчас повсеместное явление. Его избыток не лучшим образом сказывается на вкусовых качествах питья. Но использовать для бытовых и хозяйственных нужд такую жидкость можно. А вот задействовать ее в сельском хозяйстве — неверное решение.
Формулы
Являясь сильнейшим окислителем, она способна растворять даже золото. Представить ее наглядно можно по-разному.
Вариант формулы требует указания всех составляющих.
Cl2 + H2O = HCl + HClO.
Графическая вариация упрощает понимание, каким образом происходит слияние. Связь атомов в теле молекулы становится более наглядной. Так как хлорная вода содержит несколько соединений, следует рассмотреть их все.

Диспенсер напольный AquaPro 6207CH (охлаждение/нагрев/комн.темп)

Диспенсер настенный AquaPro 3207CH (охлаждение/нагрев)

Колонна аэрации AS-0844 VO-90
Хлорная и хлороводородная кислоты представляют собой электролиты. Поэтому они способны распадаться на ионы в жидкостном растворе. Течение реакций можно проследить по формулам:
- HCl ↔ H+ + Cl—
- HClO ↔ H+ + ClO—.
Эта версия демонстрирует размещение электронов в атоме, расположенных на энергетических подуровнях:
Это подтверждает то, что Cl причисляется к р-семейству элементов и показывает количество валентных электронов.
На рисунке ниже укажем формулу хлороводородной кислоты:
Нормы примесей
При растворении хлора в воде она обогащается ионами кальция и магния, что объясняет ее чрезмерную жесткость. Хлоридионы появляются в процессе образования раствора жидкость + вещество, являющегося сильнейшим электролитом MgCl2. В природе на их возникновение влияют естественные факторы, такие как вымывание хлорсодержащих пород. В водопроводной жидкости, которую мы используем для повседневных нужд, наполнения бассейнов, в качестве питья ионы возникают благодаря хлорированию. Этот процесс осуществляется с целью дезинфекции.
При этом очень важно, чтобы концентрация элемента не превышала установленную норму. Так, для употребления подходит H2O, в которой содержится не более 350 мг/л хлора. Для технического использования показатель может быть и 700 мг/л. Избавиться от лишней хлорки в воде чаще всего удается с помощью простого метода — отстаивания.
Как мы уже выяснили — очень важно соблюдать нужную дозировку. Если вещества в определенном объеме жидкости будет мало, она в короткие сроки обзаведется множеством опасных для здоровья микроорганизмов, при его переизбытке может превратиться в яд для человека. Кроме того, большая концентрация Cl наделяет питье неприятным вкусом и придает жесткость.
Оптимальное количество окислителя приблизительно 0,5 мг/л. Смешивание с реагентом производится с особой тщательностью. Употреблять питьевой раствор после реакции можно не ранее, чем через 30 минут.

Диспенсер магистральный настольный AquaPro 919H/RO (горячая и холодная вода)

Диспенсер магистральный настольный AquaPro 929CH/RO (охлаждение/нагрев)

Диспенсер напольный AquaPro 311 (пустой, без охлаждения)
Гипохлорид натрия выступает самым надежным средством для дезинфекции. Благодаря своим свойствам он эффективно устраняет вредоносные бактерии, а также является вполне безопасным по части взрывоопасности. Этот элемент более активный и не отличается токсичностью.
Вред повышенного содержания хлора в воде для здоровья человека
Мы уже разобрались, что это соединение используют для обеззараживания. В отношении человеческого организма это, конечно, не самая полезная добавка. Здесь важно осознавать степень его вреда и полезности.
В виде газа он без труда растворяется, в том числе и в дыхательных органах человека, а также на слизистых его носа и глаз. В процессе растворения элемента происходит образование соляной кислоты. Именно оказывает столь пагубное воздействие на телесную оболочку. Хлорные пары поражают сердце и легкие, заставляют задыхаться. Нарушается функционирование абсолютно всех тканей в организме.
Глаза отличаются особой чувствительностью. При попадании паров Cl появляется непрекращающееся жжение и раздражение, словно при глазной болезни. Оказавшись в такой ситуации, нужно помнить, что влияние атомарного кислорода на них невозможно предвидеть. Ухудшение самочувствия может наступить внезапно. К сожалению, слишком часто происходят такие неприятные и небезопасные для человека случаи.
Воды без хлора в системе водоснабжения практически не бывает. Набирая ванну, вы даже не замечаете, что она вместе с ним испаряется и попадает в легкие, на слизистые. Впоследствии вещество оседает на внутренних органах и выводит их из строя, также, как при употреблении такого питья.
Поэтому несмотря на выраженные обеззараживающие свойства, элемент имеет перечень противопоказаний для:
- беременных и кормящих женщин;
- маленьких детей в возрасте до 3 лет;
- людей, страдающих астмой;
- аллергиков.
Избыточное количество Cl способно спровоцировать:
- раздражение слизистой и повреждение кожного покрова;
- распад эмали зубов;
- различные экземы и высыпания;
- расстройство функционирования почек и печени;
- переход простудных заболеваний в хроническую форму;
- не проходящее чувство усталости.
Чем избыток хлорной воды вреден для бытового оборудования
Это вещество в больших количествах оказывает разрушительное воздействие не только на человеческий организм. Немалый вред оно наносит и технике. Слишком жесткая жидкость провоцирует выпадение характерного осадка, который скапливается на нагревательных элементах. Из-за этого в несколько раз возрастает вероятность поломки стиральных машин, посудомоечных аппаратов, котлов для подогрева H2O.
Воздействие на коммуникации
Коррозии вследствие избытка хлора, к сожалению, подвержены многие металлы. В системах водоснабжении хлорка выступает одной из ведущих причин возникновения разрывов и трещин в трубах, что зачастую приводит к масштабным протечкам.
Способы получения хлорной воды
Выбор методики во многом зависит от предназначения процесса и качества очищаемой среды. Большое значение имеет количество вредоносных примесей и их активность.

MBFT-75 Мембрана на 75GPD

АМЕТИСТ - 02 М Жилой дом до 10 человек или до 2 куб.м./сут.

Аэрационная установка AS-1054 VO-90
Довольно распространенный метод обеззараживания систем водоснабжения. Это вещество перевозят и хранят в емкостях из дерева или железобетона. Изнутри их в обязательном порядке отделывают кислотоупорным материалом (специальной плиткой) или цементом. Хлорирование известью производится с задействованием 2% раствора из расчета 5 кг/100 л. Существенным минусом такого способа выступают производственные затраты на изготовление очищающего средства и его большой расход.
Он отличается рядом серьезных преимуществ:
- обладает выраженными бактерицидными и дезодорирующими свойствами;
- позволяет добиться высокого качества пить
- необходимость перевозить Cl в жидком виде отпадает;
- в очищенной составе отсутствуют продукты распада;
При этом хлорная вода, ее цвет, вкус и запах соответствуют всем нормам. Однако, есть у представленного способа и свои недостатки. Он отличается дороговизной и довольно взрывоопасен, что немаловажно.
Дехлорирование
Когда концентрация превышает установленные нормы, проводят очищение от избытка элемента. Делают это посредством добавления в уже хлорсодержащую жидкость веществ, связывающих излишки и удаляющих их из состава. К таковым помощникам относятся: сульфит, гипосульфит натрия, сернистый газ.
Угольные элементы в приборе фильтрации устраняют неприятный запах, вкус, избавляют от излишков Cl, а также нежелательной органики. В процессе дехлорирования углем происходит реакция окисления. Продолжительность очистки варьируется от 2 до 8 минут. Наибольшей эффективности удастся достичь путем обратной промывки.
Вышеперечисленные методы удаления излишков хлорида можно применять как в домах, так и для очистки колодцев. Проводя обработку, следует строго соблюдать необходимые меры предосторожности.
Использование хлорной жидкости и хлорноватистой кислоты
Использовать вещества, содержащие активный Cl, начали очень давно, еще несколько столетий назад. Элемент был обозначен в далеком 1774 году химиком Бертолле. Он обнаружил, что вода, в состав которой входит хлор, способна отбеливать хлопковые и льняные ткани, удаляя с них въевшиеся желтоватые пятна. Тогда же этот выдающийся человек открыл собственное предприятие по отбеливанию материи и бумаги. Первым и единственным работником на фабрике в тот момент был только его сын.
При растворении хлора в воде появляется хлорноватистая кислота, которая не отличается высокой устойчивостью. В растворе ее обычно не больше 30%. Медленное течение реакции обеспечивает, как правило, кислая среда и температурный режим, приближенный к комнатному. Наличие соляной кислоты позволяет установиться равновесию. А при повышенных температурах в слабокислой основе процесс значительно ускоряется.
В XIX веке по результатам многочисленных исследований подтвердили дезинфицирующие свойства хлорки. В то время уже стало ясно, что аналогов, способных сравниться с данным веществом по части устранения различного рода загрязнений, не существует. Очередное же полезное качество сделало хлор еще более популярным.
Впервые с целью дезинфекции его стали задействовать в венской больнице в 1846 году. Доктора омывали им ладони перед контактом с пациентами и после. Проходивший в то время в Вене конгресс подтвердил, что подавляющее большинство болезней, характеризующихся как эпидемии, активно распространяются в водоемах. Cl в одночасье был признан одним из лучших средств для устранения заражающих бактерий из водной среды. Оказался он как нельзя кстати и при сооружении первых систем водоснабжения. На сегодняшний день продолжает занимать ведущее место среди современных средств дезинфекции.
Пожалуй, ни у кого теперь не осталось вопросов: растворим ли хлор в воде, чем опасен его избыток и как избежать связанных с ним проблем. Надеемся, что наша статья оказалась для вас действительно полезной.
Хлор в чистом виде впервые выделил шведский ученый Карл Шееле в 1774 году. Своё нынешнее название элемент получил в 1811 году, когда Г.Дэви предложил название "хлорин", которое вскоре было сокращено до "хлор" с легкой руки Ж. Гей-Люссака. Немецкий ученый Иоганн Швейгер предложил для хлора название "галоген", но этим термином было решено назвать всю группу элементов, в которую входит и хлор.
Хлор является самым распространенным галогеном в земной коре - на долю хлора приходится 0,025% всей массы атомов земной коры. По причине своей высокой активности хлор не встречается в природе в свободном виде, а только в составе соединений, при этом хлору "по барабану" с каким элементом вступать в реакцию, современной науке известны соединения хлора практически со всей таблицей Менделеева.
Основная масса хлора на Земле содержится в соленой воде Мирового океана (содержание 19 г/л). Из минералов больше всего хлора содержится в галите, сильвине, сильвините, бишофите, карналлите, каините.
Хлор играет важную роль в деятельности нервных клеток, а также в регуляции осмотических процессов, происходящих в организме человека и животных. Также хлор входит в состав зеленого вещества растений - хлорофилла.
Природный хлор состоит из смеси двух изотопов:
- 35 Cl - 75,5%
- 37 Cl - 24,5%
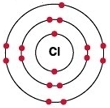
Рис. Строение атома хлора.
Электронная конфигурация атома хлора - 1s 2 2s 2 2p 6 3s 2 3p 5 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 5 электронов, находящихся на внешнем 3p-уровне + 2 электрона 3s уровня (всего 7 электронов), поэтому в соединениях хлор может принимать степени окисления от +7 до -1. Как уже было сказано выше, хлор является химически активным галогеном.
Физические свойства хлора:
- при н.у. хлор является ядовитым газом желто-зеленого цвета с резким запахом;
- хлор в 2,5 раза тяжелее воздуха;
- при н.у. в 1 л воды растворяется 2,5 объема хлора - этот раствор называется хлорная вода.
Химические свойства хлора
Взаимодействие хлора с простыми веществами (Cl выступает в роли сильного окислителя):
- с водородом (реакция протекает только при наличии света):
- с металлами с образованием хлоридов:
- с неметаллами, менее электроотрицательными, чем хлор:
- с азотом и кислородом хлор не реагирует непосредственно.
Взаимодействие хлора со сложными веществами:
Одной из самых известных реакций хлора со сложными веществами есть взаимодействие хлора с водой - кто живет в большом городе, наверняка, периодически сталкивается с ситуацией, когда, открыв кран с водой, ощущает стойкий запах хлора, после чего многие сетуют, дескать, опять воду хлорировали. Хлорирование воды является одним из основных способов ее обеззараживания от нежелательных микроорганизмов, небезопасных для здоровья человека. Почему так происходит? Разберем реакцию хлора с водой, которая протекает в два этапа:
- На первом этапе происходит образование двух кислот: соляной и хлорноватистой:
- На втором этапе хлорноватистая кислота разлагается с выделением атомарного кислорода, который окисляет воду (убивая микроорганизмы) + подвергает отбеливающему действию ткани, окрашенные органическими красителями, если их опустить в хлорную воду:
С кислотами хлор не взаимодействует.
Взаимодействие хлора с основаниями:
- на холоде:
- при нагревании:
- с бромидами металлов:
- с йодидами металлов:
- с фторидами металлов хлор не реагирует, по причине их более высокой окислительной способности, нежели у хлора.
Хлор "охотно" вступает в реакции с органическими веществами:
В результате первой реакции с метаном, которая протекает на свету, образуется хлористый метил и соляная кислота. В результате второй реакции с бензолом, которая протекает в присутствии катализатора (AlCl3), образуется хлорбензол и соляная кислота.
Получение и применение хлора
Промышленным способом хлор получают электролизом водного раствора (хлор выделяется на аноде; на катоде - водород) или расплава хлорида натрия (хлор выделяется на аноде; на катоде - натрий):
В лаборатории хлор получают действием концентрированной HCl на различные окислители при нагревании. В роли окислителей могут выступать оксид марганца, перманганат калия, бертолетова соль:
Применение хлора:
- отбеливание тканей и бумаги;
- обеззараживание воды;
- производство пластмасс;
- производство хлорной извести, хлороформа, ядохимикатов, моющих средств, каучуков;
- синтез хлороводорода в производстве соляной кислоты.
Если вам понравился сайт, будем благодарны за его популяризацию :) Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Природная вода содержит значительное количество примесей, начиная от растворенных металлов и их солей, заканчивая механическими включениями в виде ржавчины, песка, глины. Химический состав примесей огромен, среди них части встречаются соли соляной кислоты, которые влияют на общее количество хлоридов в воде.
Если вы заметили, что качество водопроводной снижено: образуется накипь на приборах и посуде, вода имеет неприятный вкус, то есть большая вероятность, что вода содержит хлориды. Также при обустройстве скважины очень важно, провести анализ воды, чтобы установить концентрацию примесей в ней. Концентрация хлоридов в воде сверхдопустимых норм опасна для здоровья человека, бытового и промышленного оборудования, поэтому важно уметь определить их присутствие и правильно очистить воду от них.
Откуда хлориды в воде
Хлориды в воде - это соли, полученные при взаимодействии соляной кислоты и катионов металла, имеющие высокую растворимость в воде. Самые распространенные хлориды - кальциевые, магниевые и натриевые. Происхождение хлоридов в воде обусловлено природными источниками. Данные соединения есть практически в каждом природном источнике воды - реках, озерах, скважинах, ручьях, колодцах.
Содержание хлоридов в озерах и реках колеблется от доли грамма до нескольких граммов на литр, в морях количество хлорид-ионов составляют 87% от массы всех анионов, поэтому уровень их концентрации в морях и подземных водах позволяет отнести их к перенасыщенным растворам и рассолам.
Появлению их в воде они обязаны грунтовым и артезианским водам, которые вымывают соединения их пластов земли, которые в свою очередь образовались в результате извержения вулканов. В состав магматических пород входят следующие минералы:
- содалит;
- хлорапатит;
- галит и другие.
Большое количество хлоридов в виде солей хлорида натрия (NaCl) содержится в морях и океанах. Средняя концентрация хлорид-иона в мировом океане - 19 г/л.
Избыток в воде солей хлоридов геологического происхождения в поверхностях водах явление достаточно редкое, поэтому присутствие хлоридов на уровне выше нормального является показателем бытового и промышленного загрязнения воды. Значительное количество хлоридов в воде, обусловленное природными явлениями, бывает в случаях:
- засоления почвы в результате подъема высокоминерализованных подземных вод;
- постоянного притока вод с последующим испарением жидкости.
Еще одна значительная причина повышенного содержание хлорид ионов в воде - деятельность человека. Удобрения, соль для растворения льда на дорогах, выбросы предприятий химической промышленности, свалки, сточные воды и отходы человеческой деятельности - все это способствует появлению и круговороту хлоридов в природе. В промышленных сточных водах могут содержаться различные соли, характер и оказываемое влияние которых зависит от производственного предприятия.
Из всех известных анионов хлориды обладают самой высокой способностью к миграции, которая объясняется высокой растворимостью, слабо выраженной способностью к сорбции и потреблению живыми организмами.
Повышенное содержание хлоридов в питьевой воде придает ей солоноватый привкус и оказывает негативное влияние на здоровье человека, также она не пригодна для хозяйственных и технических нужд.
Допустимое содержание хлоридов в природных водах
Содержание хлоридов в воде зависит от сезонности и уровня минерализации воды. Например, в водоемах северной части России норма хлоридов в воде не выше 10 мг/л, а для южных регионов характерно значение от 10 до 100 мг/л.
Речные и озерные водоемы считаются пресными водами, поэтому значение хлоридов в воде находится на уровне 10 мг/л. Если при анализе обнаружено их повышенное количество, значит, водоем загрязняется сточными водами.
Знание ПДК хлоридов в воде и уровня содержания анионов хлора определяют пригодность воды для питья, использования в сельском хозяйстве и на промышленных предприятиях.
Нормы воды по хлоридам для централизованных систем определены государственным стандартом СанПиН 2.1.4.1074-01. Так уровень хлоридов в централизованном водоснабжении не должен превышать 350 мг/л, однако, рекомендованная концентрация хлоридов в питьевой воде составляет 200 мг/л. Разница значений концентрации для поступающей в дома воды и пригодной к употреблению диктует пользователям необходимость установки специальных фильтров очистки воды. Для полива растений концентрация хлоридов должна находиться на уровне 50 - 300 мг/л в зависимости от типа растения, для водных объектов рыбохозяйственного назначения наличие хлоридов в воде не должно превышать 300 мг/дм 3 .
В бассейнах нормы содержания хлоридов в воде (ПДК) не должны быть больше 700 мг/л.
Чем опасны хлориды в воде для организма человека
Влияние на организм хлоридов в воде заметили еще в древности. Вода, содержащая хлориды, превышающие допустимые значения, негативно сказывается на здоровье. При использовании такой жидкости страдают слизистые оболочки, глаза, кожа и дыхательные пути.
Хлориды в воде вредны для здоровья. Употребляя воду с хлоридами, человек испытывает нарушение водно-солевого баланса и пищеварительного тракта, возникают отечности. Переизбыток солей хлора:
- вызывает нарушение функционирования мочеполовой системы;
- приводит к изменениям кровеносной системы;
- оказывает повышенную нагрузку на почки и сердце;
- повышает кровеносное давление;
- усугубляет течение сердечно-сосудистых заболеваний.
Хлориды в воде наносят вред домашним и сельскохозяйственным животным, влияют на рост и развитие растений.
Агрессивное воздействие солей разрушает бытовые и промышленные приборы, в разы увеличивая интенсивность коррозии. Такая вода имеет повышенную жесткость, соли оседает на нагревательных приборах, образуя накипь, снижая теплопроводность устройств и утвари, и приводят к поломкам оборудования.
На промышленные и бытовые коммуникации влияние хлоридов в воде оказывается в виде:
- коррозии и появлении темных пятен на поверхностях труб и нержавеющих стальных раковинах и агрегатах;
- из-за образующегося осадка снижается теплоотдача батарей и увеличивается расход энергии на подогрев воды;
- точечной коррозии труб и котлов отопления, приводя к разрушению стенок;
- уменьшения межремонтных периодов, вызванных аварийными ситуациями.
Как определить наличие хлоридов в воде
Самый верный способ определения концентрации хлоридов в воде - сдача пробы в лабораторию. Для этого нужно вызвать на дом специалиста, либо отобрать пробу самостоятельно и привести в специализированную организацию для проведения анализа на хлориды в воде. При самостоятельной доставке воды важно не подвергать ее воздействию температур и солнечных лучей, достаточно пропустить воду в кране в течение 5-10 минут и тонкой струей набрать воду по стенкам в 1,5-2 л бутылку, предварительно очищенную и вымытую в этой же воде.
Были разработаны ГОСТы, регламентирующие, какие методы, оборудование и расчеты использовать для определения содержания хлоридов в воде.
Методики определения содержания хлоридов в питьевой воде описаны в ГОСТ 4245-72, и основываются они на процессе титрования, при котором к имеющемуся раствору (анализируемой воде) подмешивают определенное вещество до тех пор, пока не прекратится протекать химическая реакция. Титриметрическое определение хлоридов в воде позволяет вычислить количественное или массовое содержание ионов хлора.
Иные современные нормативные документы, которые регламентируют качество воды и способы ее контроля, допускают применение химических, физико-химических и физических методов анализа. Помимо титрования используются такие методы как:
- определение хлоридов в воде с дифенилкарбазоном.
- меркуриметрический метод определения хлоридов в воде.
- определение хлоридов в воде фотометрическим методом и т.д.
Исследование воды на хлориды можно провести самостоятельно. В быту сигналом для проведения анализа могут стать:
- солоноватый вкус воды, скорее всего, превышена концентрация хлоридов натрия;
- горьковатый вкус свидетельствует о повышенном содержании хлоридов кальция.
Вода, с повышенным содержанием хлоридов, оказывает негативное воздействие на здоровье человека, на качество работы бытовых устройств и систем коммуникации. Очень важно вовремя определить концентрации анионов хлоридов и установить подходящие устройства очистки.
Как убрать хлориды в питьевой воде
Чаще всего для очистки воды от хлоридов используют методы, основанные на сорбции, ионном обмене и обратном осмосе. Все эти способы используются в системах очистки, как на крупных промышленных предприятиях, так и в быту в фильтрующих устройствах для централизованной водопроводов и воды, поступающей из скважин. Подробнее об очистке воды от хлорид-ионов вы можете прочитать в статье "Как очистить воду от хлоридов".
Читайте также:

