Формула метана с хлором
Метил хлористый (Хлорметан) – это бесцветный сжиженный газ. Сильно огнеопасно. Нагревание приводит к повышению давления с риском взрыва. Вещество может всасываться в организм при вдыхании и через кожу.
Аварийная карточка (АХОВ)
В случае пожара: охлаждать баллоны, обливая их водой. Вести борьбу с огнем из укрытия. Перекройте поступление; если невозможно и нет риска для окрестностей, дайте огню прогореть, в других случаях – тушите разбрызгиванием воды.
Провести эвакуацию из опасной зоны! Проконсультироваться со специалистом! Вентиляция. НИКОГДА не направлять струю воды на жидкость.
Нейтрализуют метил хлористый 10%-ным водным раствором щелочи (например, 100 кг едкого натра и 900 литров воды) с нормой расхода 10 тонн раствора на 1 тонну метила хлористого. При пожаре тушить распыленной водой, воздушно-механической пеной.
Для распыления воды и растворов применяют поливомоечные и пожарные машины, авторазливочные станции (ПМ-130, АЦ, АРС-14, АРС-15), мотопомпы (МП-800), а также имеющиеся на химически опасных объектах гидранты и спецсистемы.
При разливе сжиженного метила хлористого место разлива засыпают активным углем или углем катализатором, обрабатывают дегазирующим раствором № 2-ащ (2-бщ), мыльной водой.
Для утилизации загрязненного грунта на месте разлива срезают поверхностный слой грунта на глубину загрязнения, собирают и вывозят на утилизацию с помощью землеройно-транспортных машин (бульдозеров, скреперов, автогрейдеров, самосвалов). Места срезов засыпают свежим слоем грунта, промывают мыльной водой в контрольных целях.
В зараженной зоне: надеть противогаз, немедленно эвакуировать из зоны заражения.
После эвакуации из зараженной зоны: ингаляция кислорода, искусственная вентиляция легких, тепло, покой, обильное щелочное питье, срочная госпитализация. ПРИ ОБМОРОЖЕНИИ: промыть большим количеством воды, НЕ удалять одежду.
ФИЗИЧЕСКОЕ СОСТОЯНИЕ, ВНЕШНИЙ ВИД:
БЕСЦВЕТНЫЙ СЖИЖЕНЫЙ ГАЗ
ФИЗИЧЕСКАЯ ОПАСНОСТЬ:
Газ тяжелее воздуха. и может стелиться по земле; возможно возгорание на расстоянии. и может накапливаться в помещениях с низкими потолками, вызывая недостаток кислорода. См. Примечания.
ХИМИЧЕСКАЯ ОПАСНОСТЬ:
Вещество разлагается при сжигании с образованием токсичных и едких паров, в том числе хлористого водорода и фосгена. Реагирует бурно с порошкообразным алюминием, порошкообразным цинком, трихлоридом алюминия и этиленом с опасностью пожара и взрыва. Агрессивно в отношении многих металлов в присутствии влаги.
ПУТИ ПОСТУПЛЕНИЯ:
Вещество может всасываться в организм при вдыхании и через кожу.
РИСК ПРИ ВДЫХАНИИ:
При утечке содержимого очень быстро достигается опасная концентрация этого газа в воздухе.
ВЛИЯНИЕ КРАТКОВРЕМЕННОГО ВОЗДЕЙСТВИЯ:
Жидкость может вызвать обморожение. Вещество может оказывать действие на центральную нервную систему. Воздействие может вызвать потерю сознания. Воздействие на уровне, значительно превышающем OEL может вызвать поражение печени, сердечно-сосудистой системы и почек. Показано медицинское наблюдение.
ВЛИЯНИЕ ДОЛГОВРЕМЕННОГО ИЛИ МНОГОКРАТНОГО ВОЗДЕЙСТВИЯ:
Вещество может оказывать действие на центральную нервную систему приводя к эффектам, мерой которых служат поведенческие реакции. Исследования на животных показывают, что вещество, возможно, оказывает токсическое действие на репродуктивную функцию человека.
НАЛИЧИЕ
ХЛОРМЕТАНА
ОПРЕДЕЛЯЮТ:
В воздухе производственных помещений: пламенно-ионизационным сигнализатором до взрывных концентраций СДК-3, взрывоопасным искровым пневматическим сигнализатором СВИП-1, СВИП-2.
Температура кипения: -24.2°C
Температура плавления: -97.6°C
Относительная плотность (вода = 1): 0.92
Растворимость в воде, г/100 мл при 25°C: 0.5
Давление паров, кПа при 21°C: 506
Относительная плотность пара (воздух = 1): 1.8
Температура вспышки: Горючий газ
Температура самовоспламенения: 632°C
Пределы взрываемости, объем% в воздухе: 8.1-17.4
Предельно – допустимая концентрация (ПДК) метила хлористого составляет: в воздухе рабочей зоны производственных помещений 5,0 мг/м 3 , в воздухе населенных пунктов 0,06 мг/м 3 . При остром отравлении оказывает наркотическое и выраженное нейротоксическое действие, поражает почки, печень, вызывает отек легких, является мутагеном.
Признаки поражения: общая слабость, головокружение, тошнота, рвота, сонливость, повышение температуры, тахикардия, расстройство зрения; в тяжелых случаях затемнение сознания, судороги. Средняя смертельная концентрация составляет 50 мг/м 3 в течение 2-х часов. Поражающая токсодоза 90 мг∙мин./л.


ГОСТ 12794-80
ХИМИЧЕСКАЯ ФОРМУЛА: CH3Cl
МОЛЕКУЛЯРНАЯ МАССА: 50,49
Хлорметан (метилхлорид) — органическое вещество, принадлежащее к группе галогеналканов. Впервые был получен французскими химиками Жаном Батистом Дюма и Эженом Пелиго в 1835 году кипячением смеси метанола, серной кислоты и хлорида натрия. Аналогичный способ используется и в наши дни. Хлорметан — бесцветный легколетучий газ со сладковатым запахом. Благодаря слабому запаху, можно легко не заметить токсичной или взрывоопасной концентрации.
Массовая доля нелетучего остатка, %, не более
Показатель активности водородных ионов водного раствора, рН
Содержание метанола и карбонильных соединений
Массовая доля воды, %, не более
Объемная доля диметилового эфира, %, не более
Массовая доля двуокиси углерода, %, не более
Массовая доля фосфорорганических соединений в пересчете на фосфор, %, не более
ПРИМЕНЕНИЕ: Хлорметан был широкоприменяемым хладагентом. Но такое его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец). Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количества используют в качестве растворителя при производстве бутилкаучука и очистке бензина.
Хлорметан используют как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
ОСОБЫЕ СВОЙСТВА: Горючий газ, образует с воздухом взрывоопасные смеси, пределы воспламенения паров в воздухе: нижний - 5,6%, верхний - 35%. Относится ко 2 классу опасности. Обладает наркотическим действием, раздражает кожные покровы и слизистые оболочки глаз и дыхательных путей. Поражает нервную и сердечнососудистую системы.
ТАРА: Специальные железнодорожные цистерны, предназначенные для перевозки сжиженных газов, и баллоны вместимостью 20-40 дм 3 . На каждый литр емкости тары допускается наполнять не более 0,75 кг хлористого метила.
ТРАНСПОРТИРОВКА И ХРАНЕНИЕ: Транспортируется в специальных железнодорожных цистернах, предназначенных для перевозки сжиженных газов. Баллоны транспортируют только автотранспортом в соответствии с правилами перевозок опасных грузов, действующими на данном виде транспорта. Хранить в крытых складских помещениях, отвечающих требованиям правил для складов с ядовитыми горючими сжиженными газами. Гарантийный срок хранения - два месяца со дня изготовления.


- Хладагент-40
- Р-40
- метилхлорид
- Monochloromethane
- Интерактивное изображение
- 6327
- хлориодметан
- Бромхлорметан
- Dibromochloromethane
Хлорметан , называемый также хлористый метил , Хладагент-40 , R-40 или ГЦК 40 , представляет собой химическое соединение из группы , состоящей из органических соединений , называемых галогеналканы . Он был когда - то широко используется в качестве хладагента . Это бесцветный чрезвычайно горючий газ с умеренно сладким запахом. Из - за опасения по поводу своей токсичности, она больше не присутствует в потребительских товарах. Хлорметан был впервые синтезирован французскими химиками Жан-Батист Дюма и Евгений Пелиго в 1835 году путем кипячения смеси метанола , серной кислоты и хлорид натрия . Этот метод аналогичен тому , который используется сегодня.
содержание
- 1 Происшествие
- 1,1 Marine
- 1.2 Биогенез
- 1.3 Межзвездных обнаружения
- 2 Производство
- 3 Использование
- 4 Безопасность
- 5 Ссылки
- 6 Внешние ссылки
Вхождение
Хлорметан является наиболее распространенной органогалогенным , антропогенным или природным, в атмосфере. Это является составной частью табачного дыма .
Лабораторные культуры морского фитопланктона ( Phaeodactylum tricornutum , Phaeocystis зр., Thalassiosira weissflogii , Chaetoceros calcitrans , Isochrysis зр., Porphyridium зр., Synechococcus зр., Tetraselmis зр., Prorocentrum зр., И Emiliana huxleyi ) производят CH 3 Cl, но в относительно незначительные суммы. Обширное исследование 30 видов полярных макроводорослей показало высвобождение значительных количеств CH 3 Cl только Gigartina skottsbergii и Gymnogongrus antarcticus .
Солончак растения Батиса тагШт содержит фермент трансферазы хлористого метила , который катализирует синтез CH 3 Cl от S-аденозин-L-метионина и хлорида. Этот белок был очищен и выражается в E.coli , и , как представляется, присутствуем в других организмах , такие как грибы белой гнили ( Phellinus pomaceus ), красные водоросли ( Endocladia muricata ), и лед завод ( мезембриантемум хрустальные ), каждый из которых является известный СН 3 производитель Cl.
Хлорметан был обнаружен в низкой массовой Класс 0 протозвездного двоичный, ИРАС 16293 - +2422 , используя Атакама Большой миллиметровый массив (ALMA). Он был также обнаружен в кометы 67P / Чурюмов-Герасименко (67P / CG) , используя Rosetta Orbiter спектрометр для ионов и нейтральный анализ (Розина) инструмента на Розеттском космического аппарата. Обнаружения показывают , что хлорметан может быть сформированы в областях звездообразования , прежде чем планеты или жизнь формируются.

производство
Большие количества хлорметана производится естественным образом в океане при действии солнечного света на биомассу и хлор в морской пены. Тем не менее, все хлорметан , который используется в промышленности получают синтетически.
Наиболее хлорметан, получают взаимодействием метанола с хлористым водородом , в соответствии с химическим уравнением
Это может быть осуществлено либо путем барботирования газообразного хлороводорода через кипы щего метанол с или без хлорида цинка катализатора , или путем пропускания объединенных паров метанола и хлористого водорода над оксидом алюминий катализатором при температуре 350 ° C (662 ° F).
Меньшее количество хлорметана получают путем нагревания смеси метана и хлора до более чем 400 ° C (752 ° F). Тем не менее, этот способ также приводит к более высокой хлорированных соединений , таких как дихлорметан , хлороформ и четыреххлористый углерод , и, как правило , используется только тогда , когда эти другие продукты также желательно.
Пользы
Хлорметан был широко используется хладагент , но его использование было прекращено из - за его токсичности и пожароопасности. Хлорметан также когда - то использовали для изготовления на основе свинца бензин добавки (tetramethyllead).
Наиболее важное использование хлорметана сегодня в качестве промежуточного химического вещества в производстве силиконовых полимеров. Небольшие количества используют в качестве растворителя при производстве бутилкаучука и переработке нефти .
Хлорметан используется в качестве метилирующего и хлорирующего агента в органической химии . Он также используется в различных других областях: в качестве экстрагента для смазок , масел и смол , в качестве пропеллента и вспенивающего агента в полистирол производства пены, как местный анестетик , в качестве промежуточного продукта в производстве лекарственного средства, в качестве катализатора носителя в низкотемпературная полимеризация , как жидкость для термометрического и термостатического оборудования, и в качестве гербицида .
безопасности
Вдыхание хлорметан газа производит центральную нервную систему эффекты , подобные интоксикации наркотиками . Воздействие может вызвать сонливость, головокружение или путаницы и затрудненное дыхание, ходьба или разговор может произойти. При более высоких концентрациях, паралич , судороги и кома может привести.
В случае проглатывания, тошнота и рвота могут произойти. При попадании на коже, когда в виде охлажденной жидкости, может привести к обморожению . Контакт с глазами может привести к тусклому зрению и широко расширенным зрачкам , которые реагируют медленно к изменениям в свете.
Хроническое воздействие хлорметана было связано с врожденными дефектами у мышей. В организме человека, воздействие хлорметана во время беременности может привести к плоду нижних позвоночника , таз и ноги , чтобы сформировать неправильно, но это не было убедительно продемонстрировано.
Химические свойства метана ничем не отличаются от свойств, присущих всем веществам класса алканов. В школьном курсе химии метан изучают одним из первых веществ органики, так как он является одним из простейших представителей алканов.
В его составе один атом углерода и четыре атома водорода.
Формула метана и способы его получения
Метан в больших количествах содержится в атмосфере. Мы не обращаем внимания на нахождение этого газа в воздухе, ведь на нашем организме это никак не отражается, а вот канарейки очень чувствительны к метану.
Когда-то они даже помогали шахтерам спускаться под землю. Когда процентное содержание метана изменялась, птицы переставали петь. Это служило сигналом для человека, что он спустился слишком глубоко и нужно подниматься наверх.

Образуется метан в результате распада остатков живых организмов. Не случайно с английского methane переводится, как болотный газ, ведь он может быть обнаружен в заболоченных водоемах и каменноугольных шахтах.
Основным источником газа в агропромышленном комплексе является рогатый скот. Да, метан они выводят из организма вместе с остальными продуктами жизнедеятельности. Кстати, увеличение числа рогатого скота на планете может привести к разрушению озонового слоя, ведь метан с кислородом образуют взрывоопасную смесь.
Метан в промышленности можно получить с помощью нагревания углерода и водорода или синтеза водяного газа, все реакции протекают в присутствии катализатора, чаще всего никеля.
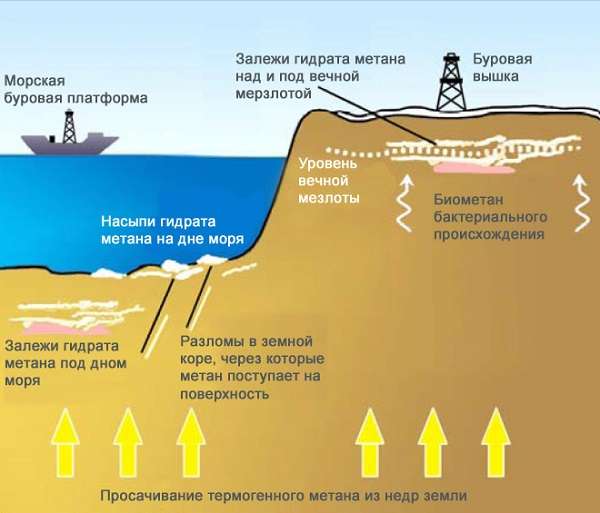
В США разработана целая система по добыче метана, она способна извлечь до 80% газа из природного угля. На сегодняшний день мировые запасы метана оцениваются экспертами в 260 триллионов метров кубических! Даже запасы природного газа значительно меньше.
В лаборатории метан получают путем взаимодействия карбида алюминия (неорганическое соединение алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262.
Физические свойства метана
- Бесцветный газ, без запаха.
- Взрывоопасен.
- Нерастворим в воде.
- Температура кипения: -162oC, замерзания: -183°C.
- Молярная масса: 16,044 г/моль.
- Плотность: 0,656 кг/м³.
Химические свойства метана
Говоря о химических свойствах, выделяют те реакции, в которые вступает метан. Ниже они приведены вместе с формулами.
Горение метана
Как все органические вещества, метан горит. Можно заметить, что при горении образуется голубоватое пламя.
СН4 + 2O2 → СO2↑ + 2Н2O
Называется такая реакция – реакцией горения или полного окисления.
Замещение
Метан также реагирует с галогенами. Это химические элементы 17 группы в периодической таблице Менделеева. К ним относятся: фтор, хлор, бром, йод и астат. Реакция с галогенами называется – реакцией замещения или галогенирования. Такая реакция проходит только в присутствии света.
Хлорирование и бромирование
Если в качестве галогена используется хлор, то реакция будет называться – реакцией хлорирования. Если в качестве галогена выступает бром, то – бромирование, и так далее.
CH4 + Cl2 → CH3Cl + НСl
CH4 + Br2 → CH3Br + НBr
Хлорирование. Низшие алканы могут прохлорировать полностью.
CH4 + Cl2 → CH3Cl + НСl
CH3Cl + Cl2 → CH2Сl2 + НСl
CH2Сl2+ Cl2 → CHCl3 + НСl
CHCl3 + Cl2 → CСl4 + НСl
Точно так же метан может полностью вступать в реакцию бромирования.
CH4 + Br2 → CH3Br + Н Br
CH3Br + Br2 → CH2Br2 + НBr
CH2Br2 + Br2 → CHBr3 + НBr
CHBr3 + Br2 → CBr4 + НBr
С йодом такой реакции уже нет, а с фтором наоборот сопровождается быстрым взрывом.
Разложение
Так же этому углеводороду свойственна реакция разложения. Полное разложение:
И неполное разложение:
2СН4 → С2Н2 + 3Н2
Реакция с кислотами
Метан реагирует с концентрированной серной кислотой. Реакция носит название сульфирования и происходит при небольшом нагревании.
2СН4 + Н2SО4 → СН3SО3Н + Н2О
Окисление
Как уже было сказано, СH4 может полностью окисляться, но при недостатке кислорода возможно неполное окисление.
2СН4 + 3O2 → 2CO + 4Н2O
СН4 + О2 → С + 2Н2O
Помимо прочего для этого газа характерно каталитическое окисление. Оно происходит в присутствии катализатора. При разном соотношении моль вещества получаются разные конечные продукты реакции. В основном это:
- спирты: 2СН4 + O2 → 2СO3OН
- альдегиды: СН4 + O2 → НСОН + Н2O
- карбоновые кислоты: 2СН4 + 3O2 → 2НСОOН + 2Н2O
Реакция протекает при температуре 1500°C. Данная реакция также носит название – крекинг – термическое разложение.
Нитрование метана
Существует также реакция нитрования или реакция Коновалова, названная в честь ученого, который доказал, что с предельными углеводородами действует разбавленная азотная кислота. Продукты реакции получили название – нитросоединения.
CH4 + НNО3 → СН3NO2 + H2O
Реакция проводится при температуре 140-150°C.
Дегидрирование метана
Кроме того, для метана характерна реакция дегидрирования (разложения) – отцепление атомов водорода и получения ацетилена, в данном случае.
2CН4 → C2H2 + 3Н2
Применение метана
Метан, как и остальные предельные углеводороды, широко используется в повседневной жизни. Его применяют в производстве бензина, авиационного и дизельного топлива.
Используют в качестве базы для получения различного органического сырья на предприятиях. Также метан широко используется в медицине и косметологии.

Метан применяют для получения синтетического каучука, красок и шин.
Атлеты используют так называемый жидкий метан для быстрого набора массы за короткий промежуток времени.
А при хлорировании метана образуется вещество, которое в дальнейшем используется для обезжиривания поверхностей или как компонент в средствах для снятия лака. Некоторое время продукт взаимодействия метана и хлора использовали в качестве наркоза.
Мы приступаем к новому разделу - органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций ;)

В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) - насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями - содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда - CnH2n+2.
Номенклатура (от лат. nomen - имя + calare - созывать) - совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса "ан": метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos - соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros - составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода - sp 3
- Валентный угол (между химическими связями) составляет 109°28'

Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.

В промышленности алканы получают путем:
-
Крекинга нефти
В ходе крекинга нефти получается один алкан и один алкен.
Гидрогенизацией угля (торфа, сланца)
Гидрированием оксида углерода II
В лабораторных условиях алканы получают следующими способами:
-
Синтез Дюма
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.

В результате электролиза солей карбоновых кислот может происходить образование алканов.

В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Гидрированием ненасыщенных углеводородов
Алканы - насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
-
Галогенирование
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее - у вторичного и значительно труднее - у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Для удобства и более глубокого понимания, азотную кислоту - HNO3 - можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.

Пиролиз (греч. πῦρ - огонь + λύσις - разложение) - термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения - в отсутствии кислорода.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

