Формула льюиса соединения между алюминием и хлором
§3.2 Ковалентная связь. Понятие о полярной ковалентной и ионной связи.
В слове "ковалентная" приставка "ко-" означает "совместное участие". А "валента" в переводе на русский – сила, способность. В данном случае имеется в виду способность атомов связываться с другими атомами.
При образовании ковалентной связи атомы объединяют свои электроны как бы в общую "копилку" – молекулярную орбиталь , которая формируется из атомных оболочек отдельных атомов. Эта новая оболочка содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки.
Рассмотрим возникновение ковалентной связи на примере образования молекулы водорода из двух атомов водорода (рис. 3-1). Этот процесс уже является типичной химической реакцией , потому что из одного вещества (атомарного водорода) образуется другое – молекулярный водород. Внешним признаком энергетической выгодности этого процесса является выделение большого количества теплоты.
Рис 3-1. Возникновение ковалентной связи при образовании молекулы водорода из двух атомов водорода. Электронные оболочки атомов водорода (с одним s-электроном у каждого атома) сливаются в общее электронное облако (молекулярную орбиталь), где оба электрона "обслуживают" ядра независимо от того, "свое" это ядро или "чужое".
Когда электронные оболочки двух атомов водорода сближаются и образуют новую, теперь уже молекулярную электронную оболочку (рис. 3-1), эта новая оболочка подобна завершенной электронной оболочке атома благородного газа гелия (1s 2 ).
Завершенные оболочки, как мы помним, устойчивее незавершенных. Таким образом, суммарная энергия новой системы – молекулы водорода – оказывается гораздо ниже суммарной энергии двух несвязанных атомов водорода. Избыток энергии при этом выделяется в виде теплоты.
Минимум энергии молекулы отвечает определенному расстоянию между ядрами атомов водорода (рис. 3-2). Если атомы в молекуле с помощью внешней силы сдвинуть еще ближе, то в действие вступает мощное отталкивание между одноименно заряженными ядрами атомов и общая энергия системы начинает возрастать. Это невыгодно системе, поэтому длина связи представляет собой строго определенное, равновесное значение. Для молекулы водорода равновесная длина химической связи составляет 0,74 ангстрема (1 А = 10 –8 см), как это видно на рис. 3-2.
Рис. 3-2. Кривая изменения потенциальной энергии при взаимодействии двух атомов водорода с образованием молекулы водорода.
В образовавшейся системе из двух водородных атомов каждое ядро обслуживается двумя электронами. В новой (молекулярной) оболочке уже невозможно различить, какой из электронов ранее принадлежал тому или другому атому. Принято говорить, что электроны обобществлены . Поскольку оба ядра претендуют на пару электронов в равной степени, электронная плотность сосредоточена как вокруг ядер, так и в пространстве между атомами (это показано на рис. 3-3).
Рис. 3-3. Другой способ изображения атомных и молекулярной орбиталей: густота точек отражает "электронную плотность", то есть вероятность нахождения электрона в какой-либо точке пространства около ядер атомов водорода. Видно, что значительная электронная плотность сосредоточена в пространстве между двумя ядрами в молекуле водорода.
На рисунках 3-1 и 3-3 вы видите очень детальное изображение ковалентной связи. На практике используют более простые способы. Например, американский химик Дж. Льюис в 1916 году предложил обозначать электроны точками рядом с символами элементов. Одна точка обозначает один электрон. В этом случае образование молекулы водорода из атомов записывается так:
Оказалось, что формулы Льюиса имеют глубокий химический смысл. Мы видим, что связь между атомами водорода обозначается парой электронов. Как предположил Льюис, именно пара электронов позволяет образовать ковалентную связь. Впоследствии это предположение подтвердилось квантовой теорией.
Ковалентной связью называется связывание атомов с помощью общих (поделенных между ними) электронных пар.
Рассмотрим связывание двух атомов хлора 17 Cl (заряд ядра Z = 17) в двухатомную молекулу с позиций строения электронных оболочек хлора. Для этого запишем формулу Льюиса для атома хлора и конфигурацию его внешней электронной оболочки:
На внешнем электронном уровне хлора содержится s 2 + p 5 = 7 электронов. Поскольку электроны нижних уровней не принимают участия в химическом взаимодействии, точками мы обозначили только электроны внешнего , третьего уровня. Эти внешние электроны (7 штук) можно расположить в виде трех электронных пар и одного неспаренного электрона.
После объединения атомов в молекулу из двух неспаренных электронов атомов получается новая электронная пара:
При этом каждый из атомов хлора оказывается в окружении ОКТЕТА электронов. В этом легко убедиться, если обвести кружком любой из атомов хлора.
Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой . Остальные пары электронов называют неподеленными парами . Они заполняют оболочки и не принимают участие в связывании.
Льюис не только предложил теорию ковалентной связи, но и первым сформулировал правило октета-дублета, которым мы уже пользовались в прошлой главе для объяснения устойчивости атомов. Это правило применительно к химическим связям можно сформулировать так:
атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрести электронную конфигурацию, подобную завершенной электронной конфигурации атомов благородных элементов.
Два атома водорода, объединившись в молекулу, приобрели “завершенную” молекулярную оболочку, подобную завершенной электронной оболочке атома благородного газа гелия (1s 2 ). Атомы хлора в молекуле приобрели молекулярную оболочку, похожую на завершенную оболочку атома аргона (. 3s 2 3p 6 ).
Познакомимся теперь с ионной связью. Как ни удивительно, она ничем принципиально не отличается от ковалентной связи. Движущей силой ее образования является все то же стремление атомов к октетной оболочке. Но в ряде случаев такая “октетная” оболочка может возникнуть только при передаче электронов от одного атома к другому. Поэтому ионная связь, в отличие от ковалентной, возникает только между атомами разного вида.
Рассмотрим конкретный пример: реакцию между атомами натрия (Z = 11) и фтора (Z = 9). При образовании связи между ними оба элемента приобретают внешнюю электронную оболочку благородного газа неона (Z = 10). Для того, чтобы убедиться в этом, надо записать электронные формулы всех трех элементов:
Na: 1s 2 2s 2 2p 6 3s 1
F: 1s 2 2s 2 2p 5
Ne: 1s 2 2s 2 2p 6
В электронных формулах нам важны только электронные конфигурации внешних уровней (они подчеркнуты). Запишем реакцию с помощью формул Льюиса:
Натрий, отдав фтору свой 3s 1 -электрон, становится ионом Na + и остается с заполненной 2s 2 2p 6 оболочкой, что отвечает электронной конфигурации атома неона. Точно такую же электронную конфигурацию приобретает атом F, приняв один электрон, отданный натрием. Теперь это ион F – . Разумеется, при этом ионы F – и Na + продолжают оставаться все теми же элементами фтором и натрием, потому что никакие электронные переходы не могут изменить природу элемента – число протонов в его ядре.
Теперь в дополнение к ковалентной составляющей химической связи в молекуле Na + : F – добавляется еще и электростатическое притяжение между ионами натрия и фтора. Это увеличивает прочность химической связи. Однако ковалентная составляющая (стремление к октету) продолжает играть большую роль и в ионных соединениях.
Полярная ковалентная связь занимает промежуточное положение между чисто ковалентной связью и ионной связью. Так же, как и ионная, она может возникнуть между двумя атомами разных видов. В полярной ковалентной связи электроны смещаются от атома к атому не так сильно, как в ионной. Это происходит тогда, когда атомам энергетически невыгодно далеко “отпускать” свои собственные электроны, отданные в общую “копилку” – молекулярную орбиталь. Если электроны слишком далеко сдвинутся к одному из атомов, молекулярная орбиталь перестанет быть похожей на “октетную”. В то же время у разных атомов разные донорные и акцепторные свойства, поэтому связывающая электронная пара не располагается точно посередине между ядрами, как в ковалентной связи.
В качестве примера рассмотрим образование воды в реакции между атомами водорода (Z = 1) и кислорода (Z = 8). Для этого удобно сначала записать электронные формулы для внешних оболочек водорода (1s 1 ) и кислорода (. 2s 2 2p 4 ). Затем на помощь приходят формулы Льюиса, которые наглядно показывают, как образуются “завершенные” электронные оболочки рядом с атомами водорода и кислорода в молекуле воды:
Оказывается, для этого необходимо взять именно два атома водорода на один атом кислорода. Однако природа такова, что акцепторные свойства атома кислорода выше, чем у атома водорода (о причинах этого чуть позже). Поэтому связывающие электронные пары в формуле Льюиса для воды слегка смещены к ядру атома кислорода. Связь в молекуле воды – полярная ковалентная, а на атомах появляются частичные положительные и отрицательные заряды.
О том, как предсказать акцепторные свойства атомов и где проходит “граница” между полярной ковалентной и ионной связями мы поговорим в параграфе 3.4.
По теории Льюиса и правилу октета связь между атомами может осуществляться не обязательно одной, но и двумя и даже тремя поделенными парами, если этого требует правило октета. Такие связи называются двойными и тройными . Например, только что рассмотренный нами кислород может образовывать двухатомную молекулу с октетом электронов у каждого атома только тогда, когда между атомами помещаются две поделенные пары:
** В специальной главе, посвященной элементу кислороду, мы еще раз вернемся к вопросу о том, как правильно изображать связь в его молекуле. А пока (в первом приближении) можно остановиться на приведенной выше формуле с двойной связью.
Атомы азота (. 2s 2 2p 3 на последней оболочке) также связываются в двухатомную молекулу, но для организации октета электронов им требуется расположить между собой уже три поделенные пары:
В настоящее время принято изображать электронные пары (то есть химические связи) между атомами черточками . Каждая черточка – это поделенная пара электронов. В этом случае уже знакомые нам молекулы выглядят так:
Формулы с черточками между атомами называются структурными формулами . Чаще в структурных формулах не изображают неподеленные пары электронов, но в ряде случаев (мы столкнемся с ними при обсуждении донорно-акцепторных связей) неподеленные пары играют важную роль.
Структурные формулы очень хороши для изображения молекул: они четко показывают – как атомы связаны между собой, в каком порядке, какими связями.
Связывающая пара электронов в формулах Льюиса – то же самое, что одна черточка в структурных формулах.
Двойные и тройные связи имеют общее название – кратные связи. О молекуле азота говорят, что она имеет порядок связи , равный трем. В молекуле кислорода порядок связи равен двум. Порядок связи в молекулах водорода и хлора – один. У водорода и хлора уже не кратная, а простая связь.
Порядок связи – это число обобществленных поделенных пар между двумя связанными атомами. Порядок связи выше трех не встречается.
Таблица 3-1. Длины и прочности связей между атомами азота в различных соединениях.
Связь
Длина связи в ангстремах 1А = 10 –8 см
Прочность связи в кДж на одинаковое число молекул
** Рассмотрим данные по длинам и прочностям связей между атомами азота в различных его соединениях. В таблице 3-1 длины связей приведены в специальных единицах – ангстремах (1А = 10 –8 см). Относительную прочность связей можно оценить по энергии, которая необходима для разрыва связей между атомами азота в разных соединениях. Эта энергия дается для одинакового числа молекул таких соединений. Чем выше кратность связи, тем она короче и прочнее.
Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь.
3.1. Исходя из строения атомов 6 C, 1 H и правила октета, составьте формулу Льюиса для соединения этих двух элементов, в составе которого 1 атом углерода. Нарисуйте для него структурную формулу.
3.2. Напишите (с указанием величины и знака заряда) символы ионов натрия, кислорода, фтора, магния, алюминия, электронные оболочки которых такие же, как у благородного газа неона.
3.3. Напишите электронные формулы внешних электронных уровней атомов 13 Al и 17 Cl. Один атом алюминия и три атома хлора дают соединение, в котором атомы этих элементов приобретают завершенные оболочки инертных газов. Какие это инертные газы? Напишите формулу Льюиса соединения между алюминием и хлором. Нарисуйте для него структурную формулу.
3.4.Составьте формулу Льюиса для соединения, включающего один атом 20 Ca и два атома 9 F. Сколько связывающих (поделенных) и несвязывающих (неподеленных) электронных пар в этом соединении? Какова его структурная формула?
3.5. Исходя из электронного строения атомов и правила октета, составьте формулы Льюиса для соединений, состоящих: а) из двух атомов 6 C и четырех атомов 1 H; б) из двух атомов 6 C и двух атомов 1 H. Каковы кратности связей между атомами углерода в этих двух соединениях? Нарисуйте их структурные формулы (первое из них называется этилен, второе – ацетилен).
3.6. По структурным формулам составьте формулы Льюиса с указанием всех неподеленных электронных пар:
В 1916г Льюис высказал предположение, что химическая связь возникает путем образования электронной пары, одновременно принадлежащей двум атомам; эта идея послужила исходным пунктом для разработки современной теории ковалентной связи. В том же году Коссель предположил, что при взаимодействии двух атомов один из них отдает, а другой принимает электроны; при этом первый атом превращается в положительно, а второй – в отрицательно заряженный ион; взаимное электростатическое притяжение образовавшихся ионов приводит к образованию устойчивого соединения. Дальнейшее развитие идей Косселя привело к созданию современных представлений о ионной связи.
В зависимости от типов атомов образующих химическую связь, выделяют несколько основных типов хим. связи:
1)ковалентная 2)ионная 3)металлическая и.д.р
Ковалентная связь- хим. связь между двумя атомами, осуществляемая за счет образования общих электронных пар.
Длина связи – это расстояние между центрами ядер связанных атомов.
Энергия связи – определяется количеством энергии, которое необходимо для разрыва связи или количеством энергии, которое выделяется при образовании связи. Различают 2 механизма образования ковалентной связи: обменный и донорно-акцепторный.
а) ковалентная неполярная- хим связь, которая образуется за счет образования общих электронных пар между неметалами с одинаковым значением электроотрицательности.
б)ковалентная полярная- хим связь, которая образуется за счет образования общих электронных пар между неметалами с разностью значения электроотрицательности от 0-1,7 Свойства ковалентной связи Направленность связи – это свойство обуславливает геометрию молекулы.
Насыщенность связи – под этим свойством понимают образование атомов определенного числа ковалентных связей. Атом способен образовывать ограниченное число ковалентных связей, т.к ограничены его валентные возможности.Поляризуемость связи – это способность связи становиться полярной или еще более полярной. Этот процесс происходит под воздействием внешнего электрического поля и под влиянием другой молекулы( партнер по р-ции).
Для кванто-механического описания ковалентности связи и строения молекул могут быть применены 2 подхода : 1)метод валентных связей 2) метод молекулярных орбиталей. В основе метода валентных связей лежит следующие положения: 1)ковалентная хим.связь образуется двумя электронами, обладающими противоположно-направленными спинами и принадлежащими двум атомам, между которыми осуществляется связь. Такая общая электронная пара может образоваться как в результате спаривания двух не спаренных электронов, принадлежащих разным атомам (обычный механизм образования связи ), так и за счёт пары эл. одного атома- донора и вакантной орбитали второго атома-акцептора (донорно-акцепторный механизм образования связи); 2)ковалентная связь тем прочнее чем в большей степени перекрываются взаимодействующие эл. облака, поэтому ковалентная связь образуется в том направлении, где облака перекрываются максимально.
Исходные положения метода МО: 1)вся молекула рассматривается как единое целое, состоящее из ядер (бывших атомов) и электронов (ранее принадлежавших атому); 2)все эл. являются общими для всех ядер, то есть хим.связи являются многоцентровыми и каждая связь простирается между всеми ядрами в той или иной степени. Таким образом с точки зрения метода МО двух центровая связь представляет собой частный случай многоцентровой хим.связи. 3) Состояние эл. в молекуле описывается с решением соответствуешего уровнения Шреденгера для молекулярной системы.
Ионная связь-химическая связь, возникающая между ионами в результате действия сил электростатического притяжения. Для оценки способности атома данного элем. оттягивать к себе общую эл. плотность пользуются величиной относительной электроотрицательности. Чем больше эл.отрицательность атома тем сильнее притягивает он общую эл. пару. Чем больше металлические свойства тем меньше эл.отрицательность. Чем больше неметаллические свойства тем выше эл.отрицательность. С ростом разности эл.отрицательности степень ионности связи возрастает.. Свойства ионной связи 1)Ионная связь ненаправленная так как эл.поле иона во всех направлениях; 2)Ионная связь ненасыщенная - вещества с ионной кристаллической решеткой – твёрдые.
Формулы Льюиса: H-Cl электроот. Н=2.1, Сl= 3, ∆Е= 3-2.1=0.9 => связь ковалентная полярная. ∆Е > 2.1 (или 1.7) – ионный характер связи, 2.1(или 1.7)>∆Е>0 – коавлентная полярная связь, ∆Е = 0 - ковалентная неполярная связь.
2)Явление Катализа.Гетерогенный катализ.
Катализатором называют в-во, которое изменяет скорость химической реакции, активно участвуя в ней, но не расходуется в результате реакции. Р-ции, которые протекают с участием катализатора называют каталитическими. Явление изменения скорости химической реакции под действием катализатора называется катализом. Одни катализаторы сильно ускоряют скорость химич. р-ции – положительный катализ, другие - замедляют - отрицательный катализ. Отрицательный катализ часто называют ингибированием, а отрицательный катализаторы, снижающие скорость рции- игнибиторами. Катализ может быть гомогенным (однородный) и гетерогенным (неоднородный). При гетерогенном катализе реагирующие в-ва и катализатор находятся в разном агрегатном состоянии: катализатор обычно твердый, а реагирующие в-ва – жидкие или газообразные. В этом случае между катализатором и реагирующими в-вами существует поверхность раздела ( примером может служить синтез аммиака: водород и азот-газы, а катализатор железо- твердое в-во).
При гетерогенном катализе механизм действия катализатора обьясняется адсорбционной теорией. Согласно этой теории поверхность катализатора неоднородная : на ней имеются так называемые активные центры, на которых главным образом и протекают каталитические реакции. Реагиоующие в-ва адсорбируются на этих центрах , в результате чего увеличивается их концентрация на поверхности катализатора. А это, отчасти приводит к ускорению реакции. Но главной причиной возрастания скорости реакции является сильное повышение химической активности адсорбционных молекул за счет ослабления в них под действием катализатора химических связей между атомами, их разрыва и образования неустойчивых промежуточных комплексов, что и ускоряет образование продукта реакции.
Некоторые в-ва снижают или полностью уничтожают активность твердого катализатора. Такие в-ва называют химическими ядами( соединения мышьяка, ртути). Но есть и такие в-ва, которые усиливают действие катализатора. Такие в-ва называют промоторами.
3)Гидролиз и сольволиз. Гидролиз солей.
Гидролиз – взаимодействие ионов соли и воды с образованием малодиссоциирующих соединений. Гидролиз всегда идет по слабому иону. Сильный ион обуславливает реакцию среды. Количественно гидролиз характеризуется степенью гидролиза.Степень гидролиза- это отношение числа молекул, подвергшихся гидролизу 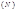
к общему числу молекул в растворе 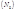
:
Сольватация- связывание молекул растворителя молекулами или ионами растворённого вещества или набухшего твёрдого тела. В случае связывания молекул воды С. называется гидратацией. В результате С. образуются сольваты (гидраты) — соединения определённого или чаще неопределенного состава. Молекулы растворителя связаны с молекулами (ионами) сольватированного вещества силами различной природы и интенсивности — от слабых сил межмолекулярного взаимодействия до сил химической связи. В растворах сольватно связанные молекулы растворителя создают вокруг молекул (ионов) растворённого вещества сольватную оболочку. Обычно различают первичную С. — взаимодействие молекул (ионов) вещества с ближайшими молекулами растворителя, и вторичную С. — взаимодействие первично сольватированных молекул (ионов) с более удалёнными молекулами растворителя. При полной С. все молекулы растворителя входят в состав оболочек, т. е. в сферу действия силового поля молекул (ионов) растворённого вещества. С. влияет на термодинамические и др. свойства раствора; ею обусловлены электролитическая диссоциация электролитов в полярных растворителях, растворимость неэлектролитов, многие жидкофазные химические реакции. С. молекул (ионов) поверхностного слоя — важнейший фактор стабилизации высокодисперсных систем с жидкой дисперсионной средой (золей, латексов, эмульсий). С. может происходить не только в жидком растворителе, но и при сорбции веществом паров растворителя из газовой среды.
Соли, образованные сильным основанием и слабой кислотой при растворении в воде показывают щелочную реакцию среды (рН >7).Соли, образованные сильной кислотой и слабым основанием при растворении в воде показывают кислую реакцию среды (рН
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Теоретические представления в органической химии
Ковалентной связью называется химическая связь, осуществляемая за счет одной или нескольких электронных пар, сильно взаимодействующих с ядрами обоих связываемых атомов. Если связаны два одинаковых атома, то пара электронов в одинаковой степени принадлежит обоим атомам (неполярная ковалентная связь).
Атомы разных элементов, обладая неодинаковой электроотрицательностью, образуют полярную ковалентную связь, в которой обобществленная электронная пара смещена в сторону более электроотрицательного атома. Такая связь является промежуточным случаем между неполярной ковалентной связью и ионной связью.
При образовании ковалентной связи происходит слияние атомных орбиталей и образование молекулярных электронных орбиталей, электроны которых принадлежат обоим ядрам связываемых атомов а электронная плотность локализована в межядерном пространстве. В зависимости от характера распределения электронной плотности в молекуле различают s- и p-молекулярные орбитали.
Молекулярная орбиталь (МО), в которой максимум электронной плотности располагается на прямой, соединяющей ядра атомов, называется s-МО. Такие орбитали возникают при слиянии s-s- и s-p-, p-p-орбиталей а также гибридных орбиталей.
Молекулярная орбиталь, возникающая в результате бокового перекрывания p-орбиталей взаимодействующих атомов так, что ее максимальная электронная плотность сосредоточена вне прямой, соединяющей ядра атомов, называется p-МО.
Ковалентные связи, движение общих электронных пар которых описывается s- и p-молекулярными орбиталями, называются соответственно σ - и π -связями. σ -Связи прочнее, чем π -связи, так как электронная пара в них находится ближе к ядрам атомов и сильнее взаимодействует с ними.
Любая химическая связь характеризуется длиной и энергией.
Формулы Льюиса
Льюис предложил представлять атом в виде "остова" и внешних электронов; остов состоит из ядра и внутренних электронов и в ходе химических превращений остается без изменений. В химических реакциях участвуют внешние (валентные) электроны. Стабильной считается комбинация из восьми электронов. Исключение составляет водород – в нем два электрона.
Свойства ковалентной связи
Кратность ковалентной связи характеризуется количеством электронных пар между соединяемыми атомами. С увеличением кратности связи уменьшается ее длина и повышается суммарная прочность.
Насыщаемость
Каждый атом может образовать по обменному механизму такое количество связей, сколько неспаренных электронов он имеет на валентном уровне.
Направленность
Атомные орбитали имеют разную форму и различную ориентацию в пространстве. При образовании ковалентной связи может происходить гибридизация атомных орбиталей.
Гибридизацией называется гипотетический процесс смешения различного типа, но близких по энергии атомных орбиталей атома с образованием того же числа новых (гибридных) орбиталей, одинаковых по форме и энергии.
В органических молекулах наблюдается гибридизация трех видов: sp 3 , sp 2 , sp.
Идея гибридизации атомных орбиталей позволяет наглядно объяснить структуру молекулы путем комбинации атомных орбиталей.
Полярность
Полярная ковалентная связь образуется между атомами разных элементов, отличающихся электроотрицательностью. Электронная плотность оказывается смещенной к более электроотрицательному элементу. Такие молекулы называются диполями. В двухатомных молекулах величина дипольного момента связи является мерой полярности молекул в целом. Для много атомных молекул дипольный момент равен векторной сумме дипольных моментов отдельных связей.
Поляризуемость
Наряду с полярностью, ковалентная связь обладает способностью поляризоваться под влиянием внешних электромагнитных полей, что выражается в изменении ее дипольного момента и может быть причиной электролитической диссоциации. В качестве внешнего поля может выступать поле соседней молекулы или иона. Поляризуемость молекулы зависит от подвижности общей электронной пары и связана с поляризуемостью образующих ее атомов. Чем больше размер частицы и чем большим количеством электронов она обладает, тем выше поляризуемость (mHF = 1,5Д; mHJ = 0,4Д, но при этом в воде HJ диссоциирует легче, чем HF).
Механизмы возникновения ковалентной связи
Известно два механизма: обменный и донорно-акцепторный.
При обменном механизме в образовании связи оба атома поставляют на молекулярную орбиталь один электрон и одну атомную орбиталь.
При донорно-акцепторном механизме один атом поставляет пару электронов на заселенной атомной орбитали другому атому, который поставляет свободную атомную орбиталь.
Близкими по характеру к донорно-акцепторным связям находятся связи в координационных соединениях. Однако они менее прочны, т.к. электроны передаются не полностью. Такие связи называют семиполярными.
В органической химии большое значение играют соединения с семиполярной связью, где в качестве доноров электронов выступают заполненные p-орбитали.
Изображение точечных структур Льюиса (также известных как структуры Льюиса или диаграммы Льюиса) может показаться сложной задачей, особенно для тех, кто только начинает изучать химию. Тем не менее, эти структуры помогают понять конфигурацию связей и валентных электронов в различных атомах и молекулах. Сложность схемы зависит от того, изображаете ли вы точечную структуру Льюиса для двухатомной ковалентной молекулы, более сложной ковалентной молекулы или молекул с ионной связью.
Запишите символ каждого элемента. Напишите рядом символы двух атомов. Таким образом вы представите атомы, соединенные ковалентной связью. Оставьте достаточно места между символами, чтобы обозначить электроны и связи.
- При ковалентной связи электроны делятся между двумя атомами. Обычно ковалентные связи возникают между двумя неметаллическими элементами.
- Например, O 2 (газообразный кислород) имеет 6 валентных электронов. Умножим 6 на 2 и получим 12.
- Чтобы определить, соблюдено ли правило октета, используйте точки для представления валентных электронов вокруг каждого атома. В случае O 2 один атом кислорода имеет 8 электронов (таким образом, правило октета соблюдено), а второй только 6 (то есть правило октета не выполняется). Это означает, что между двумя атомами кислорода требуется более одной связи. Следовательно, для двойной связи между атомами необходимо два электрона, чтобы правило октета выполнялось для обоих атомов.
Нарисуйте связи. Каждая связь изображается линией между двумя атомами. Для одинарной связи нужно просто соединить линией два атома. В случае двойной или тройной связи необходимо провести соответственно две или три линии.
- Например, в N 2 (газообразном азоте) два атома связаны тройной связью. Таким образом, на диаграмме Льюиса эта молекула будет изображена как 3 параллельные линии, соединяющие 2 атома N.
Обозначьте несвязанные электроны. Некоторые электроны одного или обоих атомов могут остаться несвязанными. В этом случае их следует обозначить точками вокруг соответствующих атомов. Как правило, атомы не имеют более 8 свободных электронов. Проверьте результат: посчитайте каждую точку как 1 электрон и каждую линию как 2 электрона.
- Например, в O 2 (газообразном кислороде) атомы соединены двумя параллельными линиями, и возле каждого атома стоят две пары точек, которые обозначают свободные электроны.
Изобразите электронную структуру центрального атома. Для каждой несвязанной пары электронов поставьте по 2 маленькие точки вокруг центрального атома. Каждую связь изобразите линией, отходящей от атома. Двойные и тройные связи отобразите соответственно двумя или тремя линиями. Таким образом вы покажете, как другие атомы соединены с центральным.
Добавьте остальные атомы. Каждый атом будет соединяться с центральным. Запишите символы каждого атома на концах линий, которые вы провели от центрального атома. Тем самым вы укажете на то, что электроны распределяются между центральным атомом и этими атомами.
Отметьте оставшиеся электроны. Учтите каждую связь как два электрона, а двойную или тройную связь как четыре или шесть электронов соответственно. Затем добавьте электронные пары вокруг каждого атома, так чтобы выполнялось правило октета. Проверьте, все ли правильно: каждая точка соответствует одному электрону, а линия - двум электронам. В сумме должно выйти 8.
- Конечно, исключение составляют те атомы, которые превышают правило октета, а также атом водорода, у которого может быть лишь 0 или 2 валентных электрона.
- При образовании молекулы водорода два атома водорода соединяются ковалентной связью, поэтому у молекулы нет свободных электронов.
Выше мы обсудили применение формул Льюиса для изображения ковалентных связей в некоторых простых молекулах - Написание формул Льюиса для более сложных молекул может поначалу представлять известные трудности. В табл. 1-4 изображено несколько органических веществ. В каждом случае отдельно показаны несвязанные атомы, затем молекулы, в которых атомы имеют октет электронов и, в заключение, так называемые формулы Кекуле.
В формулах Льюиса внутри каждого кружка находится восемь или два электрона, что показывает наличие у обведенного в кружок атома завершенной внешней электронной оболочки.
Написание формул Льюиса требует некоторой практики и представляет собой отчасти творческое занятие, так что метод проб и ошибок в этом деле поначалу вполне допустим. Тем не менее полезно процесс
Таблица 14. (см. скан) Формулы Льюиса и Кекуле некоторых органических соедииеиий
изображения формулы Льюиса разбить для простоты на ряд последовательных этапов. Ниже, в Блоке программированного обучения, приводятся эти шесть этапов, которые следует запомнить. Затем постарайтесь выполнить упражнения, не заглядывая в ответы. Вы должны суметь изобразить формулы Льюиса небольших органических молекул и многоатомных анионов.
Расчленение процесса на этапы, приводимые в этом разделе, позволит Вам научиться достаточно легко изображать формулы Льюиса. При этом требуется, особенно на заключительных стадиях, немного интуиции, которая вырабатывается в результате практики.
1. Напишите символы элементов, входящих в состав вещества. Обычно их следует размещать симметрично. Атом углерода целесообразно поместить в центр рисунка, а атомы, способные образовать лишь одну связь, такие, как водород и галогены, следует разместить по краям. Например, изображая формулу диоксида серы, следует записать:
2. Разместите вокруг символов элементов соответствующее число валентных электронов. Это число равно номеру группы периодической таблицы, в которой находится элемент.
Электроны одних атомов обозначайте точками, других - крестиками. Хотя, конечно, все электроны одинаковы, использование разных символов упрощает написание формулы и делает ее более наглядной. Размещайте электроны по одному с четырех сторон от атома - сверху, снизу и с боков. Только, если электронов больше четырех, размещайте их парами. Например, атом серы имеет шесть валентных электронов - две пары и еще два электрона:
3. Образуйте простые ковалентные связи между соседними атомами, использовав по одному электрону от каждого атома:
4. Посмотрите на образовавшуюся структуру. Проверьте наличие у каждого атома завершенной электронной оболочки. Если все атомы удовлетворяют правилу октета, значит, формула Льюиса готова. Если нет, действуйте, как указано в пунктах 5 и 6.
5. Образуйте двойные или тройные связи между уже связанными атомами и переместите один или несколько электронов от атома к атому так, чтобы правило октета оказалось выполненным.
Двойные и тройные связи имеют общее название - кратные связи. О молекуле азота говорят, что она имеет порядок связи , равный трем. В молекуле кислорода порядок связи равен двум. Порядок связи в молекулах водорода и хлора - один. У водорода и хлора уже не кратная, а простая связь.
Порядок связи - это число обобществленных поделенных пар между двумя связанными атомами. Порядок связи выше трех не встречается.
Таблица 3-1. Длины и прочности связей между атомами азота в различных соединениях.
** Рассмотрим данные по длинам и прочностям связей между атомами азота в различных его соединениях. В таблице 3-1 длины связей приведены в специальных единицах - ангстремах (1А = 10 -8 см). Относительную прочность связей можно оценить по энергии, которая необходима для разрыва связей между атомами азота в разных соединениях. Эта энергия дается для одинакового числа молекул таких соединений. Чем выше кратность связи, тем она короче и прочнее.
Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь.
3.1. Исходя из строения атомов 6 C, 1 H и правила октета, составьте формулу Льюиса для соединения этих двух элементов, в составе которого 1 атом углерода. Нарисуйте для него структурную формулу.
3.2. Напишите (с указанием величины и знака заряда) символы ионов натрия, кислорода, фтора, магния, алюминия, электронные оболочки которых такие же, как у благородного газа неона.
3.3. Напишите электронные формулы внешних электронных уровней атомов 13 Al и 17 Cl. Один атом алюминия и три атома хлора дают соединение, в котором атомы этих элементов приобретают завершенные оболочки инертных газов. Какие это инертные газы? Напишите формулу Льюиса соединения между алюминием и хлором. Нарисуйте для него структурную формулу.
3.4.Составьте формулу Льюиса для соединения, включающего один атом 20 Ca и два атома 9 F. Сколько связывающих (поделенных) и несвязывающих (неподеленных) электронных пар в этом соединении? Какова его структурная формула?
3.5. Исхода из электронного строения атомов и правила октета, составьте формулы Льюиса для соединений, состоящих: а) из двух атомов 6 C и четырех атомов 1 H; б) из двух атомов 6 C и двух атомов 1 H. Каковы кратности связей между атомами углерода в этих двух соедиениях? Нарисуйте их структурные формулы (первое из них называется этилен, второе - ацетилен).
3.6. По структурным формулам составьте формулы Льюиса с указанием всех неподеленных электронных пар.
Теория строения органических соединений A. M. Бутлерова, сформулированная ученым в 1861г., включает в себя следующие положения: 1 Атомы расположены в молекулах не хаотично, а соединены друг с другом в определенной последовательности, в соответствии с их валентностью. 2. Химические свойства веществ зависят не только от качественного или количественного состава, но и от химического строения молекул. 3. Атомы или группы атомов в молекулах взаимно влияют друг на друга, непосредственно или посредством других атомов.
Формулы органических веществ по классам
Алканы - C n H 2n+2
Циклоалканы - C n H 2n
Алкены - C n H 2n
Алкадиены - C n H 2n-2
Алкины - C n H 2n-2
Предельные одноатомные спирты - R-OH
Простые эфиры - R – O – R’
карбоновые кислоты - R -COOH
амины . Функциональная группа R -NH 2
альдегиды (общая формула (R-COH).
Электронно-точечная формула и формула Льюиса наглядно описывают строение ковалентной связи, но громоздки и занимают много места.
формула Льюиса для воды.
Согласно электронной теории строения вещества, атом любого элемента состоит из электроположительного атомного ядра (состоящего из протонов и нейтронов), в котором сосредоточена вся масса атома, и из электронной оболочки электроотрицательных электронов, которые по сравнению с ядром атома почти не имеют массы.
Ввиду того, что атом в целом является электрически нейтральным, то заряд ядра атома будет равен заряду электронной оболочки, т. е. число электронов будет равно числу протонов.
Электроны обладают отрицательным, а протоны - положительным электрическим зарядом.
Атомные орбитали (АО) характеризуются тремя квантовыми числами: главным n, орбитальным l=0,1,2… и магнитным m=0,+-1,+-2. значениям l = 0, 1, 2, 3, 4. отвечают буквы s, p, d, f,
Молекулярные орбитали (МО) описывают электрон в поле всех ядер молекулы и усредненном поле остальныхэлектронов.
Существуют два главных способа образования ковалентной связи .
1) Электронная пара, образующая связь, может образоваться за счет неспаренных электронов , имеющихся в невозбужденных атомах .
2) Ковалентные связи могут образовываться за счет спаренных электронов, имеющихся на внешнем электронном слое атома. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Атом, предоставляющий свою электронную пару для образования ковалентной связи *, называется донором, а атом, предоставляющий пустуюорбиталь, – акцептором. Ковалентная связь, образованная таким способом, называется донорно-акцепторной связью.
4. Взаимное влияние атомов в молекулах органических соединений. Эффекты электронных смещений. Индуктивный и мезомерный эффекты. Эффект гиперконьюгации. Стерический эффект.
Электронными эффектами называют смещение электронной плотности в молекуле под влиянием заместителей. 
Положительный индуктивный эффект (+I), т.е. эффект смещения электронной плотности от себя, проявляют алкильные радикалы (метил, этил, пропил и т.д.).
Большинство функциональных гpупп (галогены, аминогруппа, нитрогруппа, карбоксильная, карбонильная, гидроксильная гpуппы) проявляет отрицательный индуктивный эффект (–I), т.е. смещают электронную плотность к себе.
Положительный мезомерный эффект (+M), т.е. эффект смещения электронной плотности от себя, проявляют аминогруппа, гидроксильная гpуппа. Нитрогруппа, карбоксильная, карбонильная гpуппы проявляют отрицательный мезомерный эффект (–M), т.е. притягивают электронную плотность к себе.
Эффект, подобный положительному мезомерному, возникает при замещении водорода у кратной связи алкильной группой. Этот эффект направлен в сторону кратной связи и называется гиперконъюгацией (сверхсопряжением). Для проявления эффекта гиперконъюгации необходимо наличие хотя бы одного атома водорода при атоме углерода, соседствующем с пи- системой.
Величина эффекта гиперконъюгации тем выше, чем больше атомов водорода при углероде, связанном с ненасыщенной системой.
Стерический эффект - влияние пространственного объёма молекулы на ход химической реакции. Так, присутствие в молекуле больших групп вблизи от реагирующих атомов может препятствовать сближению этих атомов и замедлить реакцию или сделать её невозможной. Простой пример: химическая формула одинаковая, а взаимное расположение молекул - различно (когда различные конфигурации не достигаются обычным поворотом: например зеркальное отображение). И всё это влияет на свойства вещества, скорость хим. реакции и т.п.
5. Классификация орг.реакций по направлению, механизму, молекулярности. Нуклеофильные и электрофильные реакции и реагенты. Понятие о промежуточных частицах – радикалах, карбкатионах, карбанионах, ион-радикалах. Их строение. Реакции одновалентного переноса.
В основу ковалентной связи положен принцип совместного использования электронов , как стремление заполнения валентных уровней энергии.
Обычно в природе водород встречается не в виде отдельного атома, а представляет собой двухатомную молекулу - Н 2 .
Водород имеет один валентный электрон и ему нужен еще один, чтобы заполнить первый энергетический уровень (электронная формула атома водорода = 1s 1 ; см. Электронная структура атомов). Атом водорода может "позаимствовать" недостающий электрон у другого атома водорода. Но, в таком случае, атом водорода, отдавший свой единственный электрон, станет еще более нестабильным. Поэтому, такой вариант неосуществим.
Единственно возможным вариантом соединения H 2 может быть только совместное использование электронов. Два электрона как бы "принадлежат" обоим атомам водорода. Образование химической связи между атомами водорода есть результат перекрытия электронных орбиталей, которое происходит при сближении атомов. Такой вид связи называется ковалентной связью .
Электронно-точечная формула: H· + ·H → H:H
Структурная формула Льюиса: H· + ·H → H—H
У каждого атома водорода в молекуле формируется конфигурация атома гелия (см. Электронная теория валентности).

Образование прочной химической связи в молекуле водорода осуществляется за счет перекрывания s-орбиталей атомов, благодаря чему между ядрами атомов водорода создается повышенная электронная плотность, из-за чего электроны молекулы водорода испытывают притяжение одновременно двух ядер.
Согласно теории Электронной структуры атомов, атомы химических элементов в молекулах стремятся получить стабильную электронную конфигурацию ближайшего инертного газа. Например, при слиянии атомов фтора в молекулу образуется конфигурация неона:

Кроме водорода в природе существует еще 6 элементов (простых веществ), имеющих двухатомную молекулу: O 2 , N 2 , F 2 , Cl 2 , Br 2 , I 2 .
Ионная связь (ИС) образуется между металлом и неметаллом.
Ковалентная связь (КС) образуется между двумя неметаллами.
У этих связей различные свойства:
- при комнатной температуре соединения с ИС обычно твердые вещества; соединения с КС могут находиться в твердом, жидком и газообразном состоянии;
- точка плавления для ионных соединений обычно намного выше, чем для ковалентных;
- ИС - электролиты (проводят электрический ток); КС - неэлектролиты.
Следует сказать, что ковалентные связи могут возникать также между разными атомами. Например, в молекуле фтороводорода (HF) единственный атом водорода, расположенный на s-орбитали, перекрывается с непарным атомом фтора, который находится на p-орбитали, таким образом, в молекуле HF атом водорода получает электронную конфигурацию He, а атом фтора - конфигурацию Ne.

Поскольку у взаимодействующих атомов водорода и фтора различный электроотрицательный заряд, образовавшаяся общая электронная пара смещается к более электроотрицательному атому фтора, с образованием ковалентной полярной связи (в молекулах простых веществ ковалентная связь неполярная).
Выше было рассмотрено образование ковалентной связи за счет общей электронной пары двух атомов. Существует еще один механизм образования ковалентной связи, который называется координационным или донорно-акцепторным .
При донорно-акцепторном механизме образования ковалентной связи химическая связь образуется за счет электронной пары (неподеленной пары электронов), которую поставляет один из атомов (донор), при этом другой атом (акцептор) предоставляет для этой электронной пары свою свободную орбиталь.
Выше были рассмотрены ковалентные связи, использующие один электрон - одиночные связи. Существуют молекулы, в которых есть несколько общих электронных пар, образующих множественную связь.
Кислород (O 2) находится в группе VIA и имеет 6 валентных электронов. Для завершения внешнего энергетического уровня ему надо принять 2 электрона. Атом кислорода совместно использует два своих электрона с двумя электронами другого атома кислорода, создавая двойную связь.
Азот (N 2) находится в группе VA и имеет 5 валентных электронов. Для завершения внешнего энергетического уровня ему надо принять 3 электрона. Атом азота совместно использует три своих электрона с тремя электронами другого атома азота, создавая тройную связь.

Такая тройная связь намного крепче, чем одинарная - поэтому у азота очень прочная молекула, отсюда низкая активность азота в химических реакциях.
- ионные связи, образующиеся между металлами и неметаллами;
- ковалентные связи, образующиеся между неметаллами.
Могут ли образоваться связи между металлом и металлом? Увы, металл с металлом может образовать только сплав - раствор одного металла в другом.
Читайте также:
- Инвазивный рак желудка это
- К первично злокачественным опухолям относятся
- Ленорка многодетная мама у которой рак
- Опухоль овальной формы на руке
- Опухоль после растяжения мазь

