Факторы роста при опухоли
Группа опухолевых ангиогенных факторов, приводящих к опухолевому росту и повышению васкуляризации, представлена семейством факторов роста.
р-фактор роста фибробласгов (PFGF, основной фактор роста фибробластов) — гепаринсвязывающий полипетид с низкой молекулярной массой (18 000). Синтезируется многими клетками, в том числе эндотелиальными и меланоцитами. Механизмы его секреции недостаточно ясны. PFGF является митогеном эндотелиальных клеток, причем эффективность стимуляции им пролиферации -ависит : ряда условий. В частности, его ангиогенное действие in vitro реализуется в присутствии фибронектина. Естественный резервуар pFGF — базальная мембрана, повреждение которой приводит к высвобождению этого ангиогенного фактора.
Секреция PFGF может рассматриваться как маркер малигнизации. Так, несмотря на то, что [3FGF может вырабатываться меланоцитами, клетками диспластического невуса и меланомы, к его секреции способны лишь клетки меланомы. В опытах на животных показано, что секрецией |3FGF сопровождается и развитие дерматофибросаркомы.
Один из многих путей локального увеличения концентрации pFGF опухолевыми клетками связан с повышением уровня гепариназы, высвобождающей [3FGF из базальной мембраны. На поверхности клеток имеются 4 типа рецепторов, общихдля FGFh ocFGF.
Альфа-Фактор роста фибробластов (aFGF, кислый фактор роста фибробластов) — гепаринсвязывающий полипептид с низкой молекулярной массой (16 000-18 000). Вызывает пролиферацию эндотельных клеток. Имеет до 53% аминокислотных гомологии с (3FGF. Отличается более выраженной по сравнению с pFGF мито-генной активностью по отношению к керати-ноцитам, ускоряет заживление ран.
Фактор роста эндотелия сосудов (сосудистый эндотелиальный стимулятор ангиогенеза/фактор сосудистой проницаемости — VEGF/VPF) представлен четырьмя тесно связанными между собой пептидами, стимулирующими пролиферацию эндотелиальных клеток. Ранее они рассматривались как отдельные пептиды, это было обусловлено их разной степенью влияния на проницаемость сосудов и развитие онкологического асцита. В опытах на животных установлено, что нейтрализация антител к VEGF/VPF предотвращает развитие онкологического асцита у мыщей. Этот фактор ан-гиогенеза присутствует во многих нормальных и патологических клетках, включая нормальные кератиноциты, и является митогеном только для эндотелиальных клеток. Его уровень повышается в зонах гипоксии (например, при глиобластоме).
Иногда VEGF/VPF выявляют в участках гипоксии, не связанных с опухолевым ростом (диабетическая ретинопатия). Как указывалось выше, определены два рецептора для VEGF/VPF: KDR и fit-1
Тромбоцитарныи фактор роста эндотелиальных клеток (PD-ECGF) в отличие от предыдущих факторов ангиогенеза не имеет родства с гепарином. Первоначально выделен из тромбоцитов. Синтезируется многими клетками, но редко секретируется. В коже содержится в фибробластах. Стимулирует пролиферацию эндотелиальных клеток.
Ангиогенен — пептид, гомологичный ферменту рибонуклеазе. Обладает небольшой рибонуклеазной активностью, что, по-видимому, необходимо в процессе ангиогенеза. Точная роль в ангиогезе не установлена. Широко представлен в тканях организма; с возрастом его содержание в тканях увеличивается.
Онкостатин М — полипептид с молекулярной массой 28 000—36 000. Первоначально был выделен из культуры клеток лимфомы. Было замечено, что онкостатин М угнетает рост культуры клеток меланомы и является сильным митогеном для клеток саркомы Калоши у больных СПИДом. Показано, что рекомбинантный онкостатин М продлевает жизнь клеток саркомы Капоши, способных вырабатывать эндогенный онкостатин М, и является частью рецепторов для интерлейкина-6 и фактора подавления лейкоза.
Гепаринсвязанный EGF-подобиый фактор роста (HB-EGF) выделен из моноцитов и макрофагов. В опытах на свиньях было установлено, что этот фактор обнаруживается в некоторых ранах на 3-4-й день после травмы. В это время в ране содержится большое количество макрофагов, которые являются наиболее вероятным источником HB-EGF. Митогенный эффект HB-EGF наиболее выражен по отношению к фибробластам и в меньшей степени по отношению к эндотелиальным клеткам. Предшественник HB-EGF является рецептором для дифтерийного токсина.
Выделяют 4 группы важнейших факторов риска, способствующих возникновению как доброкачественных, так и злокачественных новообразований.
1. Старение.Увеличение числа опухолей с возрастом связывают с накоплением в клетках мутаций, возрастной депрессией репарации ДНК и физиологическим возрастным иммунодефицитным синдромом.
2. Влияние географических зон и факторов окружающей среды (экологических). Заболеваемость и смертность в различных странах от злокачественных опухолей неодинакова: например, от рака желудка в Японии до внедрения специальных мер профилактики и ранней диагностики, погибало в 7-8 раз больше больных, чем в США. Из факторов окружающей среды следует назвать солнечную радиацию, экологические особенности, определенный образ жизни людей (курение, алкоголизм, особенности питания и ожирение, большое число половых партнеров, особенно при раннем начале половой жизни).
3. Наследственность.От 5 до 10% злокачественных опухолей человека связаны с наследственной предрасположенностью. Наследственные формы злокачественных новообразований разделяют на 3 группы:1) наследственные опухолевые синдромы; 2) семейные формы опухолей; 3) аутосомно-рецессивные синдромы нарушенной репарации ДНК.
Наследственные опухолевые синдромы. К этой группе относят новообразования, при которых наследование единственного мутантного гена значительно повышает риск их развития. Такая предрасположенность относится к аутосомно-доминантному типу наследования. Самый частый пример из этой группы — ретинобластома (злокачественная нейроэпителиома сетчатки глаза), сочетающаяся у детей с полипозом толстой кишки.
Семейные формы опухолей. Многие распространенные типы злокачественных опухолей, которые встречаются спорадически, наблюдаются также и в семейных формах: рак толстой кишки, молочной железы, яичников, опухоли головного мозга. Общими признаками семейной формы опухолей являются возникновение в раннем возрасте, появление минимум у двух ближайших родственников, частое формирование двусторонних или множественных поражений.
Аутосомные рецессивные синдромы нарушенной репарации ДНК. Речь идет о нестабильности структуры ДНК или хромосом. В группу этих синдромов входит пигментная ксеродерма (пигментация, гиперкератоз, отек и другие изменения кожи при солнечном облучении), анемия Фанкони, характеризующаяся гипоплазией костного мозга, низким содержанием клеток крови, многими аномалиями развития.
4. Хронические пролиферативные изменения. Фоном для малигнизации (озлокачествления) может служить хроническое воспаление, которое часто сопровождается очаговой гиперплазией, метаплазией и дисплазией эпителия (данные понятия частично рассматривались в главе, посвященной процессам адаптации, компенсаторно-приспособительным процессами и также будут рассмотрены ниже при изучении морфогенеза опухоли).
Патогенез опухолей (канцерогенез)
В настоящее время канцерогенез рассматривается в виде стадийного многоступенчатого процесса,происходящего на генетическом и фенотипическом уровнях, и сопровождается активацией клеточных онкогенов и/или инактивацией антионкогенов в результате повреждения генома клетки канцерогенными агентами.
Онкогены — гены (активированные или, нередко, дефектные при мутациях) индукторов клеточного деления, пролиферации и ингибиторов апоптоза. Онкогены образуются в результате активизации протоонкогенов. Протоонкогены— нормальные гены клеток; в зрелых тканях они, как правило, неактивны. Превращение протоонкогенов в онкогены происходит при опухолевом росте, в ходе эмбриогенеза, часть из них активируется при пролиферации и дифференцировке клеток в очагах репаративной регенерации.
Активация протоонкогенов происходит по 4 основным механизмам: 1) активация при транслокации участка хромосомы с встроенным в него протоонкогеном; 2) инсерционная активация — активация под действием встроенных в геном особых генов (например, вирусных); 3) активация путем амплификации (умножении копий) протоонкогена; 4) активация при точечных мутациях протоонкогена.
Клеточные онкогены кодируют синтез белков, которые называются онкобелками, илионкопротеинами, которые принимают участие в передаче митогенетических сигналов от клеточной мембраны до ядра к определенным генам клеток. Это значит, что большинство факторов роста в той или иной степени могут взаимодействовать с онкобелками.
Таким образом, выстраивается цепочка механизмов активизации протоонкогенов и патогенеза опухолей: протоонкоген — онкоген — усиленный несбалансированный синтез онкопротеинов — гиперплазия и дисплазия с нарушением дифференцировки и последующей иммортализацией клеток — злокачественная трансформация клеток — инвазивный рост опухоли — метастазирование.
Антионкогены или гены супрессоры опухолевого роста— гены ингибиторов клеточного деления, пролиферации и индукторы апоптоза. Инактивация генов супрессоров опухолевого роста приводит к потере ими их противоопухолевой функции, что выражается в утрате способности тормозить пролиферацию клеток, соответственно укорачиваетсяG1 период клеточного цикла, в котором происходит восстановление поврежденной ДНК, а так же не происходит индукция апоптоза. В результате этих процессов начинается безудержное деление опухолевых клеток, в них возникают дополнительные мутации, что в конечном итоге приводит к развитию злокачественной опухоли. Хотя известны десятки генов супрессоров опухолевого роста, наибольшее диагностическое значение имеют мутации гена белка р53 — ингибитора клеточного деления и ключевого фактора индукции апоптоза. Мутации гена р53 встречаются более чем в половине случаев онкологических заболеваний. Почти столь же распространены в опухолях дефекты другого гена супрессора опухолевого роста — гена белка р16.
Патологическая анатомия изучает экспрессию онкогенов, антионкогенов, онкобелков и т.д. с помощью иммуногистохимического метода и методов молекулярной биологии. Выявление экспрессии многих из них в патологоанатомической практике (например, на материале биопсий) позволяет уточнять диагноз опухоли, прогнозировать ее биологическое поведение, эффективность противоопухолевого лечения.Например, при патологоанатомической диагностике рака молочной железы для определения тактики лечения важно иммуногистохимически диагностировать уровень (выраженность) экспрессии опухолевыми клетками рецепторов к эстрогенам, прогестерону, факторам роста и их пролиферативную активность.
Выделяют три основные стадии канцерогенеза — инициация, промоция и прогрессия.
Инициация— начальная фаза; заключается в том, что под действием канцерогенов происходит мутация одного из генов, регулирующего клеточное размножение, в результате чего клетка становится способной к неограниченному делению, но для проявления этой способности требуются дополнительные условия.
Промоция —стимуляция промоторами клеточного деления, что создает критическую массу инициированных клеток и способствует высвобождению их из-под тканевого контроля. Промоторами могут быть химические вещества, не являющиеся канцерогенами, но при длительном воздействии на инициированные клетки, приводящие к развитию опухоли.
Прогрессия. Рост опухоли — это не только увеличение числа однородных клеток. Опухоль постоянно претерпевает качественные изменения и приобретает новые свойства — все большую автономность от регулирующих воздействий организма, деструктивный рост, инвазивность, способность к образованию метастазов, приспособляемость к меняющимся условиям.
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя.
Курсив НЕ НУЖНО зубрить.
Рассказать о биологическом значении ФРК – это сказать, зачем нужны ФРК, какие функции ФРК выполняют в организме.
Рассказать о медицинском значении ФРК – это сказать, какие нарушения возникают при избыточном или недостаточном влиянии ФРК (значение ФРК для патогенеза),
а также – рассказать о том, как ФРК или блокаторы их рецепторов применяются в медицине в настоящее время для лечения заболеваний или могут применяться в будущем.
Какие железы вырабатывают ФРК?
ФРК вырабатываются МНОГИМИ КЛЕТКАМИ организма.
На какие клетки-мишени действуют ФРК?
Разные ФРК действуют на большинство клеток организма: на сосуды, нервы, эпителий и т.д..
При этом ФРК, секретированные одними клетками, обычно влияют на соседние клетки,
к которым диффундируют в межклеточной среде,
или на ту же клетку, которая их секретировала,
поэтому ФРК считаются местными гормонами,
действующими паракринно и аутокринно – п.99.
Так как ФРК являются белково-пептидными гормонами, то:
1) они синтезируются клетками так же, как и другие белки – из аминокислот на рибосомах шероховатого ЭПР, а затем секретируются – п.99,
2) все они или их белки-предшественники кодируются генами,
поэтому мутации в генах, кодирующих ФРК, могут привести к недостаточной или чрезмерной активности ФРК и развитию заболеваний.
Инсулин и СТГ похожи на ФРК тем, что тоже стимулируют рост клеток и их деление, но к ФРК они не относятся, вырабатываются эндокринными железами, транспортируются с током крови.
101. 1. Определения.
Биологическое значение ФРК и ЦК.
Таковы функции ФРК. Из списка функций ФРК ясно, что ФРК принимают участие:
1) в регуляции деления и дифференцировки клеток во время ЭМБРИОГЕНЕЗА, в процессах формирования тканей и органов (органогенеза), а у взрослых:
2) в регуляции КРОВЕТВОРЕНИЯ,
3) в регуляции ЗАЖИВЛЕНИЯ при травмах,
4) в РЕГЕНЕРАЦИИ эпителиальных тканей (эпидермис, слизистая ЖКТ и т.д.),
Таково биологическое значение ФРК.
ЦИТОКИНАМИ
называют те ФРК, которые влияют на лейкоциты. И, следовательно, цитокины влияют на иммунитет, на опухолевые и аутоиммунные процессы.
101. 2. Виды ФРК, классификация ФРК.
Известны ФРК, которые влияют (по известным на сегодня данным) на один вид клеток – такие ФРК называют специализированными ФРК.
Известны ФРК, которые влияют на разные типы клеток – такие ФРК называют ФРК широкого действия.
Названия многих ФРК даны по типу клеток, на которые ФРК влияют; например – фактор роста эпидермиса влияет на клетки эпидермиса, фактор роста нервов влияет на рост нервов.
Эти названия не означают, что фактор роста эпидермиса влияет только на эпидермис и не влияет на другие.
Примеры ФРК широкого действия:
1) Фактор роста эпидермиса = эпидермальный фактор роста,
2) Фактор роста тромбоцитов = тромбоцитарный фактор роста = ТФР,
Примеры ФРК узкого действия:
1) Сосудисто-эндотелиальный фактор роста (СЭФР),
2) колонийстимулирующий фактор роста = КСФР,
3) Фактор роста нервов = ФРН,
4) Нейротрофины.
Группы цитокинов:
1) Регуляторы воспаления,
2) Регуляторы естественного воспаления,
3) Циркулирующие цитокины,
4) Гематопоэтические факторы,
5) Регуляторы лимфоцитов.
6) Хемокины, хемокиновые рецепторы п.86
101. 3. Механизм действия ФРК – см.п.98.
ФРК и цитокины (как и СТГ с инсулином) связываются с рецепторами, которые активируют ТИРОЗИНКИНАЗУ (п.98).
Рецепторы цитокинов похожи на рецепторы ФРК, но есть отличие: молекула тирозинкиназы является отдельной от рецептора, самостоятельной белковой молекулой.
Рецепторы цитокинов находятся во внешних мембранах клеток, как и у всех гидрофильных гормонов (п.92). Рецепторные участки молекул белка находятся на внешней поверхности мембран, связывают молекулы цитокинов.
При связывании молекулы цитокина со своим рецептором происходит изменение конформации молекулы рецептора,
после чего эта молекула рецептора связывается с отдельной белковой молекулой тирозинкиназы, что приводит к изменению конформации и активности тирозинкиназы.
Активация тирозинкиназ приводит к тому, что они фосфорилируют ряд белков, в том числе:
1) белок Ras,
2) киназу ФИФ2, превращающую ФИФ2 в ФИФ3,
3) фосфолипазу С (п.97),
4) транскрипционные факторы.
Всё это приводит к изменению активности белков, которые регулируют деление и рост клеток, дифференцировку клеток,
В том числе к изменению активности ТРАНСКРИПЦИОННЫХ ФАКТОРОВ – белков, которые регулируют транскрипцию определенных генов.
Чрезмерная или недостаточная активность самих ФРК и белков их СТС может привести к опухолевым процессам. Поэтому ФРК и белки их СТС относятся к онкобелкам – п.98 и 87.
101. 4. Медицинское значение ФРК.
ФРК имеют отношение к развитию ряда болезней и их лечению. –
Чрезмерная или недостаточная активность самих ФРК, а также белков их СТС (как и СТГ и белков его СТС) может привести к заболеваниям.
101. 4. 1. Дефицит ФРК.
(Речь идёт о большинстве ФРК – о тех, которые стимулируют деление клеток,
но не о ФНО и других тормозящих деление клеток ФРК.)
Третье корректируется нормализацией питания: пищи и пищеварения.
Дефицит стимуляторов корректируется устранением дефицита стимуляторов, в том числе поддержанием хорошего настроения (эндорфины).
Лечение, терапия, коррекция болезней, вызванных недостаточной активности ФРК:
Если болезни вызваны дефицитом ФРК, их можно лечить с помощью ФРК, вводимых в организм извне.
ФРК для терапии ими получают с помощью генной инженерии.
Но можно искать способы усилить синтез ФРК в самом организме: например, с помощью определённых физических воздействий.
Пример применения ФРК при лечении болезней, вызванных дефицитом ФРК:
101. 4. 2. Избыток ФРК.
(Речь идёт о большинстве ФРК, но не о ФНО и других тормозящих деление клеток ФРК.)
Лечение, терапия, коррекция болезней, вызванных избыточной активностью ФРК:
Если болезни вызваны избыточным влиянием ФРК, их можно лечить с помощью блокаторов рецепторов ФРК,
то есть веществ, которые связываются с рецепторами ФРК, но не вызывают в клетке тех же изменений, что и ФРК.
Лечение опухолей за счёт блокады рецепторов ФРК, тирозинкинах и других онкобелков относят к способам биологической терапии опухолей, которые более избирательны, чем препараты, применяемые при химиотерапии: они нарушают деление не всех клеток, а преимущественно опухолевых.
Пример применения блокаторов рецепторов ФРК: применяются блокаторы рецепторов СЭФР (сосудистоэндотелиального фактора). Это позволяет замедлить развитие сосудов в растущей опухоли, а без кровоснабжения замедляется и рост самой опухоли.
101. 5. Туморнекротизирующий фактор – ТНФ.
Он же фактор некроза опухолей (ФНО).
Относится к ФРК, но,
в отличие от большинства ФРК,
не стимулирует деление клеток,
а подавляет деление клеток,
и при этом ТНФ способствует апоптозу (гибели клеток).
Таким образом, большинство ФРК – стимуляторы роста клеток, стимулирующие пролиферацию ФРК (СП-ФРК) и ингибиторы апоптоза,
а ТНФ – снижающий, ингибирующий пролиферацию ФРК (ИП-ФРК) и стимулятор апоптоза.
Именно за счёт стимуляции апоптоза, то есть смерти клеток, ТНФ, способствует гибели опухолевых клеток, из-за чего и получил своё название.
В отличие от ИФРК (стимулирующих деление клеток и снижающих апоптоз ФРК),
недостаток ТНФ ведёт не к дегенеративным процессам,
а к чрезмерному делению клеток,
в том числе к опухолевым процессам.
Избыток ТНФ может вести не к опухолям, а к денегеративным процессам.
О терминах: так как некоторые ФРК стимулируют деление клеток, а некоторые снижают деление клеток,
так как есть другие гормоны, которые стимулируют и снижают деление клеток,
то во избежание путаницы было бы удобно ввести термины:
Гормоны, стимулирующие деление клеток – ГСДК
и гормоны, ингибирующие деления клеток – ГИДК.
Или такие термины:
гормоны, стимулирующие пролиферацию – ГСП,
и гормоны, ингибирующие пролиферацию – ГИП.
К ГСП, относится большинство ФРК, (кроме ТНФ), СТГ и инсулин,
а к ГИП, относится ТНФ, ГКС, ретиноат.
101. 6. Ф Р К и другие гормоны, регулирующие пролиферацию.
а) Факторы роста. Для пролиферации всем нормальным клеткам нужна стимуляция факторами роста. Большинство растворимых факторов роста синтезируются одним типом клеток и воздействуют на соседние клетки, что индуцирует их пролиферацию (паракринный механизм).
Многие опухолевые клетки способны синтезировать те факторы роста, к которым они чувствительны (аутокринный механизм). Например, многие глиобластомы секретируют PDGF и одновременно экспрессируют рецептор PDGF. Значительное количество сарком синтезируют TGF-a и его рецептор. Считается, что аутокринные петли являются важнейшим элементом патогенеза ряда опухолей.
Однако в большинстве случаев гены факторов роста не подвергаются изменениям и не мутированы. Наиболее часто продукты онкогенов, участвующих в передаче сигналов во многих сигнальных путях, например RAS, вызывают повышение экспрессии генов, кодирующих факторы роста, в результате клетка секретирует большие количества факторов роста, например TGF-a.
Тем не менее увеличенное количество факторов роста не является достаточным условием для опухолевой трансформации. По всей вероятности, усиление пролиферации под действием факторов роста вносит свой вклад в развитие злокачественного фенотипа путем увеличения риска спонтанных или индуцированных мутаций в пуле пролиферирующих клеток.
б) Рецепторы факторов роста. Обнаружен ряд онкогенов, кодирующих образование рецепторов факторов роста. Для того чтобы понять, каким образом мутации влияют на функционирование этих рецепторов, следует напомнить, что рецепторы одного из важнейших классов являются трансмембранными белками, имеющими цитоплазматический тирозинкиназный домен и наружный лигандсвязывающий домен.
При взаимодействии неизмененных рецепторов со специфическими факторами роста происходит временная активация киназного домена, за которой следуют димеризация рецептора и фосфорилирование тирозина ряда субстратов, входящих в каскад сигналов. Рецепторы онкогенного происхождения находятся в состоянии постоянной димеризации и активации без необходимости связывания с фактором роста.
Таким образом, мутантные рецепторы постоянно посылают сигнал клетке в отсутствие фактора роста в ее окружении.
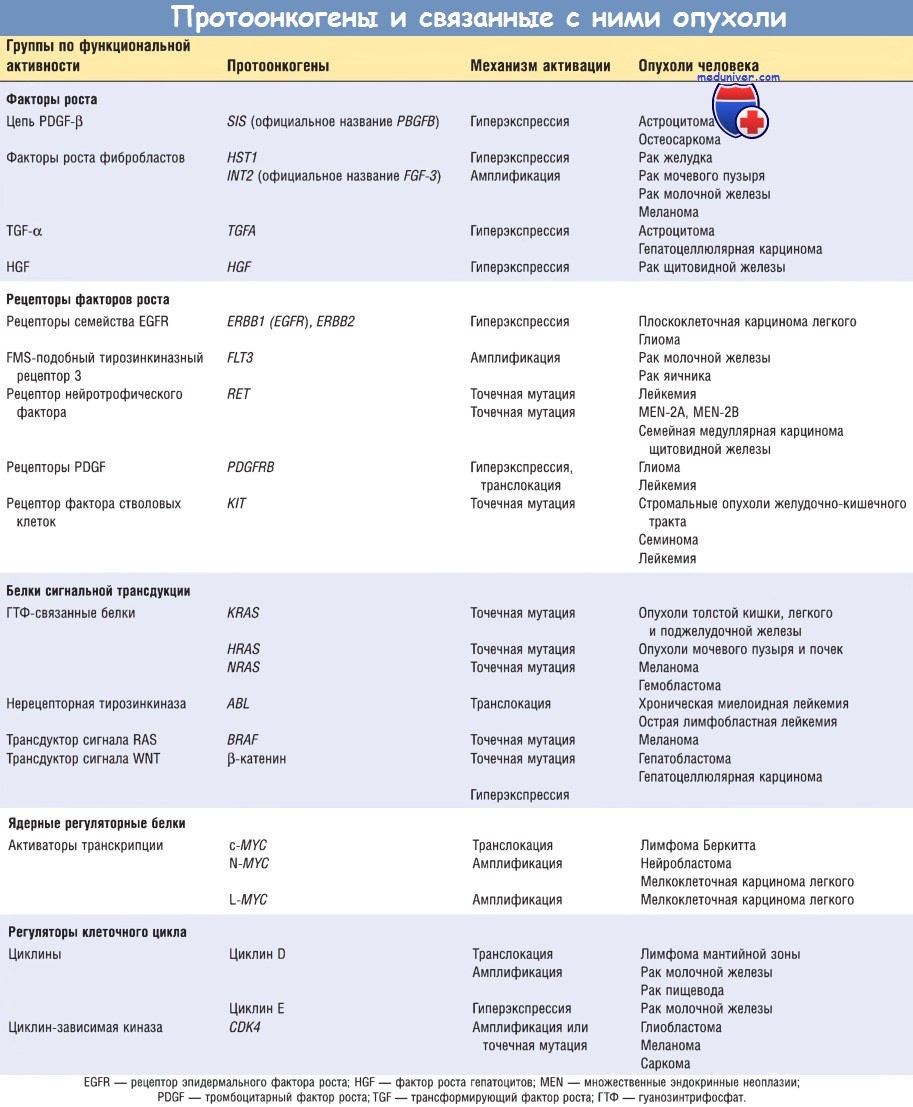
Рецепторы факторов роста в опухоли могут активироваться по нескольким механизмам, включая мутации, перегруппировку генов и повышение экспрессии. Примером онкогенной конверсии в результате мутаций и перегруппировки генов может служить протоонкоген RET, относящийся к рецепторам тирозинкиназного типа.
Белок RET является рецептором нейротрофического фактора, продуцируемого клеточной линией глиальных клеток, и по структуре относится к белкам, поддерживающим жизнеспособность клеток во время развития нервной системы. RET обычно экспрессируется нейроэндокринными клетками — парафолликулярными С-клетками щитовидной железы, мозгового вещества надпочечников и клетками-предшественниками паращитовидной железы.
Точечные мутации протоонкогена RET ассоциируются с доминантными наследственными синдромами MEN-2A и MEN-2B, а также с семейной медуллярной карциномой щитовидной железы. При MEN-2A точечная мутация во внеклеточном домене RET приводит к постоянно совершающимся димеризации и активации рецептора, сопровождающимся развитием медуллярной карциномы щитовидной железы и опухолей надпочечников и паращитовидной железы.
При MEN-2B точечная мутация локализуется в цитоплазматическом каталитическом домене, нарушая субстратную специфичность тирозинкиназы, что сопровождается опухолевым ростом в щитовидной железе и надпочечниках без вовлечения паращитовидной железы. При обоих наследственных синдромах наследуются мутации в RET, развившиеся в герминативных центрах. Спорадическая медуллярная карцинома щитовидной железы развивается с перегруппировкой онкогена RET в соматических клетках, напоминающей таковую при MEN-2B.
Онкогенная конверсия в результате мутации и перегруппировок найдена и в других генах, кодирующих рецепторы факторов роста. Точечная мутация в гене FLT3, кодирующем FMS-подобный тирозинкиназный рецептор 3, формирующий постоянный сигнал, найдена при миелоидной лейкемии.
При хронической миеломоноцитарной лейкемии с транслокацией t(5;12) обнаружено, что цитоплазматический домен рецептора PDGF полностью соединен с сегментом фактора транскрипции из семейства ETS, что обусловливает перманентную димеризацию рецептора PDGF. Более 90% стромальных опухолей ЖКТ имеют активирующую мутацию в рецепторах тирозинкиназы c-KIT или PDGF, которые являются рецепторами для фактора стволовых клеток и PDGF соответственно.
Эти мутации ответственны за специфическое ингибирование тирозинкиназы ингибитором иматиниба мезилатом. Такой тип терапии, направленный на специфическую генетическую поломку в опухолевой клетке, назван таргетной терапией.
Значительно более часто, чем мутации в протоонкогенах, наблюдается повышение экспрессии генов неизмененных рецепторов факторов роста. В ряде опухолей гиперэкспрессия является результатом амплификации гена, однако многие молекулярные механизмы усиленной экспрессии рецепторов еще полностью не изучены. Наиболее хорошо описаны два члена семейства рецепторов EGF. Нормальная форма гена ERBB1 подвергается гиперэкспрессии в 80% случаев плоскоклеточных карцином легкого, более чем в 50% случаев глиобластом и в 80-100% случаев опухолей головы и шеи.
Второй член этого семейства — ERBB2 (называемый также HER2/Neu) амплифицируется в 25% рака молочной железы и в аденокарциномах яичника, легкого, желудка и слюнных желез. На основании характерной гиперэкспрессии ERBB2 в опухолевых клетках разработан новый метод таргетной терапии опухолей с помощью антител к ERBB2, успешно применяемый в клинике.
в) Белки сигнальной трансдукции. Некоторые онкопротеины могут имитировать функции различных нормальных цитоплазматических компонентов внутриклеточной передачи сигнала от рецепторов факторов роста. Большинство белков, участвующих в такой передачи сигнала, связаны с внутренней поверхностью плазматической мембраны, где они получают сигналы извне (от активированных рецепторов факторов роста) и передают их к ядру клетки. С точки зрения биохимического строения белки сигнальной трансдукции гетерогенны. Наиболее хорошо изученным является семейство белков RAS, состоящее из гуанозинтрифосфатсвязывающих белков (G-белков).
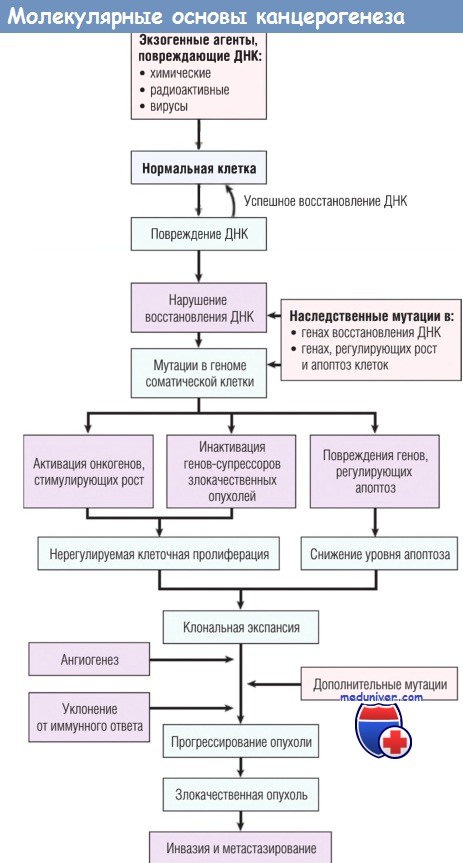
Упрощенная схема молекулярных основ злокачественных опухолей.
ДНК — дезоксирибонуклеиновая кислота.
- Вернуться в оглавление раздела "Патофизиология"
Один из основных признаков злокачественности, инфильтративный рост опухоли является прогностически неблагоприятным фактором для выздоровления: прорастание в ткани приводит к выраженным анатомическим изменениям, при которых не всегда можно удалить новообразование в полном объеме. Чем глубже и шире инвазия рака, тем хуже прогноз – прорастая в соседние органы и ткани, опухоль-паразит медленно и неуклонно убивает организм человека.

Инвазия раковых клеток – несомненный признак злокачественности
Инфильтративный рост опухоли – что это
Инвазия (прорастание) в близлежащие ткани и органы – это важнейший и обязательный признак злокачественного новообразования. В отличие от онкологии, доброкачественные опухоли и узлы раздвигают ткани и сдавливают органы, никогда не врастая в соседнюю структуру (экспансивный рост). Инфильтративный рост опухоли – это несомненный фактор злокачественности, требующий быстрого проведения всех необходимых лечебно-диагностических процедур и выбора оптимальной тактики лечения.
Опухоль-паразит не щадит организм хозяина, разрастаясь во все стороны и разрушая все вокруг себя.
Из всех анатомических структур рак не способен прорастать только в артерии, что объясняется:
- Наличием в сосудистой стенке жесткого каркаса из эластина и коллагена;
- Высоким внутрисосудистым давлением.
Инвазивный рак становится причиной функциональных нарушений, проявляющихся различными симптомами и признаками: зачастую именно эти проявления могут стать важными диагностическими критериями для постановки диагноза. В основе метастазирования рака лежит инфильтративное прорастание тканей (сначала раковые клетки распространяются в близлежащие органы, а затем отправляются в путь по лимфатической или венозной системе в отдаленные органы).
Формы инвазивного рака
Опытный врач-онколог по внешнему виду новообразования сможет определить форму рака. Инфильтративный рост опухоли может быть 3-х разновидностей:
- Экзофитная;
- Эндофитная;
- Смешанная.
Экзофитная форма – это рост по типу наружного узла, когда опухоль прорастает:
- внутрь полости органа;
- наружу за пределы анатомического образования;
- в толщу паренхиматозного органа;
- в кожу, выступая над поверхностью.
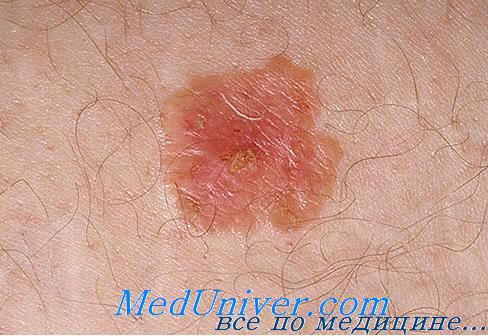
Прорастание в ткани соседних органов является прогностически неблагоприятным фактором
Для экзофитных форм рака характерны четкое отграничение от здоровых тканей (минимум 10 мм между здоровыми и больными тканями) и частое присоединение воспалительного процесса (нарушение кровообращения приводит к частичному отмиранию опухолевых тканей с развитием воспаления). Именно некроз с распадом ракового узла становится причиной формирования блюдцеообразной формы рака (проваливается центр опухоли и образуется язва с валиком вокруг). При возникновении экзофитного новообразования в паренхиматозном органе (печень, почка) может образоваться полость (киста), содержащая мертвые клетки и воспалительную жидкость. К типичным экзофитным локализациям относятся:
- Кожная опухоль;
- Практически все виды рака желудочно-кишечного тракта;
- Новообразования эндокринных органов.
Эндофитная форма рака – это внутристеночный инфильтративный рост опухоли (диффузная инвазия в стенку органа без прорастания наружу). Этот вариант является прогностически неблагоприятным, потому что поздно выявляется: прорастание и прогрессирование рака идет, но симптомов мало и ранняя диагностика маловероятна. Для эндофитного рака характерны:
- утолщение стенки пораженного раком органа;
- плотная структура тканей;
- отсутствие четких границ узла;
- раковые клетки могут быть на расстоянии до 60 мм от предполагаемого края здоровых тканей.
Диффузные формы рака типичны в следующих случаях:
- при опухоли в легких;
- на фоне рака молочной железы;
- при раке печени.
Инфильтративный рост опухоли – это прорастание рака в соседние органы, которое происходит практически всегда при 3-4 стадии злокачественного процесса.
Рак-паразит освоился и ведет себя по-хозяйски, используя организм пациента, как собственную вотчину.
Врач увидит эти изменения при осмотре (при наружных локализациях), при проведении эндоскопического исследования (прорастание внутрь полого органа) или во время хирургической операции. Форма рака помогает поставить точный диагноз, спрогнозировать исход и выбрать лучший вариант комбинированного лечения.
Мысли об онкологии: просто о сложном на Дзен.Канале Onkos
Читайте также:

