Этан реагирует с серной кислотой хлором
Задание 17. Этан взаимодействует
1) с хлороводородом
4) с оксидом углерода(IV)
Этан относится к алканам. Известно, что алканы подвергаются реакции радикального замещения с галогенами (здесь это хлор) и горят в кислороде (взаимодействие с кислородом).
Ответ: 25.
- Все задания варианта
- Наша группа Вконтакте
- Наш магазин
- Наш канал
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 1
- Вариант 1. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 2
- Вариант 2. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 3
- Вариант 3. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 4
- Вариант 4. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 5
- Вариант 5. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 6
- Вариант 6. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 7
- Вариант 7. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 8
- Вариант 8. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 9
- Вариант 9. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 10
- Вариант 10. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 11
- Вариант 11. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 12
- Вариант 12. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 13
- Вариант 13. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 14
- Вариант 14. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 15
- Вариант 15. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 16
- Вариант 16. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 17
- Вариант 17. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 18
- Вариант 18. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 19
- Вариант 19. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 20
- Вариант 20. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 21
- Вариант 21. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 22
- Вариант 22. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 23
- Вариант 23. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 24
- Вариант 24. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 25
- Вариант 25. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 26
- Вариант 26. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 27
- Вариант 27. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 28
- Вариант 28. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 29
- Вариант 29. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- Вариант 30
- Вариант 30. Задания ОГЭ 2017. Химия. А.С. Корощенко. 30 вариантов
- Решения заданий по номерам
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
Для наших пользователей доступны следующие материалы:
- Инструменты ЕГЭиста
- Наш магазин
- Наш канал

ОГЭ Химия Решения типичных заданий №17

Первоначальное сведения об органических веществах: предельных и непредельных углеводородах и кислородсодержащих веществах: спиртах, карбоновых кислотах. Биологически важные вещества: белки, жиры, углеводы.
Является составной частью природного газа Относится к непредельным углеводородам Хорошо растворяется в воде Не реагирует с кислородом Вступает в реакции с хлором
Источник — Химия. Тематический тренинг за курс основной школы (, , , )
Метан — алкан СН4
Из курса основной школы за 9 класс мы знаем, что алканы вступают в реакции галогенирования ( присоединение галогенов), а также, что метан — газ, являющийся составной частью природного газа
Общей формуле CnH2n+2 соответствует состав молекулы:
Глицерина Этана Ацетилена Метана Тристериана
Источник — Химия. Тематический тренинг за курс основной школы (, , , )
Формула CnH2n+2 соответствует алканам, в данном случае алканы — этан, метан
Строение молекулы этилена характеризует следующее:
Содержит 5 сигмы и 1 пи связь Молекула имеет тетраэдрическое строение Валентный угол равен 120 0 Образует геометрические изомеры Все атомы находятся на одной линии
Источник — Химия. Тематический тренинг за курс основной школы (, , , )
Этилен — алкен CH2=CH2
В молекуле присутствуют 5 сигма и 1 пи связи (см. теорию перед заданием) Также из курса за 9 класс мы знаем что для алкенов валентный угол равен 1200 Ответ: 13
Атомы кислорода содержат молекулы
Этилена Ацетилена Метанола Стеариновой кислоты Метана
Источник — Химия. Тематический тренинг за курс основной школы (, , , )
К кислородосодержащим углеводородам относятся: спирты, эфиры, альдегиды, кетоны, сложные эфиры, карбоновые кислоты, углеводы.
Этан может реагировать
Хлороводородом Кальцием Раствором серной кислоты Бромом при облучении Кислородом
Источник — Химия. Тематический тренинг за курс основной школы (, , )
Этан — алкан СНз — СНз
Из курса химии за 9 класс мы знаем, что для алканов характерны реакции галогенирования ( присоединение галогенов) при свету(облучение), реакции горения( присоединение кислорода и получение в продуктах углекислого газа и воды)
Как стеариновая, так и уксусная кислоты не реагируют
СІ2 СО2 C2H5OH NaOH Ag
Источник — Химия. Тематический тренинг за курс основной школы (, , , )
Как уксусная, так и стеариновая кислоты относятся к классу карбоновых кислот, для которых характерны реакции этерификации (получение сложного эфира путем реакции карбоновых кислот со спиртами), также реакции с основаниями.
К полисахаридам относятся
Фруктоза Триолеин Сахароза Крахмал Клетчатка
Источник — Химия. Тематический тренинг за курс основной школы (, , , )
Полисахариды — это полимеры моносахаридов, т. е. высокомолекулярные углеводы. К ним относятся крахмал, клетчатка, целлюлоза, хитин и д. р.

Взаимодействует с натрием с выделением водорода При дегидратации образуется уксусный альдегид Используется для получения этилена Легко присоединяет водород Реагирует с этаном с образованием простого эфира
Источник — Химия. Тематический тренинг за курс основной школы (, , , )
Этанол — спирт СНз — СН2 " ОН
Для спиртов характерны реакции с активными металлами (в продуктах выделяется водород), также при дегидратации спиртов (катализатор — конц. серная кислота и t>1400) образуется этилен и вода.
Гидролиз жиров в живых организмах протекает с участием
Спиртов Щелочей Солей Воды Ферментов
Источник — Химия. Тематический тренинг за курс основной школы (, , , )
Из курса 9 класса мы знаем, что гидролиз жиров протекает с участием воды и ферментов
Бесцветный газ, хорошо растворимый в воде Вступает в реакцию полимеризации Окисляется водным раствором перманганата калия Не присоединяет воду В больших количествах входит в состав нефти
Источник — Химия. Тематический тренинг за курс основной школы (, , , )
Этен — алкен CH2=CH2
Алкены вступают в реакции полимеризации и окисляются водным раствором перманганата калия
Члены гомологического ряда алканов имеют общие химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированной серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями – КМnО4 и т.п
Химическая устойчивость алканов объясняется высокой прочностью σ–связей С ─ С и С ─ Н, а также их неполярностью. Неполярные связи С ─ С и С ─ Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции (реакции замещения), в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов.
Алканы вступают в реакции, протекающие по свободно-радикальному (цепному) механизму и протекают обычно на свету или при нагревании. По этому механизму легче всего замещаются атомы водорода у третичных, затем вторичных и первичных атомов углерода. При хлорировании эта закономерность не соблюдается при T>400˚C.
Алканы относятся к углеводородам, в которых отсутствуют кратные связи. Из-за предельности алканов реакции присоединения для них нехарактерны.
1. Галогенирование (замещение атома водорода атомом галогена — F, Cl, Br с образованием галогеналкана).
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
Теорию цепных реакций разработал советский ученый, один из основоположников химической физики, академик Н.Н. Семенов (1896—1986), за что в 1956 г. был награжден Нобелевской премией.
Скорость реакции зависит от активности галогенов, которая уменьшается с увеличением радиуса атома.
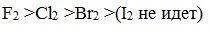
Алканы очень активно реагируют с фтором, реакция алканов с его участием сопровождается взрывом и окислением до СF4.
Реакции хлорирования и бромирования протекают под действием света (фотохимическая цепная реакция) или при 300–400 о C.
Иодирование проходит обратимо, поэтому требуется окислитель для удаления НI из реакции.
Низшие алканы (СН4, С2Н6, С3Н8) можно прохлорировать полностью. В молекуле метана атомы хлора могут заместить от одного до четырех атомов водорода в зависимости от соотношения реагентов
(hv — формула кванта света)
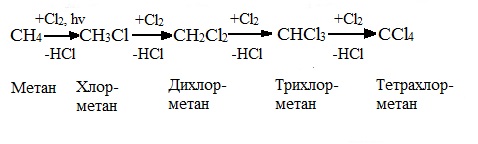
Тривиальное название трихлорметана – хлороформ.
Реакция осуществляется в три стадии:
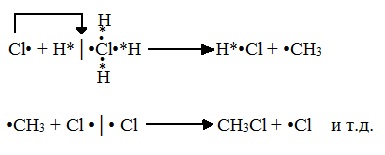
А) Инициирование (зарождение цепи) – гомолитическое расщепление молекулы Сl2 с образованием свободных радикалов хлора:

Свободные радикалы – это атомы или группы атомов с неспаренными электронами (•Сl, •Н, •СН3…)
Б) Развитие цепи (взаимодействие радикала хлора с молекулой алкана, метильного радикала с новой молекулой хлора и т.д.):
В) Обрыв цепи (происходит при соединении двух радикалов друг с другом):
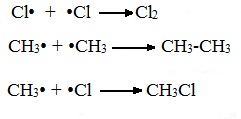
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле: 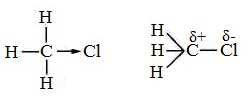
Электронная плотность связи С – Cl смещена к более электроотрицательному атому хлора, в результате этого на нем образуется частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атоме углерода в метильной группе (-СН3) создаётся недостаток электронной плотности, поэтому он оттягивает на себя электронную плотность от соседних атомов водорода, в результате этого связи С – Н становятся менее прочными и атомы водорода легче замещаются на атомы хлора.
При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайшего к заместителю:
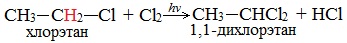
Алканы обесцвечивают раствор брома при нагревании, вступая в реакцию радикального замещения.
2.Нитрование (замещение атома водорода нитрогруппой – NO2 с образованием нитроалканов R-NO2). Нитрующий реагент – разбавленная азотная кислота HNO3 (НО─NО2).
Нитрование разбавленной азотной кислотой при t = 140 0 С и при повышенном или нормальном давлении - реакция М.И.Коновалова.
В результате реакции образуется смесь изомерных нитросоединений. Наиболее легко замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного:
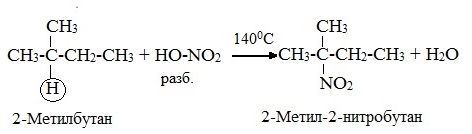
3.Сульфирование (замещение атомов водорода сульфогруппой SO3Н с образованием алкансульфокислот RSO3Н). Сульфирующий реагент – серная кислота Н2SO4 (НО─SO3Н). Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании.
Наиболее легко замещается атом водорода у третичного атома углерода:
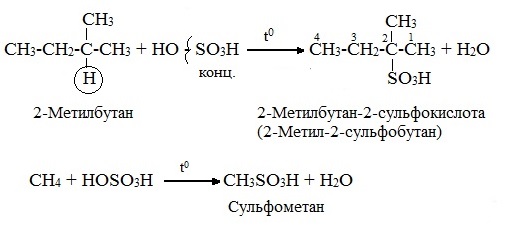
Алканы – соединения с низкими степенями окисления углерода и в зависимости от условий реакции они могут окисляться с образованием различных соединений. 
При обычных условиях алканы устойчивы к действию сильных окислителей (КМnO4, К2Сr2О7).
1. Горение (окисление кислородом воздуха при высоких температурах)
А) Полное окисление (избыток О2)
При избытке кислорода происходит полное окисление алканов до СО2, где углерод имеет высшую степень окисления +4, и воды. Горение углеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическая реакция).
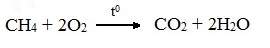
Низшие гомологи (метан, этан, пропан, бутан) образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. С увеличением молекулярной массы алканы загораются труднее.
Процесс горения углеводородов широко используется для получения энергии (в двигателях внутреннего сгорания, в тепловых электростанциях и т.п.).
Общий вид реакции горения алканов:
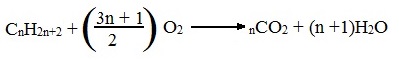
Б) Неполное окисление (недостаток О2)
При горении высших алканов ((n >>1)) при недостатке кислорода образуются продукты частичного окисления: угарный газ СО (степень окисления углерода +2), сажа (мелкодисперсный углерод, со степенью окисления 0).
Поэтому высшие алканы горят на воздухе коптящим пламенем, выделяя токсичный угарный газ, представляющий опасность для человека.
Горение метана при недостатке кислорода происходит по уравнениям:
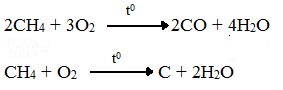
Последняя реакция используется в промышленности для получения сажи из природного газа, содержащего 80-97% метана.
2. Каталитическое окисление
Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–С и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов.
Например, при неполном окислении бутана происходит разрыв связи (С2–С3) и получается две молекулы уксусной кислоты: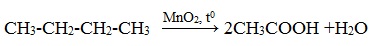
Этим способом в промышленности получают уксусную кислоту.
При мягком окислении метана кислородом воздуха в присутствии катализаторов могут быть получены метиловый спирт, формальдегид и муравьиная кислота.
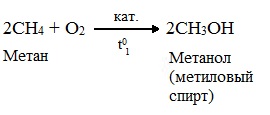
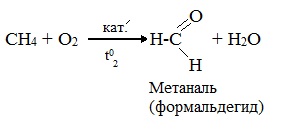
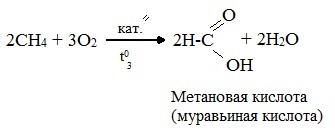
Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С12–С18, которые используются для получения моющих средств и поверхностно-активных веществ.
1. Крекинг (анг. сracking — расщепление) алканов является основой переработки нефти с целью получения продуктов меньшей молекулярной массы, которые используются в качестве моторных топлив, смазочных масел, а также сырья для химической и нефтехимической промышленности.
Для осуществления этого процесса используют два способа: термический крекинг (при нагревании без доступа воздуха) и каталитический крекинг (более умеренное нагревание в присутствии катализатора).
Термический крекинг — это разрыв связей С ─ С в молекулах алканов с длинными углеродными цепями, в результате которого образуются алканы и алкены с меньшим числом атомов углерода.
Термический крекинг (пиролиз) осуществляется при температуре 450 – 700 0 С:
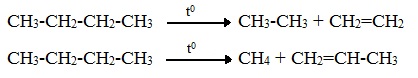
Крекинг н-гексана (работа Литвишко Алексея, г. Самара)
Каталитический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре 500 0 С и атмосферном давлении. При этом с разрывом молекул происходит реакция изомеризации и дегидрирования.
Крекинг октана (работа Литвишко Алексея, г. Самара)
2.При нагревании метана или этана до температуры 1000 0 С начинается пиролиз – разложение на простые вещества:
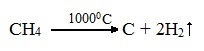
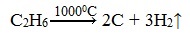
Полученный этим способом углерод является достаточно чистым, в технике называется сажей и используется, например, при производстве автомобильных покрышек.
3. Конверсия метана с образованием синтез – газа (СО + Н2)

Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов.
1.Дегидрирование (отщепление водорода; происходит в результате разрыва связей С ─ Н; осуществляется в присутствии катализатора при повышенных температурах).
В ходе пропускания алканов над катализатором (Pt, Pd, Ni, А1203, Сг203) при высокой температуре (400 — 600°С) происходит отщепление молекулы водорода и образование алкена: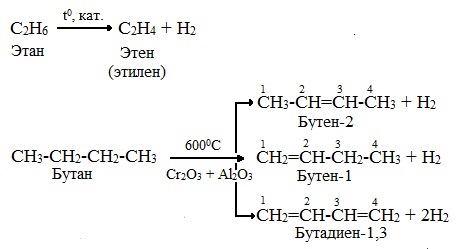
2. Если метан нагреть до более высокой температуры (1500 0 С) и быстро охладить, то происходит межмолекулярное дегидрирование и образуется этин (ацетилен):
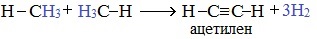
3.Дегидроциклизация (ароматизация) — реакция дегидрирования, которая приводит к замыканию цепи в устойчивый цикл.
Алканы, содержащие в основной цепи больше 4-х атомов углерода, используются для получения циклических соединений.
Если основная цепь молекулы алкана содержит 5 (но не более) атомов углерода (н-пентан и его алкильные производные), то при температуре 300 0 С над Pt-катализатором атомы водорода отщепляются от концевых атомов углеродной цепи и образуется пятичленный цикл (циклопентан или его производные): 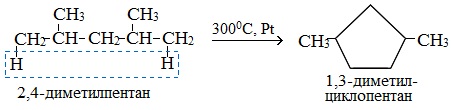
Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола м его производных:
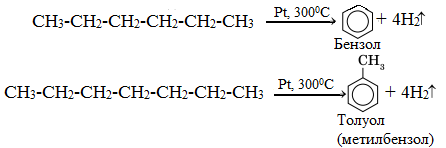
1.Изомеризация (превращение химического соединения в его изомер):
Нормальные алканы под влиянием катализаторов и при нагревании способны превращаться в алканы с разветвленной цепью без изменения состава молекул. В этих случаях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов:
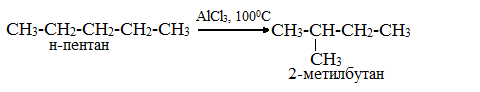
Эта реакция является важной для производства бензина, поскольку наличие в его составе разветвленных углеводородов повышает октановое число, т.е. качество топлива.
Видеоопыт "Установление качественного состава предельных углеводородов"
Читайте также:

