Эстрадиол при раке простаты
- Блог
- Статьи
- Книги
Если цель задающего вопрос была в определении его правового статуса при назначении лечения, то такой способ исследования был подходящим, чтобы разобраться, считают ли коллеги по профессии разумной такую терапию. Юридически врач обезопасит себя, если другие засвидетельствуют, что его практика является стандартной.
К середине 1980-х годов в некоторых исследованиях было показано, что лечение эстрогеном совершенно не продлевало жизнь пациентам с раком простаты, но утверждалось, что пациенты, которые принимали эстроген, были счастливее тех, кто его не принимали.
Очевидно, на многих врачей-экспертов по общепринятому лечению рака счастье их пациентов, получавших эстроген, не произвело большого впечатления, поскольку опрос на медицинской конференции показал, что многие из них предпочли бы никак не лечиться, если бы у них обнаружили рак простаты. А совсем недавно вышли рекомендации не лечить пожилых пациентов агрессивно, поскольку их раки так медленно растут, что пациенты, скорее всего, умрут от какой-то другой возрастной причины.
Несмотря на статьи, которые я показал моему другу, и вопреки моим предостережениям о том, что эстроген может вызывать инсульты и сердечные приступы, он согласился на лечение эстрогеном. Уже через неделю он начал страдать астмой и нарушением сна. Далее он перенес серию инсультов и умер.
Со времен Брауна-Секварда и Ойгена Штейнаха было принято, что снижение тестикулярной функции является обычным явлением при старении, а тестостерон был, возможно, первым гормоном, о котором было четко установлено, что он постоянно падает с возрастом (Vermeulen, et al., 1972, 1979).
Многим это казалось странным, что увеличение простаты происходит, в основном, у пожилых мужчин, если тестостерон — это гормон, который вызывает рост простаты, а эстроген — анатагонист этого роста. Природа роста простаты у пожилого мужчины сильно отличается от таковой у юноши.
Еще десятилетия назад было известно, что уровень эстрогена у пожилых мужчин растет (Pirke and Doerr, 1975), также как он растет при стрессе, во время болезни, при плохом питании и гипотиреозе (который также связан со старением). Эстроген вырабатывается в жире (Siiteri, and MacDonald, 1973, Vermeulen, 1976), содержание которого в теле с возрастом увеличивается, когда имеется недостаток гормона щитовидной железы и прогестерона. Преобразование тестостерона в эстроген происходит в яичках, но благоприятная гормональная среда молодости подавляет это превращение. Активный гормон щитовидной железы, Т3, с возрастом падает, а это с необходимостью снижает выработку прегненолона и прогестерона. Для обоих полов, как оказалось, в результате дефицита гормона щитовидной железы, прогестерона и прегненолона чаще во время стресса повышается ДГЭА.
У стареющих женщин и мужчин, по мере атрофии грудных желез и предстательной железы, растет соотношение эстроген/антиэстроген.
Абнормальная картина гормонов гипофиза отражает стресс и гормональный дисбаланс, но последние также непосредственно участвуют в широко распространяющихся изменениях содержания гликопротеинов в тканях. Простата специализируется на выработке больших количеств муцина. Эндокринная физиология выработки муцина простатой плохо понимаема, но, скорее всего, существует взаимодействие между системами регулирования роста и секреции.
Тестикулярный рак легко диагностируется, и с 1950 года его случаи явно участились (на 100 % у белых мужчин и на 200 % у черных). Чаще встречаются неопущение яичка, аномалии уретры, сходные с наблюдаемыми у ДЭС-сыновей (сыновья женщин, которым во время беременности назначали диэтилстильбэстрол — прим. перев.) и диких животных. Поэтому становится понятным громадный рост смертности от рака предстательной железы на протяжении того же периода времени.
Хотя исследования на животных и показали, что применение эстрогена стимулирует увеличение простаты, можно было предположить, что рост простаты у человека стимулирует только тестостерон, пока не сделаны тесты in vitro, чтобы определить, как именно влияют гормоны на деление клеток.
На срезах простаты человека деление клеток стимулируют несколько гормонов (включая инсулин и, возможно, пролактин); тестостерон в таких экспериментальных условиях рост деления клеток не вызывает (McKeehan, et al., 1984). Вопреки стереотипным представлениям были высказаны предположения о том, что дополнительные андрогены могут держать рак простаты под контролем (Umekita, et al., 1996), и что антагонисты пролактина и эстрогена могут быть соответствующим образом использованы в гормональной терапии (например, Wennbo, et al., 1997; Lane, et al., 1997).
К 50 годам у мужчин часто наблюдается избыток пролактина и эстрогена, а также дефицит гормона щитовидной железы и тестостерона. Именно в этом возрасте зачастую становится заметным увеличение простаты.
У стареющих мужчин также снижаются прогестерон и прегненолон. В нескольких исследованиях с применением синтетических прогестинов было показано, что они эффективно сокращают гипертрофированную простату, а средство на основе со пальметто, применяемое при увеличенной простате, как сообщалось, содержит прегненолон или нечто близкое по составу. Можно предположить, что эти вещества сокращают преобразование тестостерона и других андрогенов в эстроген.
Насыщенные жиры не высвобождают эстроген из сывороточного белка, который связывает его, это дело ненасыщенных жирных кислот — высвободить, повысить его доступность и активность в тканевых клетках.
Добавки гормона щитовидной железы, адекватный животный белок, микроэлементы и витамин А — вот первые меры для предотвращения гипертрофии простаты и рака. Чтобы не наносить дополнительный вред, пищевая и эндокринная поддержка может сочетаться с рациональными противораковыми процедурами, поскольку между различными подходами, направленными на достижение эндокринного и иммунологического баланса, не существует, в действительности, никакой четкой границы.
Гормонотерапия при раке простаты ещё несколько лет назад была предпочтительным методом лечения пожилых мужчин и даже при раннем раке составляла конкуренцию радикальным способам — хирургии и лучевой терапии.
Недавнее изучение эффективности адъювантного (профилактического) эндокринного воздействия показало, что ведущий критерий гарантированной результативности гормонотерапии — низкий уровень ПСА не оправдал клинических надежд, а стандартные показания к использованию гормональных средств при раке простаты нуждаются в коррекции.
Что такое гормональная терапия?
Ведущий механизм лечебного эндокринного воздействия при раке простаты — снижение уровня тестостерона в клетках железы за счёт уменьшения его продукции яичками или блокадой его проникновения внутрь клетки.
Лечение рака простаты гормонотерапией
Гормонотерапия не считается радикальным воздействием, то есть неспособна излечить от злокачественного заболевания, но на длительный срок останавливает прогрессию опухоли.
- дополняет радикальную операцию, снижая вероятность рецидива заболевания при распространении ракового процесса в лимфоузлы, но на проценте выживаемости через 10 лет после хирургии, как выяснили исследования, отражается мало;
- используется до операции — неоадъювантно, позволяя уменьшить размеры первичного образования и лимфатических узлов при продвинутой стадии;
- предваряет и сопровождает дистанционное облучение и брахитерапию, общий срок применения в 3 года существенно улучшает общие результаты лечения;
- самостоятельно используется при метастатическом варианте или противопоказаниях к радикальным способам лечения, позволяя на годы продлить жизнь без тяжких симптомов болезни;
- используется вместе с химиотерапией, повышая результативность цитостатиков.
В качестве гормонального воздействия на разных этапах развития простатической карциномы в разных комбинациях можно использовать операцию и пять групп гормональных препаратов.
Антагонисты ЛГРГ лишены синдрома вспышки, поскольку включаются в работу уже в гипофизе головного мозга, по эффективности не уступают другим методикам кастрации. Препарат дегареликс вводится только раз в месяц, но обладает неприятными побочными эффектами, самый частый из которых — сильная боль при подкожном введении.
Антиандрогены на поверхности раковой клетки связываются с рецептором, не допуская тестостерон внутрь, опосредовано снижая и выброс ЛГРГ. Представлены тремя нестероидными препаратами — бикалутамидом, нилутамидом и флутамидом, и тремя стероидами, из которых клиническое значением имеет только ципротерон. Различия в строении лекарств не влияют на эффективность, в отличии от спектра побочных реакций. Как правило, используются вместе с агонистами ЛГРГ или после хирургической кастрации, но не исключается и монотерапия. Лечение многолетнее и ежедневное, оптимальная суточная доза набирается за несколько приемов.
К препаратам второго ряда отнесён аминоглютетимид, снижающий уровень выработки андрогенов надпочечниками, и требующий обязательного дополнительного приёма глюкокортикоидов для уменьшения побочных эффектов, самое опасное из которых — надпочечниковая недостаточность.
В каких случаях назначают гормонотерапию при раке простаты?
Гормональное лечение возможно при любой стадии рака простаты, как изолированно, так и вместе с радикальными подходами.
Профилактическое использование рекомендуется при высоком риске послеоперационного рецидива, что вероятно после удаления большой первичной опухоли и метастазах более чем в двух лимфоузлах, а также после радикальной лучевой терапии. Гормональные средства не нужны после удаления раннего рака невысокой степени агрессивности, такие пациенты и без дополнительного лечения имеют все шансы жить долго и навсегда забыть про рак.
Очень помогает высокой выживаемости без рецидива присоединение профилактической по задачам гормонотерапии к облучению, эндокринное воздействие продолжается 2-3 года. В качестве адъювантной может использоваться хирургическая кастрация или медикаментозная в комплексе с антиандрогенами, которые начинают принимать загодя — за неделю до агониста ЛГРГ, предотвращая неприятности синдрома вспышки.
Гормонотерапия пациентов с формально операбельным процессом без метастазов, но с тяжкими сопутствующими болезнями, препятствующими хирургии и облучению, позволяет избежать смерти от рака простаты.
При метастатической стадии рака простаты достойной альтернативы гормонам не существует, даже химиотерапия не показывает такой результативности, прогрессирование процесса останавливается на долгие годы и даже десятилетия, позволяя больному активно жить при минимальных проявлениях болезни.
При рецидиве рака простаты лекарственное лечение эндокринными препаратами проводится после облучения или в самостоятельном виде.
Следует уточнить, что даже при резистентном к гормональной терапии раке, дополнение антиандрогенов к химиотерапии помогает пациенту больше, чем одна химиотерапия.
Достоинства гормонотерапии
Достоинство гормональной терапии в её высокой эффективности, до настоящего времени клинические исследования не выявили самого лучшего препарата или комбинации, поэтому для каждого конкретного пациента можно подобрать оптимальное лечение с учётом сопутствующих болезней, доступности лечебного учреждения и финансов пациента.
Гормональное воздействие не свободно от побочных реакций, но в сравнении с другими методами лечения рака лучше переносится и не мешает активной жизни пациента.
Противопоказания
Гормонотерапия переносится хорошо большинством пациентов, что позволило её сделать альтернативой хирургической операции у очень пожилых или ослабленных хроническими болезнями пациентов.
Противопоказание для хирургической кастрации одно — психологический негатив больного мужчины.
Агонисты ЛГРГ противопоказаны в монорежиме при прогнозировании феномена вспышки — только вместе с антиандрогенами.
Эстрогенотерапия невозможна при заболеваниях сердца и сосудов.Исключается применение только одних антиэстрогенов при первичном раннем раке предстательной железы, поскольку существуют менее токсичные методики. Лучевая терапия при небольшой опухоли простаты, особенно брахитерапия, поможет полному избавлению от болезни, при полном противопоказании к облучению должно проводиться лечение комбинацией гормональных препаратов.
Возможные последствия
Гормональные препараты не столь токсичны, как принято считать, конечно же лечение ими не свободно от побочных реакций, но не таких ярких и тяжких, как последствия противоопухолевых цитостатиков.
Большинство реакций обусловлено снижением выработки половых гормонов, все препараты вызывают:
- импотенцию (эректильную дисфункцию)
- снижение полового влечения (либидо)
- нарушение жирового обмена с исходом в избыточный вес
- дисгормональный остеопороз
- приливы и увеличение молочных (грудных) желез — гинекомастию.
К таким последствиям в разном наборе и разной степени выраженности приводят и лекарства, и кастрация — хирургическая и медикаментозная.
Двусторонняя орхидэктомия исключает использование в дальнейшем одной современной методики лечения, снижающей токсические проявления — интермиттирующей андрогенной блокады, когда препараты даются не постоянно, а по схеме.
Антиандрогены неблагоприятно действуют на слизистую желудочно-кишечного тракта, почти также часто, как широко используемые с обезболивающей целью НПВС. Они снижают функциональные возможности печеночных клеток, способны ухудшить состояние сердечно-сосудистой системы, только стероидные препараты наносят урон за счёт эффекта, подобного действию прогестерона, а нестероидные — из-за повышения содержание тестостерона в крови. Наименее токсичный из одногруппников — бикалутамид, при его длительном приёме довольно редки повреждения желудочно-кишечного тракта, но со стороны грудных желез жалоб больше — увеличение их сопровождается болевым синдромом.
Прогноз и эффективность
За время болезни почти каждому пациенту удаётся получить лечение практически всеми группами лекарственных средств, когда по мере прогрессирования одна линия сменяет другую. Большинству больных проводится не менее 4 комбинаций гормональной терапии — беспрецедентная возможность, недоступная страдающим другими злокачественными процессами.
У каждого шестого с отсутствием эффекта от кастрации приём одних только антиандрогенов позволяет достичь позитивного результата. При прогрессировании на фоне антиандрогенов у каждого третьего мужчины эстрогены способны остановить рост рака. После исчерпания эффекта гормонов остается альтернатива в виде химиотерапии.
Многое определяется возможностями клиники и искусством онкоурологов и химиотерапевтов, умело манипулирующими гормональными препаратами и симптоматическими средствами для купирования осложнений лечения, неизбежных при многолетнем противоопухолевом эндокринном воздействии. Всем пациентам нашей клиники мы помогаем жить активно, как можно лучше и дольше.
1 Шевченко А.Н. 1 Франциянц Е.М. 1 Комарова Е.Ф. 1 Хомутенко И.А. 1 Черярина Н.Д. 1 Таварян И.С. 1
Исследован уровень тестостерона, эстрадиола, прогестерона, пролактина в крови больных раком предстательной железы T3bN0M1b. Отличительной особенностью больных при дополнении стандартной гормонотерапии доцетакселом (6 курсов по 75 мг/м2 каждые три недели) было резкое в 8,5 раз снижение уровня эстрадиола и повышение в 3,3 раза содержания прогестерона по сравнению с показателями до лечения. Учитывая возможность влияния применяемой терапии на звенья гипоталамо-гипофизарно-гонадной оси, коррелирующего с клиническим эффектом, считаем такой вид терапии патогенетически обоснованным для больных раком предстательной железы.
рак предстательной железы
1. Берштейн Л.М. Гормональный канцерогенез. – СПБ., 2000. – 199 с.
2. Кроненберг Г.М., Мелмед Ш., Полонски К.С., Ларсен П.Р. Эндокринология по Вильямсу. Заболевания коры надпочечников и эндокринная артериальная гипертензия. – М., 2010. – С. 207.
3. Гранов А.М., Молчанов О.Е., Карелин М.И. Роль гормонального профиля в коррекции тактики лечения рака предстательной железы // Вопросы онкологии. – 2008. – Том 54. – №4. – С. 457-462.
4. Кеттайл В.М., Арки Р.А. Патофизиология эндокринной системы. – М., 2001. – С.335.
5. Роберт С. Манфорд. Иммуно-эндокринные взаимодействия. Физиология эндокринной системы // под. ред. Дж. Гриффина, С. Охеды. – М., – 2010. – С. 114-128.
6. Naz R.K. Prostate: Basic and Clinical Aspecys.-New York: CRC Press, 1997. – 377 p.
При развитии злокачественных опухолей исследовательской школой В.М.Дильмана доказана важная роль дисфункций гипоталамо-гипофизарно-надпочечниковой и гипоталамо-гипофизарно-гонадной осей нейроэндокринной системы. Накоплен большой экспериментальный материал, касающийся участия половых гормонов в патогенезе рака предстательной железы. Однако исследования, посвященные изучению стероидных и пептидных гормонов в клинике, остаются единичными [3].
Вместе с тем, в настоящее время известно, что направление и интенсивность влияния этих гормонов изменяется в зависимости от стадии процесса и варианта лечения больных раком предстательной железы [1]. Потеря чувствительности опухоли к регуляторному действию тестостерона при прогрессировании процесса сменяется аутокринной, паракринной и эндокринной регуляцией трофики и пролиферативной ее активности с помощью гормонов и факторов роста пептидной природы [6].
Установлено также, что эстрогены обладают способностью накапливать количество кортикостероидов в депонированном виде, тем самым тормозить их метаболизм, снижая образование тетрагидроформ [2,4]. Известно, что связь гормонов с органами иммунной системы во многом опосредствуется через иммунорегуляторные пептиды, а стероиды глюкокортикоидного ряда оказывают дозозависимое действие на состояние иммунной системы [5].
Целью настоящего исследования явилось изучение уровня половых гормонов и пролактина в крови больных гормончувствительным раком простаты в динамике лечения.
Материалы и методы исследования
Исследование основано на результатах диагностики и лечения 50 пациентов, имеющих морфологически подтвержденный, впервые выявленный гормоночувствительный рак предстательной железы с метастазами в кости T3bN0M1b. По основным клиническим параметрам пациентов, гистологии и иммуногистохимии опухоли обе группы были сопоставимы.
По методу применяемой терапии больные были распределены на две группы:
Контрольная группа – 25 пациентов, получавших лечение по стандартной схеме в виде интермиттирующей андрогенной супрессии (бикалутамид 50 мг внутрь 1 раз в день; гозералин подкожно 3,6 мг 1 раз в 28 дней; золедроновая кислота 4 мг внутривенно капельно каждые четыре недели)
Основная группа – 25 пациентов, получавших лечение по предложенной нами методике (шесть курсов химиотерапии доцетакселом 75 мг/м2 каждые три недели внутривенно капельно в дополнение к стандартному методу лечения).
Радиоиммуннометрическим методом в периферической крови больных обеих групп до начала лечения и по его завершению определяли состояние гормонального профиля, включающего уровень тестостерона, эстрадиола, прогестерона, пролактина (IMMUNOTECH, Чехия). Гормоны исследовали в утренние часы, чтобы исключить биоритмологические колебания их уровня в течение дня.
Статистический анализ результатов проводили с помощью пакета Statistica (версия 8). Оценка достоверности произведена с использованием t-критерия Стьюдента. Уровень Р 1
Следовательно, стероидные гормоны повышают интенсивность ДНК-зависимой РНК-полимеразной реакции в предстательной железе и являются пусковым фактором, обеспечивающим усиление биосинтеза белковых ферментов, от которых зависит соотношение компонентов секрета предстательной железы. Это в свою очередь обеспечивает дыхание, движение и жизнедеятельность сперматозоонов.
Различные андрогены вызывают рост предстательной железы, превращаясь в ДГТ. Не только натуральные, но и синтетические андрогены (например, тестостерона пропионат) опосредованно действуют через ДГТ.
Приведенные выше данные дают основание считать ДГТ активной формой тестостерона (Mainwaring, 1970; Schubert, 1972; Gigon, 1973).
Для функциональной активности предстательной железы большое значение имеют также, эстрогены.
Пути проникновения эстрогенов в клетки предстательной железы мало изучены. Однако известно, что эстрадиол связывается с цитоплазматическими протеинами предстательной железы (Unhjem, 1970). Рецепторы к эстрогенам обнаружены в предстательной железе свиньи, теленка (Gungblut, 1974), человека (Wagner, 1975; Hawkins, 1975) и крысы (Armstrong и Bashirelahi, 1978).
Эстрогены (как эндогенные, так и экзогенные) влияют на функции предстательной железы. Под влиянием эстрадиола бензоата повышается активность щелочной фосфатазы в вентральной предстательной железе крыс и аргиназ в дорсолатеральной (Jamaпака и соавт., 1975). При введении эстрогенов угнетается активность мальтазы в предстательной железе (Gunaga и соавт., 1970), значительно тормозится зависимая от тестостерона секреция фруктозы (Thomas и Knych, 1966). Аналоги стильбэстрола подавляют синтез тестостерона, активность ферментов андрогенного метаболизма в предстательной железе, в частности, тестостерон-17-20-лиазы (Danutra и соавт., 1973). Под влиянием эстрогенов снижается секреторная активность предстательной железы, а спустя 2 нед после начала инъекций прекращается совсем (Leav и соавт., 1971; Hoissaeter, 1975).
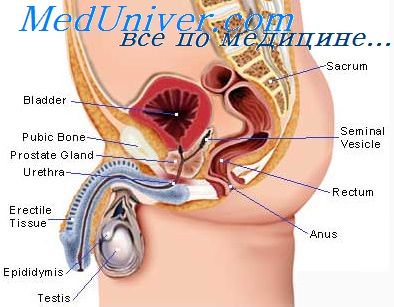
Концентрация плазменного тестостерона достоверно снижалась уже через 24 ч после инъекции экстрадиола бензоата, а в яичках обнаруживались только его следы (Chowdhury, 1974).
При введении эстрогенов резко подавляется активность 5а-редуктазы (Shimazaki и соавт., 1972; Moore и соавт., 1973). Путь обмена тестостерона изменяется на окислительный с преимущественным образованием андростендиона (Leav и соавт., 1971).
Под влиянием длительного введения эстрогенов полностью тормозятся метаболизм тестостерона в предстательной железе и связанные с ним физиологические эффекты. При этом атрофии подвергается лишь кортикальная (андрогенозависимая) часть предстательной железы. В мозговой (эстрогенозависимой) зоне после введения эстрогенов наблюдается пролиферация соединительной и гладкомышечной ткани.
По мнению Л. М. Шабад (1949), Chierego и соавторов (1957), присутствие андрогенов необходимо для функционирования клеток железистого эпителия и миоэпителиальных элементов предстательной железы. На развитие же соединительной фиброзной ткани мужские половые гормоны не влияют. Возможно, андрогены стимулируют-эпителий дополнительных органов размножения, в то время как эстрогены вызывают в этих органах увеличение мышечной ткани.
Специфическое связывание эстрогенов в добавочных органах репродуктивной системы человека и многих видов млекопитающих отмечали Armstrong и соавторы (1973), Rennie и Bruchovsky (1973), Bashirebahi и Armstrong (1974), Varkarakis и соавторы (1975).
Ferland и соавторы (1976) показали, что относительно высокие дозы эстрогенов могут тормозить секрецию обоих гонадотропинов. Причем это влияние осуществляется на уровне гипоталамуса. Авторы отмечают, что эстрогены в зависимости от дозы могут стимулировать или тормозить секрецию люлиберина. Эстрогены повышают чувствительность ответной реакции лютропина на люлиберин.
Максимальная андрогенная блокада
В настоящее время актуальным для лечения метастазирующего рака простаты является определение адекватного типа гормональной блокады и оптимальных сроков такого лечения.
Максимальная андрогенная блокада (МАБ) означает простую схему лечения:
а) медикаментозная или хирургическая орхиэктомия, блокирующая подавление центральной секреции андрогенов;
б) применение стероидных или нестероидных антиандрогенов (флуцином, касодекс, андрокур), блокирующих периферическую циркуляцию андрогенов.
Для полного удаления андрогенов из организма человека, страдающего метастатическим раком простаты, предлагаются разные обозначения, имеющие одинаковый смысл, — блокада тотальная, комбинированная максимальная. Последняя более всего соответствует истине, поскольку означает, что для целей депривации могут комбинироваться различные по механизму действия средства.
Максимальная андрогенная блокада предусматривает:
• подавление биосинтеза андрогенов (аналоги лютеинизирующего рилизинг-гормона (ЛГРГ));
• упреждение связывания андрогенов с их рецепторами в ткани предстательной железы (андрокур).
Варианты максимальной андрогенной блокады:
а) орхиэктомия + антиандрогены;
б) антиандрогены + эстрогены;
в) аналоги ЛГРГ + антиандрогены.
Гормональная монотерапия в большинстве стран мало используется у пациентов с распространенным или метастатическим раком простаты.
В этом контексте максимальная блокада андрогенами становится необходимой в:
• проводимой неоадъювантной терапии;
• обнаружении лимфогенных метастазов, в том числе и при микрометастазах;
• адъювантных ситуациях, когда есть угроза рецидива заболевания.
Концепция МАБ означает устранение андрогенов как тестикулярной, так и адренальной природы, и является более эффективным эндокринным лечением рака простаты, чем удаление только тестикулярных андрогенов.
Максимальная андрогенная блокада означает воздействие на центральную ингибицию андрогенной продукции (т.е. медикаментозную — аналоги лютеинизирующего рилизинг-гормона или хирургическую кастрацию) и периферическую блокаду циркулирующих андрогенов (т.е. флуцином, бикалутамид, ципротерона ацетат) (рис. 98).

Рис. 98. Принцип максимальной андрогенной блокады. Аналоги ЛГРГ ингибируют гипофизарную секрецию ЛГ, чем редуцируется яичковая секреция андрогенов. Антиандрогенами блокируется периферическая секреция тестостерона за счет их воздействия на андрогенные рецепторы
Несмотря на 5 %-ный объем адренальных андрогенов, они имеют потенциал для стимуляции роста раковых клеток. Более того, доказано, что, внутриклеточный дигидротестостерон в простатических клетках уменьшается только на 50 % после орхиэктомии (J. Geller et al., 1978).
Главный источник адренальных андрогенов, которые стимулируют простатические клетки, обязательно образуется в результате конверсии адренальных андрогенов в самой простате. По данным J. Geller и J.D. Albert (1984), около 40 % внутриклеточных андрогенов в простатических раковых клетках имеют надпочечниковое происхождение и 60% — принадлежит продукции яичек.
F. Labrie et al. (1983) опубликовали результаты первичного комбинированного подавления продукции андрогенов, используя нестероидный антиандроген флутамид в сочетании с аналогами лютеинизирующего рилизинг-гормона. Авторы сообщили о двухлетнем выживании 83% больных с костными метастазами. Результаты намного лучше тех, что были получены в предыдущих исследованиях.
Выживание и качество жизни — главная цель лечения. Важно учитывать побочные эффекты и их влияние на каждую группу больных для того, чтобы выбрать оптимальный метод. На основании нашего опыта можем подтвердить, что пациенты с метастатическим раком простаты живут значительно дольше, менее страдают мучительными болями, когда в их лечении используется максимальная андрогенная блокада, в сравнении с проведенной только одной кастрацией.
Большинство антиандрогенов воздействуют на центральные механизмы регуляции гормонального баланса. Их можно представить следующим образом. Пролиферация опухолевых клеток зависит от сочетанного действия андрогенов, которые синтезируются в яичках (95%) и коре надпочечника (5%). Их биосинтез стимулирует гормон передней доли гипофиза — лютеинизирующий гормон рилизинг-гормона.
В этой связи возникает естественное стремление прервать патологическую цепь путем синтеза и использования агонистов ЛГРГ для снижения или полного подавления концентрации тестостерона в крови. Главный удар направлен на десенсибилизацию гипофизарных рецепторов гонадотропин-рилизинг-гормона. Среди препаратов данного ряда выделяется своей эффективностью золадекс (гозе-релин), представляющий синтетический аналог природного лютеинизирующего рилизинг-гормона.
Основной механизм действия антиандрогенов состоит в блокировании андрогенных рецепторов, которые недосягаемы для естественных андрогенов, и клетки предстательной железы лишаются необходимой стимуляции роста. Отсюда вырисовывается и основное свойство антиандрогенов, а именно: торможение клеточного метаболизма циркулирующих андрогенов.
Весьма существенным является лечение осложнений распространенного рака предстательной железы. J.A. Smith et: al. (1999) предлагают схему лечения осложнений распространенного рака предстательной железы (табл. 16).
Таблица 16. Общая симптом-обусловленная лечебная стратегия распространенного рака простаты

Эстрогенотерапия
Синтетические эстрогены, независимо от новых возможностей эндокринной терапии распространенного рака простаты, занимают свою нишу в гормонотерапии второй линии лечения данной патологии.
Для лечения рака простаты антигонадотропное действие эстрогенов применяется со времен Ch. Haggins (1941). За последние два десятилетия многие клинические исследования подтвердили ценность этого противоопухолевого лечения. Клинически и экспериментально доказано, что эстрогенотерапия по сравнению с кастрацией имеет преимущества в отношении непосредственной эффективности, что, вероятно, связано с прямым воздействием на опухоль, а также стимуляцией апоптоза (M. Landstrom et al., 1996).
Если говорить о механизме действия эстрогенов, предполагается (R.L. Сох, Е.D. Crawford, 1995), что они увеличивают синтез половых гормонов, связывающих глобулин, понижают уровни адренальных андрогенов предположительно путем изменения печеночной функции, ингибиции 5а-редуктазы супрессии дедифференциации, непосредственного действия на функционирование клеток Лейдига и обладают возможным цитотоксическим эффектом.
Ввиду того, что эстрогены сопровождаются осложнениями, рутинная эстрогенотерапия как первая линия лечения распространенного рака простаты в некоторых странах практически не используется. Ведущая терапевтическая роль эстрогенов подверглась сомнению урологов тогда, когда в первых исследованиях было показано, что при лечении диэтилстильбэстролом в дозе 5 мг в день отмечалась высокая смертность пациентов (36%) от кардиоваскулярных осложнений. На этом этапе возник интерес к поиску новых средств, обладающих меньшей токсичностью, вследствие чего появились антиандрогены и аналоги лютеинизирующего рилизинг-гормона.
Этим объясняется, что в Англии ЦПА применяется для долгосрочного лечения и только тогда, когда другие терапевтические средства оказываются неэффективными. Кроме того, учитывая расходы на лечение, необходимо заметить, что большая часть лекарств (ЛГРГ, антиандрогены) дороже, чем эстрогены, и прежде всего, когда их применяют в комбинированной терапии.
В физиологических концентрациях эстрогены не оказывают непосредственного действия на клетки рака простаты.
Первичный эффект эстрогенов при лечении рака простаты основан на их системном действии, а именно:
1) они способны тормозить продукцию лютеинизирующего гормона (ЛГ) по механизму отрицательной обратной связи и таким образом снижать продукцию тестостерона в яичках;
2) in vitro доказан непосредственный ингибирующий эффект эстрогенов на высвобождение тестостерона из клеток Лейдига яичек;
3) оральные эстрогены вызывают повышение уровня глобулина, связывающего половой гормон в крови, что приводит к снижению биологически активного тестостерона в сыворотке крови;
4) обладают некоторым ингибирующим действием на адренальный стероидогенез;
5) оральные эстрогены подавляют клеточный и опухольассоциированный иммунитет;
6) эстрогены вызывают повышение в сыворотке крови уровня гормона роста;
7) индуцируют увеличение уровня пролактина, который потенцирует биологическое действие андрогенов на рост предстательной железы.
Прямое цитотоксическое воздействие эстрогенов на клетки рака простаты изучено in vitro и in vivo:
1) эстрогенотерапия рака простаты основывается на способности препаратов эстрогенного действия оказывать влияние на пролиферативную активность эпителиальных клеток предстательной железы. Предполагается, что эстрогены сокращают число клеток рака простаты, в то время как кастрация только сокращает объем опухолевых клеток без каких-либо признаков их гибели. Более того, эстрогены увеличивают объемную плотность опухолевой стромы при сравнении только с одной кастрацией;
2) эстрогены могут оказывать ингибирующее действие также на андрогенонезависимые опухоли;
3) в процессе прямого воздействия па клетки рака простаты эстрогены могут ингибировать активность полимеразы ДНК и 5а-редуктазы;
4) эффективность эстрогенотерапии определяется также блокированием активности изоферментов ЛГ с нарушением анаэробных и аэробных гликолитических процессов в опухоли, в результате чего происходит деструкция клеточных структур рака простаты.
Значение рецепторов эстрогенов в отношении ответа на лечение эстрогенами рака простаты пока не ясно. В последнее время было доказано, что лечение антиэстрогеном тамоксифеном не снижает противоопухолевое действие эстрогена на экспериментальной модели рака простаты.
Прежде всего надо сказать, что эстрогены никто не забывал, а в ряде клиник эндокринное лечение как раз и начинается с назначения эстрогенов. Авторы считают эстрогенотерапию эффективной, а в некоторых случаях и спасением при запущенных формах. Они применили эстрадурин у 62 пациентов, вводя его парентерально. Препарат не оказывал серьезных сердечно-сосудистых побочных эффектов даже при использовании максимальных доз. Эстрадурин вводится в дозе 240 мг парентерально каждые 30 дней на протяжении трех месяцев с последующим переходом на поддерживающую терапию дозировкой 160 мг.
Из природных и синтетических эстрогенов наиболее часто используется диэтилстильбэстрол (ДЭС). Выпускается в форме 3% масляного раствора в ампулах по 1 мл (30 мг) для внутримышечного введения. Высшая суточная доза при лечении рака простаты составляет 60 мг.
Диэтилстильбэстрадиола дипропионат — дипропионовый эфир ДЭС. Относится к препаратам пролонгированного действия. Выпускается 0,1% масляный раствор в ампулах по 1 мл для внутримышечного введения.
Этинилэстрадиол — синтетический эстрогенный препарат, производное стильбена, широко применяемый в скандинавских странах. Активен при пероральном применении благодаря хорошей всасываемости из желудочно-кишечного тракта. По фармакологическим свойствам аналогичен эстрадиолу-17в, но по активности превосходит его в 15 раз, что позволяет достичь лечебного эффекта у больных, трудно поддающихся лечению другими эстрогенными препаратами. В дозе 0,05 мг 2 раза в сутки обеспечивает такое же снижение содержания тестостерона в крови, как и ДЭС в суточной дозе 3 мг. Выпускается в таблетках по 0,00001 г (микрофоллин) или 0,00005 г (микрофоллин-форте).
Препарат назначается в дозе 150 мкг в сутки в сочетании с астралурином — 80-160 мг один раз в месяц. Такая комбинация способствует снижению концентрации тотального тестостерона в сыворотке крови до уровней, обеспечивающих паллиативный эффект в лечении рака простаты.
Синэстрол (гексэстрол) — синтетическое производное стильбена. По силе эстрогенного действия эквивалентен эстрону, но уступает ДЭС. Активен при парентеральном введении и приеме внутрь. Синэстрол хорошо действует на крупно- и мелкоацинарную аденокарциному, солидно-трабекулярный рак с сохраненной железистой структурой, недифференцированный рак, но мало влияет на криброзный и солидно-трабекулярный рак с преобладанием солидных структур. Выпускается в форме 0,1 или 2% масляного раствора в ампулах по 1 мл для внутримышечного или подкожного введения, а также в таблетированной форме по 0,001 г. Для лечения рака простаты применяют 2% раствор синэстрола (20 мг в 1 мл).
В послевоенные годы для лечения рака предстательной железы широко применялись инъекции 2% раствора синэстрола по 2 мл. Ввиду наблюдаемых сердечно-сосудистых осложнений, нередко сопровождавшихся смертельным исходом, а также болевыми ощущениями и гинекомастией, от этого препарата в большинстве клиник отказались. Поэтому вызывает удивление тот факт, что в ряде солидных публикаций отечественных авторов, синэстрол предлагается в качестве первой линии лечения всех видов рака предстательной железы.
По данным Л.М. Гориловского (1994), наблюдение в течение 46,7 месяцев за 280 больными раком предстательной железы (РПЖ), которые получали хонван 5 г и фосфэстрол 6 г на курс лечения путем внутривенного вливания 2-3 раза в год (суммарная средняя доза составила 33 г) показало, что у больных улучшилось качество жизни, летальность составила 30,7 %.
Полиэстрадиола фосфат (эстрадурин) — полимеризованный эстрадиола-17в-фосфат, являющийся пролонгированным эстрогенным препаратом для парентерального введения. Обладает высокой терапевтической активностью, нс вызывает сердечнососудистых осложнений и в 2-3 раза дешевле, чем эстрогены для приема внутрь.
Эстрамустина фосфат (эстрацит) — эстрогеноцитостатик, который в настоящее время применяется при первичной или вторичной резистентности рака простаты. Эстрацит оказывает специфическое гормональное, цитотоксическое и анти метастатическое воздействие на клетки-мишени. Форма выпуска эстрацита — капсулы по 140 мг или 280 мг, в растворе для инъекций — но 150 мг или 300 мг.
Препарат в организме быстро гидролизуется с образованием цитотоксических метаболитов — эстрамустина и эстромустина, обладающих антимитотическим эффектом, а также до эстрогенов эстрадиола и эстрона, которые проявляют антиандрогенное действие, эквивалентное орхиэктомии. Эстрадиол в составе эстрамустина выполняет функцию переносчика алкилирующей части молекулы (азотистого иприта) к предстательной железе.
По сводным литературным данным, наиболее частыми осложнениями от приема оральных эстрогенов являются: осложнения со стороны сердечнососудистой системы (60-70%), гепаторенальная токсичность (80-85%), гинекомастия (49-80%), иммунодепрессия (80-100%), импотенция (97-100%), нарушение свертывающей системы крови (30-40%), куда входят венозные тромбозы (2-8%), перемежающаяся хромота (2%), транзиторная ишемия (2%), флебит (1-7%). Кроме того, отмечаются приливы жара (11-17%), периферические отеки (16-23%), тошнота, рвота (4-16%).
Данные литературы свидетельствуют о высоком проценте летальности при лечении больных раком простаты эстрогенными препаратами, в первую очередь по причине тяжелых сердечно-сосудистых осложнений. Последние при эстрогенотерапии классифицируются по категориям: причинно связанные с ишемической болезнью сердца (ИБС), тромбозы сосудов головного мозга, коронарных и легочных сосудов, тромбоэмболии вен, задержка жидкости в организме, сердечно-сосудистая недостаточность различной выраженности.
По сводной статистике L.О. Madsen et al. (1970), от осложнений эстрогенотерапии умирает больных больше, чем непосредственно от рака простаты. В экспериментальных исследованиях доказано, что введение эстрогенов животным обусловливает их гибель в связи с развитием обширных некрозов сердечной мышцы.
По данным Л.М. Гориловского и соавт. (1992), в результате лечения 105 больных, принимающих эстрогенные препараты, отмечалось учащение приступов стенокардии (77,1%), развивался острый инфаркт миокарда (у 39%), отмечалось нарушение ритма сердца (у 53,2%), обострение гипертонической болезни (в 7,3%). развитие сердечно-сосудистой недостаточности (в 71,5-89,2%). Несмотря на профилактику в лечении развившихся осложнений, 71 из 105 обследованных больных умерли.
Однако ссылки в адрес чрезмерной опасности эстрогенотерапии вызывают ряд возражений, указывающих, на то, что высокая частота сердечно-сосудистых осложнений вполне закономерна для больных этим видом злокачественной опухоли, большинство из которых составляют люди пожилого и старческого возраста, страдающие различными гериатрическими заболеваниями.
В последних работах показано, что парентеральное введение эстрогенов, в отличие от перорального, приводит не только к исчезновению первичного метаболизирования, снижению частоты побочных желудочно-кишечных эффектов, но при нем наблюдаются относительно низкие уровни эстрогенов вследствие их циркуляции в кровотоке, что оказывает минимальный эффект на синтетическую активность печени и тем самым снижает риск сердечно-сосудистых и тромбоэмболических осложнений.
В настоящее время значение парентерального введения эстрогенов широкомасштабно изучается.
Есть сообщения об использовании низких доз ДЭС (0,1 мг/день) в комбинации с ЦПА 100 мг/день. Такое сочетание препаратов, обладающее низкой токсичностью, приводит к быстрому падению содержания тестостерона в сыворотке крови до посткастрационного уровня. Данного метода низкодозной эстроген-антиандроген ной терапии придерживаются ряд отечественных авторов.
Учитывая то обстоятельно, что затормозить секрецию половых гормонов можно более эффективн путем введения эстрогенов не перорально и внутримышечно, как обычно, а эндоликворно, то можно ожидать более высокого эффекта от данного вида гормонотерапии.
Теоретической основой эндоликворной гормональной терапии рака простаты является более высокая чувствительность гипоталамических структур к малым дозам гормона, попадающего в цереброспинальную жидкость после его субокцинитального введения по сравнению с более высокими дозами того же гормона, приносимого с током крови к ядрам гипоталамуса после орального или внутримышечного введения и оказывающего, помимо основного положительного эффекта (снижение уровня андрогенов), отрицательное побочное влияние.
Результаты наших исследований (А.С. Переверзев и соавт., 1997) показали преимущества комбинированного подавления андрогенного действия эстразином. Так, через месяц после начала лечения частичная регрессия процесса отмечена у 16,7 % больных, стабилизация — у 83,3%, а после монотерапии эстразином стабилизация — у 75%, прогрессирование заболевания — у 25%. Через три месяца в первой группе те же показатели составляли соответственно 50 и 30%, во второй значительно ухудшались.
И все-таки мнимый «ренессанса, связанный с попытками активного применения эстрогенов для лечения метастатического рака простаты, можно образно сравнить с призрачным рассветом, поскольку эффективность эстрогенов минимальна, несмотря на их низкую стоимость.
Читайте также:

