Есть ли у раковой опухоли полость
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
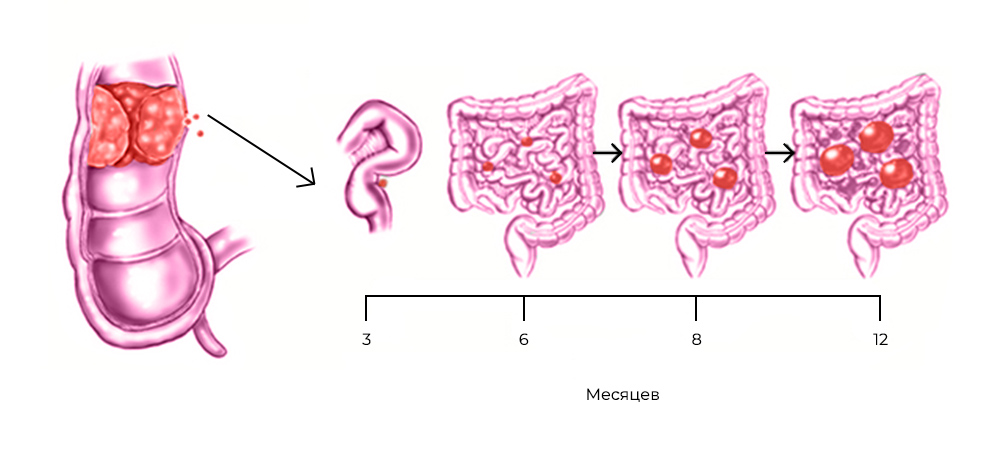
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
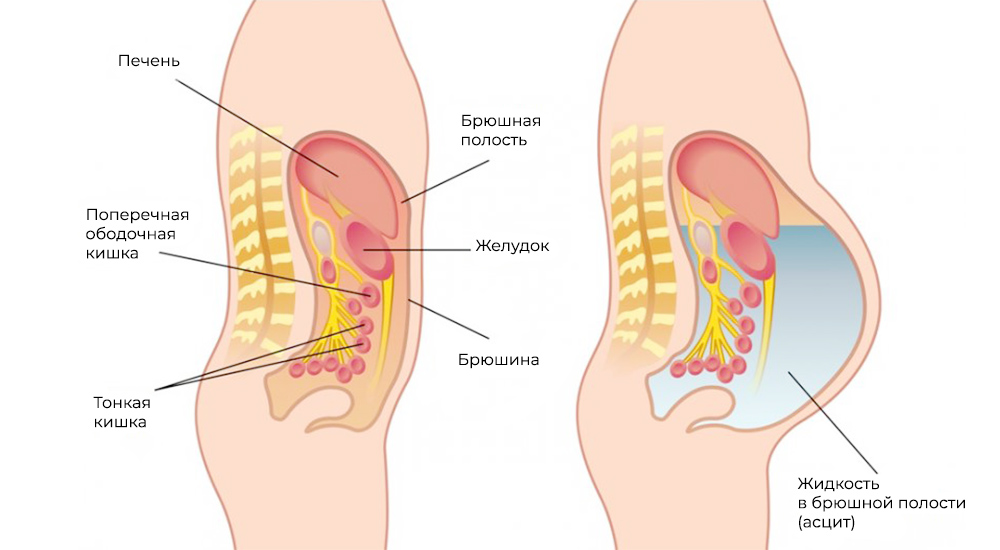
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
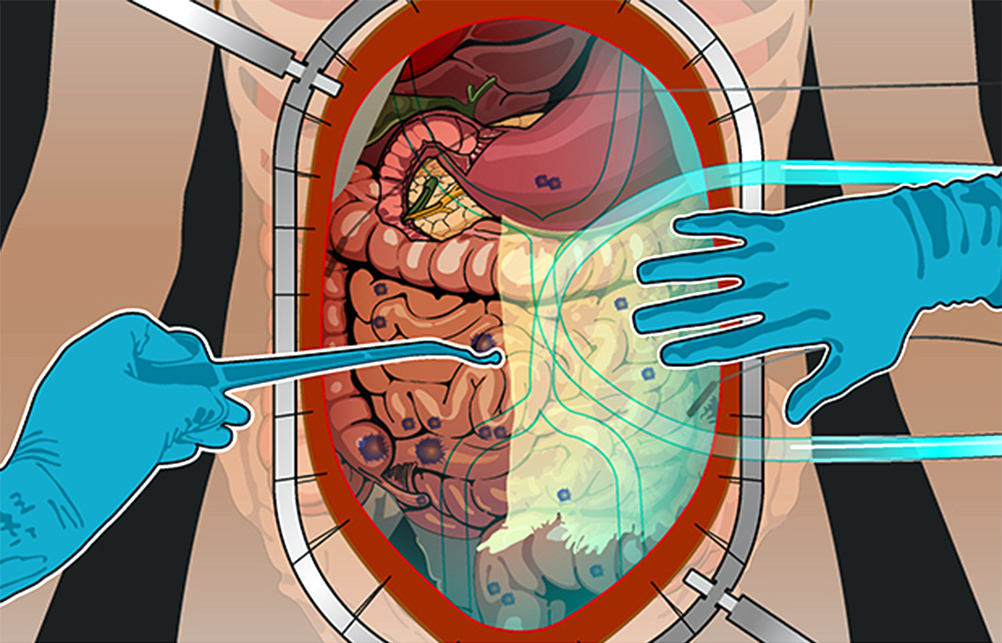
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
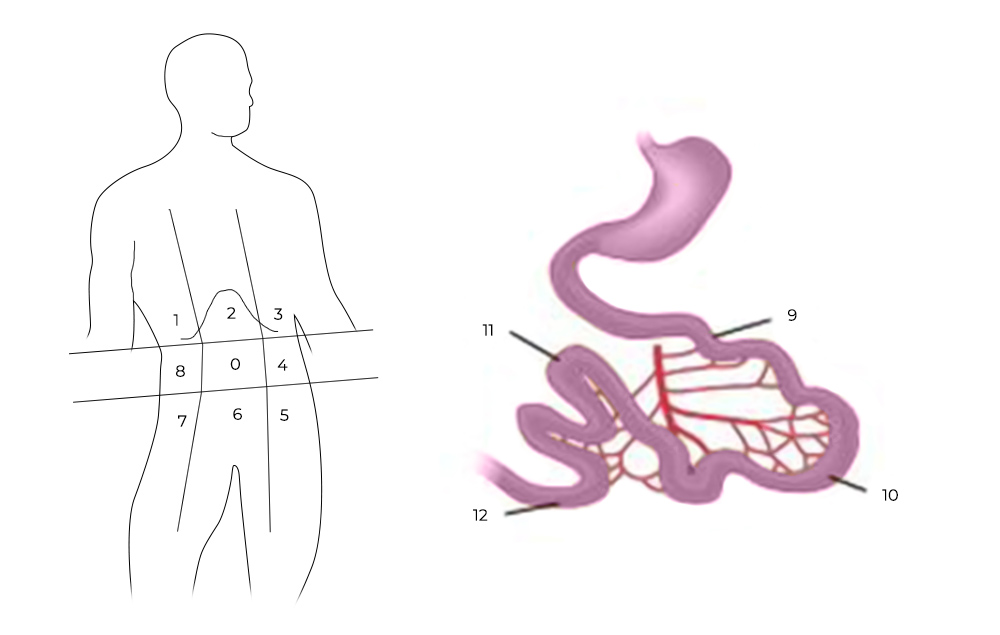
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
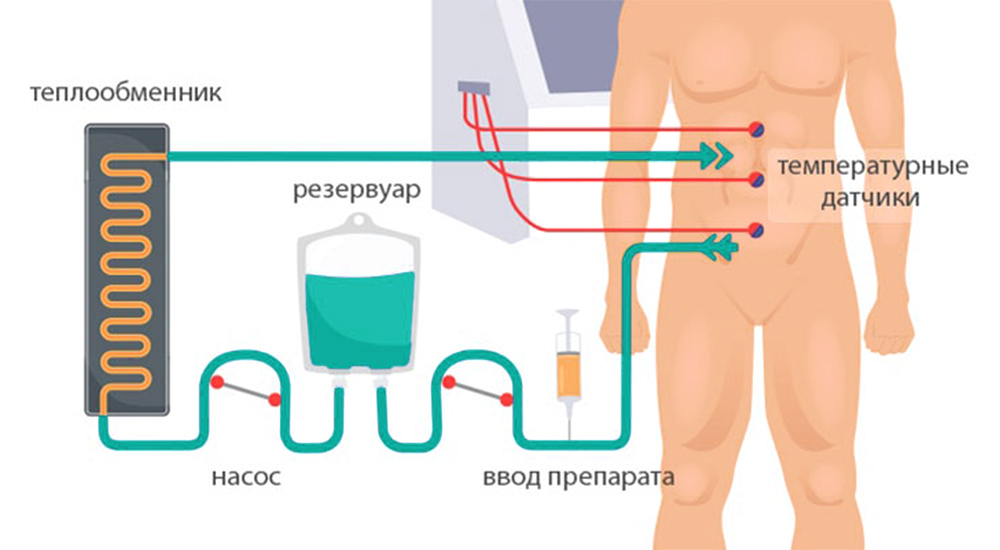
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.
- Брюшная полость и брюшина — что это такое?
- Виды рака брюшной полости
- Симптомы
- Осложнения
- Диагностика рака брюшной полости
- Лечение
- Прогноз и профилактика
Брюшная полость и брюшина — что это такое?
Брюшная полость — это пространство в животе, заполненное кишечником и другими внутренними органами. Сверху она ограничена диафрагмой, снизу — тазом, по бокам и спереди — мышцами брюшного пресса, сзади — позвоночником и поясничными мышцами.
Изнутри полость живота выстилает тонкая пленка из соединительной ткани — брюшина. Ее висцеральный листок, покрывает внутренние органы, париетальный — стенки брюшной полости. Между листками брюшины находится замкнутое щелевидное пространство, а в нем — минимальное количество жидкости, выполняющей функцию смазки и обеспечивающей свободное скольжение органов. В некоторых местах брюшина образует складки: брыжейки, на которых подвешены органы, сальники.
Внутренние органы могут быть расположены по отношению к брюшине по-разному:
- Интраперитонеально — покрыты брюшиной со всех сторон.
- Мезоперитонеально — покрыты частично.
- Ретроперитонеально (забрюшинно) — покрыты только с одной стороны.
Виды рака брюшной полости
Первичные опухоли брюшной полости встречаются редко. Они бывают разных типов: мезотелиальные, эпителиальные, гладкомышечные неопределенные. Особая разновидность злокачественных опухолей брюшины — псевдомиксома. Она развивается из клеток, которые продуцируют большое количество желеобразной жидкости. Чаще всего такие опухоли распространяются на брюшину из аппендикса.
Зачастую первичные злокачественные опухоли брюшной полости имеют строение и ведут себя, как рак яичников. Они вызывают сходные симптомы, и врачи применяют для борьбы с ними примерно одни и те же методы лечения.
Известно, что в целом вероятность развития первичного рака брюшной полости выше у женщин, чем у мужчин. Риски повышаются с возрастом. Есть связь между вероятностью развития заболевания и изменениями в генах BRCA1, BRCA2.
При разных типах рака на поздних стадиях опухолевые клетки отделяются от первичного новообразования, распространяются по организму и образуют новые очаги в различных органах, в том числе в брюшной полости. Этот процесс называется метастазированием. Чаще всего в брюшину метастазирует рак толстой и прямой кишки (в 15% случаев), желудка (в 50% случаев), яичника (в 60% случаев), поджелудочной железы. Иногда метастазы распространяются из органов, которые находятся за пределами брюшной полости: молочной железы, плевры (пленки из соединительной ткани, покрывающей легкие и выстилающей стенки грудной полости), легкого.

Симптомы
Зачастую в течение длительного времени симптомы при раке брюшной полости отсутствуют, поэтому нередко его диагностируют на поздних стадиях. Проявления патологии неспецифичны, их можно легко принять за признаки других заболеваний:
- Дискомфорт, спазмы, вздутие живота.
- Повышенное газообразование в кишечнике.
- Жидкий стул.
- Запоры.
- Тошнота.
- Снижение аппетита.
- Частые мочеиспускания.
- Одышка.
- Быстрый набор или потеря массы.
- Кровотечения из прямой кишки, у женщин — из влагалища.
Если канцероматоз брюшины возник в результате метастазирования злокачественной опухоли из другого органа, сильно ухудшается прогноз. Противоопухолевая терапия начинает работать хуже, потому что многие препараты плохо проникают через брюшину.
Осложнения
Главное осложнение данного заболевания — асцит. Этим термином называют состояние, при котором в животе скапливается жидкость. В норме между листками брюшины ежедневно вырабатывается и всасывается около 1,5 жидкости. При канцероматозе нарушается отток лимфы, и жидкость всасывается хуже. Она начинает скапливаться внутри живота.
Пока жидкости немного, больной не испытывает каких-либо симптомов. Затем начинают беспокоить тяжесть, тупые боли в нижней части живота. Затрудняется дыхание, возникает одышка. Из-за того что жидкость сдавливает органы, больной жалуется на отрыжку, тошноту, проблемы со стулом и мочеиспусканием. Живот увеличивается в размерах, может возникать пупочная грыжа. При выраженном асците развивается сердечная недостаточность, отеки.
Диагностика рака брюшной полости
Злокачественную опухоль помогают выявить следующие методы диагностики:
- Ультразвуковое исследование. Зачастую его назначают в первую очередь, как простой, доступный, безопасный и в то же время информативный метод диагностики.
- Компьютерная и магнитно-резонансная томография помогают оценить состояние брюшины и внутренних органов, выявить патологические образования, оценить степень распространения рака.
- ПЭТ-сканирование в настоящее время является золотым стандартом для поиска отдаленных метастазов.
- Биопсия — самый точный метод диагностики злокачественных опухолей. Врач может получить образец опухолевой ткани во время диагностической лапароскопии — процедуры, во время которой через проколы в брюшной стенке в живот вводят миниатюрную видеокамеру и специальные инструменты. Образец отправляют в лабораторию, проводят его гистологическое, цитологическое исследование, молекулярно-генетический анализ. Это помогает не только диагностировать рак, но и установить природу опухолевых клеток, разобраться, какими препаратами с ними лучше бороться.
- Рентгеноконтрастные исследования помогают оценить состояние пищеварительного тракта, выявить опухолевые очаги и другие патологии.
- Анализ на онкомаркер CA-125 (углеводный антиген 125). Уровень этого вещества повышается в крови при раке брюшины и яичников. Но для диагностики этих заболеваний данный анализ недостаточно точен. Как правило, его применяют для контроля течения рака и эффективности лечения.
- Женщины должны пройти осмотр у гинеколога.
Обычно врачи-онкологи устанавливают диагноз на основании таких признаков, как асцит, утолщение брюшины, появление на ней узелков, смещение, сдавление петель кишки, патологические изменения со стороны печени и складок брюшины — сальников.

Лечение
Выбор тактики лечения зависит от локализации, размеров, стадии злокачественной опухоли, количества узлов. Врач также должен учитывать общее состояние больного, его возраст, наличие сопутствующих заболеваний.
Зачастую при поражении брюшины опухолевых очагов очень много, многие из них мелкие, и полностью их удалить невозможно. Хирургическое лечение направлено на удаление как можно большего числа очагов, как правило, оно предшествует химиотерапии. Обычно удаляют матку, яичники, участки кишечника, — словом, всё, что поражено злокачественной опухолью. Если злокачественное новообразование вызывает кишечную непроходимость или другие осложнения, проводят паллиативные хирургические вмешательства.
Для того чтобы уничтожить опухолевые клетки при первичном раке в полости живота, применяют химиопрепараты, зачастую те же, что при раке яичников. Лекарства вводят внутривенно или в брюшную полость — такая химиотерапия называется интраперитонеальной (внутрибрюшинной).
С 2018 года врачи Европейской клиники практикуют инновационный метод лечения канцероматоза брюшины — гипертермическую интраперитонеальную химиотерапию (HIPEC). Суть ее заключается в том, что хирург удаляет все достаточно крупные опухолевые очаги, а затем промывает полость живота подогретым раствором химиопрепарата. Это помогает уничтожить максимальное количество опухолевых клеток и существенно продлить жизнь больного.
При асците наши доктора проводят лапароцентез (прокол в брюшной стенке и выведение жидкости), устанавливают перитонеальные катетеры для постоянного оттока, проводят хирургические вмешательства, которые препятствуют дальнейшему накоплению асцитической жидкости.
На поздних стадиях проводится паллиативное лечение, которое помогает уменьшить симптомы и продлить жизнь больного.

Прогноз и профилактика
Прогноз при первичном раке брюшины напрямую зависит от того, удалось ли удалить все опухолевые очаги во время хирургического вмешательства. К сожалению, зачастую заболевание диагностируют на поздней стадии, поэтому после лечения часто развиваются рецидивы. Обычно пациентам требуется более одного хирургического вмешательства, курса химиотерапии.
Канцероматоз брюшины при метастазах других типов рака резко ухудшает прогноз. Обычно продолжительность жизни таких больных измеряется месяцами. Но HIPEC может ее существенно продлить, до нескольких лет — в случае, если проведение такого лечения возможно у конкретного пациента.
Специальных мер профилактики данного заболевания не существует. Нужно в целом вести здоровый образ жизни, женщинам — регулярно проходить осмотры у гинеколога. Мера профилактики метастазов в брюшину — своевременная диагностика и лечение злокачественных опухолей.
Раковая опухоль является чрезвычайно сложным заболеванием. Чтобы понять процесс образования и развития раковых опухолей, сначала необходимо разобраться, как функционируют клетки нашего тела. Проще говоря, рак является заболеванием, вызванным неконтролируемым размножением клеток.
Образование и развитие раковых опухолей
Большинство клеток, ставшими непригодными для дальнейшего функционирования, просто отмирает, и затем их остатки удаляются при помощи специальных клеточных механизмов. Этот нормальный процесс отмирания клеток и удаления их остатков, называемый апоптозом, постоянно осуществляется в организме.
Если клетка подвергается мутации, то определенные соединения, ответственные за проверку сохранности ДНК, могут активировать апоптоз. За счет этого защитного механизма организм избавляется от сбойных и аномальных клеток. Проблема в том, что некоторые мутировавшие клетки могут терять способность к апоптозу, что может приводить к развитию рака. Отталкиваясь от этого, медики стремятся разработать препараты, активизирующие механизмы апоптоза в таких сбойных клетках и тем самым препятствующие образованию раковых опухолей.
Раковые клетки, в отличие от здоровых, делятся неконтролируемо, им больше не контролируют внутренние и внешние клеточные механизмы, управляющие этим процессом в норме. Независимо от того, каким образом клетка стала злокачественной, в основе ее раковой природы лежит ее неконтролируемое деление. К счастью, множество механизмов служит для предотвращения трансформации клетки в злокачественную форму. Для образования раковой опухоли требуется сбой сразу нескольких механизмов (сбой механизма контроля деления, нарушение клеточного цикла, развитие способности проникать в окружающие ткани и метастазировать в другие части тела).
Для того чтобы клетка стала раковой, требуются многочисленные мутации в геноме. В ходе развития раковой опухоли отмечается появление способности раковых клеток распространяться внутри нормальной ткани, в которой они изначально возникли. Также у них может появиться способность метастазировать. Наиболее часто образование метастаз отмечается в лимфатических узлах, легких, печени, костной ткани и мозге. В последнем случае наблюдаются раковые опухоли мозга.
Потеря клеткой способности к контролю собственного деления может происходить не только по причине сбоев в ходе митоза. Клетки могут содержать онковирусы, которые зачастую вредоносно влияют на функционирование клеточных белков. Это может приводить к нарушению механизмов митоза. Женщины, зараженные ВПЧ, характеризуется повышенным риском развития раковой опухоли матки, так как этот вирус противодействуют нормальному функционированию клеток данного органа.
Раковая клетка характеризуется сложным окружением в виде других клеток и тканей. Специфика раковых клеток накладывает отпечаток на их взаимодействие с окружающими тканями. Например, при раковой опухоли молочной железы они соседствуют с нормальными клетками различных типов (соединительные, железистые и т.д.). Однако при раковой опухоли груди здоровые клетки характеризуются намного большей уязвимостью по сравнению с раковыми. В частности, раковые клетки не отмирают в отличие от нормальных при потере контакта с базальной мембраной молочной железы, то есть они более жизнестойки.
Проблема осложняется тем, что воспалительные процессы в тканях порой создают благоприятные условия для развития и образования раковых опухолей. Этот механизм зачастую используются в лечении раковых опухолей и их профилактике. Например, химиопрофилактика, снижая воспалительный процесс в целевой ткани, уменьшает риска развития раковой опухоли желудка, толстого кишечника и других онкологических заболеваний.
Симптомы раковых опухолей
Невозможно привести полный перечень признаков и симптомов, указывающих на наличие раковой опухоли. Это обусловлено тем, что существует более 200 различных типов рака, поражающих разнообразные органы и системы организма, что приводит к чрезвычайно широкому спектру проявлений этого заболевания. В случае наличия подозрения на рак следует безотлагательно обратиться к врачу, ведь раковые заболевания эффективнее лечить на ранних стадиях. Ниже приведены некоторые примеры, которые в случае присутствия у пациента на протяжении более 2 недель, могут свидетельствовать о вероятности раковой опухоли:
- изменения ритма опорожнения мочевого пузыря и кишечника;
- наличие незаживающих язв в ротовой полости или на коже;
- присутствие любой формы необычного кровотечения или выделения из вагины, заднего прохода, мочевого пузыря или молочных желез;
- уплотнение или образование сгустко в в молочных железах, в семенниках или других частях тела;
- расстройство пищеварения или проблемы с глотанием;
- различимые изменения в размерах , форме и окраске родинок и бородавок;
- непрекращающийся кашель , осиплость или потеря голоса.
Диагностика раковых опухолей
При обнаружении опухолевидных структур требуется уточнение их природы, являются ли они злокачественными или доброкачественными. Для этого может использоваться биопсия, а также различные инструментальные и биохимические методы исследования. В случае обнаружения злокачественной природы опухоли могут быть назначены дополнительные виды диагностики раковых опухолей.
Именование определенного типа рака осуществляется на основании органа его исходной локализации. Даже если рак пускает метастазы в другие части тела, название не меняется. Например, при раковой опухоли груди говорят именно о раке груди, даже если метастазы обнаруживаются в легких. Рак простаты, распространившийся в костную ткань, называется метастатическим раком простаты.
К другим, широко распространенным типам рака относится карцинома, саркома и лимфома. Названия этих типов рака также соответствуют их начальной локализации в организме. Карцинома является общим термином для опухолей, возникших в эпителиальных тканях, например, в коже или слизистой таких органов, как матка и легкие. То есть сказать, что у женщины имеется раковая опухоль матки, это то же самое, как если заявить, что у нее карцинома матки. Аналогично, раковая опухоль желудка может именоваться карциномой желудка.
Опухоли, возникающие в соединительной ткани, например, в мышечной или костной, называются саркомами. Первичные раковые опухоли мозга называются глиомами, а злокачественные образования, возникшие в лимфатической системе — лимфомами. Опухоли, локализующиеся в костном мозге, называются лейкемиями.
Одной из причин, по которым доктора рекомендуют проходить плановые медицинские проверки, заключается в возможности обнаружения опухолевидных структур на ранних стадиях. Регулярный скрининг позволяет повысить выявление раковых опухолей на ранних стадиях заболевания. Раковая опухоль, будучи выявлена на ранних стадиях заболевания, обычно легче поддается лечению.
Если в ходе стандартного медицинского осмотра у доктора возникают подозрения, что он обнаружил раковую опухоль, то он может назначить цервикальный мазок (для выявления раковой опухоли матки), маммограмму (в целях диагностики раковой опухоли груди) и другие виды анализов. Для оценки рисков развития рака простаты может быть назначен анализ крови, а для диагностики раковых опухолей легких применяется спиральное КТ-сканирование.
Возраст человека, семейный анамнез и характер профессиональной деятельности могут в значительной степени определять рекомендуемую частоту плановых медицинских освидетельствований для диагностики раковых опухолей. В случае отклонения результатов диагностики от нормы требуется их внимательное изучение и назначение уточняющих видов обследования.
Например, результаты цервикального мазка могут указывать на присутствие в шейке матки аномальных клеток. Гинекологические исследования показывают, что со временем эти клетки могут привести к раковой опухоли шейки матки, однако это происходит не всегда. В таких случаях гинеколог может порекомендовать более частую сдачу цервикальных мазков в целях отслеживания ситуации и заблаговременной диагностики. В некоторых случаях цервикальный мазок может выявить раковые клетки на шейке матки. После этого обычно назначаются анализы для стадирования раковой опухоли или биопсия.
Некоторые люди обращаются к врачу при наличии определенных симптомов, говорящих о риске образования раковой опухоли (уплотнение в груди, изменения цвета или размера родинки, сильные головные боли и т. д.). В случае, когда доктор посчитает, что такие симптомы могут быть вызваны образованием раковых опухолей, может быть назначена биопсия — процедура, используемая для диагностики раковых опухолей. Если биопсия покажет наличие раковых клеток во взятом образце, то затем проводится стадирование раковой опухоли. Стадирование заключается в уточнении расположения раковой опухоли, ее стадии и влияния на организм. Следует отметить три важных момента, касающиеся диагностики:
- не для всех типов раковых опухолей разработаны качественные методы скрининга;
- даже при качественном скрининге при некоторых типах раковых опухолей ранняя диагностика не всегда успешна;
- патологические изменения, выявленные в ходе скрининговой диагностики, не всегда относятся к раковым опухолям.
Клиническая стадия раковой опухоли устанавливается на основании медицинского освидетельствования, анализов крови и инструментальных методов обследования. Эти меры необходимы для диагностики стадии заболевания, выработки подходящего лечения раковой опухоли и выдачи прогноза. В некоторых случаях для корректной диагностики может потребоваться проведение биопсии. Список, приведенный ниже, указывает на некоторые особенности проведения диагностики раковых опухолей:
- Подозрительные припухлости или аномальные участки могут быть полностью изъяты в ходе биопсии (например, определенный лимфатический узел или язва на коже).
- Биопсия может включать взятие образцы клеток из глубоко расположенной опухлости (например, при подозрении на раковую опухоль в молочной железе).
- Иногда в целях диагностики используется эндоскоп, для забора небольшого фрагмента ткани из определенного органа. Например, при подозрении на раковую опухоль желудка может применяться гастроскоп, вводимый в полость этого органа с целью взятие образца ткани.
- При подозрении на лейкемию забор клеток производится из костного мозга.
- В диагностике раковых опухолей иногда применяется анализ образцов мочи или мокроты на присутствие в них раковых клеток.
Биохимическая структура, характеризующая определенное заболевание или эффективность его лечения, называются биомаркером. Простатспецифический антиген является биомаркером на присутствие рака простаты. Если после проведения антиангиогенной терапии в образцах пациента выявляется снижение биомаркера VEGF, то обычно это свидетельствует об эффективности лечения раковой опухоли.
Различные виды анализов крови позволяют выявить присутствие в ней определенных биомаркеров, активно синтезируемых раковыми клетками. В норме маркеры присутствуют в крови в незначительном количестве. Увеличение концентрации определенного маркера может говорить об образовании раковых опухолей определенного типа. Анализы на биомаркеры также применяются в процессе лечения раковых опухолей, чтобы определить эффективность применяемой терапии. Ученые постоянно ведут исследования с целью выявления новых биомаркеров. Ниже приведён перечень аббревиатур некоторых наиболее распространенных онкомаркеров и некоторые примеры соответствующих им форм рака:
- CEA — раковая опухоль в молочной железе, раковая опухоль желудка;
- CA 19-9 — раковая опухоль желудка;
- AFP и beta-HCG — герминогенные опухоли;
- OC-125 — карцинома яичника;
- PSA — рак простаты.
Заключение
Рак является сложным заболеванием, принимающим множественные формы. Большое значение имеет своевременное выявления раковых опухолей на ранних стадиях. Для выработки окончательного формата лечения необходимо проведение всего комплекса обследований для обеспечения адекватной диагностики этого заболевания.
Читайте также:

