Эмболизация маточных артерий при раке шейки матки как делать

Эмболизация — малоинвазивная процедура, которая может дополнять хирургическое лечение или использоваться самостоятельно. Хирург через прокол в бедренной артерии проводит специальный катетер в артерии, непосредственно питающие опухоль и через него закрывает их специальными частицами — эмболами, которые перекрывают кровоток. В ряде случаев используют эмболы, способные выделять химиопрепарат в ткань опухоли — такое вмешательство называется химиоэмболизация.
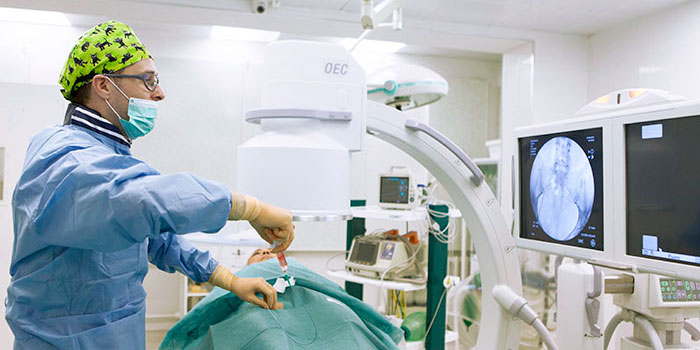
Эмболизация применяется для лечения многих заболеваний. С начала XXI века эта процедура получает все более широкое применение и в онкологии, в первую очередь из-за своей эффективности и малоинвазивности — эмболизации безболезненны, не требуют наркоза, инструмент вводится через пункцию артерии, т. е. нет никакой операционной раны.
Эмболизация у онкологических пациентов
Эмболизация артерий для лечения опухолей и их метастазов помогает решить следующие задачи:
- в качестве самостоятельного метода лечения — эмболизация (чаще всего в варианте химиоэмболизации) может приводить к ишемии ткани опухоли и ее гибели. Для некоторых заболеваний, например, ряд опухолей печени, этот лечения может приводить к полной ремиссии без хирургического лечения.
- в сочетании с хирургическим лечением эмболизация используется как вспомогательная технология — чаще всего для уменьшения кровотечения во время операции за счет деваскуляризации (обескровливания) новообразования;
- в ряде случаев эмболизация, выполненная перед операцией, дает возможность проведения более радикальной операции за счет предварительного уменьшения опухоли;
- эмболизация также может применяться для борьбы с симптомами и осложнениями онкологических заболеваний — это в первую очередь остановка опасных кровотечений, которые угрожают жизни пациента, кроме того — облегчение боли, вызванной злокачественным новообразованием; еще одним эффектом является уменьшение объема и замедление роста опухоли.
Виды эмболизации артерий у онкологических больных:
- предоперационная — выполняется в качестве первого этапа хирургического вмешательства;
- в качестве самостоятельного метода лечения — чаще всего при опухолях печени, почек и ряде других опухолей
- в качестве паллиативного метода лечения — для остановки кровотечений, уменьшения болевого синдрома, уменьшения объемов и темпа роста опухоли.
Как проводится эмболизация артерий?
Эмболизация выполняется врачами-рентгенохирургами в специально оборудованной ангиографической операционной. Перед эмболизацией всегда проводят ангиографию. В сосуды вводят рентгенконтрастное вещество, в ходе чего записывают рентгеновское изображение в цифровом видеоформате. Это помогает врачу оценить расположение и анатомию сосудов, определить, из каких артерий осуществляется кровоснабжение опухоли.
Чаще всего эмболизацию выполняют под местной анестезией. В редких случаях приходится использовать общую анестезию (наркоз). За 4–5 часов до процедуры пациента просят ограничить прием пищи, иногда дают успокоительные препараты.
В большинстве случаев доступ к нужному сосуду получают через бедренную артерию, это самый типичный доступ для всех ангиографических исследований и вмешательств, но могут использовать и другие артерии в других местах (лучевую на запястье, плечевую в области локтевого сгиба и т. п.). Врач обрабатывает кожу антисептиком и делает небольшой прокол, вводит в артерию специальный катетер размером не более 1,5 мм и продвигает его до тех пор, пока не достигнет нужного сосуда. Через катетер в сосуд вводят эмболы, которые перекрывают его просвет.
Существуют разные виды эмболов:
- Поливинилалкоголь (PVA) представляет собой частицы размером от 50 до 1000 мкм. Это относительно недорогой и простой в применении препарат, однако, в настоящее время он считается устаревшим. Сейчас чаще всего применяют сферические эмболы, например, Bead Block и Embozene.
- Спирали из платины и нержавеющей стали. После установки в просвете сосуда на них быстро образуется тромб, который перекрывает кровоток. Иногда такие спирали применяют вместе с желатиновыми губками: сначала устанавливают спираль, а затем через катетер вводят губку — ее частички оседают между витками. Их применяют только для остановки кровотечений, обусловленных опухолями.
- Химиоэмболизация — введение в просвет сосуда эмболов, содержащих химиопрепарат. Таким образом, с одной стороны происходит закупорка сосудов, кровоснабжающих опухоль, а с другой химиопрепарат поступает непосредственно в ткань опухоли и не оказывает побочные эффекты, которые возникают при его введении в вену. При этом в самой опухоли создаются очень высокие концентрации препарата, невозможные при обычном введении. Мы применяем самые современные препараты для химиоэмболизации: DC Beads (Terumo, Япония) и Hepaspheres (Merit Medical, США)., которые высвобождают химиопрепарат в течение длительного времени, в стабильной дозировке.
- Радиоэмболизация — введение эмболов, содержащих радиоактивные изотопы. Эта процедура еще называется внутренней лучевой терапией, так как в опухоль изнутри вводят дозу радиации, разрушающей ее клетки. Для этого обычно используют изотоп Иттрий-90.
К эмболизации артерий наиболее часто прибегают при следующих онкологических заболеваниях:
- В качестве самостоятельного метода лечения: Первичные и метастатические опухоли печени, почек, легких и других локализаций.
- В комбинации с хирургическими методами: Первичные и метастатические опухоли печени, почек, легких, костей, позвоночника, матки, простаты, мочевого пузыря и т. д.
- Для остановки кровотечений при опухолях: малого таза, легких, прямой кишки, толстой кишки, печени, матки, простаты, опухолях головы и шеи. Т. е. практически при любой локализации с целью прекращения кровотечения.
Эмболизация также широко применяется для лечения заболеваний, не связанных с онкологией:
- Миома матки. Эмболизация маточных артерий — наименее травматичный способ лечения миомы матки, обладающий высокой эффективностью — около 98,5% женщин, перенесших эту процедуру, не нуждаются в дополнительном лечении.
- Аденома простаты. Эмболизация - эффективный, малоинвазивный способ лечения аденомы предстательной железы, который сегодня становится все более распространен в развитых странах.
- Варикоцеле — наименее инвазивная альтернатива хирургическому лечению, выполняется амбулаторно за 20–30 минут.
- Сосудистые мальформации различной локализации.
- Аневризмы — в первую очередь аневризмы головного мозга, способные вызвать геморрагический инсульт.
Насколько безопасна эмболизация?
Цель эмболизации в онкологии — не только прекратить приток крови к патологическому очагу, но и сохранить при этом кровообращение в соседних здоровых тканях. Современная техника эмболизации с использованием микрокатетеров позволяет обеспечить необходимую точность эмболизации.
Для того чтобы обеспечить точность в ходе эмболизации всегда проводят ангиографию. Врач внимательно изучает сосудистую сеть, кровоснабжение опухоли и определяет, в какой сосуд должны быть введены эмболы. Эмболы вводятся только после детального изучения сосудистой анатомии опухоли в ходе вмешательства. Перед эмболизацией вам также могут назначить УЗИ, КТ, МРТ и другие исследования.
Существует ряд противопоказаний к проведению эмболизации, но все они являются относительными, то есть процедура, как правило, все же может быть проведена при соблюдении некоторых условий. Например, у пациента с нарушением функции почек должно быть нормализовано артериальное давление, водно-солевой баланс, а во время ангиографии нужно использовать минимальное количество контрастного вещества.
В Европейской клинике с каждым пациентом работают индивидуально. Врач оценивает общее состояние больного, учитывает сопутствующие заболевания, размеры и расположение опухоли, особенности ее кровоснабжения.
Врачи-специалисты Европейской клиники имеют огромный опыт проведения эмболизации артерий при различных видах опухолей. Мы используем значительный собственный и опыт коллег из ведущих зарубежных клиник. Некоторые процедуры, которые мы предлагаем пациентам в Европейской клинике (например, эмболизация при аденоме простаты), даже в Европе, США и Израиле являются прерогативой крупных университетских клиник из-за необходимости иметь хирургов самого высокого уровня.
Нашими врачами были выполнены первые в России эмболизации миомы матки, артерий простаты, мы первыми стали работать с самыми современными препаратами для эмболизации — Bead Block, Embozene, DC Bead и др.

Известно, что рак шейки матки (РШМ) - одна из наиболее часто встречающихся опухолей женских половых органов, занимающая ведущее положение среди злокачественных новообразований у женщин. По данным ВОЗ, ежегодно в мире выявляется более 500 000 первично заболевших РШМ [30, 41]. При этом 75 % из них приходится на развивающиеся страны Африки, Латинской Америки и Азии, и 25 % - на экономически развитые страны Европы и Северной Америки.
В последние годы в экономически развитых странах наметилась стойкая тенденция к снижению заболеваемости РШМ. Так, в США за последние годы заболеваемость РШМ снизилась на 25 % и занимает теперь 7 место в структуре онкологической заболеваемости женщин [30, 41, 46]. В России заболеваемость РШМ также снизилась до 5,4 %, занимая 2 место среди онкогинекологических заболеваний [2, 4, 7, 30].
Максимальный уровень заболеваемости РШМ зафиксирован в группе женщин 45-55 лет. Вместе с тем анализ возрастных показателей заболеваемости указывает на увеличение числа больных в младших возрастных группах [30, 32]. Особенно заметное повышение заболеваемости РШМ определяется у женщин в возрасте до 29 лет - ежегодный прирост в России составляет 2,1 % [7]. Аналогичная тенденция к увеличению заболеваемости у женщин репродуктивного периода отмечается и в других странах. Так, в США на 2002 г., по данным Американского онкологического общества, 47 % больных РШМ - женщины в возрасте до 35 лет [37]. Повышение заболеваемости РШМ среди женщин до 30 лет связывают с акселерацией, более ранним половым созреванием и началом половой жизни [32, 44, 53]. В настоящее время Международное агентство по исследованию рака официально объявило вирус папилломы человека (HPV), передающийся половым путем, 16 и 18 генотипов - канцерогенными факторами, а 31, 33 и 35 - возможными канцерогенами [2, 3, 16, 17, 18].
Основной проблемой при РШМ остается большое число больных с поздними стадиями заболевания, что связано, как правило, с несвоевременным обращением к онкогинекологу и недостаточной организованностью профилактических осмотров [2, 50]. По данным разных авторов, пятилетняя выживаемость при РШМ в начальных стадиях составляет 95 %. Этот показатель снижается до 17-22 % при наличии III-IV стадии заболевания. Основной причиной летальности являются рецидивы рака, развивающиеся у 37-50 % всех пролеченных больных. Поэтому проблема повышения контроля эффективности терапии у больных с поздними стадиями РШМ остается по-прежнему актуальной [2, 3, 4, 8, 9, 10, 19, 20, 21, 50].
В настоящее время основными лечебными методами при РШМ являются хирургический и лучевой, применяемые как отдельно, так и в различных комбинациях [2, 3, 15]. Как правило, несостоятельность сочетанного лучевого лечения РШМ проявляется в виде локально-регионарного рецидива в параметральной клетчатке, тазовых лимфатических узлах и/или как местный рецидив, с наибольшей вероятностью клинической манифестации в первые 2 года после лечения. Объем хирургического вмешательства в запущенных случаях напрямую зависит от распространенности опухолевого процесса.
Лучевая терапия наряду с хирургическим вмешательством всегда считалась наиболее эффективным методом лечения больных местнораспространенным РШМ. Современные технологии радикального лечения начальных инвазивных форм цервикального рака заметно улучшили показатели выживаемости при данной патологии. В настоящее время использование предоперационной брахитерапии позволило улучшить 5-летнюю выживаемость больных РШМ почти на 20 %. Посредством лучевой терапии излечивается 65 % больных I-III стадии [14, 23, 24, 27, 52, 53]. Однако, несмотря на совершенствование лучевой техники, внедрение различных вариантов динамического фракционирования и других методических приемов, среднестатистические цифры выживаемости больных раком шейки матки III стадии не превышают 55 % [6].
В связи с этим основные направления научного поиска в лучевой терапии заключаются в повышении противоопухолевого эффекта на фоне снижения различных форм лучевых осложнений, что определяет качество жизни онкогинекологических больных. С этой целью в радиологии в последние годы находят применение программы радикальной лучевой терапии с использованием различных химических и физических радиомодифицирующих агентов. Для повышения эффективности лечения применяются новые схемы полирадиомодификации с динамической интеграцией химиотерапевтических препаратов в различные этапы курса сочетанной лучевой терапии распространенных форм РШМ [19].
Так как хирургический и лучевой методы являются эффективными в лечении местнораспространенного РШМ, химиотерапия традиционно использовалась для паллиативного лечения при распространенных формах, отдаленных метастазах, рецидивах, когда уже были исчерпаны все возможности хирургического и лучевого методов [13, 22]. Однако в настоящее время в ряде клиник мира ведутся исследования, касающиеся использования химиотерапии как в качестве неоадьювантного (первичного), так и адьювантного метода лечения РШМ. Теоретическими предпосылками к этому являются лучшая доставка лекарств к опухоли сосудами, неповрежденными вследствие лучевой терапии и операции; возможность уменьшения опухоли с целью большей эффективности последующих методов лечения; эрадикация микрометастазов [4, 20]. Многие авторы сходятся во мнении, что для больных с поздними стадиями заболевания перспективным направлением в дальнейшем представляется использование режимов неоадьювантного лекарственного лечения [4, 48, 49, 51, 53].
Уже опубликованные результаты 5 крупных рандомизированных исследований отчетливо продемонстрировали увеличение 3-летней выживаемости на 10 % в группах больных РШМ, получавших химиолучевое лечение по сравнению с режимами монорадиотерапии. Парентеральное использование современных цитостатиков при несомненном ингибирующем действии на рост опухолевых клеток несколько улучшает результаты лечения [32].
Вместе с тем неуклонный рост запущенности РШМ, а также увеличение заболеваемости среди женщин молодого возраста диктуют необходимость разработки новых и совершенствования уже существующих методов хирургического, комбинированного и комплексного лечения больных РШМ [1]. В связи с более молодым возрастом этих больных по сравнению с другими локализациями гинекологического рака, остро стоит вопрос об органосохраняющем лечении. С другой стороны, учитывая более автономное и агрессивное течение по сравнению с гормонозависимыми опухолями, необходимо максимально радикальное лечение. Не вызывает сомнений, что качество жизни пациентов в большинстве цивилизованных стран мира относится к числу приоритетных, наиболее важных и перспективных направлений современной онкологии. Увеличение сроков выживания сегодня поднимает вопрос не только о том, сколько лет прожила пациентка, но и как она их прожила.
Таким образом, достигнутые на сегодняшний день достаточно высокие показатели выживаемости больных распространённым РШМ всё же нельзя признать удовлетворительными. Это диктует необходимость проведения разноплановых исследований, имеющих цель увеличить продолжительность жизни возможно большего числа больных с распространенными стадиями РШМ. Исходя из сегодняшней ситуации, и возникла необходимость поиска адекватных подходов в лечении больных РШМ, обеспечивающих наряду с радикализмом гормональный, сексуальный и психоэмоциональный статус пациенток как важнейших составляющих компонентов качества жизни [20].
В настоящее время интервенционная радиология как дисциплина входит в число важнейших показателей, отражающих уровень развития медицины, как в отдельном крупном лечебном учреждении, так и в стране в целом [5, 11]. В онкологической практике рентгенохирургические вмешательства используются не только в сочетании с хирургическими, лучевыми и химиотерапевтическими методами, но и в качестве самостоятельного вмешательства. Такого рода вмешательства чаще всего применяются с целью паллиативного или симптоматического лечения.
В последнее десятилетие рентгеноэндоваскулярная окклюзия или эмболизация артериального русла получила широкое распространение в лечении различных заболеваний опухолевой и неопухолевой природы, для остановки кровотечений, коррекции нарушений функции органов. Эмболизация артериального сосуда, питающего пораженный злокачественной опухолью орган, приводит к некрозу опухоли и замедлению ее роста [6, 14, 23, 24, 35, 36, 40, 42, 43, 45].
Несмотря на значительное увеличение эффективности лечения некоторых онкологических заболеваний за счет применения РЭВВ, возможности последних зачастую ограничиваются множественным характером кровоснабжения опухоли, ее гиповаскулярностью, химиорезистентностью и т.д. Для нивелирования этих отрицательных моментов и усиления эффективности чрезартериального воздействия на опухоль разрабатываются методы взаимного усиления эффективности РЭВВ и модифицирующих физико-химических воздействий (лучевая терапия, гипертермия, гипергликемия и др.) [11, 12, 31]. Однако накопленный материал об эффективности рентгеноэндоваскулярной эмболизации в онкогинекологической практике еще невелик, поэтому клиническая ценность метода продолжает изучаться.
Известно, что кровотечение является частым осложнением гинекологических опухолей. Как правило, хроническое кровотечение приводит к анемии и ограничивает применение лучевой и химиотерапии в этой группе больных. Лечение угрожающего жизни кровотечения при опухоли, исходящей из половых путей, представляет сложную задачу. Обычные консервативные мероприятия, включающие тампонаду влагалища, гемостатическую терапию, гемотрансфузию, часто оказываются неэффективными. Хирургическое легирование ВПА является технически сложной и травматичной процедурой, что определяется глубоким расположением этих сосудов и наличием в малом тазу распространенной опухоли. Кроме того, проксимальная перевязка ВПА вызывает быстрое развитие коллатералей и нередко сопровождается рецидивом кровотечения [47].
Публикаций, посвященных чрескатетерной остановке кровотечения из опухоли матки, немного. Имеются лишь отдельные сообщения, в которых описано использование эмболизации внутренних подвздошных артерий (ВПА) для остановки кровотечений и уменьшения болевого синдрома при опухолях женских половых органов [23, 24]. В отличие от травматических и жизнеугрожающих опухолевых кровотечений, при хронических геморрагиях скорость кровопотери менее 0,5 мл/мин и поэтому на ангиограммах нет признаков экстравазации контрастного вещества. Из-за невозможности идентифицировать кровоточащий сосуд и большого числа коллатералей, необходимо окклюзировать все артерии, кровоснабжающие опухоль. По этой же причине целесообразно выполнять двустороннюю окклюзию висцеральных ветвей ВПА. Односторонняя окклюзия ВПА не приводит к остановке кровотечения из-за обильной сосудистой сети и последующего развития коллатералей [47].
При неудавшейся попытке установить катетер дистальнее ягодичной артерии следует произвести эмболизацию ее металлическими спиралями, так как попадание мелких частиц эмболизата в париетальные ветви ВПА может привести к некрозу кожи и мышц ягодиц, а также к неврологическим симптомам из-за ишемии седалищного нерва [26, 27]. При невозможности суперселективной катетеризации используют проксимальную эмболизацию задней порции ВПА спиралью, после чего выполняют окклюзирование вентральной порции мелкими эмболизатами. С другой стороны, очевидно, что при технической возможности следует окклюзировать лишь передние части ВПА [23, 24]. В целом после чрескатетерного гемостаза кровотечение останавливается у 75-100 % больных [26, 27]. Рецидив геморрагии наблюдается в 10-30 % случаев и зависит от скорости прогрессирования опухоли.
Одни авторы считают рентгеноэндоваскулярные вмешательства (РЭВВ) эффективным методом остановки кровотечений у больных местнораспространенным раком матки. Сочетание лечения с регионарной химиоэмболизацией ВПА способствует повышению эффективности лучевой терапии больных раком шейки матки [3]. Уменьшение размеров опухоли в ближайшие 1-3 месяца авторы объясняют ишемическим некрозом новообразования [29, 38], а также усилением иммунного ответа организма [33].
Другие исследователи говорят, что эмболизация ВПА не дает заметного противоракового эффекта и является лишь средством остановки кровотечения [39]. Морфологическое исследование препаратов, удаленных у оперированных больных в исследованиях П.Г. Таразова и соавт. [28], показало, что полного некроза опухоли не происходит. Наблюдение неоперированных пациенток свидетельствует о высокой частоте дальнейшего прогрессирования заболевания. Уменьшение объема новообразования сохраняется лишь несколько недель и может, по мнению авторов, объясняться снижением притока крови и уменьшением венозного застоя в опухоли. Изучение этого вопроса требует использования современных методов мониторинга (компьютерной и магнитно-резонансной томографии), а также детального гистологического исследования.
В исследованиях И.В. Столяровой и В.Л. Винокурова [3, 25] проводилась оценка эффективности регионарной артериальной химиоэмболизации в комплексной терапии у 95 больных местно-распространенными формами рака шейки и тела матки. После РЭВВ кровотечение было остановлено у всех больных, что позволило реализовать в полном объеме стандартные программы лучевой терапии. У пациенток с выраженной анемией отмечено улучшение гематологических показателей периферической крови. Контрольное ангиографическое исследование показало уменьшение размеров опухоли на 25-50 % по сравнению с исходными данными. Анализ отдаленных (трехлетних) результатов лечения позволил констатировать повышение выживаемости больных, лучевое лечение которых сочеталось с применением рентгеноэндоваскулярных вмешательств (47 и 36 % в контроле) [25].
В исследованиях Ю.В. Суворовой и соавт. [27] эмболизация внутренних подвздошных артерий (ВПА) была выполнена у 8 женщин, из них: 3 с рецидивом рака шейки матки III стадии (лучевое лечение осуществлялось за 1-2 мес. до момента настоящею поступления) и 5 первичных больных раком шейки матки III стадии и раком эндометрия I стадии. В первые 1-2 сут после артериальной эмболизации кровотечение остановилось у 6 пациенток, у двух остальных наблюдались небольшие кровянистые выделения в течение 4 и 7 дней. Постэмболизационный синдром проявлялся кратковременными умеренно выраженными болями в низу живота и повышением температуры тела. В дальнейшем всем женщинам проводили лучевое лечение и системную химиотерапию. В отдаленные сроки (11-48 мес.) у 7 из 8 пациенток рецидива кровотечения не было [26, 27].
В исследованиях П.Г. Таразова и соавт. [28] выполнялись срочные (10 больных) и экстренные (4 больных) ангиография и эмболизация ВПА у женщин в возрасте от 31 до 74 лет с диагнозом рак шейки (9 больных) и тела (5 больных) матки. Во всех случаях наблюдалось угрожающее жизни кровотечение, резистентное к гемостатической терапии. Ангиографию таза осуществляли по стандартной методике путем катетеризации бедренной артерии по Сельдингеру. Эмболизаты использовали в различных сочетаниях, добиваясь полной окклюзии сосудов, кровоснабжающих опухоль. Кровотечение остановилось у всех 14 пациенток в первые 1-3 ч после процедуры. Постэмболизационный синдром в виде болей или тяжести внизу живота и повышения температуры тела до 38 °С не требовал специального лечения и купировался самостоятельно через 2-8 суток. У 1 больной после эмболизации отмечались парестезии в ягодичной области, а еще у 1 пациентки процедура осложнилась некрозом слизистой верхней трети влагалища, который успешно ликвидирован консервативно. У 3 из 4 больных с операбельной опухолью через 2-8 недель произведена экстирпация матки с придатками. Через 2-4 недели после эмболизации отмечались уменьшение размеров опухоли на 50 % и более у 2, на 25-50 % у 4, стабилизация у 3 и прогрессирование у 2 из 11 неоперированных больных. Рецидив геморрагии наблюдался в 2 из 4 случаев эмболизации ствола ВПА спиралями и аутогемосгустками. Массивное кровотечение через 1 месяц возникло у 1 женщины [28].
Таким образом, имеющиеся к настоящему времени литературные данные свидетельствуют о несомненной пользе малотравматичного метода рентгеноэндоваскулярной эмболизации внутренних подвздошных и маточных артерий в составе комплексного и комбинированного лечения, а также самостоятельного симптоматического и паллиативного метода в лечении злокачественных опухолей матки. Дальнейшее развитие метода эндоваскулярной эмболизации в онкологии, по общему мнению, должно идти по пути усовершенствования техники избирательной катетеризации опухолевых сосудов, создания оптимальной дисперсности масляной эмульсии химиопрепаратов для ее лучшего проникновения в опухоль, а также разработки способов оптимального сочетания чрезартериального, интерстициального, лучевого и гипертермического воздействия на опухоль [31]. Рентгеноэндоваскулярные вмешательства с селективной эмболизацией и химиоэмболизацией маточных артерий и передних ветвей внутренних подвздошных артерий являются одним из современных методов, который может повысить эффективность лечения местнораспространенных форм рака шейки матки, осложненных кровотечением.
Рецензенты:
Химиоэмболизация при раке шейки матки
Терапевтическое лечение злокачественных новообразований предполагает назначение разных способов введения препаратов. В частности, химиоэмболизация при раке шейки матки зарекомендовала себя как эффективное средство уменьшения размера опухоли. Одновременное блокирование питающего сосуда и введение противоопухолевых средств позволяет добиться лучших результатов, чем простое назначение химиотерапии. Также такое лечение может назначаться в качестве подготовки к операции. Врачебная консультация поможет пациенту узнать больше о такой процедуре, как химиоэмболизация маточных артерий при раке шейки матки: способы, назначения, противопоказания и другие особенности.
Рак шейки матки – это распространенная форма онкологического заболевания у женщин. Злокачественное новообразование поражает внутреннюю оболочку органа, эндометрий. Постепенный рост опухоли сопровождается нарушением функций внутренних половых органов и возникновением других осложнений. На поздних стадиях формируются вторичные опухоли в отдаленных анатомических областях (метастазы). Онкологи отмечают, что рак эндометрия чаще всего возникает после менопаузы.
Для понимания особенностей патологии следует иметь представление об анатомии и функциях матки. Так, маткой называют внутренний половой орган у женщин, необходимый для вынашивания ребенка в процессе беременности. Полость матки соединена с влагалищем в области шейки и яичниками в верхнем отделе. Основные процессы происходят после выделения зрелой яйцеклетки из яичника и оплодотворения. Формирующийся зародыш внедряется в эндометрий матки и получает питание вместе с кровью. Все перечисленные процессы неразрывно связаны с гормональными влияниями.
Онкологические заболевания во многом отличаются от других патологий. Растущее новообразование является своеобразным организмом, получающим питание с кровью и обеспеченным собственным метаболизмом. Опухоль может кровоснабжаться с помощью уже имеющихся артерий или стимулировать рост новых сосудов. В связи с этим химиоэмболизация при раке шейки матки считается перспективным методом лечения болезни.
Этиология онкологических заболеваний до сих пор изучается. Формирование опухоли в области эндометрия традиционно связывают с особенностями гормональной системы, функциями матки и наследственными факторами. Также следует учитывать влияние длительного травмирования тканей.
Злокачественные новообразования образуются из ранее здоровых клеток, потерявших способность к саморегуляции в результате экспрессии мутантных генов или других факторов. Аномальная клетка начинает бесконтрольно делиться, в результате чего и возникает опухолевый процесс. Распространение болезни в другие органы связано с проникновением пораженных клеток в кровоток и лимфу.
- Негативные наследственные факторы. Наличие рака шейки матки в семейном анамнезе указывает на высокий риск возникновения опухоли у пациента.
- Нарушение баланса женских половых гормонов в организме. Из-за некоторых заболеваний яичники могут выделить недостаточное или избыточное количество эстрогена и прогестерона.
- Поликистоз яичников – заболевание, сопровождающееся угнетением функций органа.
- Позднее возникновение менструации или раннее формирование менопаузы. Все эти процессы влияют на функции матки.
- Отсутствие беременности в анамнезе. Нерожавшие женщины в большей степени подвержены риску онкологии.
- Ожирение. Предполагается, что избыточное количество подкожного жира влияет на гормональный баланс в женском организме.
- Гормональная терапия рака молочной железы. Пациенткам с этим заболеванием назначают блокаторы синтеза половых гормонов.
- Наследственный рак прямой кишки. Это новообразование может распространяться на область матки.
Далеко не во всех случаях врачам удается выявить реальную причину возникновения рака.
Главным медикаментозным методом лечения злокачественных новообразований является химиотерапия, подразумевающая введение в организм пациента противоопухолевых лекарств. Действие компонентов химиотерапии направлено на уничтожение опухолевых клеток, предотвращение метастазирования и блокирование роста новообразования. В отличие от оперативного вмешательства, проведение химиотерапии чаще всего не ограничено ранней стадией болезни. Кроме того, это менее травматичная процедура.
Действие противоопухолевых препаратов связано с различными механизмами. Так, злокачественные клетки чаще всего характеризуются определенными особенностями обмена веществ, поэтому лекарства могут выборочно воздействовать именно на опухолевые компоненты. К сожалению, большинство видов химиотерапии также поражает здоровые ткани, из-за чего возникают осложнения. Исследователи постоянно работают над созданием высокоселективных медикаментов.
Главные виды химиотерапии:
- Цитотоксические препараты, действие которых направлено на уничтожение аномальных клеток. Механизм воздействия может быть связан с поражением внутриклеточного метаболизма.
- Цитостатические препараты, действие которых направлено на остановку роста и деления злокачественных клеток. Цитостатики нарушают работу ДНК клеток, в результате чего останавливается рост опухоли.
Обычно онкологи назначают сразу несколько препаратов для улучшения эффективности лечения. Большинство режимов химиотерапии предусматривает назначение комбинированной терапии, включающей цитостатические и цитотоксические средства. Также учитывается частота приема лекарств и продолжительность курса лечения.
Химиоэмболизация при раке шейки матки – это эффективный терапевтический метод лечения заболевания. Во время процедуры врач вводит лекарственное вещество, блокирующее кровоснабжение опухоли и транспортирующее противоопухолевые препараты непосредственно в пораженную ткань. В результате остальные ткани организма не повреждаются из-за воздействия цитотоксических вещества, а в новообразование поддерживается высокая концентрация медикаментов в течение длительного времени.
Химиоэмболизация маточных артерий при раке шейки матки предполагает разные виды доступа. Обычно производится пункция бедренной артерии и введение катетера в сосудистую систему. Постепенно катетер достигает маточной артерии и высвобождает микросферы, содержащие цитостатический препарат карбоплатин. Микросферы полностью закупоривают артерию, останавливая кровоснабжение опухоли, а цитостатик предотвращает дальнейший рост опухоли. В течение нескольких недель после процедуры врачи оценивают состояние пациента с помощью лабораторных тестов. При положительном эффекте онколог может назначить операцию или другие виды терапии.
Химиоэмболизация при раке шейки матки может привести к следующим результатам:
- Уменьшение размера опухоли на 30-50%.
- Снижение концентрации онкомаркеров в крови.
- Полное устранение патологического очага.
- Остановка роста опухоли.
Операция проводится под контролем визуализации. Тем не менее любое хирургическое вмешательство связано с риском возникновения осложнений.
- Повреждение стенок кровеносных сосудов и внутреннее кровотечение.
- Формирование псевдоаневризмы в области пункции бедренной артерии.
- Нарушение кровоснабжения здоровых тканей.
- Интоксикация при некрозе опухоли.
- Инфекция или воспаление.
Соблюдение правильной техники эмболизации позволяет избежать возникновения негативной симптоматики. Также следует учитывать, что химиоэмболизация маточных артерий позволяет уменьшить воздействие химиотерапии на другие ткани, что является неоспоримым преимуществом.
Химиоэмболизация шейки матки не может быть назначена без предварительной диагностики. Во время консультации онколог спрашивает пациентку о жалобах, изучает анамнестические данные и проводит физикальное обследование. Уже на этой стадии часто выявляются патологические образования. Для подтверждения диагноза, уточнения стадии болезни и подбора лечения врач назначает инструментальные и лабораторные исследования.
Основные методы обследования:
- Гистероскопия – метод инструментального осмотра полости матки. Специалист вводит гистероскоп, оснащенный источником света и линзами, в шейку матки и оценивает состояние эндометрия. Такой способ диагностики иногда позволяет удалить некоторые патологические структуры непосредственно во время исследования.
- Осмотр анатомических структур малого таза. Пациентку просят расположиться удобнее в кресле для гинекологического осмотра, после чего гинеколог проводит пальпаторное обследование матки.
- Биопсия опухолевых клеток – забор участка новообразования с последующей микроскопией для выявления типа патологии и назначения правильной схемы химиотерапии. Только после такой процедуры может быть запланирована химиоэмболизация при раке шейки матки.
- Трансвагинальная ультразвуковая диагностика – сканирование шейки матки с помощью высокочастотных звуковых волн.
- Компьютерная и магнитно-резонансная томография – эффективные способы визуализации внутренних органов.
Таким образом, химиоэмболизация при раке шейки матки является одним из самых результативных методов лечения болезни. Рекомендуется как можно скорее записаться на прием к врачу при подозрении на онкологию.
Читайте также:

