Egfr мутации при колоректальном раке
Сигнальный путь EGFR и мутации генов семейства RAS при колоректальном раке
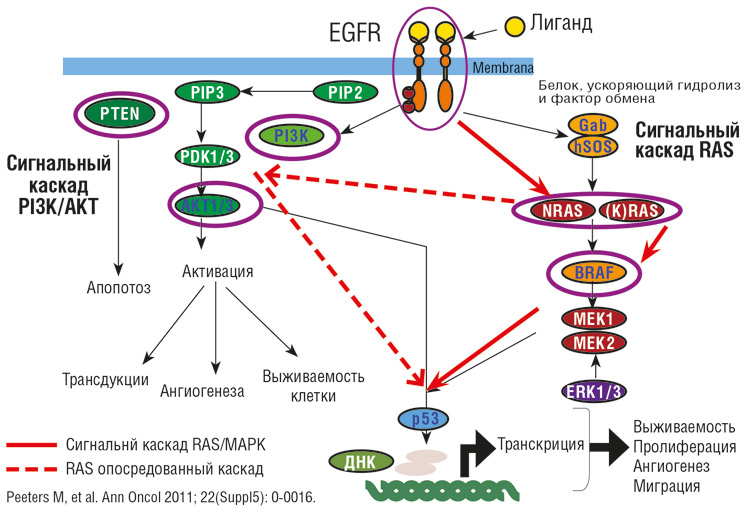
Постоянная активация сигнального каскада рецептора эпидермального фактора роста (EGFR) является одной из ведущих причин опухолевой трансформации и прогрессии.
Причинами подобной активации могут быть:
- Увеличение количества молекул рецептора на мембране клеток.
- Мутации в структуре рецептора, позволяющие ему генерировать сигнал без участия лиганда.
- Мутации других генов-участников каскада, способных активировать его вне зависимости от статуса EGFR.
Для колоректального рака характерны 1 и 3 пути активации.
Блокада сигнального каскада EGFR с помощью моноклональных антител, связывающихся с рецептором, показала высокую клиническую эффективность при целом ряде опухолей, в том числе при колоректальном раке. Однако использование этих препаратов в неселектированной группе больных приводило к ответу на лечение лишь у 25% пациентов.
Первоначальный молекулярный анализ образцов пациентов, участвовавших в исследованиях OPUS и CRYSTAL, показал, что существенную роль в резистентности опухоли к терапии моноклональными антителами играют мутации гена KRAS, одного из участников внутриклеточной части сигнального каскада EGFR.
Однако дальнейшие исследования показали, что не меньшее значение в определении полноты противоопухолевого ответа играют и другие участники сигнального пути, начинающегося с рецептора EGFR: гены RAS-RAF-MEK-ERK-МАРК.
Сигнальный путь RAS
В RAS-зависимом сигнальном пути ключевую роль играют белки семейства RAS. Фиксированные на внутренней стороне клеточной мембраны, белки RAS являются первыми членами каскада киназ, которые приводят к активации сигнальных путей и транскрипции генов, регулирующих дифференцировку и пролиферацию клетки.
Роль белка RAS в сигнальном пути EGFR
Семейство генов RAS (Retrovirus Associated DNA Sequences) включает 3 гена: KRAS, HRAS, NRAS. Первые два гена получили название от своих гомологов, выделенных из линий вирусов мышиной саркомы Kirsten и Harvey, последний был идентифицирован в клеточной линии нейробластомы. Три гена кодируют четыре варианта протеинов – два типа KRAS, А и В (наиболее часто распространенный), и по одному типу HRAS и NRAS.4 Все они относятся к белкам, связывающим энергетическую молекулу ГТФ. RAS-белки могут существовать в двух формах: неактивной, GDP- и активной, GTP-связанной. Благодаря собственной GTP-азной активности, а также под действием факторов обмена (Sos и др.), белок RAS циклически переходит из GTP-связанной активной формы в GDP-связанную неактивную и обратно.
Нормальный RAS находится преимущественно в неактивной, GDP-связанной форме. Активация RAS регулируется рецепторной тирозинкиназой EGFR. После связывания рецепторной внеклеточной части тирозинкиназы с фактором роста и ее димеризации происходит взаимное фосфорилирование ее внутриклеточных доменов. Фосфорилирование создает активную конформацию киназы. Образование активного комплекса RAS-GTP происходит в присутствии активирующего GTP-азу белка GAP, в сотни раз ускоряющего гидролиз. После гидролитического превращения GTP в GDP RAS снова инактивируется. Сигнал прерывается. Чтобы воспринять новый сигнал, если он еще существует вне клетки, цикл реактивации должен быть повторен.
Таким образом, каскадная последовательность реакций сигнального пути RAS действует как включатель, определяющий регуляцию генной экспрессии, требующуюся для реализации деления или дифференцировки клетки.
Нарушение систем передачи сигнала и канцерогенез
RAS-белки часто упоминают как протоонкогенные продукты: их постоянная активация ведет к злокачественному перерождению клеток. Характерный механизм перерождения RAS – точечные мутации в соответствующих генах. Наиболее частыми онкогенными мутациями генов всего семейства RAS являются мутации в 12 и 61 кодонах.
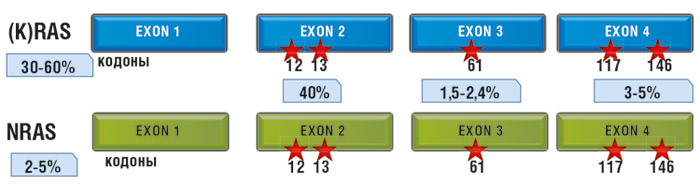
Мутации в гене KRAS в опухолях толстой кишки встречаются в 30-60% случаев. Наиболее часто мутации KRAS определяются в экзоне 2, кодонах 12 и 13. Однако описаны мутации в экзоне 3, кодоне 61, и в экзоне 4, кодонах 117 и 146. Мутации в гене NRAS (в идентичных экзонах и кодонах) при КРР составляют до 5%. Мутации в гене HRAS при аденокарциноме толстой кишки не описаны.
Мутации генов семейства RAS при злокачественных опухолях
(по базе данных COSMIC)
| Орган | Тип опухоли | Мутации (%) | ||
|---|---|---|---|---|
| HRAS | KRAS | NRAS | ||
| Колоректальный рак | Аденокарцинома | 0 | 42 | 5 |
| Желчные пути | Аденокарцинома | 0 | 35 | 2 |
| Мочевой пузырь | Уротелиальная карцинома | 12 | 4 | 2 |
| Печень | Гепатоцеллюлярный рак | 0 | 4 | 4 |
| Легкое | Крупноклеточный рак | 4 | 21 | 4 |
| Аденокарцинома | 0 | 16 | 1 | |
| Поджелудочная железа | Протоковая аденокарцинома | 0 | 69 | 1 |
| Эндокринные опухоли | 0 | 1 | 75 | |
| Кожа | Меланома | 1 | 2 | 20 |
Точечные мутации онкогенов RAS при мКРР
Значение различных мутаций RAS
Как уже говорилось выше, при колоректальном раке почти 90% всех нарушений представляют собой точечные замены одного нуклеотида на другой во втором экзоне генов KRAS и NRAS, в последовательностях, кодирующих 12 и 13 аминокислоты. В норме в обеих позициях располагается глицин, единственная аминокислота, не имеющая боковой цепи. Любое изменение этой последовательности приводит к замене глицина на разветвленные аминокислоты, что ведет к нарушению пространственной конформации протеина. В результате этого блокируется способность специальных белков инактивировать комплекс RAS с ГТФ путем гидролиза энергетической молекулы. Сигнал начинает передаваться от активированного RAS к другим участникам каскада независимо от статуса EGFR.
Около 10% мутаций этой гена в колоректальных опухолях происходят в 3 и 4 экзонах, с одинаковой частотой в 61 и 146 кодонах и крайне редко – в 117 кодоне. Мутации, затрагивающие 61 кодон, нарушают водородные связи между RAS и белками-инактиваторами, приводя к тому же эффекту, что и при нарушениях в 12 и 13 кодонах гена. Мутации 146 кодона не сопровождаются существенными изменениями активности протеина.
Тем не менее, эти мутации оказывают свое негативное воздействие в результате накопления дефектного белка на фоне аллельного дисбаланса – увеличения копийности мутантного гена или перехода его в гомозиготное состояние, что весьма характерно для опухолей с мутациями генов семейства RAS.
Возрастающая роль сигнального пути RAS в индивидуализированной терапии мКРР
Самым известным биомаркером в таргетной анти-EGFR терапии пациентов c мКРР является статус мутаций кодонов 12 и 13 гена KRAS. Доказано, что активация KRAS за счет мутации сводит на нет эффект ингибирования EGFR моноклональными антителами. Таким образом, наличие мутантных аллелей гена KRAS является независимым предсказательным маркером эффективности терапии ингибиторами EGFR. Поэтому панитумумаб и цетуксимаб назначают только больным мКРР с диким типом гена KRAS.
Влияние дополнительных мутаций гена KRAS и новых мутаций гена NRAS, а также мутаций гена BRAF на эффективность таргетной терапии ингибиторами EGFR изучалось в исследованиях с панитумумабом и цетуксимабом пациентов мКРР:
- Анализ мутаций генов KRAS/NRAS и мутации гена BRAF в исследовании 3 фазы PRIME: комбинации панитумумаб+FOLFOX4 в сравнении с FOLFOX4 в 1-й линии терапии метастатического колоректального рака
Oliner K, Douillard JY, Siena S, et al. Analysis of KRAS/NRAS and BRAF mutations in the phase III PRIME study of panitumumab (pmab) plus FOLFOX versus FOLFOX as first-line treatment (tx) for metastatic colorectal cancer (mCRC). ASCO 2013 (poster discussion): 3511 - Анализ мутаций генов RAS/RAF в исследовании 2 фазы PEAK: комбинации панитумумаба с mFOLFOX6 в сравнении с бевацизумабом в комбинации с mFOLFOX6 в 1-й линии терапии пациентов с метастатическим колоректальным раком с WTKRAS
Schwartzberg LS, Rivera F, Karthaus M, et al. PEAK (study 20070509): A randomized phase II study of mFOLFOX6 with either panitumumab (pmab) or bevacizumab (bev) as first-line (tx) in patients (pts) with unresectable wild type (WT) KRAS metastatic colorectal cancer (mCRC). J Clin Oncol 2013; 30 (Suppl 34): 446 - Анализ влияния мутаций генов семейства RAS (2 экзона KRAS и других RAS-мутаций) в исследовании CRYSTAL: комбинации цетукпсимаба с FOLFIRI в сравнении с FOLFIRI в 1-й линии терапии пациентов с метастатическим колоректальным раком на выживаемость пациентов без прогрессии и общую выживаемость
Van Cutsem et al. Fluorouracil, leucovorin, and irinotecan plus cetuximab treatment and RAS mutations in colorectal cancer. J Clin Oncol. 2015 Mar 1; 33(7): 692-700
Все исследования показали, что, несмотря на то, что индивидуализация терапии антителами по статусу генов семейства RAS предусматривает сужение круга пациентов (примерно 50/50 вместо 60/40 при отборе только лишь по статусу 2 экзона гена KRAS), пациенты с диким типом генов KRAS и NRAS в опухоли получат максимальную пользу от терапии антителами в комбинации со стандартной химиотерапией, по сравнению с пациентами без мутаций гена KRAS во 2 экзоне. Пока нет достаточных доказательств негативного влияния мутаций генов BRAF, PI3K, PTEN и других участников сигнального пути RAS-RAF-MEK-ERK-МАРК по результатам крупных проспективных рандомизированных исследований, однако не исключено, что появление таких исследований вновь существенно изменит наши представления о группе пациентов, для которых применение анти-EGFR антител окажется наиболее выгодным.
В связи с этим целью программы является максимально широкое внедрение генетического тестирования при колоректальном раке в ежедневную практику онкологов, как одного из важнейших условий проведения современной эффективной терапии у целевой группы пациентов.
- Heldin CH. Dimerization of cell surface receptors in signal transduction. Cell 1995; vol.80, no.2, pp.213-223.
- Carpenterand G, Cohen S. Epidermal growth factor. J Biol Chem, 1990; vol.265, no.14, pp.7709-7712.
- Citri A, Yarden Y. EGF-ERBB signalling: towards the systems level. Nature Rev Molecular Cell Biol 2006; vol.7, no.7, pp.505-516.
- Boguski MS, McCormick F. Proteins regulating Ras and its relatives. Nature 1993; 366: 643-654.
- Vakiani E, Solit DB. KRAS and BRAF: drug targets and predictive biomarkers. J Pathol 2011; 223: 219-229.
- Edkins S, O’Meara S, Parker A, et al. Recurrent KRAS codon 146 mutations in human colorectal cancer. Cancer Biol Ther 2006; 5: 928-932.
- Janakiraman M, Vakiani E, Zeng Z, et al. Genomic and biological characterization of exon 4 KRAS mutations in human cancer. Cancer Res 2010; 70: 5901-5911.
- Soh J, Okumura N, Lockwood WW, et al. Oncogene mutations, copy number gains and mutant allele specific imbalance (MASI) frequently occur together in tumor cells. PLoS One. 2009, 14, no.4(10). P.7464.
в базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Биологические функции генов семейства RAS
Одно из ключевых свойств любой опухоли — это нарушение баланса между клеточным делением, т.е. размножением клеток, и клеточной гибелью. Для того, чтобы процесс деления осуществлялся в норме, необходимо поступление верного сигнала в клеточное ядро. Подобным сигналом являются специальные белки – факторы роста. Они прикрепляются к определённым рецепторам на поверхности клеточной оболочки и запускают внутри клетки ряд последовательных биохимических реакций. Результатом становится производство и накопление внутри клетки белков, которые необходимы для дальнейшего деления.
Необходимо отметить, что активирующие мутации не только в этих генах, но и в других звеньях сигнальной цепочки могут приводить к постоянной стимуляции клеточного деления. К таким событиям относятся, например, мутации в генах EGFR, BRAF и др. Упомянутые генетические повреждения в разной степени свойственны опухолям различных органов. Например, мутации в генах семейства RAS (KRAS, NRAS, HRAS) встречаются при раке поджелудочной железы, толстой кишки, лёгкого, кожи и т.д. Мутации EGFR характерны для немелкоклеточного рака легкого, а повреждения BRAF с наибольшей частотой обнаруживаются при меланоме.
В каких случаях нужно сделать тест на мутацию в генах KRAS и NRAS?
Тестирование опухоли на наличие мутаций в генах KRAS и NRAS выполняется пациентам с опухолями толстой кишки. Тест позволяет лечащему онкологу решить вопрос о возможности использования в терапии антител к определенному фактору роста и деления клеток ‒ EGFR. Данные препараты – панитумумуаб или цетуксимаб ‒ блокируют расположенные на мембране клеток рецепторы эпидермального фактора роста (EGFR) и препятствуют росту опухоли.
Более того, существуют сведения о том, что ошибочное назначение анти-EGFR терапии пациентам, у которых мутация в перечисленных генах не выявлена, может ускорять рост опухоли. Частота мутаций в гене KRAS при опухолях толстой кишки достигает 50%. Ещё около 10-20% приходится на мутации в генах NRAS и BRAF. Таким образом, при правильном обследовании лечение антителами к EGFR должно назначаться не более 30-40% пациентов с раком толстой кишки, в остальных случаях используются другие схемы терапии.
Что делать, если в опухоли толстой кишки обнаружена мутация в гене KRAS или NRAS?
Обнаружение мутации в гене KRAS или NRAS является абсолютным противопоказанием к использованию цетуксимаба или панитумумаба, т.к. присутствие этих мутаций полностью препятствует противоопухолевому действию данных препаратов. Как упоминалось выше, при ошибочном назначении антител к EGFR пациентам с мутациями в генах RAS может наблюдаться ускорение роста опухоли – именно поэтому полноценное исследование данных генов является обязательным условием для подбора правильной терапии. В случае наличия мутаций в генах KRAS и NRAS в клетках опухоли успешно используются другие разновидности лечения.
Как сдать анализ на мутации в гене KRAS, NRAS, EGFR, BRAF?
Чтобы провести молекулярно-генетическое тестирование, специалистам необходимы опухолевые клетки. Они могут быть получены либо при биопсии, либо в ходе хирургической операции по удалению новообразования. При этом, материал для исследования должен быть подготовлен определенным образом. В противном случае тестирование будет невозможно.
В ходе первичного обследования онкологическому пациенту практически всегда выполняют биопсию, на основании которой происходит патоморфологическое подтверждение диагноза. Для этого полученные клетки пациента проходят многоэтапную химическую обработку. В результате из них создаётся специальный парафиновый блок. С одной стороны, он необходим для получения качественного тонкого среза (толщиной 5 мкм) с целью патоморфологической диагностики. С другой стороны, в правильно подготовленном парафиновом блоке молекулы ДНК надёжно сохраняются на протяжении десятилетий.
Аналогичные манипуляции патологи проводят в отношении опухолевых тканей, удалённых во время операции. Правильное выполнение процедуры фиксации тканей позволяет использовать образцы опухолей для молекулярно-генетического исследования ДНК спустя месяцы и годы после заливки образца в парафин.
Идеальным набором для молекулярно-генетического исследования является следующий комплект: парафиновый блок c тканью опухоли и одно стекло, окрашенное специальными красителями (гематоксилином и эозином). Всё перечисленное хранится в патологоанатомических архивах медицинских учреждений, а окраска гематоксилином и эозином – основная окраска, используемая в современной патоморфологической диагностике. Если медицинское учреждение по какой-либо причине не может предоставить блоки, то для молекулярно-генетического тестирования достаточно 5-10 неокрашенных срезов ткани опухоли на непокрытых стёклах толщиной 3-5 мкм и одно стекло, окрашенное гематоксилином и эозином.
Требования к упаковке материала перед транспортировкой
- Закрывающийся пластиковый пакет или контейнер, либо картонная коробка
- Полное соответствие номеров отправляемых блоков и стёкол в направлении на тест и копии патоморфологического заключения.
- Лабораторные стекла должны быть обёрнуты плотной бумагой для избежания повреждений.
- Хранение производится при комнатной температуре, не допустим нагрев блоков и стёкол выше +50 о С.
В настоящее время многие молекулярно-диагностические исследования выполняются за счет средств территориальных фондов ОМС регионов России (как Санкт-Петербурга, так и остальных субъектов РФ).
![]()

Аннотация научной статьи по клинической медицине, автор научной работы — Богомолова И.А., Антонеева И.И., Долгова Д.Р.
Наличие мутаций KRAS , NRAS , BRAF связывают с неблагоприятным прогнозом при колоректальном раке (КРР). В то же время отсутствует единая точка зрения на течение заболевания при проведении адъювантной химиотерапии (АХТ). Цель. Изучить мутации KRAS , NRAS и BRAF в опухоли и их влияние на клинические особенности течения колоректального рака . Материалы и методы. Материалом для исследования служили парафиновые блоки первичной опухоли КРР (n=37). С использованием геномной ДНК, выделенной из первичной опухоли, методом ПЦР в реальном времени определены наиболее часто встречающиеся мутации при КРР: ген KRAS (экзон 2, район кодонов 12-13), ген NRAS (экзон 3, район кодона 61), V600E гена BRAF . Результаты. Результаты генотипирования образцов ДНК, выделенных из парафиновых блоков первичной опухоли КРР, показали, что в 8,2 % случаев были выявлены мутации гена BRAF , в 5,4 % гена NRAS , в 37,8 % гена KRAS . Зависимости распределения мутаций от пола и возраста пациентов не выявлено. В аденокарциномах высокой и умеренной степени дифференцировки чаще встречались исследованные мутации. Безрецидивный период после АХТ у пациентов с выявленными мутациями в генах KRAS , NRAS , BRAF значительно меньше, чем при отсутствии мутаций. Заключение. Полученные данные позволяют предполагать, что наличие мутаций EGFR-сигнального пути ( KRAS , NRAS и BRAF ) повышает риск развития рецидива заболевания и является неблагоприятным прогностическим фактором.
Похожие темы научных работ по клинической медицине , автор научной работы — Богомолова И.А., Антонеева И.И., Долгова Д.Р.
CLINICAL CHARACTERISTICS OF COLORECTAL CANCER IN PATIENTS WITH EGFR-SIGNALING PATHWAY GENE MUTATIONS
KRAS , NRAS , BRAF mutations are associated with an unfavorable prognosis for colorectal cancer (CRC). At the same time, there is no single point of view on disease development during adjuvant chemotherapy (ACT). Objective. The authors aimed at studying KRAS , NRAS and BRAF mutations in the tumor and their influence on the clinical characteristics of colorectal cancer development. Materials and Methods. Paraffin blocks of the primary CRC tumor (n=37) were used as the material for the study. Using genomic DNA, isolated from the primary tumor, real-time PCR was used to determine the most common mutations in CRC: KRAS gene (exon 2, codon region 12-13), NRAS gene (exon 3, codon region 61 ), B6F V600E gene. Results. The results of genotyping of DNA samples isolated from the primary CRC tumor paraffin blocks showed that BRAF gene mutations were detected in 8.2 % of cases, NRAS gene mutations were detected in 5.4 % of cases, and KRAS gene mutations were detected in 37.8 % of cases. The authors didn't reveal any dependencies of the mutation distribution on patients' gender and age. The examined mutations were more common in adenocarcinomas of high and moderate degrees of differentiation. The relapse-free period after ACT in patients with identified KRAS , NRAS , BRAF gene mutations is significantly less than in those without mutations. Conclusion. The findings suggest that EGFR signaling pathway mutations ( KRAS , NRAS and BRAF ) increase the risk of disease recurrence and are an unfavorable prognostic factor.
УДК 616.34-006.6:616-08-059 DOI 10.34014/2227-1848-2019-1-60-67
КЛИНИЧЕСКИЕ ОСОБЕННОСТИ ТЕЧЕНИЯ КОЛОРЕКТАЛЬНОГО РАКА У ПАЦИЕНТОВ С МУТАЦИЯМИ ГЕНОВ EGFR-СИГНАЛЬНОГО ПУТИ
И.А. Богомолова, И.И. Антонеева, Д.Р. Долгова
Наличие мутаций KRAS, NRAS, BRAF связывают с неблагоприятным прогнозом при колорек-тальном раке (КРР). В то же время отсутствует единая точка зрения на течение заболевания при проведении адъювантной химиотерапии (АХТ).
Цель. Изучить мутации KRAS, NRAS и BRAF в опухоли и их влияние на клинические особенности течения колоректального рака.
Материалы и методы. Материалом для исследования служили парафиновые блоки первичной опухоли КРР (n=37). С использованием геномной ДНК, выделенной из первичной опухоли, методом ПЦР в реальном времени определены наиболее часто встречающиеся мутации при КРР: ген KRAS (экзон 2, район кодонов 12-13), ген NRAS (экзон 3, район кодона 61), V600E гена BRAF. Результаты. Результаты генотипирования образцов ДНК, выделенных из парафиновых блоков первичной опухоли КРР, показали, что в 8,2 % случаев были выявлены мутации гена BRAF, в 5,4 % - гена NRAS, в 37,8 % - гена KRAS. Зависимости распределения мутаций от пола и возраста пациентов не выявлено. В аденокарциномах высокой и умеренной степени дифференциров-ки чаще встречались исследованные мутации. Безрецидивный период после АХТ у пациентов с выявленными мутациями в генах KRAS, NRAS, BRAF значительно меньше, чем при отсутствии мутаций.
Заключение. Полученные данные позволяют предполагать, что наличие мутаций EGFR-сиг-нального пути (KRAS, NRAS и BRAF) повышает риск развития рецидива заболевания и является неблагоприятным прогностическим фактором.
Ключевые слова: колоректальный рак, мутации NRAS, KRAS, BRAF, адъювантная химиотерапия.
Введение. Колоректальный рак (КРР) является одной из наиболее распространенных злокачественных опухолей в России, а показатели заболеваемости им в мире и в России ежегодно увеличиваются. По данным за 2017 г., в Ульяновской области КРР выявляют с частотой 142,9 случая на 100 тыс. населения [1]. Продолжительность жизни больных КРР связана со степенью распространенности опухоли, наличием метастазов. При выявлении КРР на I стадии уровень пятилетней выживаемости составляет 93 %, а при прогрессировании заболевания наблюдается явное снижение выживаемости. При II стадии заболевания уровень пятилетней выживаемости снижается до 72 %, при III стадии выживаемость не превышает 45 %, при IV - 8 % [2].
Колоректальный рак представляет собой гетерогенную группу опухолей. Они отлича-
ются по механизмам канцерогенеза, агрессивности течения опухолевого процесса, молекулярным изменениям, а следовательно, по чувствительности к противоопухолевому лечению и прогнозу течения болезни. Поэтому для выбора тактики лечения в настоящее время необходимо учитывать молекулярный профиль опухоли.
Ключевые изменения в процессе канцерогенеза КРР происходят в сигнальных каскадах клетки. Гены участников сигнальных каскадов являются протоонкогенами (KRAS, БЯАР, EGFR, HER2/neo, VEGFR) и антионкогенами (р53, BRCA1/2, Е^ PR) [3]. Каскад, стимулируемый БОРЯ, является одним из основных. Он вовлечен в регуляцию роста, дифференцировки, пролиферации и апоптоза клетки. Постоянная активация БОРЯ-сигнального пути возникает чаще все-
го в результате мутаций в генах нижележащих каскадов. Таким образом, происходит активация сигнального пути без участия EGFR.
Персонифицированная адъювантная химиотерапия (АХТ), основанная на результатах изучения мутационного статуса опухоли, была предложена в начале XXI в. Связано это с появлением препаратов, избирательно блокирующих EGFR-сигнальные пути на различных уровнях (цетуксимаб, бевацизумаб) [4]. Однако результаты ряда рандомизированных исследований не выявили значимого увеличения общей и безрецидивной выживаемости при добавлении к основной полихимиотерапии ингибиторов EGFR-сигналь-ного пути [5, 6].
KRAS - это протоонкоген с собственной активностью фермента, гидролизирующего гуанозинтрифосфат (ГТФаза). Мутации в гене KRAS приводят к активации сигнального пути рецептора эпидермального фактора роста (EGFR). Активация EGFR запускает сигнальный каскад через RAS-RAF-MEK-MAPK- и Р13К-АКТ-путь, тем самым приводя к стимуляции ангиогенеза и метастазирования, повышению в опухолевых клетках пролиферации [8]. Мутации в гене KRAS - это наиболее частые генетические изменения, возникающие на ранних этапах канцерогенеза КРР. Чаще всего они происходят в 12-м, 13-м ко-донах гена KRAS и являются одним из возможных факторов химиорезистентности [9].
BRAF - протоонкоген, являющийся членом семейства киназ RAF. Он, как и KRAS, участвует в сигнальном пути RAS-RAF-MEK-MAPK. Генетические повреждения BRAF приводят к его постоянной стимуляции, и BRAF начинает непрерывно передавать стимулы по RAF-MEK-MAPK-пути, запуская процессы клеточного деления [12]. Мутационный статус генов BRAF и KRAS находится в реципрокных взаимоотношениях. Таким образом, если при КРР обнаруживается активация KRAS, то нарушение в кодоне 600 гена BRAF практически исключено; если в опухоли наблюдается мутация KRAS, то статус BRAF почти всегда остаётся нормальным [13, 14]. В рамках исследований NSABP C07 и C08 при анализе результатов АХТ при КРР наихудший прогноз и низкая выживаемость были ассоциированы с мутацией в гене BRAF [15]. В настоящее время рекомендуется выполнять молекулярно-генетическое тестирование на мутации RAS и BRAF, если выявлены отдаленные метастазы аденокарциномы толстой кишки, так как это может повлиять на выбор таргетных препаратов в лечении метастатического процесса [16].
Цель исследования. Изучить мутации EGFR-сигнального пути в первичной опухоли и их влияние на клинические особенности течения колоректального рака.
оптимальный объем адъювантной химиотерапии при II-III стадиях включал в себя комбинацию оксалиплатина с фторпиримидинами в течение 6 мес. - режимы FOLFOX или XELOX. Оценка клинико-морфологических параметров включала в себя определение уровня онкомаркеров РЭА и СА-19/9 в динамике лечения, степени дифференцировки, периода безрецидивной выживаемости (от последнего курса полихимиотерапии).
Характеристика больных КРР, включенных в экспериментальную группу

Что же заставляет живые клетки позабыть об эгоизме и работать на благо всего организма? Это свойство закодировано в их генетическом коде. Существуют определенные молекулы, белки, которые регулируют клеточную жизнь.
Одна из таких молекул — рецептор эпидермального фактора роста, по-английски — epidermal growth factor receptor, сокращенно — EGFR. Еще его обозначают как ErbB-1 и HER1. За открытие этой молекулы в 1986 году получили Нобелевскую премию два ученых — американский биохимик Стэнли Коэн и итальянский биолог Рита Леви-Монтальчини.
Какие функции в организме выполняет рецептор эпидермального фактора роста?
Когда сигнальная молекула (например, эпидермальный фактор роста) достигает клетки и взаимодействует с EGFR, этот белок активируется и запускает внутри клетки каскад биохимических реакций. В итоге клетка начинает размножаться.
Мутации EGFR и рак
Мутации гена EGFR определяются при разных типах рака, включая злокачественные опухоли легких, головы и шеи, толстой кишки, поджелудочной, молочной железы, яичников, мочевого пузыря, почек и др.
Из-за повышенной активности рецептора эпидермального фактора роста опухолевые клетки быстрее размножаются, агрессивнее вторгаются в окружающие ткани, метастазируют. Усиливается ангиогенез — образование новых кровеносных сосудов, питающих опухоль.
В общем наличие мутации EGFR в опухолевых клетках ухудшает прогноз для пациента.
Когда ученые поняли, что рецептор эпидермального фактора роста играет роль в развитии рака, возникла идея создать лекарственные препараты, которые могли бы блокировать этот белок. И сегодня такие препараты существуют.
Но нужно понимать, что молекулярно-генетические характеристики и гистологический тип рака — разные и не всегда связанные между собой вещи. Если взять две одинаковые злокачественные опухоли легких, то в одной активность EGFR может быть повышена, а в другой нет. Рассматривая опухоль под микроскопом, нельзя сказать, есть ли в ней такие мутации, будут ли в данном случае эффективен препараты из группы блокаторов EGFR. Для этого нужны специальные анализы. И они тоже существуют.
Кому показан анализ на EGFR?
В настоящее время показанием к исследованию является немелкоклеточный рак легкого (НМРЛ), в особенности если он представлен аденокарциномой (гистологический тип НМРЛ, который встречается в 40% случаев), в случаях, когда пациенту показано лечение ингибиторами EGFR. Это исследование помогает проверить, будет ли пациент реагировать на терапию.
- Ингибиторы EGFR эффективны у 80% больных, имеющих мутацию в гене рецептора эпидермального фактора роста. Причем, у некоторых из этих пациентов препараты действуют довольно сильно и в течение длительного времени.
- При отсутствии данных мутаций ингибиторы EGFR эффективны лишь у 10% пациентов.
Ингибиторы EGFR помогают в течение некоторого времени, в среднем 8 месяцев. Затем развивается резистентность: в злокачественной опухоли происходят новые мутации, и она перестает реагировать на лечение. В этом случае врач может назначить повторный анализ. Для этого нужно снова взять образец опухоли и отправить в лабораторию.
Не все мутации в гене EGFR делают рак чувствительным к ингибиторам рецептора эпидермального фактора роста. Некоторые, напротив, вызывают резистентность. Одна из таких мутаций обозначается как T790M. Если она обнаружена, применяют препарат, который эффективен в таких случаях — осимертиниб. Именно из-за мутации T790M злокачественные опухоли чаще всего (в 60% случаев) перестают реагировать на ингибиторы EGFR.
Анализ на мутации в гене EGFR может быть выполнен как отдельно, так и в составе панели, которая также включает исследования других мутаций — в частности, в генах KRAS, ALK, ROS1, BRAF. Это поможет врачу подобрать оптимальную терапию.
Избыточная активность гена рецептора эпидермального фактора роста, как мы упомянули, встречается и при других типах рака. Но на данный момент анализ рекомендован только при немелкоклеточном раке легкого.
Методы определения статуса мутаций EGFR
Для того чтобы провести анализ на мутации в гене EGFR, нужно провести биопсию — получить образец опухолевой ткани. При этом образец должен быть достаточно большого размера и содержать достаточное количество опухолевых клеток. Поэтому важно, чтобы забор материала проводил опытный врач, который хорошо владеет этим навыком.
Для того чтобы обнаружить мутантный ген EGFR, обычно применяют полимеразную цепную реакцию (ПЦР): метод предполагает создание множества копий ДНК с помощью ферментов.
Когда анализ завершен, лаборатория выдает одно из двух заключений:
- Результат положительный: обнаружена мутация в гене EGFR, при этом указывают, какая именно.
- Результат отрицательный: мутация не обнаружена.
На основе этих данных врач (онколог, химиотерапевт) определяется с дальнейшей тактикой лечения.
Методы лечения: ингибиторы EGFR и их эффективность
Ингибиторы EGFR относятся к группе таргетных препаратов. В отличие от классических химиопрепаратов, они действуют прицельно, на определенную молекулу, а не поражают все подряд быстро размножающиеся клетки.
Для лечения рака легкого применяют такие ингибиторы EGFR, как гефитиниб (Иресса), эрлотиниб (Тарцева), афатиниб (Гиотриф), бригатиниб (Алунбриг), икотиниб (Конмана). При раке толстой кишки применяют цетуксимаб (Эрбитукс), панитумумаб (Вектибикс).
Ингибиторы EGFR имеют разную химическую структуру, разные механизмы действия, и в зависимости от этого их можно разделить на две большие группы:
При раке легкого ингибиторы EGFR чаще всего используют на поздних стадиях, отдельно или в сочетании с химиопрепаратами.
Таргетные препараты действуют более прицельно по сравнению с классическими химиопрепаратами, тем не менее, они могут приводить к некоторым побочным эффектам. При применении ингибиторов EGFR чаще всего возникают такие проблемы, как сыпь и инфекции кожи, диарея, потеря аппетита. Более серьезные побочные эффекты встречаются редко.
Гефитиниб — таргетный препарат из группы ингибиторов EGFR для лечения немелкоклеточного рака легких в случаях, когда опухоль проросла в окружающие ткани, либо имеются отдаленные метастазы. В 2002 году он был одобрен в Японии, в 2003 году — в США. На данный момент гефитиниб продается более чем в 60 странах мира.
Препарат принимают в виде таблеток, по одной в день. Доказано, что в более высоких дозах гефитиниб не действует более эффективно, но возрастает риск побочных эффектов.
Чем доказана эффективность гефитиниба?
В 2009 году завершилась третья фаза клинического исследования, в котором участвовали пациенты с запущенной аденокарциномой легкого из Восточной Азии. Испытуемых поделили на три группы. В первой группе лечение проводилось гефитинибом, в двух других — химиопрепаратами карбоплатином и паклитакселом. В подгруппе пациентов, имеющих мутацию гена EGFR, эффективность гефитиниба оказалась значительно выше.
В Европейской клинике применяются все таргетные препараты, зарегистрированные на территории России, и у нас есть возможность провести молекулярно-генетические исследования, которые помогут выявить мутации и подобрать оптимальную терапию. Свяжитесь с нами, мы знаем, как помочь.
Читайте также:

