Долговременная выживаемость детей со злокачественными опухолями составляет

Если считать вместе с гематологическими патологиями, которые тоже являются очень тяжелыми, то всего больных детей около 350. Ежегодно выявляется в среднем 30 первичных случаев заболевания. Получается, что на 100 тысяч детского населения 12 — 13 случаев. Этот показатель соответствует среднему показателю по России
— Отличается ли взрослый и детский рак?
— Конечно, структура опухолей у детей отличается от структуры опухолей у взрослых. Если у взрослых в 90 процентах случаев эпителиальные раки — рак желудка, кишечника, молочных желез, легких и т.п., то у детей это гемобластозы, составляющие в структуре заболеваемости 50 процентов. Иными словами, это лейкемии и лимфомы. На втором месте стоят опухоли ЦНС — это опухоли головного и спинного мозга. На третьем месте — лимфомы Ходжкина и неходжкинские лимфомы. Отличается и само течение болезни. У детей по сравнению со взрослыми процесс протекает быстрее. То есть если не лечить ребенка с лейкемией, то максимум он проживет месяц. Есть некоторые виды лимфом, когда опухоль может достичь максимальных размеров за месяц. Таким образом, у детей очень высокий пролиферативный потенциал и быстрая генерализация процесса.
— Дети какого возраста наиболее часто заболевают раком?
— Онкология бывает и у новорожденных, и у детей первого года жизни. Но чаще онкологические заболевания диагностируются у детей в возрасте от 2 до 10 лет и от 15 до 17 лет. Также есть и определенная спе-цифика. Например, некоторые опухоли встречаются только в подростковом возрасте. Это опухоли костей, лимфомы Ходжкина. А лейкемия, или, как говорили в старину, белокровие, составляет 35 процентов от всех злокачественных новообразований, и ею болеют чаще дети в возрасте от 2 до 7 лет.
— А вы можете рассказать, что из себя представляет лечение онкологических заболеваний у детей?
— У детей лечение злокачественных новообразований проходит в комплексной терапии. Так, лейкемия не требует оперативного вмешательства, нужно только проведение химиотерапии и лучевой терапии. А солидные опухоли, например опухоли головного мозга, костей, печени, почек, обязательно требуют первичного оперативного вмешательства с последующим проведением химио- и лучевой терапии. Больных с опухолями центральной нервной системы мы направляем на операцию в НИИ нейрохирургии имени Бурденко (Москва) за счет федеральных средств. Только если ребенок получил весь комплекс терапии, можно считать, что лечение было проведено качественно.
— А есть ли случаи полного излечения от рака? Может ли такая терапия вылечить ребенка?
— Почему-то в обществе сложилось мнение, будто от рака все умирают. Это не так. Выживаемость достаточно высокая. И таких детей много, они растут и развиваются, как все здоровые дети. Просто о них не говорят. После вылечивания дети до 18 лет наблюдаются у детского онколога, а затем переводятся во взрослую сеть. При выявлении злокачественной патологии оформляется инвалидность. Если в течение 5 лет наблюдения идет стойкая ремиссия, нет рецидивов заболевания, то ребенок считается выздоровевшим.
— А каков период лечения?
— Для каждой опухоли, для каждой стадии есть определенное время лечения. Курс лечения, допустим, острого лимфобластного лейкоза составляет 208 дней интенсивного лечения в стационаре, а затем проводится поддерживающая химиотерапия в течение двух лет. А например, при первой стадии лимфомы Ходжкина ребенку необходимо пройти два цикла химиотерапии. Первый курс — две недели, после этого следует двухнедельный отдых, и затем второй курс, он также длится две недели. То есть это примерно 45 — 50 дней. Затем ребенок идет на облучение — это 20 — 30 дней. При второй стадии требуется четыре курса химиотерапии, при третьей — шесть. То есть, чем выше стадия, чем выше риск, тем длиннее и интенсивнее терапия.
— А много ли детей умирает от рака?
— А зависит ли что-то от родителей? Могут ли они помочь ребенку победить недуг?
— Конечно, зависит. Прежде всего, родители должны быть очень внимательны к своим детям. Они должны обращать внимание на все — как ребенок ест, спит, как учится, насколько активен, какое у него самочувствие и т.д.
— А какие еще симптомы должны настораживать родителей?
— Обычно симптомы проявляются сразу?
— Они могут нарастать. Например, недавно к нам доставили ребенка, у которого в течение двух месяцев болели ноги. Он не мог спать. Но за помощью родители обратились только сейчас.
— Как сами дети воспринимают свой диагноз? Понимают ли они, что тяжело больны?
— Те дети, что постарше, конечно, в полной мере все осознают и понимают. Дети помладше (7 — 9 лет) тоже понимают, что болеют тяжело, но адаптируются они быстрее. Дети легче, чем взрослые, переносят лечение, высокодозную химиотерапию.
— А есть ли у такого лечения побочные эффекты и возможны ли осложнения?
— Как правило, побочные эффекты — это тошнота, рвота, токсические эффекты. А чтобы осложнений было меньше, наряду с химио- и лучевой терапией проводится так называемая сопроводительная терапия. Она, как и химиотерапия, очень дорогостоящая, но обойтись без нее сложно. Так, примерно через неделю после шестидневной интенсивной непрерывной химиотерапии в организме снижается уровень лейкоцитов, так как вместе с раковыми клетками подавляется нормальное крове-творение. А жить без лейкоцитов человек не может, ведь они защищают организм от инфекций. После курса химиотерапии лейкоцитов может не быть в течение месяца. Из-за этого могут возникнуть сепсисы, лихорадки и другие инфекционные осложнения. Именно поэтому обязательно нужно проводить сопроводительную терапию — это и антибиотики широкого спектра действия, противогрибковые препараты широкого спектра действия, иммуноглобулины. Стоят все эти лекарства очень дорого. Но они необходимы, чтобы помочь ребенку перенести химиотерапию и избежать тяжелых инфекций. Кроме того, после высокодозной химиотерапии у больного могут быть и токсические осложнения в виде поражения печени, почек и т.д.
— А каковы основные причины рака у детей?
— Ответить на этот вопрос однозначно сложно, так как причин много. Это и ионизирующее облучение, радиация. Научно доказана роль некоторых вирусов, которые могут спровоцировать заболевание, и иммунодефицитные состояния, кроме того, характерны у детей и эмбриональные (врожденные) опухоли. В некоторых случаях прослеживается наследственность, например, при ретинобластоме (опухоли глаза).
Детская онкология — это не приговор. Но дети должны поступать на лечение своевременно. Чем раньше поставлен диагноз, тем лучше будет результат. Запущенные стадии онкологии вылечить очень сложно. Детская смертность от рака в Бурятии не превышает российских показателей. В 2009 году смертность составила 4,7 на 100 тысяч детского населения.
Но у нас несколько выше поступление детей в запущенной стадии рака. Это связано с низкой онкологической настороженностью населения, ведь никто не думает, что у детей может быть рак. Поэтому родителям нужно очень внимательно относиться к своим детям.
Родители назвали эту белокурую, синеглазую девочку красивым, звучным именем Виолетта. Несмотря на то что в дружной семье Григорьевых уже есть двое старших детей, родители давно мечтали о маленькой принцессе Виолетте.
Развитая не по годам девочка без устали радовала своих любящих родителей — с четырех месяцев она начала выговаривать простые слова, а в 10 месяцев стала ходить.

Семья Григорьевых не богата. Они живут в краю старообрядцев, в селе Бичура Бичурского района Бурятии, и собрать такие деньги без помощи земляков не смогут.
По всем вопросам можно обращаться по тел.: +7(914) 837-02-11.
Деньги на операцию Виолетте Григорьевой можно перечислить по этим реквизитам:
ИНН 7707083893, КПП 032302001, ОГРН 1027700132195
Бурятское отделение №8601 Сберегательного банка Российской Федерации,
г. Улан-Удэ, БИК 048142604
Расчётный счёт №40703810609160018734

Прогноз выживаемости при раке
Важен и такой показатель, как относительная выживаемость. При его подсчёте учитывают количество лиц, страдающих раком определённой локализации, которые умерли от сопутствующей патологии. Выживаемость при раке зависит от стадии заболеваемости, пола, возраста и, чувствительности к проводимому лечению и наличия фоновых заболеваний.
Согласно данным ВОЗ (Всемирной организации здравоохранения) смертность от онкологической патологии увеличилась за последнее время на 11%. Рост заболеваемости раком отмечают у детей и лиц среднего возраста. Так, в 2011 году распространённость злокачественными новообразованиями составила 15000 на 100000 жителей страны, в Украине – 1520, а в Беларуси – 1514.
Структура онкологических заболеваний выглядит таким образом:
рак лёгкого, бронхов и трахеи, - 13,8%;.
новообразования кожи - 11,0%, меланома - 12,4%;
опухоли желудка составили - 10,4%;
рак молочной железы установлен в 10,0%;
неопроцесс ободочной кишки - 5,9%, прямой кишки, прямокишечно-сигмовидного соединения и анальной области - 4,8%;
онкопатология лимфатической и кроветворной системы - 4,4%;
шейки матки - 2,7% ,рак тела матки - 3,4%, а яичников - 2,6 %,
опухоли почек - 3,1%;
злокачественные новообразования поджелудочной железы - 2,9 %;
рак мочевого пузыря - 2,6 %.
Выживаемость после лечения рака предполагает подсчёт количества пациентов, которые выжили в течение определённого периода после проведенного радикального или паллиативного лечения. Учитывается двухлетняя, пятилетняя, семилетняя и десятилетняя выживаемость.
Процент выживаемости при раке различной локализации
Рассмотрим показатели выживаемости при различной локализации злокачественных новообразований в зависимости от стадии заболевания. Для этого, прежде всего, определимся со стадиями рака. Наиболее приемлемой для определения прогноза выживаемости является классификация TNM, в которой T – размер опухоли, N – поражение лимфатических узлов, а M – наличие метастазов в отдалённых органах.
Прогноз выживаемости при раке кожи определяется, прежде всего, стадией заболевания. Он зависит и от гистологической структуры опухоли, а также степени дифференцировки раковых клеток.
Рак 1 степени. Прогноз таков: излечение наступает у 100% пациентов.
Рак 2 степени. Прогноз для выздоровления удовлетворительный у 86% пациентов.
Рак 3 степени. Прогноз выздоровления – 62%.
Рак 4 стадии. Прогноз пятилетней выживаемости 12%.
Меланома является чрезвычайно агрессивной опухолью, которая происходит из пигментных клеток. Прогноз выживаемости зависит от стадии болезни, локализации опухоли и степени дифференциации атипичных клеток.
При I стадии меланомы до пяти лет живут около 97% пациентов.
При II стадии пятилетняя выживаемость составляет 65%.
При III стадии рака процент выживаемости –37%.
При IV стадии заболевания до одного года доживает всего 15%пациентов.
Прогноз выживаемости при раке нижней губы находится в прямой зависимости от стадии заболевания, возраста пациента, степени дифференцировки опухоли и её чувствительности к лучевой терапии:
A. При I стадии до пяти лет живут 70% пациентов.
B. При II стадии пятилетняя выживаемость 59% .
C. Когда в III стадии определяют рак, процент выживаемости всего 35%.
D. При IV стадии рак губы до одного года доживает 21% болеющих людей.
Многим пациентам ставят диагноз рак ротовой полости. Процент выживаемости у них зависит не только от стадии заболевания, но и от формы роста опухоли, степени дифференцировки раковых клеток и возраста пациента. Прогноз выживаемости показан на таблице №1.
Таблица №1.Прогноз выживаемости при раке слизистой оболочке ротовой полости
Процент пятилетней выживаемости
Опухоль ротовой полости – это достаточно агрессивный рак. Процент выживаемости до одного года – всего лишь 16.
Динамику пятилетней выживаемости при раке щитовидной железы в зависимости от стадии заболевания можно увидеть на графике №1.
График №1. Динамика пятилетней выживаемости при разных стадиях рака щитовидной железы.

Трагическая судьба пациентов при выявлении неоперабельного рака лёгких: 90% из них погибает в течение первых двух лет после установления диагноза. При одном выполненном хирургическом вмешательстве в течение пяти лет выживает 30% пациентов, у которых в лёгких диагностирован рак. Процент выживаемости при радикальном комплексном лечении рака лёгких можно увидеть на таблице№2.
Таблица №2. Пятилетняя выживаемость пациентов, страдающих раком лёгких, в случае полноценного радикального лечения
Процент пятилетней выживаемости
Выживаемость после радикального оперативного лечения рака пищевода является чрезвычайно информативным показателем. Она представлена на таблице №3.
Таблица №3. Пятилетняя выживаемость после оперативных вмешательств по поводу рак пищевода
Конечно же, на показатель выживаемости пациентов, страдающих раком пищевода, влияет и стадия заболевания. При первой стадии онкологического процесса процент пятилетней выживаемости наиболее высокий: он составляет 57%. В течение пяти лет выживает 43% людей, у которых выявлен рак пищевода второй стадии. При третьей стадии заболевания в течение пяти лет живут 25% больных людей. К сожалению, только пациентов, у которых рак пищевода диагностирован на четвёртой стадии, выживают один год.


03 марта 2016, 14:23
Рак грудины – злокачественное новообразование, развивающееся в результате мутации костных клеток. В большинстве случаев он.

03 марта 2016, 14:17
Рак желудка до сих пор является одним из наиболее распространённых злокачественных новообразований органов пищеварения. В.

03 марта 2016, 14:09
Рак молочной железы относится к визуальным формам рака. Это значит, что опухоль на ранней стадии.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Проведен анализ литературы, посвященной проблеме исходов беременности женщин, перенесших в детском возрасте лечение злокачественных опухолей. Благодаря современным достижениям в терапии злокачественных опухолей у детей большинство пациентов достигают репродуктивного возраста. Известно, что применяемые для лечения данных опухолей цитостатические препараты и ионизирующее излучение являются потенциальными мутагенами. У женщин, излеченных в детском возрасте от злокачественных опухолей, достоверно повышаются риски осложнений беременности и родов, выкидышей на раннем сроке, внутриутробной задержки роста и развития плода, гестационного диабета, артериальной гипертензии, преждевременных родов, анемии, разрыва матки в родах. Для детей, рожденных от таких матерей, характерны более низкий вес при рождении, высокая частота врожденных пороков развития, а также мертворождений. С целью своевременного выявления отклонений в течении беременности и аномалий развития плода необходимо тщательное наблюдение беременных, перенесших в детском возрасте лечение злокачественных опухолей. Они требуют повышенного внимания к планированию и ведению беременности и родов, а их родившиеся дети обязательно должны быть тщательно обследованы на наличие стигм дизэмбриогенеза и пороков развития.
Ключевые слова: беременность, злокачественные новообразования, дети, фертильность.
Для цитирования: Курочкина Д.Н., Кулева С.А. Исходы беременности женщин, излеченных от злокачественных опухолей в детстве. РМЖ. 2019;6:53-56.
Pregnancy outcomes of female childhood cancer survivors
D.N. Kurochkina 1 , S.A. Kuleva 2
1 St. Petersburg Clinical Scientific and Practical Center of Specialized Medical Care (Oncological), St. Petersburg
2 National Medical Research Center of Oncology named after N.N. Petrov, St. Petersburg
Keywords: pregnancy, malignant tumors, children, fertility.
For citation: Kurochkina D.N., Kuleva S.A. Pregnancy outcomes of female childhood cancer survivors. RMJ. 2019;6:53–56.
В статье проведен анализ литературы, посвященной проблеме исходов беременности женщин, перенесших в детском возрасте лечение злокачественных опухолей
Введение
Благодаря современным достижениям в терапии злокачественных опухолей у детей долговременная выживаемость излеченных превышает 80% [1]. Следовательно, большинство пациентов достигают репродуктивного возраста.
Известно, что применяемые для лечения опухолей цитостатики и ионизирующее излучение являются потенциальными мутагенами и причиной увеличенного риска спонтанных выкидышей, мертворождения, рождения незрелых плодов и аномалий развитий плода, в т. ч. наличия у них злокачественных новообразований. Некоторые исследования доказывают влияние гамма- и нейтронного излучения на частоту мутаций через несколько лет после экспозиции, используя частоту мутаций в локусе гликофорина А [2, 3] или в локусе гипоксантингуанинфосфорибозилтрансферазы [4].
Все цитостатики можно классифицировать как мутагенные и немутагенные. К первой группе относятся доксорубицин, даунорубицин, циклофосфамид, ифосфамид, 1-(2-хлороэтил)-3-циклогексил-1-нитрозомочевина (ломустин), 1,3-бис (2-хлорэтил)-1-нитрозомочевина (кармустин), 5-(3,3-диметил-1-триазено)-имидазол-4-карбоксамид (дакарбазин), цис-диамминдихлороплатинум (II) (цисплатин), прокарбазин, хлорамбуцил, этопозид и меркаптопурин [5–9]. К немутагенным агентам причислены винкристин, винбластин, метотрексат, аспарагиназа и дактиномицин [7–10].
Исходы беременности у женщин, перенесших в детском возрасте лечение злокачественных опухолей, стали предметом многих исследований [11, 12]. Эмбриональные пороки диагностированы у 19,2% (10 из 52) плодов, матери которых получали в I триместре беременности аминоптерин [11], у 50% (3 из 6) плодов, матерям которых на том же сроке вводился циклофосфамид, у 50% (один из двух) после лечения матери хлорамбуцилом и у 9,1% (2 из 22) — бусульфаном [12]. Неоднозначны сообщения о последствиях применения метотрексата на фоне беременности: есть сообщения о рождении ребенка с множественными врожденными пороками [8], в то же время немало сообщений о рождении абсолютно здоровых детей на фоне приема метотрексата [13], и даже после полихимиотерапии (ПХТ) меркаптопурином, метотрексатом, винкристином, преднизолоном и в качестве реиндукции — винкристином, преднизолоном и доксорубицином [14].
Исходы беременности после онкологического лечения в детстве
Большинство работ по изучению исходов беременности в основном связаны с первичной лимфомой Ходжкина (ЛХ), опухолью Вильмса и острым лимфобластным лейкозом (ОЛЛ). В таблице 1 представлены сведения об исходах беременности у больных, прошедших лечение по поводу первичной ЛХ [15–23].
По сообщениям G. E. Holmes и F. F. Holmes (1978), у пациентов, получавших ПХТ по поводу ЛХ, новорожденные дети чаще имели аномалии в развитии (аутизм, склеродерма, врожденные пороки), чем в группе контроля, которая включала здоровых сиблингов. Это исследование, одно из ранних по данной теме, интересно еще и тем, что одной из групп сравнения были пациенты, лечившиеся только с использованием лучевой терапии (ЛТ) [17].
В исследовании E.A. McKeen et al. (1979) у 50% новорожденных (4 из 8), родители которых лечились по поводу ЛХ, были диагностированы врожденные пороки, в то время как среди новорожденных, родители которых уже завершили лечебную программу, пороки имелись только у 14,7% (5 из 34), это доказывает вероятность временнóй связи терапии с частотой пороков [18].
Исследования S. S. Donaldson и H. S. Kaplan (1982), D. M. Green и B. Hall (1988) показали отсутствие нежелательных исходов беременности у пациенток, получавших терапию по поводу ЛХ в детском и подростковом возрасте (см. табл. 1) [22, 23].
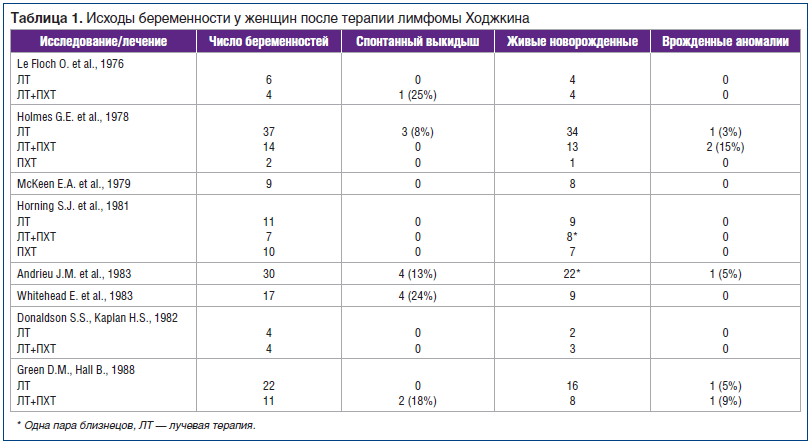
D. M. Green et al. (1982) опубликовали сведения о 81 ребенке, родившемся от 27 женщин и 9 мужчин, в детстве лечившихся от опухоли Вильмса. Частота спонтанных абортов не отличалась от таковой в общей популяции. Вес новорожденных от женщин, получивших ЛТ брюшной полости, был достоверно ниже [24]. Это подтверждено в исследовании F. P. Li et al. (1987) [25]. Без врожденных пороков рождены несколько детей пациентками, в детстве лечившимися от ОЛЛ [26].
Наиболее масштабным было исследование исходов беременности у 20 276 больных, в детстве перенесших злокачественное заболевание и наблюдавшихся 5 и более лет после лечения (исследование выживших после рака в детском возрасте Childhood Cancer Survivor Study) [27]. У 1950 женщин было 4029 беременностей: 63% беременностей закончились рождением живых детей, 1% — мертворождением, 15% — самопроизвольным выкидышем, 17% — абортом. Соотношение новорожденных по полу (мальчиков и девочек) составило 1,09:1 (как и в здоровой популяции). Женщины в возрасте 21–25 лет чаще остальных прерывали беременность по медицинским показаниям.
У больных, леченных по поводу злокачественных опухолей ЦНС, чаще возникали самопроизвольные выкидыши: относительный риск (Relative Risk — RR) составил 1,65; 95% доверительный интервал (Confidence Interval — CI) 1,16–2,34 (p=0,006). Кроме того, краниоспинальное облучение увеличивало частоту выкидышей на сроках гестации более 12 нед. (RR=6,10; 95% CI: 3,06–12,2; p 2 (HR=0,22; 95% CI: 0,06–0,79; p=0,020), в дозе ≥450 мг/м 2 (HR=0,14; 95% CI: 0,03–0,55; p=0,0051) и ломустин в дозе >411 мг/м 2 (HR=0,41; 95% CI: 0,17–0,98; p=0,046) [28].
Группой по исследованию опухоли Вильмса (National Wilms Tumor Study Group) представлены сведения о 427 беременностях у пациенток, выживших после лечения опухоли Вильмса [29]. Был один самопроизвольный выкидыш, 4 мертворождения, 406 живых новорожденных и 12 двоен. Среди осложнений беременности авторы выделяют гипертензию, ранние или преждевременные роды, неправильное положение плода, слабость родовой деятельности, обвитие пуповиной. Ранние или преждевременные роды (p=0,03) и неправильное положение плода (p=0,007) чаще диагностированы у женщин, получавших в анамнезе ЛТ на органы малого таза.
Средний гестационный возраст у новорожденных, родившихся у женщин после облучения брюшной полости, составил 37,23±4,00 нед., у женщин, не подвергавшихся облучению, — 38,47±2,95 нед.
Средний вес новорожденных детей у больных, лечившихся с применением ЛТ, составил 3036±805 г, без ЛТ — 3245±620 г (p=0,02). Достоверно чаще вес ребенка при рождении составлял менее 2500 г у рожениц, в детстве получивших облучение (p=0,017). Большинство маловесных детей соответствовали гестационному возрасту. Не было различий в количестве маловесных детей в группе излечившихся только дактиномицином или винкристином и дактиномицином и в группе получавших трехкомпонентную схему ПХТ.
Причинами рождения детей с малым весом, по-видимому, являются недостаточная функция яичников, нарушения васкуляризации и объема матки, возникающие после облучения малого таза.
C. Anderson et al. (2017) пришли к выводу, что у подростков и молодых взрослых, излеченных от злокачественных опухолей, в будущем чаще рождаются недоношенные, маловесные дети, чем в никогда не болевшей популяции. А вот частота низкой оценки по шкале Апгар (менее 7 баллов) не коррелировала с наличием ПХТ и/или ЛТ в анамнезе [30].
В исследованиях, проведенных в группах пациентов, в детстве излеченных от опухоли Вильмса и от ОЛЛ, не выявлено повышения частоты рождения детей с врожденными пороками развития [31, 32]. По данным D. M. Green et al. (2002), 32 порока развития диагностированы у 309 новорожденных: 12 из них имели одиночный порок, 5 — по 2 порока, 2 — по 3 порока и один ребенок имел 4 порока развития. В данном исследовании подтверждена достоверность увеличения частоты аномалий у детей, матери которых получали ЛТ (p=0,054). Комбинации цитостатиков в данном исследовании на частоту аномалий развития влияния не имели [30].
Схожие результаты были опубликованы японскими учеными M. Sekiguchi et al. (2017). В исследование включена 61 женщина с общим числом родов 71. Из них 24% — преждевременные роды, в среднем на сроке 37,9 нед. Также характерно было рождение маловесных детей (средний вес новорожденных составил 2718 г). Число врожденных пороков — 4,2% (3 ребенка от общего количества беременностей). Исследователи отметили, что количество преждевременных родов было выше, а вес новорожденных — ниже у женщин, получавших в детском возрасте ЛТ на область малого таза, в сравнении с теми женщинами, кто ЛТ не получал (соответственно 42% и 16%, p=0,025; 2,436±737 г и 2,827±483 г, p=0,010) [33].
Дети, родившиеся в семьях с наследственно обусловленным фенотипом рака (билатеральная ретинобластома, нейрофиброматоз, семейный полипоз кишечника и др.), имеют повышенный риск развития злокачественной опухоли. Частота же новообразований у детей, родители которых в детстве лечились по поводу той или иной опухоли (генетически недетерминированной), составляет 0,3%, в группе контроля здоровых сиблингов — 0,23% [34].
Заключение
Таким образом, проанализировав данные литературы, можно сделать вывод, что результаты всех исследований схожи. У женщин, излеченных в детском возрасте от злокачественных опухолей, достоверно повышаются риски осложнений беременности и родов. Риски можно разделить на две группы: связанные с матерью и связанные с рожденным ребенком. К первой группе относятся повышенный риск выкидышей на раннем сроке, внутриутробной задержки роста и развития плода, гестационного диабета, артериальной гипертензии, преждевременных родов, анемии, разрыва матки в родах. Для детей, родившихся от матерей, излеченных в детстве от злокачественных опухолей, характерен более низкий вес при рождении, более низкий гестационный возраст, выше частота врожденных пороков развития, мертворождений в отличие от детей, рожденных от здоровых женщин.
Несомненно, беременные женщины, в детстве перенесшие злокачественное заболевание, требуют повышенного внимания к планированию и ведению беременности и родов, а их родившиеся дети обязательно должны быть тщательно обследованы на наличие стигм дизэмбриогенеза и пороков развития.
Только для зарегистрированных пользователей

Все пациенты по-разному реагируют на диагноз онкологического заболевания. Многие предпочитают избегать информации, которая может быть неприятной, в то время как другие ищут максимально точные ответы. Никто не может сказать, какая из этих стратегий является более правильной. Тем не менее, одним из частых вопросов онкологических пациентов является вопрос к врачу о предполагаемой продолжительности жизни. В онкологии для предполагаемой оценки продолжительности жизни пациентов используются различные статистические термины, многие из которых непонятны для пациента. В данном материале описаны основные термины, которые используют врачи для определения прогноза при онкологических заболеваниях.
Важно понимать, что ни один врач не может точно ответить пациенту на вопрос о его продолжительности жизни. Срок жизни любого человека зависит от многих факторов, не все из которых связаны с болезнью. Предполагаемая продолжительности жизни онкологического пациента зависит от:
- Вида злокачественной опухоли и её расположения в организме (локализации);
- Стадии заболевания, включая размеры и распространенность опухоли;
- Биологических особенностей опухоли. её агрессивности и скорости роста, а также некоторых генетических особенностей раковых клеток;
- Чувствительности опухоли к проводимому лечению;
- Возраста и общего состояния здоровья пациента.
Для оценки эффективности различных методов лечения применяются статистические методы, которые позволяет оценить выживаемость групп пациентов. Наиболее часто оцениваются следующие показатели выживаемости:
Разновидностью общей выживаемости является относительная выживаемость пациентов, которая является наиболее удобным показателем для оценки выживаемости пациентов пожилого возраста. При оценке этого показателя оценивается соответствие выживаемости пациентов определенного возраста со злокачественным новообразованием с выживаемостью людей схожего возраста, но без наличия онкологического заболевания.
Пример 1: 5-летняя выживаемость пациентов с диагнозом рака шейки матки составляет 68%. Это означает, что 68 пациенток из 100 переживает 5 лет с момента постановки диагноза.
Пример 2: медиана выживаемости пациенток с диагнозом определенной злокачественной опухоли составляет 60 месяцев. Это означает, что 50% пациенток с данным заболеванием переживают 5-летний срок с момента постановки диагноза.
Именно указанные выше показатели используются в клинических исследованиях (подробнее про клинические исследования – здесь) для того, чтобы оценить эффективность различных методов лечения и сделать вывод о целесообразности их применения.
Для графического отображения показателей выживаемости используются специальные графики, на которых изображаются так называемые "Кривые Каплана-Майера" (Рисунок 1).
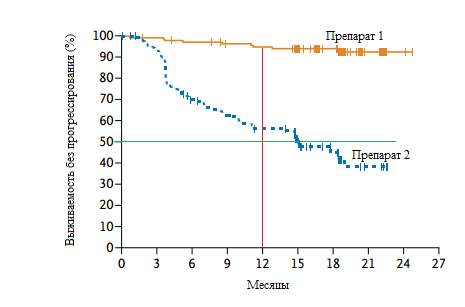
Рисунок 1. Пример кривых Каплана-Мейера по выживаемости без прогрессирования пациентов в одном из исследований. Красной линией обозначена 1-летняя выживаемость без прогрессирования, зеленой - медиана выживаемости без прогрессирования. Из графика видно, что препарат 1 демонстрирует значительные преимущества перед препаратом 2.
Таким образом, предсказать точную продолжительность жизни для отдельного пациента является крайне трудной задачей. Для предположительной оценки выживаемости врачи используют статистические данные, полученные в ходе проведения клинических исследований, в которых участвовало большое количество пациентов с определенными видами и стадиями опухолей. Такие оценки позволяют оценить среднюю выживаемость в больших группах пациентов, однако эту статистику бывает трудно перенести на отдельного пациента. Кроме того, методы лечения злокачественных опухолей постоянно совершенствуются, по этой причине данные такой статистики могут не учитывать все многообразие доступных методов лечения.
К примеру, Ваш врач может сообщить, что он оценивает прогноз течения заболевания как благоприятный. Это означает, что имеющиеся данные указывают на чувствительность опухоли к терапии и высокую вероятность хорошего контроля болезни в течение длительного времени, достижения длительной ремиссии – или даже излечения.
Подводя итоги, следует еще раз подчеркнуть следующие основные моменты:
- Статистика позволяет оценить выживаемость больших групп пациентов, но не позволяет предсказать прогноз течения заболевания и точную продолжительность жизни отдельного пациента;
- Статистика выживаемости может значительно отличаться при различных типах и стадиях опухолевого процесса, возраста пациента и проводимого лечения;
- Показатели общей выживаемости и выживаемости без прогрессирования широко применяются в клинических исследованиях для того, чтобы оценить эффективность изучаемого метода лечения;
- Статистические данные дают врачам полезную информацию для выбора наиболее подходящего метода лечения, но являются лишь одним из факторов, которые необходимо учитывать при выработке плана лечения.
Читайте также:

