Дистанционная гамма-терапия при раке молочной железы
В связи с высокой распространенностью рака молочной железы возникает необходимость в усовершенствовании методов лечения. Раком груди, согласно статистике, болеет каждая десятая женщина. Мужчины подвергаются ему реже, но заболевание у них носит более агрессивный характер.
Причин множество. Это и генетическая предрасположенность, и гормональные нарушения, и воспалительные и онкологические заболевания половых органов, и низкая стрессоустойчивость, пагубные привычки, отсутствие в анамнезе беременностей и родов, и много других. В последние годы все больше ученых склоняются к вирусной теории онкологических заболеваний молочной железы, но убедительные данные пока не получены.
Симптомы рака молочной железы на ранних стадиях отсутствуют, а с прогрессированием заболевания появляются свойственные раку изменения груди и присоединяются симптомы раковой интоксикации.
Диагностика рака груди включает сбор жалоб, анамнеза, осмотр, пальпацию и дополнительные методы исследования. Окончательный диагноз ставится на основании гистоиммунохимического исследования биоптата, взятого во время биопсии.
А вот лечение подбирается индивидуально в каждом конкретном случае. Оно зависит от многих факторов. К ним относятся:
- Стадия рака молочной железы;
- Гистоиммунохимическое строение опухоли;
- Степень дифференцировки клеток новообразования;
- Гормонозависимость раковых клеток;
- Наличие метастазов;
- Наличие сопутствующей патологии;
- Распространенности процесса;
- Общего состояния пациента и др.
На сегодняшнее время в лечении рака молочных желез применяют следующие методы лечения:
Каждый из этих методов имеет свои преимущества и недостатки.
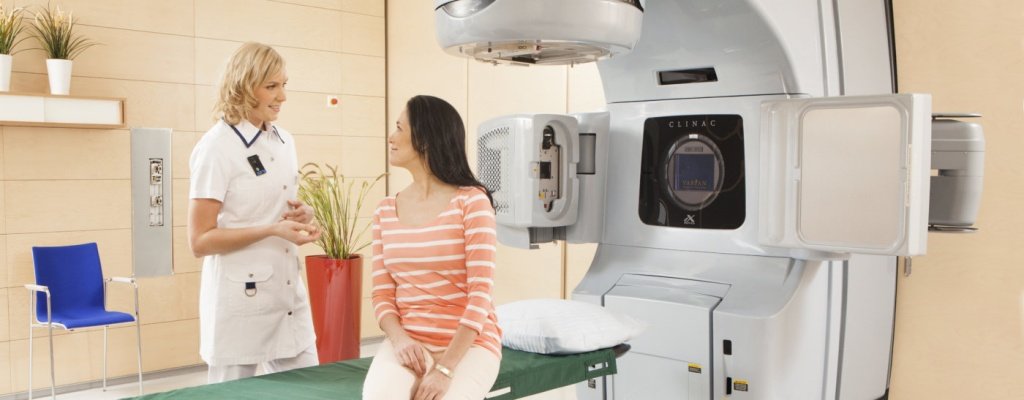
Лучевая терапия при раке молочной железы – метод комплексного лечения, который пагубно влияет на раковые клетки путем воздействия ионизирующего излучения. Используется в комбинации с другими методами лечения, чаще всего с хирургическим или химиотерапией. Радиотерапия применяется на всех стадиях рака молочной железы, поскольку помогает либо полностью излечиться от рака, либо повысить качество жизни и ее длительность. Развитие лучевой терапии позволило избавиться от многих несовершенств и излучение теперь действует более целенаправленно.
В Юсуповской больнице специалисты работают, используя современные методики радиотерапии. Количество курсов и дозу определяют индивидуально для каждого пациента, учитывая его особенности и характеристики опухолевого процесса. Врачи подбирают комплексное лечение, которое ведет к максимально благоприятному прогнозу. Очень часто лучевая терапия применяется после хирургического лечения рака молочной железы, так как многие типы склонны к рецидиву. В Юсуповской больнице тщательно планируются все этапы лечения, максимально качественно оказываются услуги. При возникновении вопросов необходимо записаться на консультацию.
Виды лучевой терапии при раке молочной железы
Лучевая терапия может проводиться в следующих режимах:
- Наружная радиотерапия – облучение рентген аппаратом в стационарных условиях. Один курс длится месяц-полтора. Данный режим используется наиболее часто.
- Брахитерапия – внутренняя радиотерапия, выполняется путем введения имплантатов с радиоактивными средствами. Сеанс длится около пяти минут на протяжении недели. После процедуры остаются маленькие разрезы, через которые водился катетер.
В зависимости от поставленной цели радиотерапия подразделяется на такие виды:
- Внутритканевая – применяется при узловой форме рака молочной железы;
- Самостоятельная радиотерапия – на терминальных стадиях, при неоперабельных новообразованиях;
- Предоперационная – для предотвращения рецидивов, улучшения абластики;
- Интраоперационная лучевая терапия – применяется во время операций, цель которых есть удаление опухоли с сохранением молочной железы;
- Послеоперационная радиотерапия – для воздействия на оставшиеся раковые клетки и лимфоузлы.
Показания к лучевой терапии при раке молочной железы
Показаниями к радиотерапии являются:
- Обширный рак без распада;
- Более четырех вовлеченных в процесс лимфатических узлов;
- Обширное раковое поражение лимфоузлов с возникновением конгломерата с нервами, артериями, венами;
- Операция, при которой удаляется только часть железы.
Согласно отзывам, как врачей, так и пациентов, применение лучевой терапии при раке молочной железы дает возможность добиться полного выздоровления, предотвратить рецидив, либо существенно продлить и улучшить качество жизни.
Последствия лучевой терапии при раке молочной железы
Последствия лучевой терапии при раке молочной железы, благодаря усовершенствованию методов, значительно уменьшились. После курса лучевой терапии возможно возникновение следующих последствий:
- Болевой синдром умеренной интенсивности, который связан с миозитом после облучения и специальной терапии не требует;
- Отек молочной железы, который самостоятельно проходит на протяжении года;
- Изменение цвета кожи на месте облучения, которое носит обратимый характер.
Но иногда возникают и последствия, требующие контроля и/или лечения:
- Болевой синдром, выраженный, с дегенеративными изменениями и снижением мышечной силы;
- Постлучевые язвы;
- Отек верхней конечности;
- Пневмонит вследствие облучения и др.
В Юсуповской больнице радиотерапия проводится с использованием современной техники и под контролем врачей высшей категории. Данный метод применяется успешно с минимальным количеством последствий.
Гамма терапия представляет собой воздействие на пораженную раком часть тела радиоактивным излучением изотопов. В зависимости от вида онкологического поражения преследует две основные задачи:
- Уничтожение мутированных клеток в очаге патологического роста опухоли.
- Стабилизация развития злокачественного новообразования путем блокирования процессов размножения раковых элементов.
Как делают гамма-терапию?
В зависимости от расположения очага мутации в онкологической практике используются следующие методики гамма-терапии:
- Контактный метод:
Данная методика включает применение специального аппликатора с радиоактивными изотопами, который располагается непосредственно на кожных покровах. Перед проведением процедуры врач опускает специальную пластину в горячую воду, где она через 10-15 минут размягчается. После этого будущий аппликатор прикладывается к пораженному участку тела и он приобретает соответствующую форму, повторяя все неровности и изгибы. Аппликационная гамма-терапия осуществляется размещением индивидуальной пластмассовой пластины с зафиксированными на ней радиоактивными элементами. С профилактической целью терапевтическую область покрывают специальной свинцовой пластиной для защиты других участков тела от радиационного облучения.
Контактная гамма-терапия показана при злокачественном поражении кожных покровов, кавернозных ангиомах и других поверхностных формах опухолей.
- Внутритканевой метод:
Это такой способ радиологической терапии, при которой радиоактивные элементы в виде цилиндрической иглы вводятся непосредственно в пораженную ткань. Процедура, как правило, проводится под местной инфильтрационной или проводниковой анестезией. Необходимая доза облучения исчисляется в единицах на 1см². Внутритканевая терапия показана при высокодифференцированных опухолях размером до 5 см. Недостатком данной методики считается неравномерное распространение рентгеновского излучения и быстрое падение дозы облучения.
- Внутриполостной метод:
Представляет собой процедуру введения радиоактивного зонда шаровидной формы в полость пораженного органа. За ходом процедуры проводится постоянный мониторинг с помощью рентгенологической диагностики. Данная методика требует применения высокоактивных изотопов. Процедура показывает высокую эффективность при терапии злокачественных поражений желудочно-кишечного аппарата, мочевыводящей системы и тела матки. Внутриполостное лечение, как самостоятельная методика, используется исключительно при онкологии слизистых оболочек. В других клинических случаях эта терапия сочетается с дистанционным методом.
- Дистанционная гамма-терапия:
Это способ воздействия на опухоль высокоактивным радиологическим излучением специального стационарного гамма-аппарата, который генерирует облучение на определенном расстоянии от патологической области. Данное лечение показано практически для всех глубоко локализованных опухолей с высокой рентгенологической чувствительностью.
По способу проведения дистанционная радиотерапия бывает двух видов:
- Статическая методология. Источник гамма-излучения и онкобольной находятся в фиксированном положении.
- Подвижная терапия. Пациент фиксируется в неподвижном состоянии, а излучатель перемещается вокруг пораженной области тела.
Все способы дистанционного воздействия требуют постоянного рентгенологического контроля за ходом процедуры.
Гамма-терапия: показания к проведению
Гамма-терапия достаточно широко применяется во всех сферах онкологии, но в большинстве случаев является неотъемлемой частью комплексной противораковой терапии. Такие раковые заболевания, как лимфатический рак, злокачественные поражения глотки, носоглотки и другие быстропрогрессирующие опухоли, требуют незамедлительного проведения рентгенологического облучения.

Эпителиальная онкология, согласно всемирным стандартам оказания медицинской помощи, подлежит комплексному применению хирургического способа лечения и гамма-терапии. Также, после неполной резекции пораженного органа, показано осуществление курса радиологической терапии для уничтожения оставшихся раковых клеток.
Абсолютным показанием к лучевой терапии служит неоперабельная форма злокачественного новообразования. Например, при раковом заболевании мозговых тканей целесообразными считаются такие методики:
- Гамма-нож. Суть метода заключается в применении специального шлема с встроенными излучателями радиоактивных волн. Во время процедуры энергия облучателя концентрируется в области раковой опухоли, что обеспечивает уничтожение раковых клеток. Использование технологии гамма-нож сохраняет здоровые ткани в безопасности, действуя исключительно на зону онкологии.
- Кибер-нож. Данный способ противораковой терапии включает использование роботизированного аппарата с мощным линейным ускорителем радиоактивных частиц. Данное устройство вычисляет наиболее эффективное направление и дозировку гамма излучения. Эта методика требует высокоточной предварительной диагностики ракового поражения.
Преимуществами подобных технологий считается абсолютная безболезненность процедуры, отсутствие разрезов кожи или трепанации черепа, точность радиоактивного воздействия и простота в применении.
Гамма-терапия: последствия и возможные осложнения
Наиболее распространенным осложнением гамма-терапии считается радиологическое повреждение кожных покровов, которое может проявляться как в ходе процедуры, так и через несколько дней после облучения. Сначала поверхность кожи становится красной с образованием сухого вида дерматита. В последующем такое воспаление эпидермиса может перейти в экссудативную фазу. Воспалительные явления могут наблюдаться также со стороны внутренних органов, которые находятся в зоне действия гамма-излучения.
В некоторых пациентов после радиологического лечения врачи диагностируют необратимые изменения тканей в виде полной или частичной атрофии.
Отдаленные осложнения гамма-терапии могут протекать в таких формах:
- Фиброз. Из-за гибели раковых тканей в стенках органа часто наблюдается замещение некротической области соединительной тканью, что сопровождается нарушениями функций.
- Выпадение или полная потеря волосяного покрова головы.
- Сухость слизистых оболочек ротовой и носовой полостей.
- Чувство хронической усталости.
- Нарушения в работе центральной нервной системы, включая развитие депрессивного синдрома.
- Летальный исход. Смерть пациента может произойти в случае сопутствующей тяжелой патологии сердца.
Рак молочной железы — одна из наиболее частых форм злокачественных опухолей у женщин. Распространение опухоли происходит путем прорастания ее в окружающие ткани, а также по лимфатическим и кровеносным путям.
Опухоль нередко вовлекает в процесс кожу молочной железы. Вследствие широкой сети лимфатических сосудов происходит довольно раннее метастазирование в регионарные лимфатические узлы.
Лечебная практика при раке молочной железы целиком определяется стадией развития заболевания. Основными методами лечения при этом являются хирургический и комбинированный, которые заключаются в оперативном вмешательстве, предоперационной и (или) послеоперационной лучевой терапии.
При распространенных формах заболевания широко используют химиотерапию и гормонотерапию, нередко в комплексе с локальным лучевым воздействием.
Ввиду многообразия течения рака молочной железы, вариаций размеров и положения первичного очага и регионарных метастазов лучевую терапию рака молочной железы осуществляют с помощью различных источников излучения — статических и подвижных гамма-установок, пучков быстрых электронов, тормозного излучения с энергией 6 — 25 МэВ.
В клинической практике наиболее распространенным способом при этом является статическая гамма-терапия. В I стадии заболевания и иногда даже в стадии IIа в настоящее время обычно ограничиваются только радикальным хирургическим вмешательством.
Классификация рака молочной железы
| Стадия заболевания | Международная классификация | Отечественная классификация |
| I | T1NOMO | Iа |
| II | T2NOMO | IIа |
| Т1 — 2N1MO | IIб | |
| III | ТЗ — 4NOMO | IIIа |
| ТЗ — 4N1MO | IIIб |
По международной классификации: Т — Опухоль, N — регионарные лимфатические узлы, М — отдаленные метастазы.
Т1 — опухоль размером до 2 см, кожа не поражена, нет ретракции соска.
Т2 — Опухоль размером 2 — 5 см, неполная фиксация кожи, морщинистость или ретракция соска.
ТЗ — опухоль размером более 5 см, но не более 10 см. Полная фиксация к грудной мышце или коже (инфильтрация, изъязвление) или наличие отека в коже, над опухолью.
Т4 — опухоль размером более 10 см или поражение кожи; или наличие отека в зоне, превосходящей размеры опухоли, но в пределах молочной железы; или фиксация к грудной стенке.
N0 — подмышечные лимфатические узлы на стороне поражения не пальпируются.
N1 — пальпируются одиночные плотные подмышечные лимфатические узлы на стороне поражения, не связанные ни между собой, ни с другими органами или тканями.
N2 — пальпируются спаянные между собой или другими анатомическими образованиями плотные подмышечные лимфатические узлы на стороне поражения.
N3 — определяются плотные над- или подключичные лимфатические узлы или отек руки.
МО — отдаленные метастазы отсутствуют.
M1 — имеются отдаленные метастазы.
Во II стадии, как правило, проводится предоперационная лучевая терапия с последующим радикальным оперативным вмешательством. С двух тангенциальных прямоугольных полей облучают всю молочную железу и фигурным полем — подмышечную область.
Лучевая терапия рака молочной железы

а — предоперационная дистанционная гамма-терапия; облучение молочной железы двумя противоположными полями; б — расположение полей облучения при послеоперационной дистанционной электронной терапии рака молочной железы (электроны 15 МэВ).
ГАММА-ТЕРАПИЯ (гамма[-излучение]+ греч, therapeia лечение) — вид лучевой терапии, основанный на использовании гамма-излучения.
Источниками гамма-излучения служат естественные изотопы — радий и мезоторий и искусственные — кобальт, цезий, иридий и тантал.
Длительный период полураспада этих изотопов ( 226 Ra — 1620 лет, 228 Msth — 6,7 года, 60 Со — 5,25 года, 137 Cs — 30 лет, 192 Ir — 74,4 дня, 182 Та — 111 дней) обусловливает их применение только для наружного облучения; в ткани их вводят в герметически закрытых металлических трубках-фильтрах, изготовленных либо из тяжелого металла (для 226 Ra и 228 Msth), либо из никеля, нержавеющей стали или тонкого слоя золота (для 60 Со, 137 Cs, 192 Ir, 182 Та).
Методика Г.-т. (расположение источника излучения по отношению к облучаемому органу) зависит от локализации, объема и гистол, строения патол, образования.
Содержание
- 1 Дистанционная гамма-тeрапия
- 2 Внутриполостная гамма-терапия
- 3 Внутритканевая гамма-терапия
- 4 Аппликационная гамма-терапия
- 5 Осложнения
- 6 Противопоказания
Дистанционная гамма-тeрапия
Дистанционную гамма-тeрапию (телегамматерапию) применяют в комбинации с хирургическим методом лечения — до и после операции — и самостоятельно для лечения по радикальному плану или с паллиативной целью. Под влиянием предоперационного облучения изменяются биол, свойства опухоли, снижается митотическая активность опухолевых клеток, разрушаются анапластические клетки, наиболее склонные к диссеминации, в результате чего уменьшается частота рецидивов и метастазов. Цель послеоперационного облучения — воздействие на клетки, диссеминированные во время операции, а при нерадикальных операциях и на остаточную опухолевую ткань. Как самостоятельный метод лечения дистанционную Г.-т. применяют с целью достижения полной регрессии опухоли путем разрушения наиболее чувствительных к излучению опухолевых клеток, стойкого нарушения процессов размножения менее чувствительных клеток и усиления реакции окружающей соединительной ткани, к-рая, разрастаясь в самой опухоли и вокруг нее, разделяет опухоль на отдельные комплексы и нарушает ее кровоснабжение.
Источник излучения ( 137 Cs, 60 Со) находится на расстоянии 6—75 см от поверхности тела больного. Для лечения патол, процессов, расположенных на глубине 3—5 см от поверхности тела (рак гортани, миндалин, щитовидной железы, метастазы рака в периферических лимф, узлах), можно производить облучение как на малом, так и на большом расстоянии; при локализации патол, процесса на глубине более 5 см — только на большом расстоянии. Облучение может быть статическим и подвижным. В первом случае источник излучения и больной находятся в фиксированном положении. При подвижном облучении источник излучения перемещается относительно оси тела больного (длинной или короткой) обычно на 90—360°. Угол вращения от 360 до 240° показан при центральном расположении опухоли, длинник к-рой совпадает или параллелен оси тела больного. При эксцентрическом расположении опухоли угол вращения должен быть меньше. Эксцентрическое секторное облучение применяют при поверхностном расположении патол, образований. Подвижное облучение позволяет сконцентрировать максимум дозы в области патол, очага и уменьшить ее на поверхности тела. Вращение источника излучения можно производить вокруг одной, двух или четырех осей. Двух- и четырехосное облучение чаще применяют при лечении распространенных патол, процессов в органах таза. Размеры полей облучения определяют таким образом, чтобы в зону 100% изодозы входила первичная опухоль и регионарные метастазы, а в зону 80% изодозы — область субклиническом распространения опухоли. По мере уменьшения размеров опухоли в процессе Г.-т. поля облучения, учитывая малую толерантность здоровых органов и тканей, включаемых в зону облучения, и большую радиочувствительность периферической части опухоли (см. Радиочувствительность), соответственно уменьшают. Для перемещения максимума дозы в патол, очаг в целях защиты радиочувствительных органов от действия излучения применяют свинцовые блоки и клиновидные фильтры. При Г.-т. больших опухолей для повышения толерантности подкожной клетчатки и близко расположенных органов и тканей необходимо использовать свинцовые решетки или растры. Величина общей очаговой дозы при дистанционной Г.-т. определяется гистол. строением опухоли или характером патол, процесса, его распространением, локализацией, возрастом больного, наличием сопутствующих заболеваний. Облучение производят фракционно. Дозы и интервалы между облучениями зависят от длительности митотического цикла опухолевых и нормальных клеток и от других факторов. При ежедневном фракционированном облучении разовая доза составляет 150—250 рад; при облучении с 2—3-дневными интервалами— 300—500 рад; при крупном фракционированном облучении с интервалом в 7 дней — 700—1000 рад. При увеличении разовой дозы соответственно уменьшают общую дозу.
При лечении рака полостных органов (шейки и тела матки, прямой кишки, мочевого пузыря, носоглотки, пищевода и др.) дистанционную Г.-т. целесообразно сочетать с внутриполостной.
Внутриполостная гамма-терапия
Внутриполостную гамма-терапию применяют при небольших опухолях прямой кишки, мочевого пузыря, полости носа после удаления небольших экзофитных опухолей этих органов или при любых размерах опухоли в сочетании с наружным облучением (при раке влагалища, матки, прямой кишки, мочевого пузыря, пищевода, носоглотки). Применение внутриполостной Г.-т. обусловлено необходимостью увеличения очаговой дозы в наиболее резистентной части опухоли, что вполне возможно вследствие быстрого падения мощности дозы излучения при распределении ее в тканях (уже на глубине 2 см остается до 40% дозы). В качестве источника излучения используют препараты 60Со цилиндрической или шаровидной формы (так наз. бусы), покрытые неактивным золотом.
В пораженную полость вводят и фиксируют в ней специальные аппликаторы, зонды или баллоны. Положение их по отношению к опухоли и соседним органам контролируют по рентгенограммам. Радиоактивные препараты из контейнера ручным способом или автоматически перемещают в аппликаторы. Мощность дозы определяют в зависимости от характера и распространения патол, процесса. Облучение с высокой мощностью дозы проводят в течение 30—60 мин. с интервалом в 1 нед. (при раке шейки, тела матки и прямой кишки), с малой мощностью — в течение 4—8 час. с интервалом в 3—4 дня (при раке пищевода, носоглотки и прямой кишки) или в течение 24— 48 час. с интервалом в 5—6 дней (при раке шейки, тела матки и носоглотки). В зависимости от локализации патол, очага и типа фракционирования аппликации повторяют 2—6 раз.
Внутритканевая гамма-терапия
Внутритканевую гамма-терапию применяют при лечении четко отграниченных опухолей диаметром не более 5 см, со средней и малой радиочувствительностью (рак языка, слизистой оболочки полости рта, нижней губы, кожи, рецидивы опухолей различного гистол, строения, неоперабельные метастазы в лимф, узлах, рак мочевого пузыря в первой стадии, рак в области анального канала). При внутритканевой Г.-т. радиоактивные препараты в виде игл или найлоновых трубочек, содержащих б0Со, 182Та или 192Ir (см. Радиоактивные препараты), вводят непосредственно в опухоль и вокруг нее, располагая их параллельными рядами на расстоянии 1—1,5 см друг от друга или по прямоугольнику. Для фиксации радиоактивных игл используют приспособления из оргстекла или пластмассы. Помимо гамма-излучающих препаратов, можно применять жидкие изотопы со смешанным излучением (гамма и бета). При введении препаратов необходимо соблюдать правила асептики.
Облучение производят с малой мощностью излучения непрерывно в течение 6—8 дней. Общая доза в зависимости от объема облучаемого патол, очага—5000—7000 рад при мощности излучения 30— 40 рад в час. Распределение дозы при внутритканевом облучении характеризуется быстрым падением ее мощности на расстоянии 1 см от препарата, благодаря чему осуществляется локальное воздействие, обеспечивающее его высокую биол, эффективность.
При метастазах рака полости рта и гортани в лимф, узлы подчелюстной области и шеи, при раке молочной железы, саркоме мягких тканей и других операбельных и стоящих на грани неоперабельности злокачественных опухолях, а также с целью предотвращения рецидивов и метастазов опухоли по брюшине и лимф, путям после операции по поводу рака желудка, кишечника и яичников применяют радиохирургический метод внутритканевой Г.-т.: опухоль удаляют, а в ее ложе и в окружающие ткани вводят радиоактивные препараты или ткани инфильтрируют коллоидными радиоактивными растворами. Коллоидный раствор 198Au, разведенный в изотоническом растворе хлорида натрия, вводят в брюшную полость через 10—14 дней после операции. Для анестезии брюшины применяют 0,25% раствор новокаина: 200 мл до введения радиоактивного препарата и столько же после.
Аппликационная гамма-терапия
Аппликационная гамма-терапия показана при доброкачественных (кавернозные ангиомы) и злокачественных опухолях кожи и слизистых оболочек, распространяющихся по поверхности и инфильтрирующих ткани вглубь не более чем на 1 —1,5 см. Источники излучения (60Со, 137Cs) располагают в одной плоскости в виде прямоугольника, квадрата или многоугольника. Препараты укладывают на предварительно приготовленном слепке (муляже) пораженной области, сделанном из пластической, затвердевающей при комнатной температуре массы. По мере прохождения излучения через опухолевую ткань отмечается быстрое падение мощности дозы: на глубине 2 см нормальные ткани не повреждаются. Облучение проводят ежедневно фракционно, разовая доза — 200—600 рад в течение 4—10 час. в день. В связи с трудностями радиационной защиты больного и обслуживающего персонала аппликационный метод применяют редко.
Осложнения
Осложнения при Г.-т., так же как и при других видах лучевой терапии (см. Лучевые повреждения), возникают при понижении толерантности нормальных тканей и органов, вызванном сопутствующими заболеваниями (гипертоническая болезнь, гипотензия, диабет, аллергии различной этиологии, сердечно-сосудистая недостаточность, авитаминоз, белковое голодание, ожирение). Причиной осложнений могут быть также ошибки при составлении плана терапии и отсутствие учета радиочувствительности соседних органов; в редких случаях — высокая индивидуальная радиочувствительность.
Характер осложнений определяется и методом Г.-т. При дистанционной Г.-т. осложнения чаще проявляются развитием склероза и атрофии облученных тканей и органов (фиброз подкожной клетчатки, пневмосклероз и др.); наиболее серьезные осложнения внутриполостной Г.-т.— перфорация органа, лучевые язвы, свищи; при внутритканевой Г.-т. (в случае расположения радиоактивных препаратов близко к хрящевой или костной ткани) — лучевые перихондриты, остеомиелит и лучевые язвы (в мягких тканях).
Противопоказания
Противопоказания к Г.-т.: 1) абсолютные — кахексия, истощение, декомпенсированные формы заболеваний сердца, печени, почек, гипоплазия костного мозга, наличие свищей в соседние полостные органы и выраженные склеротические изменения в тканях, вызванные предшествующей лучевой терапией, прогрессирующие формы туберкулеза; 2) относительные — воспалительные процессы, сопровождающие развитие опухоли, обширные опухолевые процессы, склонность опухоли к распаду и кровоточивости.
Библиография: Козлова А. В. Лучевая терапия злокачественных опухолей, М., 1971, библиогр.; П а в л о в А. С. Внутритканевая гамма- и бетатерапия злокачественных опухолей, М., 1967, библиогр.; Ратнер Т. Г. и Бибер-г а л ь А. В. Формирование дозных полей при дистанционной гамматерапии, М., 1972, библиогр.
Лучевая терапия воздействует только на делящуюся раковую клетку. Поэтому важно её проводить строго ритмично, без перерывов на праздники.
Показания к лучевой терапии при раке молочной железы
Если при раке молочной железы сохранить грудь, но провести её облучение, то риск местного возврата болезни (рецидива) снижается до уровня, как если бы пациентке была выполнена мастэктомия (удаление всей молочной железы). Кроме того, полное удаление молочной железы не всегда исключает необходимость лучевой терапии (если опухоль во внутренних квадрантах, или были выявлены метастазы в лимфатические узлы — показана лучевая терапия даже при мастэктомии).
Подготовка и техника проведения
Перед назначением лучевой терапии, пациентка проходит тщательный осмотр
Прежде чем назначать лучевую терапию, врач тщательно осматривает пациентку в условиях стационара. Если противопоказаний нет, женщину должны ознакомить с возможными осложнениями и особенностями реабилитации.
В ходе выполнения процедуры женщину кладут на твердую поверхность и надежно фиксируют. Лежать нужно на спине, рука с больной стороны отводится вбок. Это обеспечивает точное попадание лучей в требуемую зону.
Как только аппарат будет включен, из помещения выходят все, кроме пациентки, но при этом связь с доктором не утрачивается. Обеспечивается общение специальным прибором. Процедура совершенно безболезненна и в большинстве случаев отнимает мало времени.
Лучевая терапия при раке молочной железы после мастэктомии может быть нескольких видов:
- Облучение молочных желез подмышечная область надключичная область подключичная область. Разрабатывается лечение в различных комбинациях в зависимости от формы и стадии развития патологии.
- Облучение молочной железы или отдельного ее фрагмента по методу MammoSite.
Сроки проведения лучевой терапии при раке молочной железы после операции могут колебаться от нескольких дней до трех недель.
При лучевой терапии питание должно быть дробным, высококалорийным и полноценным, обогащенным большим количеством витаминов и минералов. Ежедневно нужно выпивать не менее 3 литров чистой воды, включая минеральную воду, витаминные чаи и соки.
Есть ли особенности лучевой терапии при РМЖ и импланте груди
Если лучевая терапия проводится на имплант, установленный вместо удалённой молочной железы, то очень важно, чтобы она проводилась с применением 3D — навигацией для линейного ускорителя (специалистом, который умеет его настраивать). Более старые аппараты не позволяют равномерно распределить дозу облучения и увеличивают и без того более высокий риск ожогов и потери импланта. Развитие капсульной контрактуры после лучевой терапии тоже бывает чаще.
Прогнозы при раке молочной железы СМОТРИТЕ ЗДЕСЬ
Реабилитационный период
Категорически запрещено пораженное место обрабатывать йодом
Осложнения и побочные действия зависят от количества курсов, а также силы облучения. После прохождения лучевой терапии назначается реабилитационный курс, включающий фототерапию для ускорения регенерации клеток и тканей организма.
Особенности реабилитационного периода:
- Сбалансированное питание, обогащенное витаминами, минералами, макро- и микроэлементами.
- Категорически запрещается пораженное место обрабатывать йодом и спиртовыми настойками, а также греть и травмировать грудину.
- Больше проводить времени на свежем воздухе.
- Запрещено употреблять алкоголь и курить.
При отсутствии противопоказаний можно приступать к выполнению лечебной физкультуры.
Когда можно начинать лучевую терапию при раке молочной железы
Если Вам предстоит курс лучевой терапии — договоритесь заранее с радиологом о времени его прохождения. Лучевую терапию можно проводить через 2-5 недель (в среднем — через 3-4 недели) после последнего введения химиопрепаратов (последнего цикла химиотерапии). Наши зарубежные коллеги не прерывают химиотерапию для проведения лучевой терапии, а проводят облучение сразу после неё.
Если химиотерапия не требуется — лучевую терапию можно начинать через 3-4 недели после операции, но не раньше 1 недели после удаления дренажа (если в зоне его стояния не копится лимфа-жидкость). Если же проводились пункции лимфы для эвакуации — лучевую терапию можно начинать не раньше 1 недели от последней пункции (при условии, что жидкость больше не копится).
Некоторые наши специалисты утверждают, что через 3-4 месяца лучевую терапию проводить неэффективно. Если до облучения Вы получали химиотерапию больше этого срока — это утверждение не верно!
Если химиотерапия не показана, то лучевую терапию можно начинать уже через неделю после удаления дренажа (или через неделю после того, как после операции под лоскутами перестала копиться лимфа — если это было после удаления дренажа).
Побочные явления
Часто можно услышать о страшном влиянии радиации на организм человека. Но в случае с курсом лечения таких последствий почти нет. На начальном этапе больные иногда отмечают тошноту. В дальнейшем эти ощущения проходят, но появляется чувство быстрой утомляемости, слабости. Это связано с тем, что под воздействием данного лечения меняются клинические показатели крови ( падает количество гемоглобина, лейкоцитов).
К середине курса может возникнут дерматит на месте воздействия лучей. Он проявляется в виде покраснения, шелушения, зуда. Для этого необходимо обрабатывать кожу детским кремом.
Для предотвращения побочных явлений нужно соблюдать рекомендации врача:
С чем можно сочетать облучение при раке молочной железы
Если Вам планируются или уже проводятся введения герцептина — их можно сочетать с проведением лучевой терапии. В отношении сочетания лучевой терапии с химиотерапией — это сопровождается более выраженными проявлениями угнетения кроветворения.
Существуют некоторые дополнительные модификации проведения лучевой терапии — дробление дозы, использование дополнительных лекарств, улучшающих лечебный эффект лучевой терапии, но они используются редко, так как трудоёмки и не оплачиваются медицинскому персоналу (вопрос может быть индивидуально обсуждаем с радиологом).
В отношении сочетания лучевой терапии и гормонотерапии: исследований — подтверждающих или опровергающих эффективность такого — нет. Однако, теоретически гормонотерапия делает раковую клетку неделящейся, тогда как лучевая терапия (как и химиотерапия) эффективны, воздействуя только на делящуюся клетку.
Трудности, с которыми можно столкнуться при лучевой терапии
| Дополнительно о способах профилактики осложнений лучевой терапии (при раке молочной железы) можете прочитать ЗДЕСЬ |
Как уменьшить вред
Рекомендовано проводить комплексные мероприятия по улучшению общего состояния пациентки и сбережения функции органов, подверженных излучению. Начинать нужно с палаты и постели больной. Постельное бельё должно быть чистым, комнату нужно освежать и кварцевать. Чем меньше источников бактерий, тем меньше шансов получить осложнения на коже.
Для обеспечения защиты тканей извне необходимо принимать пищу, богатую витаминами С и Е. Каждый день нужно соблюдать питьевой режим, не понижая количество выпитой жидкости менее 1 литра. Следует убрать из ежедневного использования ароматизированные мыло, шампуни и кондиционеры. Для гигиены лучше всего использовать детское мыло и детский крем.
Врачи часто назначают небольшие курсы ЛФК для поддержания нормального кровотока в молочной железе и грудных мышцах. Это позволит защитить грудные мышцы от возникновения в них узлов из соединительной ткани (уплотнений).
Для увеличения общей резистентности организма к излучению необходимо принимать адаптогены. Наиболее популярным является корень женьшеня.
Где пройти лучевую терапию при раке молочной железы в Санкт-Петербурге
Ниже перечислены учреждения в СПб и их адреса, в которых установлены линейные ускорители. Не во всех указанных учреждениях есть только современные аппараты (сегодня Северо-Западный регион только на 30% обеспечен современными аппаратами и на 70% — от их общей потребности).
- ПСПбГМУ им.акад.И.П.Павлова. Линейный ускоритель на ул. Рентгена д.8. Нужно оформление квоты для жителей СПб, ЛО и всех регионов РФ
- Городской Клинический онкологический диспансер — ГКОД (2 Берёзовая аллея 3/5). По полису ОМС только для жителей СПб (юга города)
- Российский научный центр радиологии и хирургических технологий им.акад. А.М. Гранова (пос. Песочный, ул. Ленинградская, д.70). Нужно оформление квоты для жителей СПб, ЛО и всех регионов РФ.
- Институт Онкологии им. Н.Н. Петрова — НИИ Онкологии (пос. Песочный, ул. Ленинградская, д.68). Нужно оформление квоты для жителей СПб, ЛО и всех регионов РФ.
- Клинический Научно-практический Центр Специализированных Видов Медицинской Помощи — КНпЦСВМПО (пос. Песочный, ул. Ленинградская 68а, ЛИТ.А). Лечение по полису ОМС только для жителей СПб (севера города).
- Частный центр ЛДЦ МИБС (пос. Песочный, ул. Карла Маркса, д.43). Необходимо оформление квоты — для жителей СПб, ЛО.
Если информация нашего сайта была Вам полезна — пожалуйста, оставьте свои отзывы о нём и рекомендации в интернете для других пациентов.
Автор статьи: Чиж Игорь Александрович заведующий, кмн, онколог высшей квалификационной категории, хирург высшей квалификационной категории, пластический хирург
Обследования после радиотерапии
После окончания курса лечения потребуется проведение некоторых обследований:
- Если была назначена симптоматическая радиотерапия, особенно костей скелета, то потребуется сцинтиграфия – для обнаружения метастаз.
- После выполнения курса паллиативного облучения (назначается для уменьшения отёчности карциномы, а также для отграничения образования), нужно повторно провести осмотр груди и шеи с помощью МРТ для уточнения объёмов предстоящего оперативного вмешательства. Во время такого обследования уточняется объем груди, который попытаются сохранить.
- После радикального хирургического вмешательства и последовавшего за ним облучения, женщина должна наблюдаться у доктора не менее 5 лет. Рекомендуется ежегодная маммография в обязательном порядке и регулярные осмотры раз в 3 месяца первые 2 года. В дальнейшем на приём к врачу достаточно приходить раз в 6 месяцев. Если будет обнаружен рецидив опухоли, то потребуется повторить лечение.
Количество мероприятий для восстановления здоровья зависит от степени интоксикации получивших облучение здоровых клеток. Лечебная терапия нужна не всегда. Многие женщины не чувствуют особых последствий и осложнений (кроме сильной усталости), после полученного облучения.
Важное значение в успешности проведения радиотерапии и эффективности восстановлении имеет своевременность обращения за медицинской помощью, а также точное соблюдение врачебных рекомендаций.
Читайте также:

