Диссеминированный рак желудка что это такое
Лечение рака желудка начатое с курса химиотерапии, усиленной нагревом, позволяет повредить опухоль до операции и снизить ее активность к росту и метастазированию. Это существено повысит радикальность операции. После хирургического вмешательства химиотерапии под нагревом повредят жизнеспособность оставшихся опухолевых клеток.

Клинический пример:
Пациент: больная К., рак желудка с метастазами
Возраст: 45 лет
28.10.2002 г. больная поступила в клинику с диагнозом рак желудка (пилорического отдела) T4N3M1, осложненный декомпенсированным стенозом, метастазы в яичники, лимфоузлы брюшной полости и забрюшинного пространства.
Из анамнеза: в 2002 году отметила прогрессирующее снижение веса на 19 кг. В августе 2002 года у больной выявлен рак желудка (пилорического отдела) T4N3M1, осложненный декомпенсированным стенозом, метастазы в яичники, лимфоузлы брюшной полости и забрюшинного пространства.
Цитология № 7751/53 – низкодифференцированная аденокарцинома желудка.
10.09.2002 г. произведена операция – лапаротомия, ревизия органов брюшной полости. Наложение переднего впередиободочного гастроэнтероанастомоза с анастомозом Брауна. Проведение полихимиотерапии не планировалось, учитывая большую распространенность опухоли и низкую эффективность химиотерапии.
План лечения рака пилорического отдела методом гипертермии
При поступлении в клинику “К-тест” состояние удовлетворительное, ослабленное, определяется асцит. При рентгеноскопии подтвержден рак дистальной половины желудка с метастазами. На КТ определяется асцит, двусторонний плеврит, увеличение отдельных забрюшинных лимфоузлов до 10 мм (рис. 3а). При ультразвуковом исследовании в малом тазу лоцируется метастаз Крукенберга размером 50 × 40 мм.
30.10.2002 г. проведен первый сеанс общей гипертермии с полихимиотерапией (5-фторурацил, лейковорин, доксорубицин). Максимальная температура составила 42,45 °С. В постгипертермическом периоде отмечалась транзиторная гипербилирубинемия (49,6 ммоль/л).
Повторно больная поступила в клинику 02.12.2002 г. через 4 недели после первого сеанса гипертермии. Состояние при поступлении удовлетворительное, жалоб нет, прибавила в весе 3 кг. При ультразвуковом исследовании органов малого таза отмечено уменьшение размеров метастазов в яичниках до 45 × 35 мм, что соответствует стабилизации.
05.12.2002 г. проведен второй сеанс общей гипертермии с полихимиотерапией, максимальная температура составила 42,58 °С. Постгипертермический период протекал гладко, и больная была выписана в удовлетворительном состоянии на пятые сутки после сеанса гипертермии.
Обследована в январе 2003 года через 1 месяц после второго сеанса общей гипертермии. При КТ брюшной полости асцита, плеврита и увеличения забрюшинных лимфоузлов не отмечается (рис. 3б). При ультразвуковом исследовании размеры яичников уменьшились до 30 × 28 мм, что соответствует частичной регрессии.
В марте 2003 года больная чувствует себя удовлетворительно, за период с октября 2002 года по март 2003 года прибавила в весе 16 кг, ремиссия сохраняется.
Оперативное лечение рака желудка с метастазами стало возможным.
Результат лечнния рака пилорического отдела желудка
Данный пример показывает возможность достижения частичной регрессии при использовании общей гипертермии у больной диссеминированным раком желудка. В приведенном примере объективный эффект был получен после второго сеанса общей гипертермии с полихимиотерапией, что дало возможность выполнить радикальную операцию.
Ист. болезни: 526/586
В статье представлены результаты клинического наблюдения за больным диссеминированным раком желудка. Химиотерапия оказалась эффективной и позволила достичь полной регрессии отдаленных метастазов и длительной ремиссии болезни. От предложенного хирургического лечения пациент отказался, в связи с чем ему была продолжена поддерживающая химиотерапия в течение 18 месяцев. Спустя два года после ее завершения зарегистрировано прогрессирование болезни в виде метастазов в легких, лимфатических узлах средостения. Химиотерапия была возобновлена. Продолжительность жизни больного к сентябрю 2016 г. составила 57 месяцев, выживаемость без прогрессирования болезни на первой линии химиотерапии – 48 месяцев, длительность частичной ремиссии – 46 месяцев. На фоне возобновления трехкомпонентного режима первой линии в современной модификации в качестве терапии второй линии также была достигнута и подтверждена частичная регрессия опухоли. Продолжительность жизни пациента с момента начала химиотерапии второй линии превышает девять месяцев.
В статье представлены результаты клинического наблюдения за больным диссеминированным раком желудка. Химиотерапия оказалась эффективной и позволила достичь полной регрессии отдаленных метастазов и длительной ремиссии болезни. От предложенного хирургического лечения пациент отказался, в связи с чем ему была продолжена поддерживающая химиотерапия в течение 18 месяцев. Спустя два года после ее завершения зарегистрировано прогрессирование болезни в виде метастазов в легких, лимфатических узлах средостения. Химиотерапия была возобновлена. Продолжительность жизни больного к сентябрю 2016 г. составила 57 месяцев, выживаемость без прогрессирования болезни на первой линии химиотерапии – 48 месяцев, длительность частичной ремиссии – 46 месяцев. На фоне возобновления трехкомпонентного режима первой линии в современной модификации в качестве терапии второй линии также была достигнута и подтверждена частичная регрессия опухоли. Продолжительность жизни пациента с момента начала химиотерапии второй линии превышает девять месяцев.
Рак желудка занимает лидирующие позиции в структуре онкологической заболеваемости и смертности как в России, так и за рубежом. Ежегодно в мире выявляют свыше 1 млн новых случаев заболевания, около 700 000 больных умирают [1]. В России рак желудка на протяжении многих лет занимает второе место в структуре смертности от онкологических заболеваний [2].
Согласно статистике, на момент установления диагноза операбельный процесс выявляется лишь у 20% пациентов, более чем у половины больных отмечаются отдаленные метастазы.
Тактика лечения
В настоящее время стандартным методом лечения больных диссеминированным раком желудка является лекарственная терапия. Химиотерапия позволяет увеличить продолжительность жизни до одного года при выживаемости без прогрессирования заболевания до шести месяцев и более, а также устранить или облегчить симптомы, связанные с опухолью, и тем самым улучшить качество жизни пациентов [3]. Сравнительный анализ эффективности двух- и трехкомпонентных режимов химиотерапии показал статистически достоверное увеличение продолжительности жизни больных при использовании трехкомпонентных комбинаций [4, 5].
Одной из наиболее эффективных схем химиотерапии при диссеминированном раке желудка признана комбинация DCF (доцетаксел + цисплатин + 5-фторурацил (5-ФУ) в режиме суточных инфузий) [6]. Однако ее применение ограничено высокой токсичностью. Так, нейтропения 3–4-й степени наблюдается у 82% больных, в том числе у 29% лечение сопровождается фебрильной лихорадкой.
Полная регрессия отдаленных метастазов зафиксирована у трех пациентов. Двум из них после достижения полной регрессии отдаленных метастазов по брюшине была выполнена паллиативная операция в объеме гастрэктомии с лимфодиссекцией D2. Продолжительность жизни этих пациентов составила 16 и более 31 месяца. Третий пациент после констатации полной регрессии отдаленных метастазов от хирургического лечения отказался, и ему была продолжена поддерживающая химиотерапия. Приводим выписку из его истории болезни.
Клинический случай
Больной М. 53 лет обратился в РОНЦ им. Н.Н. Блохина в ноябре 2011 г. с жалобами на нарушение прохождения пищи по пищеводу (дисфагия 2-й степени), снижение веса на 10 кг в течение пяти месяцев.
При эзофагогастродуоденоскопии (ЭГДС) выявлена бугристая опухоль, исходящая из желудка, распространяющаяся на пищевод, с проксимальной границей инфильтрации на уровне 35 см от резцов. Опухоль циркулярно охватывала стенки пищевода, деформируя и суживая его просвет до 1 см. Эндоскоп с трудом был введен в желудок, где на уровне субкардиального отдела визуализирована дистальная граница опухоли. Розетка кардии циркулярно занята изъязвленной опухолью, стенки ригидные, несмыкаемые. Гистологическое заключение: аденокарцинома.
Ультразвуковое исследование (УЗИ) органов брюшной полости и забрюшинного пространства показало наличие множественных метастатически измененных лимфатических узлов в забрюшинном пространстве от уровня эпигастрия до бифуркации аорты размером 3,8 × 1,5 см. В шейно-надключичной области слева визуализировались множественные лимфатические узлы до 1,7 × 1,3 см (метастазы), справа – до 1,2 × 0,5 см.
Результаты магнитно-резонансной томографии брюшной полости: конгломерат увеличенных парагастральных лимфатических узлов общим размером до 5,5 × 4,5 см, увеличенные парааортальные, паракавальные и аортокавальные лимфатические узлы размером до 3,5 см. Утолщение стенок желудка. Асцит отсутствовал.
Диагностирован рак проксимального отдела желудка с переходом на пищевод (аденокарцинома) с метастазами в надключичные лимфатические узлы слева, забрюшинные лимфатические узлы, стадия IV, сTхNxM1.
Сопутствующие заболевания отсутствовали.
С декабря 2011 г. по май 2012 г. проведено восемь курсов химиотерапии по схеме TOFL: доцетаксел 75 мг/м² во второй день + оксалиплатин 100 мг/м² во второй день + лейковорин 50 мг внутривенно струйно в первый – третий дни + 5-ФУ 500 мг/м² в первый – третий дни в виде трехчасовой инфузии. Значимых побочных явлений в ходе лечения не зарегистрировано.
На фоне терапии жалобы на дисфагию полностью исчезли после первого курса, пациент начал прибавлять в весе. При контрольном обследовании после трех курсов отмечалась выраженная положительная динамика. По данным УЗИ перестали определяться забрюшинные и шейно-надключичные лимфатические узлы с обеих сторон. При ЭГДС в пищеводе на уровне 35 см от резцов по заднеправой полуокружности обнаружено плоское изъязвление с подрытыми относительно мягкими краями, от которого плоский инфильтрат в виде продольного участка распространялся до кардии и далее до границы с субкардией. Розетка кардии была эластичная, свободно проходима. Просвет пищевода на уровне опухоли расширился, стенки стали эластичными. При ретрофлексионном осмотре выявлен небольшой участок опухолевой инфильтрации субкардии по задней стенке.
По окончании трех курсов лечения зарегистрирована частичная регрессия опухоли с полной регрессией забрюшинных и надключичных лимфатических узлов. Пациент продолжал получать химиотерапию по прежней схеме.
При обследовании по окончании шести курсов химиотерапии данных о наличии отдаленных метастазов при УЗИ не получено, что было подтверждено результатами компьютерной томографии (КТ) брюшной полости. Данные ЭГДС также подтвердили частичную регрессию опухоли.
В связи с нарастающей положительной динамикой было решено провести еще два курса химиотерапии по прежней схеме.
После завершения восьми курсов химиотерапии при ЭГДС в нижнегрудном отделе пищевода визуализировалась опухоль, которая занимала половину окружности стенки пищевода и половину диаметра просвета за счет экзофитного компонента. Дистальный край опухоли лоцировался на уровне 38 см от резцов, дистальнее на 2 см определялась плоская овальная язва 0,6 × 0,4 см, с выраженной краевой эпителизацией, без признаков неопластической перестройки. Розетка кардии располагалась на уровне диафрагмального сужения (41 см), эластичная, слизистая оболочка в зоне кардии не инфильтрирована.
Таким образом, после восьми курсов химиотерапии, по данным УЗИ и КТ, зарегистрированы полная регрессия отдаленных метастазов и значительное уменьшение первичной опухоли.
Для уточнения распространенности процесса с последующим выбором лечебной тактики на консилиуме с участием хирургов пациенту предложили проведение лапароскопии. Однако и от лапароскопии, и от оперативного лечения он категорически отказался, в связи с чем ему назначили поддерживающую химиотерапию лейковорином по 50 мг внутривенно струйно в первый – третий дни в комбинации с 5-ФУ по 500 мг/м² в виде трехчасовой инфузии в первый – третий дни каждые 21–28 дней. С июня 2012 г. по декабрь 2013 г. проведено 20 курсов поддерживающей химиотерапии на фоне регулярного контрольного обследования каждые три курса.
При регулярном УЗИ периферических лимфоузлов, органов брюшной полости, забрюшинного пространства и таза в процессе поддерживающего лечения данных о метастазировании процесса не получено. При ЭГДС определялось лишь изъязвление в пищеводе на уровне 36 см от резцов размером от 0,5 до 1 см. При неоднократной биопсии слизистой оболочки в зоне изъязвления с последующим морфологическим исследованием биоптатов элементы опухоли не обнаружены. С января 2014 г. больному рекомендовано динамическое наблюдение.
В декабре 2015 г. во время очередного планового обследования при рентгеновской КТ грудной клетки в базальных отделах S2 верхней доли левого легкого у главной междолевой плевры выявлено узловое образование с бугристыми контурами диаметром 1,6 см. Паратрахеально справа определялись лимфатические узлы до 1,2 см в диаметре, паравазально и в аортопульмональном окне – множественные лимфоузлы до 0,9 см, в области бифуркации трахеи – конгломерат лимфатических узлов до 4,3 × 2,7 см. Корень левого легкого несколько расширен, в нем также определялись увеличенные лимфатические узлы размером до 1,5 см. Результаты рентгеновской КТ: метастатическое поражение легкого, лимфатических узлов средостения и корня легкого. При ЭГДС динамики не зафиксировано, по-прежнему по задней полуокружности в области кардиоэзофагеального перехода определялось изъязвление, при гистологическом исследовании биопсийного материала – лейкоцитарно-некротические массы и мелкий кусочек грануляционной ткани.
Изменения, выявленные при рентгеновской КТ органов грудной клетки, были расценены как метастатические, констатировано прогрессирование рака желудка и возобновлена химиотерапия по схеме FLOT в виде реиндукции.
С декабря 2015 г. по апрель 2016 г. проведено девять курсов химиотерапии. Лечение больной переносил удовлетворительно.
При обследовании после шестого курса зарегистрирована частичная регрессия опухоли: образование в базальных отделах S2 верхней доли левого легкого практически перестало определяться (на его месте сохранялось небольшое уплотнение легочной ткани). Конгломерат лимфатических узлов в области бифуркации трахеи уменьшился вдвое: с 4,3 × 2,7 см до 2,2 × 1,1 см. Лимфатические узлы средостения уменьшились на 50%, лимфатические узлы корня левого легкого – с 1,5 см до 0,8 см.
При обследовании после девяти курсов химиотерапии в мае 2016 г. частичная регрессия сохранялась. Пациенту рекомендовано динамическое наблюдение.
Таким образом, в результате химиотерапии доцетакселом, оксалиплатином и 5-ФУ продолжительность жизни больного исходно диссеминированным раком желудка к сентябрю 2016 г. составила 57 месяцев, выживаемость без прогрессирования заболевания на первой линии химиотерапии – 48 месяцев, длительность частичной ремиссии – 46 месяцев. Эффективным оказалось и возобновление трехкомпонентного режима первой линии в современной модификации в качестве терапии второй линии, на фоне которой также была достигнута и подтверждена частичная регрессия опухоли. Продолжительность жизни пациента с момента начала химиотерапии второй линии превышает девять месяцев.
К сожалению, на современном этапе развития медицины мы не можем спрогнозировать ни эффективность определенного режима химиотерапии у конкретного больного диссеминированным раком желудка, ни вероятность достижения длительной ремиссии. Выбор химиотерапии обычно осуществляется эмпирически. Однако появление эффективных режимов химиотерапии при диссеминированной аденокарциноме желудка или кардиоэзофагеального перехода позволило существенно улучшить результаты лечения данной категории пациентов.
Представленное клиническое наблюдение демонстрирует возможность достижения длительной ремиссии на фоне применения современной трехкомпонентной химиотерапии с включением доцетаксела и оксалиплатина, а также ставит перед врачами новые тактические вопросы. Одним из них является вопрос о целесообразности подключения хирургического лечения в случае полной регрессии отдаленных метастазов на фоне эффективной химиотерапии.
Данное наблюдение свидетельствует также о том, что при прогрессировании диссеминированного рака желудка после длительной ремиссии целесообразна реиндукция той же схемы химиотерапии, при использовании которой был получен первый выраженный эффект.
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
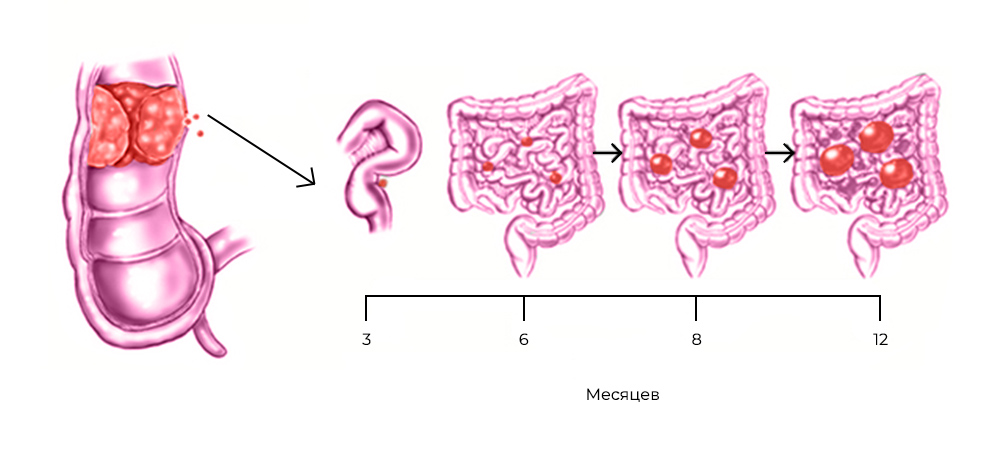
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
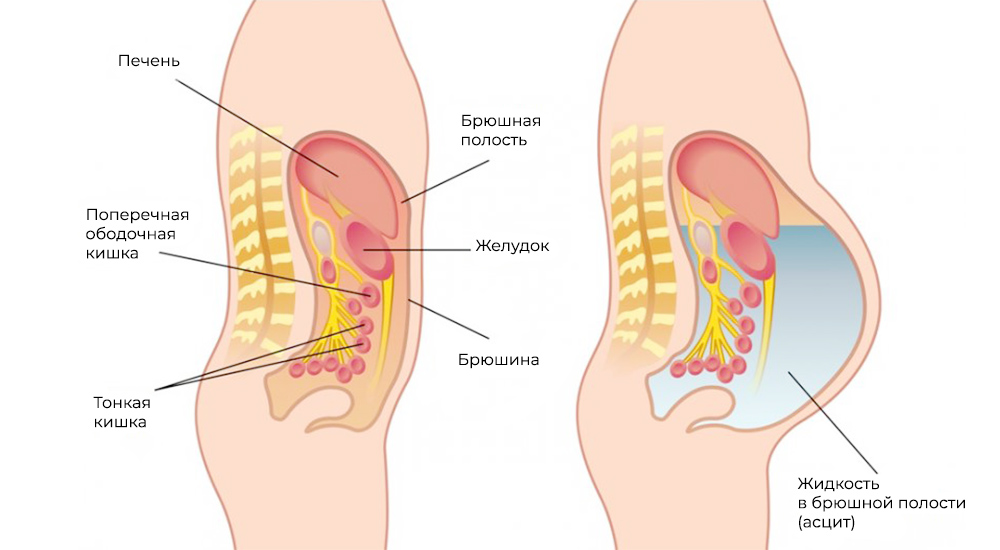
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
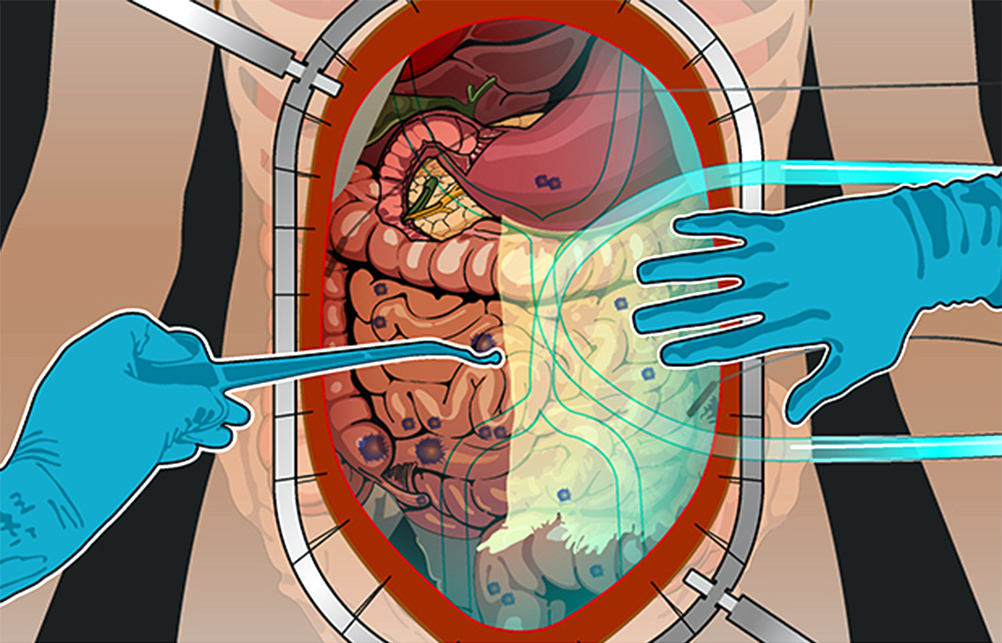
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
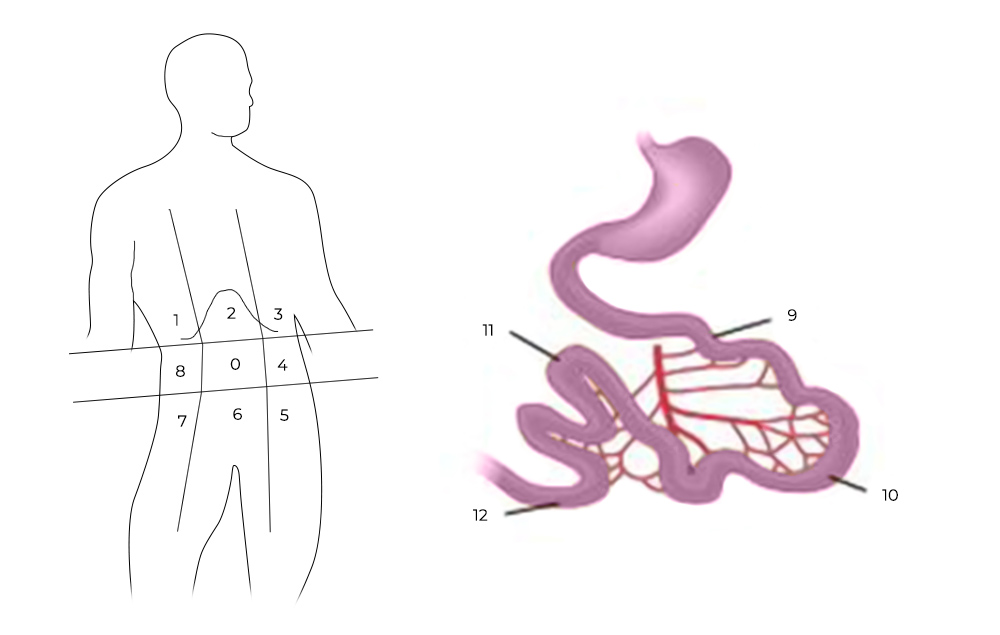
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
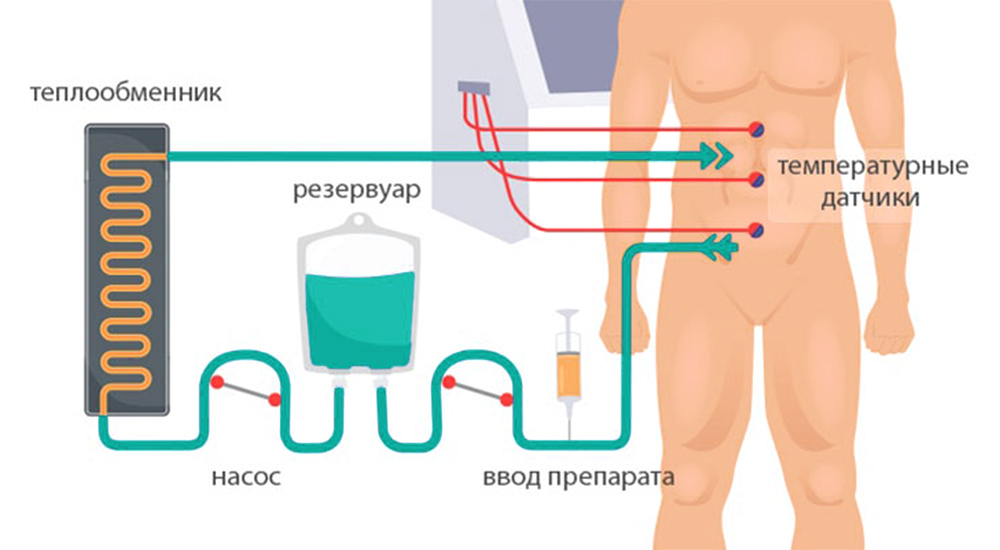
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.
Читайте также:

