Диссеминированные формы злокачественных новообразований
Диссеминация – это распространение возбудителя инфекции или клеток опухоли из первичного очага заболевания по всему органу или организму. Осуществляется это посредством кровотока и лимфатической системы. После диссеминации обычно происходит процесс генерализации, представляющий собой развитие множества очагов. Такие вторичные проявления называются метастазами.
Виды очагов заболеваний и их характеристика
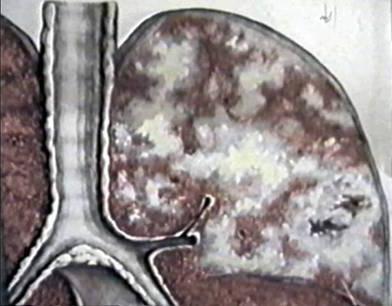
Наличие в организме очагов с размерами патологических теней от 1 до 10 мм означает, что происходит диссеминация. Это могут быть участки, различные по патогенезу и морфологической структуре. Они бывают воспалительные и невоспалительные, фиброзированные. В целом, могут представлять собой скопление тканей и клеток. В области воспалительных очагов возникает процесс перифокального характера. Кроме того, такие участки имеют свойство сливаться. При этом они начинают напоминать инфильтративно-пневмонический процесс. При поражении легких отмечается двусторонняя патология. Здесь следует упомянуть о некоторых различиях в диагнозе. Раньше такие процессы принято было называть диффузными легочными заболеваниями. Однако не всегда может наблюдаться тотальное поражение. В связи с этим название "диссеминированный" в этом случае подходит больше. Изменения при этом могут не являться диффузными.
Симптомы
Диссеминация - это рентгенологическое определение, которое включает в себя около ста различных заболеваний. Они могут протекать со всевозможными симптомами. Диссеминация в легких обычно сопровождается воспалительным процессом плевры. Симптомы при этом носят двоякий характер. При воспалительных заболеваниях возникает синдром интоксикации и гипоксии. На фоне диссеминированного рака легких и карциноматоза – дыхательная недостаточность, прогрессирующая с дальнейшим развитием патологии. Легочная диссеминация трудно диагностируема. Именно поэтому существует большая вероятность ошибки. Для более точного диагноза необходимо полное обследование пациентов.
Классификация патологий
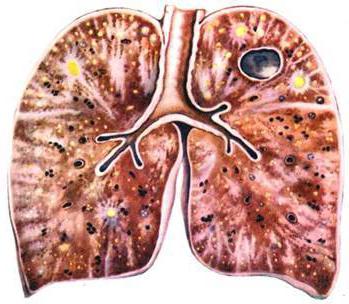
Заболевания, при которых происходит диссеминация, это:
- альвеолиты (токсический фиброзирующий, экзогенный аллергический альвеолиты, синдром Хаммена-Рича, микролитиаз, протеиноз);
- гранулематозы (пневмокониоз, саркоидоз, диссеминированный туберкулез, пневмомикозы, гистиоцитоз);
- воспаления, сопровождающиеся опухолевыми образованиями (карциноматоз, бронхоальвеолярный, метастатический рак);
- редкие заболевания (синдром Гудпасчера, идиопатический гемосидероз, лейомиоматоз);
- интерстициальные фиброзы, которые образуются при поражении иных органов и систем (коллагеноз, лучевые повреждения, кардиогенный склероз, а также склероз с заболеванием печени).
Признаки
Наряду с общими, наблюдаются и индивидуальные признаки, свидетельствующие о развитии диссеминированных процессов. Знание и умение распознавать их значительно облегчают диагностику. При фиброзе легких происходит умеренное сужение легочных полей. Также снижается их прозрачность. Изменения туберкулезной формы располагаются в верхних отделах легких. А вот пневмосклероз диффузного характера более выражен в нижней части. Метастазы рака располагаются поодиночке в среднем отделе легких, а при карциноматозе наблюдается большое количество узлов. При туберкулезе очаги имеют различные размеры, их локализация субплевральная. В случае пневмокониоза патологический процесс прогрессирует в нижних лимфатических узлах, потом возникают гранулемы, далее ткани склерозируются. Остальные процессы диссеминации значительно хуже диагностируются, поэтому необходим комплекс лабораторных обследований.
ДИССЕМИНИРОВАННЫЙ ПРОЦЕСС В ЛЕГКИХ — ЧТО ЭТО ТАКОЕ?
Диагностика диссеминированных процессов в легких – это самая сложная область пульмонологии. Диссеминированным называется заболевание, которое проявляется более-менее однотипным распространением (диссеминацией) патологического процесса на большую часть легочной ткани. Такое распространение процесса по легким, как правило в виде очагов, сетчатых изменений или смешанного типа, диагностируется как с помощью рентгенографии, так и с помощью компьютерной томографии (КТ).
Сложность диагностики диссеминированных заболеваний заключается в том, что похожая рентгенологическая картина может наблюдаться при огромном количестве болезней самого разного происхождения. До 80% пациентов с легочной диссеминацией получают при первичной диагностике неверные диагнозы. Кроме того, многие заболевания легких, сопровождающиеся диссеминацией, протекают бессимптомно, что также оттягивает верную диагностику. У некоторых пациентов между началом заболевания и правильно поставленным диагнозом проходит несколько лет, а кому-то правильный диагноз не выставляется вовсе.
ДИССЕМИНИРУЮЩИЙ ПРОЦЕСС В ЛЕГКИХ — ВАРИАНТЫ ПАТОЛОГИИ
Какие болезни легких способны проявляться диссеминацией на КТ и рентгенографии?
1. Альвеолиты
1. 1. Идиопатический фиброзирующий альвеолит
1. 2. Экзогенный аллергический альвеолит
1. 3. Токсический фиброзирующий альвеолит
2. Гранулематозы
2. 1. Саркоидоз легких
2. 2. Гематогенно — диссеминированный туберкулез легких
2. 3. Гистиоцитоз
2. 4. Пневмокониозы (силикоз, силикатозы, бериллиоз и др. )
2. 5. Пневмомикозы (актиномикоз, кандидоз, криптококкоз легких и др.)
3. Диссеминации опухолевой природы
3. 1. Бронхиолоальвеолярный рак
3. 2. Карциноматоз легких
3. 3. Раковый лимфангиит
4. Редкие формы диссеминированных процессов в легких
4. 1. Идиопатический гемосидероз легких
4. 2. Синдром Гудпасчера
4. 3. Альвеолярный протеиноз
4. 4. Лейомиоматоз легких
4. 5. Первичный амилоидоз легких
Как видите, список очень длинный, а ведь здесь далеко не все диссеминированные болезни!
О чем нужно задуматься, если у Вас в легких обнаружен диссеминированный процесс? Прежде всего, об исключении самых опасных болезней – туберкулеза и рака легкого! Не является ли диссеминация туберкулезной или опухолевой природы?
МНОЖЕСТВЕННЫЕ МЕТАСТАЗЫ В ЛЕГКИХ — САМЫЙ ОПАСНЫЙ ДИССЕМИНИРОВАННЫЙ ПРОЦЕСС
Прежде всего, врачам при обнаружении диссеминированного заболевания легких необходимо исключить злокачественную опухоль. Это может быть как метастатическая диссеминация рака (гематогенный, лимфогенный карциноматоз), так и первичная диссеминированная опухоль легкого — бронхиолоальвеолярный рак. Множественные метастазы в легкое чаще всего встречаются при раке молочной железы, почек, яичников, кишечника, желудка и матки. При правильном анализе результатов компьютерной томографии (КТ) врач-рентгенолог в большинстве случаев способен отличить метастазы от других вариантов диссеминации.
КАК ОТЛИЧИТЬ ОДНО ДИССЕМИНИРОВАННОЕ ЗАБОЛЕВАНИЕ ОТ ДРУГОГО?
ВТОРОЕ МНЕНИЕ ПРИ ДИССЕМИНИРОВАННОМ ПРОЦЕССЕ
Нередко возникает ситуация, когда даже КТ не вносит полной ясности в диагноз. Например, врачи могут сомневаться, что у пациента: саркоидоз или метастазы в легких, диссеминированный туберкулез или грибковая инфекция, и т.п. В таких случаях полезно получить дополнительное мнение высококвалифицированного рентгенолога, который повторно проанализирует снимки и выскажет свое мнение. Подобное экспертное мнение поможет Вашему лечащему врачу уточнить диагноз и назначить правильное лечение. Если Вы живете вдалеке от крупных центров, снимки можно отправить специализированному радиологу по интернету, например через службу Национальной телерадиологической сети. Полученное в результате второе мнение по КТ легких с подписью и печатью опытного специалиста снизит риск неверного диагноза.
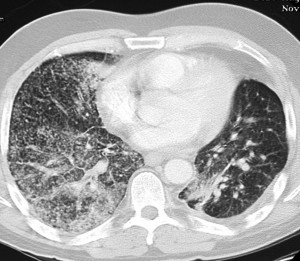
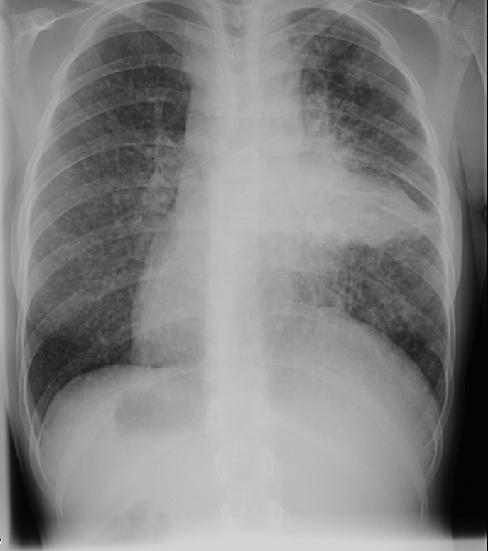
КТ при бронхиолоальвеолярном раке. Множественные хаотичные очаги, чередующиеся с участками уплотнения по типу матового стекла, фокусами альвеолярной консолидации.
VI РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ЛЕЧЕНИЕ ДИССЕМИНИРОВАННЫХ ГЕРМИНОГЕННЫХ ОПУХОЛЕЙ У МУЖЧИН
Герминогенные опухоли (ГО) представляют собой гетерогенную по гистологическому строению и месту возникновения группу опухолей, объединенную общим происхождением. Все они, несмотря на свое разнообразие, произошли из клеток-предшественников герминогенного эпителия, выстилающих канальцы яичка. Факторами, способствующими образованию ГО яичка, являются крипторхизм, дисгенезия гонад, синдром Кляйнфельтера, наличие в семье случаев заболевания ГО яичка у ближайших родственников. Еще одним фактором, способствующим развитию ГО яичка, является гормональный фон, в частности, продолжительный прием эстрогенов матерью в период беременности, что повышает риск развития рака яичка у сыновей. Крипторхизм, дисгенезия гонад, синдром Кляйнфельтера клинически сочетаются с атрофией гонад и нарушением сперматогенеза. У 75% больных ГО яичка в момент постановки диагноза определяется олиго- или аспермия. Атрофия гонад компенсаторно стимулирует продукцию и выброс гипофизом гонадотропина, что является мощным пролиферативным сигналом для клеток герминогенного эпителия. Длительная стимуляция пролиферации, возможно, является важным условием формирования ГО яичка.
Факторы инициации, равно как и механизм трансформации клеток герминогенного эпителия в опухолевые, остаются неизвестными. Это могут быть изменения генетической информации ДНК в результате воздействия карциногена, вируса или мутации, что делает активированную герминогенную клетку независимой от внешних факторов роста и регуляции. Одним из последних открытий в биологии ГО является обнаружение специфичного для этого заболевания хромосомного маркера. Практически у всех больных ГО в клетках опухоли определяется добавочная хромосома (изохромосома), представляющая собой короткую ветвь хромосомы 12 (12р). Проведенный анализ показал, что одним из генов, расположенных в изохромосоме и, возможно, участвующих в канцерогенезе ГО, является ген CCND2, отвечающий за продукцию циклина D2 - мощного стимулятора клеточной пролиферации. Циклин D2, наряду с другими циклинами, регулирует процесс фосфорилирования белка ретинобластомы (pRb), который является важнейшим фактором контроля сверочной точки G1 S клеточного цикла. Усиленная продукция циклина D2 приводит к усиленной фосфориляции pRb и утрате последним способности препятствовать вхождению клетки в процесс клеточного деления. Таким образом, происходит потеря контроля над пролиферативной активностью клетки герминогенного эпителия.
Появлению ГО яичка предшествует стадия carcinoma in situ, которая обнаруживается у 80% больных семиномой и у 100% больных несеминомными опухолями яичка. Клетки carcinoma in situ затем способны претерпевать изменения с образованием семиномы или эмбрионального рака. Клетки эмбрионального рака, в свою очередь, дают начало тератокарциноме - мультипотентной опухоли, родоначальнице как высоко злокачественных опухолей, таких как хориокарцинома и опухоль желточного мешка, так и опухоли с высокой степенью дифференцировки - тератоме. Для удобства клиницистами принято разделять ГО на семиному и несеминомы, что обусловлено различиями в течении, прогнозе и тактике лечения.
Семинома составляет около 50% всех герминогенных опухолей. Она характеризуется индолентным течением, появлением в более позднем возрасте (пик заболеваемости приходится на 35 лет), чувствительностью к лучевой терапии и большей чувствительностью к химиотерапии. 70-75% пациентов семиномой на момент диагностики не имеют отдаленных метастазов. У диссеминированных больных наблюдается, как правило, лимфогенное метастазирование в забрюшинные лимфоузлы, реже - в лимфоузлы средостения и надключичные лимфоузлы. Лишь у 10% пациентов имеются висцеральные метастазы.
В отличие от семиномы, к несеминомным ГО относится группа разнородных гистологических подтипов опухолей, начиная от низкодифференцированных и агрессивных форм, таких как хорионкарцинома, эмбриональный рак, опухоль желточного мешка и заканчивая тератомой в различных вариантах ее дифференцировки - от незрелой до зрелой формы, являющейся доброкачественной. Зачастую одновременно имеется сочетание нескольких вариантов ГО в первичной опухоли.
ГО характеризуются быстрым ростом и очень агрессивным течением. Лишь около 30% больных могут быть излечены с помощью хирургических методов лечения (орхфуникулэктомия ± профилактическая забрюшинная лимфаденэктомия). У подавляющего большинства пациентов в момент обнаружения опухоли в яичке либо уже имеются видимые метастазы в лимфоузлы забрюшинного пространства, средостения или во внутренние органы, как правило, в легкие, либо они проявят себя вскоре после выполнения орхофуникулэктомии. Поэтому проведение системной химиотерапии при лечении этого заболевания диктуется биологическими свойствами самой опухоли.
Еще в 60-х гг. подавляющее большинство заболевших ГО погибало от прогрессирования заболевания. В настоящее время благодаря развитию химиотерапии удается излечивать более 80% больных даже при наличии отдаленных метастазов. Высокая чувствительность герминогенных опухолей к современным противоопухолевым препаратам выделяет эту форму злокачественных новообразований из многочисленного ряда солидных опухолей, и предоставляет онкологам уникальное поле деятельности по разработке новых более эффективных лечебных подходов к лечению этой патологии.
Другой уникальностью ГО является их способность продуцировать онкофетальные белки, такие как ?-фетопротеин (АФП) и хорионический гонадотропин (ХГ), обнаруживаемые у 80% больных несеминомой. Повышенный уровень АФП при семиноме говорит о наличии нераспознанного несеминомного компонента в опухоли. Определение маркеров, кроме диагностического, имеет важное прогностическое значение, а также позволяет оценивать в динамике состояние болезни и эффективность проводимой терапии.
Чаще всего ГО образуются в яичке, однако около 6-10% больных имеют внегонадное происхождение заболевания. В последнем случае ГО может локализоваться в средостении, забрюшинных лимфоузлах, головном мозге без видимых проявлений заболевания в гонадах.
В лечении больных ГО яичка мы придерживаемся следующей тактики. На первом этапе с диагностической и лечебной целью выполняется орхофуникулэктомия, и определяется прогноз больного в соответствие с классификацией IGCCCG (табл. 1). При наличии признаков диссеминации процесса сразу после операции начинается индукционная комбинированная химиотерапия. Обязательным является мониторинг АФП, ХГ и ЛДГ перед каждым курсом химиотерапии. У больных с хорошим прогнозом проводятся 4 курса комбинацией EP. Другой альтернативой для этой группы больных является проведение 3 курсов химиотерапии комбинацией ВЕР. Пациенты из групп промежуточного и плохого прогноза получают комбинацию ВЕР. Обычно проводятся 4 курса химиотерапии с интервалом 3 недели, считая от первого дня лечения. У больных с исходным повышением маркеров (АФП, ХГ, ЛДГ) необходимо стремиться к их нормализации, после которой должны быть проведены 2 консолидирующих курса химиотерапии, поэтому у отдельных больных объем лечения может быть расширен до 6 циклов (если нормализация маркеров наступила только на 4 курсе). При достижении полного эффекта пациенты остаются под динамическим наблюдением. Если по окончании индукционной химиотерапии у больного с несеминомной опухолью сохраняются остаточные образования ?1 см, то производится их хирургическое удаление (забрюшинная лимфаденэктомия, удаление лимфоузлов средостения, резекции легких и печени).
Таблица 1.
Классификация International Germ Cell Collaborative Group (IGCCCG).
*ВГН - верхняя граница нормы
В случае роста опухолевых маркеров или замедления их снижения начинают химиотерапию второй линии (комбинации VeIP, TGP). При лечении больных несеминомой следует помнить о возможности синдрома "зрелой тератомы", когда на фоне снижения маркеров в процессе химиотерапии мы иногда видим увеличение размеров опухолевых очагов, часто с образованием кист. Это свидетельствует о созревании опухоли, а не о прогрессировании заболевания. Пациенты с семиномой даже при наличии остаточных масс дальнейшему лечению не подвергаются, так как в большинстве случаев эти массы представлены некрозом, и при наблюдении происходит их полная резорбция. Химио- или лучевая терапия возобновляются только при прогрессировании заболевания. Следует обратить самое серьезное внимание на строгое соблюдение интервалов между курсами химиотерапии, который не должен превышать 3 недели с момента начала предыдущего курса. При лечении больных ГО лейкопения и нейтропения не могут служить абсолютным противопоказанием к проведению очередного курса или снижению доз противоопухолевых препаратов!
Ниже приведены основные применяемые нами режимы химиотерапии:
Комбинация ЕР: цисплатин 20 мг/м 2 1-5 дни + этопозид 100 мг/м 2 1-5 дни каждые 3 недели;
Комбинация ВЕР: цисплатин 20 мг/м 2 1-5 дни + этопозид 100 мг/м 2 1-5 дни + блеомицин 30 мг 1, 3, 5 дни каждые 3 недели;
Комбинация VeIP: цисплатин 20 мг/м 2 1-5 дни + винбластин 0,11 мг/кг 1,2 дни + ифосфамид 1200 мг/м 2 с урометоксаном 400 мг/м 2 в/в 3 раза в день 1-5 дни каждые 3 недели.
Комбинация TGP: паклитаксел 135 мг/м 2 1 день + гемцитабин 1000 мг/м 2 1, 8 дни + цисплатин 80 мг/м 2 1 день каждые 3 недели.
Таблица 2.
Характеристика больных распространенными герминогенными опухолями, получавших химиотерапию первой линии в отделении клинической фармакологии и химиотерапии в 1987-2001 гг.
| Семинома | Несеминома | |
|---|---|---|
| Число больных | 118 | 482 |
| Медиана возраста, лет (ранг) | 35 (20-62) | 28 (14-64) |
| Локализация первичной опухоли | ||
| Яичко | 110 | 446 |
| Забрюшинное пространство | 2 (1,8%) | 17 (3,5%) |
| Средостение | 6 (5,5%) | 19 (3,9%) |
| Метастазы | ||
| Забрюшинные лимфоузлы | 112 (94,9%) | 358 (74,3%) |
| Лимфоузлы средостения | 8 (6,8%) | 49 (10,2%) |
| Надключичные лимфоузлы | 3 (2,5%) | 43 (8,9%) |
| Легкие | 4 (3,4%) | 205 (42,5%) |
| Нелегочные висцеральные (печень, кости, головной мозг) | 6 (5,5%) | 55 (11,4%) |
| IGCCCG прогноз | ||
| Хороший | 112 (94,9%) | 186 (38,6%) |
| Умеренный | 6 (5,1%) | 169 (35,1%) |
| Плохой | - | 125 (25,5%) |
| Неизвестен | - | 2 |
Как видно из представленной таблицы, у большинства больных (около 93%) имелась тестикулярная локализация первичной опухоли. Больные семиномой были в среднем на 7 лет старше своих "коллег" из группы несемином. Обращает на себя внимание тот факт, что подавляющее число больных семиномой (94,9%), в отличие от несемином (38,5%), принадлежат к группе хорошего прогноза, что является отражением более благоприятного течения этого заболевания. Этот же факт подтверждает и меньшая частота поражения висцеральных органов при семиноме (8,9%) в сравнении с несеминомой (53,9%). Медиана срока наблюдения за выжившими больными несеминомой составила 39 (8-168) мес., а за выжившими больными семиномой - 38 (10-124 мес.).
Данные по выживаемости больных ГО в зависимости от локализации первичной опухоли представлены в табл. 3.
Таблица 3.
Выживаемость больных ГО в зависимости от гистологического строения, локализации первичной опухоли и прогноза.
| Число больных | 4-летняя общая выжива- емость | P | |
|---|---|---|---|
| Гистологический вариант: семинома несеминома | 118 472 | 92% 71% | |
| Несеминомные ГО (локализация опухоли): - яичко - забрюшинное пространство - средостение | 446 17 19 | 73% 73% 33% | 0,0002 |
| Семинома (локализация опухоли): - яичко/забрюшинное пространство - средостение | 110/2 6 | 91% 100% | 0,47 |
| Несеминома (прогностические группы): - хорошая - промежуточная - плохая | 185 (39%) 170 (35%) 125 (26%) | 88% 71% 45% | Поделиться | |
Диссеминированная форма бронхиолоальвеолярного рака.
Диссеминированная форма бронхиолоальвеолярного рака (аденоматоз легких, альвеолярно-клеточная аденома легких, мультицентрический альвеолярный канцероматоз и др.) - высокодифференцированная адено-карцинома, развивающаяся из альвеолярно-бронхиального эпителия или эпителия слизистых желез бронхов. Бронхиолоальвеолярный рак у человека впервые подробно описан K.Helly в 1907 г. По вопросам происхождения бронхиолоальвеолярного рака у клиницистов и морфологов единого мнения нет. Одни считают, что бронхиолоальвеолярный рак характеризуется пролиферацией альвеолярного и бронхиолярного эпителия, превращающегося в кубический или цилиндрический. Другие исследователи полагают, что опухоль развивается внутри бронхиол из клеток эпителия, которые не секретируют сурфактант и, разрастаясь, имплантируются на внутренней поверхности альвеол.
Болезнь составляет от 2 до 8% всех первичных злокачественных новообразований легких, поражает преимущественно средний возраст. Описаны случаи возникновения заболевания в раннем детском и преклонном возрасте. Мужчины и женщины заболевают достаточно часто.
Особенностью бронхиолоальвеолярного рака является стелющийся рост опухоли по межальвеолярным и межлобулярным перегородкам, что приводит к их уплотнению и утолщению, вызывая вентиляционно-перфузионные нарушения, артериальную гипоксемию, прогрессирующую дыхательную недостаточность.
Развитие опухоли из эпителия слизистых желез бронхов предопределяет наличие наиболее характерных клинических признаков болезни - повышенное слизеобразование и выделение большого количества светлой пенистой мокроты. В тех случаях, когда опухоль развивается из клеток, не продуцирующих слизь в норме, мокрота может отсутствовать.
По мере прогрессирования заболевания появляется одышка, рефрактерная к какому-либо лечению и неуклонно усиливающаяся. Больные худеют, может повышаться температура тела до субфебрильной или фебрильной. Признаки интоксикации усугубляются нарушениями водно-солевого баланса вследствие выделения большого количества мокроты. Боль в груди отмечают приблизительно половина больных. В далеко зашедших случаях болезни может возникать пневмоторакс вследствие распада подплеврально расположенных опухолевых узлов. Болезнь заканчивается летально вследствие прогрессирующей дыхательной недостаточности на фоне выраженных явлений интоксикации. Присоединение интеркуррентных заболеваний ускоряет летальный исход.
Различают 3 рентгеноанатомические формы БАР: узловую, пневмониеподобную и диссеминированную. В отношении происхождения последней существует несколько точек зрения. Полагают, что при БАР может наблюдаться первично-множественное диссеминированное поражение легких и, таким образом, эту опухоль следует рассматривать как пример мультицентрического рака легкого. Однако в большинстве случаев диссеминированная форма вторична по отношению к локализованным и развивается из узловой или пневмониеподобной формы БАР в результате преимущественно бронхогенного внутрилегочного распространения опухоли.
Диагностика этой формы патологии легких весьма трудна, больные с диссеминированной формой БАР длительное время наблюдаются и лечатся с ошибочными диагнозами диссеминированного туберкулеза, пневмонии.
Очень редко заболевание протекает малосимптомно и выявляется при флюорографическом осмотре, в остальных 93,8% случаях - при обращении к врачу с жалобами на одышку, частый кашель с выделением мокроты слизистого или слизисто-гнойного характера, кровохарканье, боль в груди, снижение аппетита.
На доклиническом этапе диагностировались следующие заболевания: туберкулез - 46,9%, пневмония - 39,4%, диссеминация неясного генеза - 6,2%, рак легкого - 12,4%.
У 47% больных кашель был сухой, у 25% - сопровождался выделением до 100 мл мокроты, у 22% - до 200 мл, у 6% больных выделялось более 1000 мл мокроты в сутки. Чаще мокрота была слизистой или слизисто-пенистой. Следует подчеркнуть, что истинная бронхорея (более 1000 мл слизисто-пенистой мокроты) наблюдалась очень редко.
Практически у всех больных отмечалась выраженная одышка, причем у 87,5% больных - одышка в покое (II-III степень дыхательной недостаточности), сопровождающаяся цианозом слизистых оболочек, тахикардией, отеками нижних конечностей, увеличением размеров печени.
Аускультативно у больных определялось ослабленное дыхание, сухие или влажные хрипы, или хрипы смешанного характера.
Изменение гемограммы в 31,3% случаях отсутствовали, у 22% больных СОЭ была увеличена до 15-30 мм/ч, у 18,7% - до 40 мм/ч, у 28,1% больных - более 40 мм/ч; у 37,5% пациентов имел место лейкоцитоз от 8 до 10х109/л, у 19% отмечена эозинофилия от 5 до 12%, у 1% - увеличение палочкоядерных нейтрофилов.
При поступлении одностороннее поражение наблюдалось у 18,7% больных; впоследствии поражение приобрело двусторонний характер. В 37,5% случаях наблюдались явная тенденция к быстрому нарастанию изменений в легких, главным образом в виде появления новых очаговоподобных теней, слияния этих теней и образования крупных узлов или инфильтратов, увеличение имевшихся узлов и пневмониеподобных фокусов.
Следует подчеркнуть, что тяжелая дыхательная недостаточность затрудняет, а в ряде случаев исключает возможность широкого применения наиболее показанных и информативных методов биопсии - трансторакальной пункционной и трансбронхиальной биопсии легкого, торакотомии. Цитологической исследование мокроты оказалось положительным в 21% случаев, цитологическое исследование бронхиального аспирата - в 28%. У 28,1% больных диагноз БАР был верифицирован только на аутопсии.
Выделили 3 основных рентгеноанатомических варианта распространенной диссеминированной формы БАР: очагово-диссеминированную, очагово-узловую, очагово-инфильтративную.
Очагово-диссеминированный вариант БАР встречается в 15,6% наблюдений. Изменения в легких представлялись в виде двусторонней, нарастающей, более или менее мономорфной, мелко и среднеочаговой распространенной диссеминации. По мере прогрессирования отмечалось слияние (особенно заметное в нижних полях легких) части очагов, которые, чередуясь с участками просветления, создавали картину "сотового" легкого. Многочисленные просветления округлой формы определялись как в самих очаговых тенях, так и в "свободных" участках легкого. Эти просветления выглядели как бы завуалированными.
Анатомическим субстратом поражения легких при очагово-диссеминированном варианте распространенной формы БАР является очаговая опухолевая диссеминация. Макроскопически в таких случаях респираторная ткань " нафарширована" множественными сероватыми полупрозрачными ячеистыми очажками диаметром от нескольких миллиметров до 1-1,5 см, с не совсем четкими контурами, имеющими тенденцию к слиянию в средне-нижних отделах легких.
Очагово-узловой рентгеноанатомический вариант БАР определен у 34,4% больных. Этот вариант характеризуется наличием крупного узла и прогрессирующей диссеминацией очагового типа. Рентгеноморфологические сопоставления показали, что основной анатомической особенностью данного варианта является наличие локального опухолевого фокуса (массивный узел или узел с перифокальным пневмониеподобным инфильтратом) на фоне двусторонней опухолевой диссеминации полиморфного типа (сливающиеся очажки, очаги и инфильтраты).
Очагово-инфильтративный вариант распространенной формы БАР встречается у 50% больных. Рентгенологически он характеризуется сочетанием распространенных очаговоподобных теней с массивной, нарастающей двусторонней пневмониеподобной инфильтрацией легочной ткани. Этой инфильтрации присущи рентгенологические признаки, характерные как для пневмониеподобной, так частично и для узловой формы БАР.
Морфологические данные свидетельствуют, что для БАР характерно аэрогенное (бронхогенное) распространение опухоли, признаки которого определялись практически во всех случаях - свободно "плавающие" среди слизи "слущенные" клетки опухоли как внутри альвеол, так и в просвете бронхиол и бронхов, наличие мелких внутрилегочных имплантационных метастазов. Можно полагать, что аэрогенному распространению опухоли при БАР способствует целый ряд факторов, которые несвойственны другим формам рака легкого. Это свободное "слущивание" клеток опухоли в полость альвеолярного мешочка за счет ослабления клеточностромальных связей, так как БАР не имеет собственной стромы и использует строму альвеолярных перегородок в качестве "стромальной подстилки"; возможность свободного распространения клеток опухоли вместе со слизью (при слизеобразующих типах БАР) по бронхиолам и бронхам, просвет которых сохраняется, так как БАР их не поражает; способность клеток БАР к имплантации в стенку альвеолы и к дальнейшему росту на ней при попадании в полость еще не пораженного опухолью альвеолярного мешочка, т.е. к формированию имплантационных внутрилегочных метастазов.
Клинико-рентгеноморфологическое исследование распространенной диссеминированной формы БАР свидетельствует, что, вероятнее всего, эта форма является терминальной стадией развития локализованных форм опухоли - узловой и пневмониеподобной. Формирование распространенной формы происходит преимущественно за счет внутрилегочного аэрогенного распространения опухоли.
Клинико-рентгенологическая диагностика диссеминированной формы БАР представляет значительные трудности, так как патогномоничные симптомы при этом заболевании отсутствуют; выраженная бронхорея наблюдается чрезвычайно редко. Прижизненная диагностика возможна при соответствующей клинико-рентгенологической симптоматики в сочетании с результативным цитологическим исследованием мокроты или аспирата бронхиального содержимого либо цитологическим и гистологическим исследованием трансторакального или трансбронхиального биоптата. Высокоинформативная диагностическая торакотомия чаще всего невозможна из-за тяжелого состояния больного, так как способствует прогрессированию дыхательной недостаточности.
Диагноз при "сухой" форме основывается на отсутствии эффекта от противотуберкулезного и противопневмонического лечения, цитологическом исследовании мокроты и лаважной жидкости, биопсийных исследованиях. Прогноз неблагоприятен.
Читайте также:

