Дендритные клетки при раке желудка
Роль иммунной системы
Другим важным этапом было выделение первого антигена опухолей человека, распознаваемого Т-клетками [6]. Это стало возможно в результате клонирования гена MAGE (melanoma antigen-encoding gene), который кодирует антигены, распознанные цитотоксическими Т-клетками. Это открытие было не только новым доказательством способности нашей иммунной системы находить и разрушать опухолевые клетки, но также впервые была определена молекулярная природа этих антигенов.
Иммунотерапия: вакцины против рака
Вакцина против рака создана с целью усиления способности иммунной системы человека распознавать и разрушать опухолевые клетки путем стимулирования опухолеспецифичных Т-лимфоцитов. В частности, опухолевые антигены должны быть распознаны Т-клетками с помощью специальных антиген-презентирующих клеток (например, дендритных клеток). Обычно эти антигены представляют собой малые внутриклеточные пептиды, которые на поверхности опухолевых клеток имеют молекулы главного комплекса гистосовместимости и распознаются Т-клетками. Молекулы комплекса гистосовместимости I класса отвечают за презентацию антигена СD3+ CD8+, а II класса – СD3+СD4+.
В настоящее время были обнаружены и изучены тысячи опухолевых антигенов. Ген MAGE, впервые найденный у больных меланомой, представлен по-разному в различных солидных опухолях, но он также присутствует на нормальных клетках, не проявляя себя. Другие найденные потенциальные антигены являются пептидами, связанными с мутациями (например, KRAS и связанные с ним мутации), антигены дифференцировки, антигены избыточной экспрессии (например, HER2/neu и раково-эмбриональный антиген) и вирусные антигены (например, HPV).
Рак желудка экспрессирует MAGE в 38% случаев. В доклинических исследованиях показано, каким образом Helicobacter pilori может индуцировать экспрессию МАGE-3 [7,8]. Нановакцина, нагруженная пептидом МАGE-3 с целью усилить иммунный ответ, была изучена на мышиной модели рака желудка. В результате была получена регрессия опухоли [9]. Японскими учеными проведена I/II фаза исследования на 22 больных с распространенным раком желудка с использованием пептидов от VEGF-R1 и VEGF-R2 совместно с применением S-1 и цисплатина. В результате была получена частичная регрессия у 55% больных и увеличение продолжительности общей выживаемости [10]. Кроме того, опухолевые антигены, связанные с HER2/neu, обычно избыточно экспрессируемые при раке желудка, могут играть важную роль в развитии новых подходов к иммунотерапии и вакцинации.
В одном из последних исследовании у 44 больных с распространенным раком желудка были использованы тумор-ассоциированные лимфоциты в комбинации с или без химиотерапии [12]. Результаты показали, что общая выживаемость была лучше в группе комбинации химиотерапии с тумор-ассоциированными лимфоцитами. Более того, при раке желудка были исследованы цитокин-индуцированные киллеры [13,14]. Клинические исследования подтвердили что больные, которых лечили химиотерапией в комбинации с цитокин-индуцированными киллерами, обработанными in vitro интерлейкином-2 совместно с антителами анти-СD-3, имели лучшую выживаемость по сравнению с больными, которым была проведена только химиотерапия. Однако высокая специфичность обработанных киллеров этого типа является крайне важной, позволяя уменьшить риск жизнеугрожающих побочных эффектов, связанных с выраженным иммунным ответом.
Ингибиторы иммунных контрольных точек
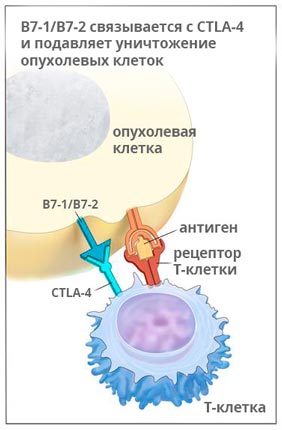
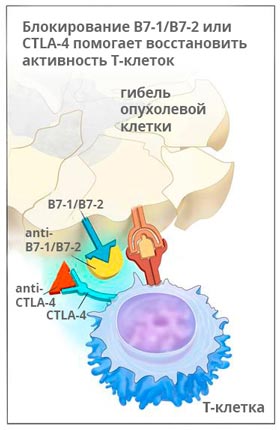
Чтобы избежать избыточной пролиферации и повреждения ткани, необходимо тщательно регулировать активность . В этот процесс включено несколько иммунных контрольных точек. Т-клетки экспрессируют ингибирующие рецепторы CTLA-4 и РD-1. Эти молекулы обычно появляются на поверхности Т-клеток после их активации и передают негативный сигнал. Блокада этих рецепторов с помощью антител вызывает повышенную активность Т-клеток, которая достаточно высока при многих видах опухоли.
Не так давно в геномном атласе рака были проанализированы молекулярные характеристики аденокарциномы желудка [15]. Были выделены 4 опухолевых подтипа: опухоли, позитивные по вирусу Эпштейна-Барр, микросателлитные нестабильные опухоли, геномно-стабильные опухоли и опухоли с хромосомной нестабильностью. В подгруппе с вирусом Эпштейн-Барр, составляющей 15% от всех, выявлена повышенная экспрессия РD-L1, что говорит о выраженном присутствии иммунных клеток при раке желудка и позволяет использовать ингибиторы иммунных контрольных точек.
Было проведено исследование II фазы с использованием тремелимумаба – полностью гуманизированного моноклонального антигена анти CTLA-4 – в качестве 2-й линии терапии 18 больных раком желудка [16]. Хотя объективный ответ отмечен у 5% больных, медиана выживаемости составила 4,8 мес. и соответствовала таковой при лечении рака желудка с использованием химиотерапии.
Кроме того, можно предположить, что комбинация ингибиторов из 2 блокаторов иммунного ответа может быть более эффективна у больных с распространенным раком желудка. Новый препарат MEDI 4736 является моноклональным антигеном человека IgG1, который связывается с РD-L1 и предотвращает его связывание с РD-1 и СD-80. Полученные в I фазе предварительные данные показали многообещающий клинический эффект препарата при многих видах опухоли [17]. Сегодня продолжается несколько исследований MEDI 4736 как монотерапии, так и в комбинации с иммуномодуляторами, например, тремелимумабом.
Ниволумаб – антитело, которое блокирует взаимодействие между РD-1 и соответствующим лигандом РD-L1. Ниволумаб показал впечатляющую эффективность при многих видах опухолей. В декабре 2014 FDA одобрило ниволумаб для лечения нерезектабельной или метастатической меланомы после прогрессирования на ипилимумабе (и BRAF ингибиторе при наличии BRAF V600 мутации). Позже ниволумаб получил одобрение в качестве 2-й линии лечения при плоскоклеточном немелкоклеточном раке легкого. Основой тому послужило улучшение общей выживаемости в сравнении с доцетакселом (9,2 мес. vs 6,0 мес., HR 0,59, р=0,00025).
В настоящее время при раке желудка проводится I фаза исследований этого анти-PD-1 иммуностимулирующего антитела самостоятельно или в комбинации. Доклинические исследования показали, что двойная блокада РD-1 и СТLА-4 приводила к повышению выброса цитокинов и увеличивала пролиферацию СD8+ и СD4+ Т-клеток по сравнению с блокадой одного из рецепторов [18,19]. Продолжаются исследования Ib/II фазы по изучению активности ниволумаба в монотерапии или в комбинации с ипилимумабом у больных метастатическим раком желудка, раком поджелудочной железы, трижды-негативным раком молочной железы и мелкоклеточным раком легкого [20].
Пембролизумаб является высокоспецифичным гуманизированным моноклональным IgG4 антителом, которое блокирует взаимодействие PD-1 c его лигандами PD-L1 и PD-L2. Это антитело показало обещающие результаты у 135 больных метастатической меланомой в большом исследовании I фазы (KEYNOTE-001) [21,22]. Использование пембролизумаба привело к общему ответу у 26% больных и имело управляемый профиль токсичности. На этом основании FDA одобрило его для лечения меланомы. Недавно было проведено исследование по безопасности и активности пембролизумаба у больных раком желудка в I фазе, было скринировано 165 больных распространенным раком желудка и гастроэзофагального соединения [23]. 65 больных (40%) были PD-L1 позитивными (критерием служило окрашивание PD-L1 в строме или ≥1% опухолевых клеток), 39 из них получали пембролизумаб (10 мг/кг) каждые 2 недели. У 41% больных отмечено уменьшение опухоли. Общий ответ в азиатской популяции больных составил 32%, в неазиатской – 30%. Отмечено, что лечение больные перенесли хорошо, даже несмотря на то, что они предварительно получали серьезное лечение. Далее, были получены предварительные доказательства взаимосвязи между выживаемостью без прогрессии, ответом опухоли на лечение и экспрессией PD-L1.
Иммунотерапия в настоящее время выходит на передовую позицию. Получены неожиданные результаты, особенно при лечении меланомы, при которой этот терапевтический подход позволил улучшить выживаемость. При раке желудка, несмотря на некоторые результаты, требуется дальнейшее изучение этого вопроса. Кроме того, открытие эффективных биомаркеров позволило бы сделать важный шаг в определении групп больных, где иммунотерапия была бы оптимальной. Это могло бы не только увеличить количество больных, у которых возможен эффект от лечения, но также выделить больных, у которых возможно развитие выраженной токсичности. Такой подход поможет определить экономическую выгоду от лечения. Следовательно, дальнейшие клинические исследования могли бы быть посвящены изучению потенциальных биомаркеров, таких как экспрессия PD-L1, инфильтрации иммунными клетками (например, СD8/регуляторные Т-клетки и хемокины) и использования частоты мутаций в опухоли.
- Couzin-Frankel J. Breakthrough of the year 2013. Cancer immunotherapy. Science 2013; 342: 1432-1433.
- Burnet FM. Cancer: a biological approach. Brit Med J. 1957; 1: 841-847.
- Burnet FM. The concept of immunological surveillance. Prog Exp Tumor Res. 1970; 13: 1-27.
- Thomas L. Cellular and Humoral Aspects of the Hypersensitive states. Sherwood Lawrence, MD New York, Paul B. Hoeber, Inc., 1959, 667 pp.
- Dunn GP, Bruce AT, Ikeda H, et al. Cancer immunoediting: from immuno-surveillance to tumor escape. Nat Immunol. 2002; 3: 991-998.
- Van der Bruggen, Traversari C, Chomez P, et al. A gene encoding an antigen recognized by cytolytic T lymphocytes on a human melanoma. Science. 1991; 254: 1643-1647.
- Inoue H, Mori M, Honda M, et al. The expression of tumor-rejection antigen ‘MAGE’ genes in human gastric carcinoma. Gastroenterology. 1995; 109: 1522-1525.
- Fukuyama T, Yamazaki T, Fujita T, et al. Helicobacter pylori, a carcinogen, induces the expression of melanoma antigen-encoding gene (Mage)-A3, a cancer/testis antigen. Tumor Biol. 2012; 33: 1881-1887.
- Yang J, Li ZH, Zhou JJ, et al. Preparation and antitumor effects of nanovaccines with MAGE-3 peptides in transplanted gastric cancer in mice. Chin J Cancer. 2010; 29: 359-364.
- Masuzawa T, Fujiwara Y, Okada K, et al. Phase I/II study of S-1 plus cisplatin combined with peptide vaccines for human vascular endothelial growth factor receptor 1 and 2 in patients with advanced gastric cancer. Int J Oncol. 2012; 41: 1297-1304.
- Yamaue H, Tanimura H, Tsunoda T, et al. Clinical application of adoptive immunotherapy by cytotoxic T lymphocytes induced from tumor-infiltrating lymphocytes. Nihon Gan Chiryo Gakkai Shi. 1990; 25: 978-989.
- Kono K, Takahashi A, Ichihara F, et al. Prognostic significance of adoptive immunotherapy with tumor-associated lymphocytes in patients with advanced gastric cancer: a randomized trial. Clin Cancer Res. 2002; 8: 1767-1771.
- Jiang J, Xu N, Wu C, et al. Treatment of advanced gastric cancer by chemotherapy combined with autologous cytokine-induced killer cells. Anticancer Res. 2006; 26: 2237-2242.
- Jiang JT, Shen YP, Wu CP, et al. Increasing the frequency of CIK cells adoptive immunotherapy may decrease risk of death in gastric cancer patients. World J Gastroenterol. 2010; 16: 6155-6162.
- The Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014; 513: 202-209.
- Ralph C, Elkord E, Burt DJ, et al. Modulation of lymphocyte regulation for cancer therapy: a phase II trial of tremelimumab in advanced gastric and esophageal adenocarcinoma. Clin Cancer Res. 2008; 16: 1662-1672.
- Segal N. Preliminary data from a multi-arm expansion study of MEDI4736, an anti-PD-L1 antibody. J Clin Oncol. 32:5s, 2014 (suppl; abstr 3002).
- Curran MA, Montalvo W, Yagita H, et al. PD-1 and CTLA-4 combination blockade expands infiltrating T cells and reduces regulatory T and myeloid cells within B16 melanoma tumors. Prc Natl Acad Sci USA. 2010; 107: 4275-4280.
- Duraiswamy J, Kluger H, Callahan MK, et al. Dual blockade of PD-1 and CTLA-4 combined with tumor vaccine effectively restores T-cell rejection function in tumors.Cancer Res. 2013; 369: 122-133.
- Callahan M, Bendell J, Chan E, et al. Phase I/II, open-label study of nivolumab (anti-PD-1; BMS-936558, ONO-4538) as monotherapy or combined with ipilimumab advanced or metastatic solid tumor. J Clin Oncol. 32:5s, 2014 (suppl; abstr TPS3114).
- Hamid O, Robert C, Daud A, et al. Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma. N Engl J Med. 2013; 369: 134-144.
- Robert C, Ribas A, Wolchok JD,e t al. Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. Lancet. 2014; 384: 1109-1111.
- Muro K, Bang Y, Shankaran V, et al. A phase 1b study of pembrolizumab in patients with advanced gastric cancer. Annals Onc. 2014; Suppl 5: v1-v41.

Во время деления клеток в нашем организме периодически возникают ошибки. Это неизбежно. Если что-то пошло не так, после деления дочерние клетки имеют неправильное строение, могут становиться раковыми. Иммунная система всегда настороже и готова их уничтожить.
Однако, иммунитет справляется со своей функцией не всегда — в противном случае ни у кого бы не возникали злокачественные опухоли.
Раковые клетки коварны, они могут обзавестись разными видами защиты:
- Если раковая клетка вырабатывает недостаточно много чужеродных веществ, иммунитет её не замечает.
- Некоторые опухоли умеют вырабатывать вещества, которые подавляют работу иммунных клеток.
- Иногда ведущая роль принадлежит микроокружению опухоли — клеткам и молекулам, которые окружают раковые клетки. Микроокружение тоже может подавлять иммунитет.
Для того чтобы иммунная система начала расправляться с опухолью, её нужно активировать, либо предоставить ей необходимые компоненты. Современные врачи и ученые знают, как это сделать. Такое направление лечения рака называется иммунотерапией. Существует несколько её разновидностей.
Какие бывают разновидности иммунотерапии?
На данный момент онкологам доступны разные виды иммунотерапии:
Многие ученые считают, что за иммунотерапией будущее в лечении рака. Исследования в этом направлении продолжаются, в лабораториях разрабатывают и тестируют новые препараты.
Моноклональные антитела
Чужеродные вещества в организме человека называют антигенами. В ответ на их внедрение иммунная система вырабатывает специфические белковые молекулы — антитела. Каждое антитело связывается с соответствующим ему антигеном, после чего происходит ряд событий, приводящий к уничтожению чужеродного агента.
Моноклональные антитела — по сути искусственные заменители собственных антител человека. Каждое из них находит в организме свою молекулу-мишень и связывается с ней. В случае с онкологическими заболеваниями такой мишенью является определенное вещество, которое раковые клетки вырабатывают в достаточно большом количестве, а здоровые — в очень малом, или не вырабатывают вообще.
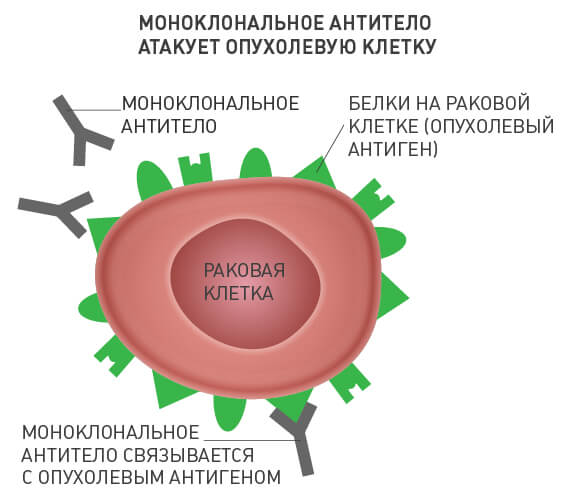
Различные моноклональные антитела действуют по-разному:
Моноклональные антитела можно использовать для доставки к раковым клеткам других лекарств. Например, можно прикрепить к молекуле антитела радиоактивную частицу или химиопрепарат.
За последние годы в мире было одобрено и внедрено в клиническую практику более десятка разных моноклональных антител. Они применяются для лечения ряда злокачественных опухолей, обладающих определенными молекулярно-генетическими характеристиками. В настоящее время ученые работают над созданием новых препаратов, некоторые лекарства проходят испытания и, возможно, вскоре будут введены в клиническую практику.
Кейтруда (Пембролизумаб)
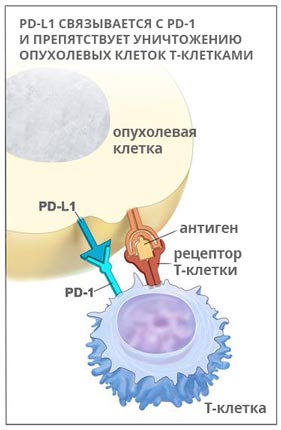
PD-1 – это рецептор, который находится на поверхности T-клеток. Когда он взаимодействует с белком PD-L1, замедляется размножение иммунных клеток, они перестают выделять цитокины и атаковать опухолевую ткань. Кейтруда разрывает эту связь и снимает блок с лимфоцитов:
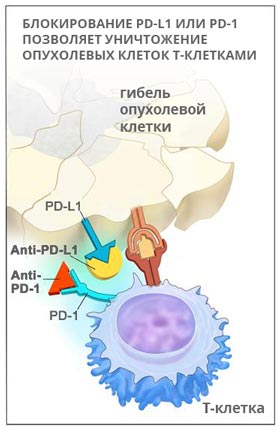
Пембролизумаб был одобрен к применению в Америке в сентябре 2014 года. В настоящее время его используют для лечения меланомы, немелкоклеточного рака легких, опухолей головы и шеи. Кейтруду обычно назначают при некурабельных опухолях, которые невозможно удалить хирургически, если другие методы лечения не помогают.
Ниволумаб (Опдиво)
Ниволумаб, как и Кейтруда, является ингибитором белка-рецептора PD-1. В декабре 2014 года этот препарат был одобрен в Америке для лечения меланомы. В настоящее время основными показаниями к применению Ниволумаба являются: метастатическая и неоперабельная меланома, местнораспространенный или метастатический мелкоклеточный и немелкоклеточный рак легких, почечно-клеточный рак на поздних стадиях. В ряде случаев ниволумаб сочетают с другим ингибитором контрольных точек – ипилимумабом (Ервой).

Ритуксимаб (Мабтера, Ритуксан)
Мишень для ритуксимаба — рецептор CD20, который находится на поверхности B-лимфоцитов. Соединяясь с рецептором, препарат заставляет NK-клетки (натуральные киллеры — разновидность иммунных клеток) атаковать B-лимфоциты, как злокачественные, так и нормальные. После курса лечения организм производит новые нормальные B-лимфоциты, их количество восстанавливается.
Ритуксимаб был одобрен к применению достаточно давно — еще в 1997 году. В настоящее время его используют для лечения аутоиммунных и онкологических заболеваний: хронического лимфолейкоза, вульгарной пузырчатки, неходжкинской лимфомы, идиопатической тромбоцитопенической пурпуры.
Ипилимумаб (Ервой)
Ервой связывается с молекулой CTLA-4 и активирует иммунную систему, для того чтобы она могла бороться с раком. Исследования показывают, что препарат помогает надолго остановить рост опухоли, а в 58% случаев способствует уменьшению её размеров, как минимум, на треть.
Ипилимумаб применяют у пациентов, страдающих меланомой на поздних стадиях, раком легкого, простаты.
Цитокины
Цитокины – это неспецифические стимуляторы иммунитета. Они активируют иммунную систему не против какого-то определенного антигена, а в целом. В настоящее время в онкологии главным образом применяют два препарата – интерлейкин-2 (ИЛ-2) и интерферон-альфа.
Интерлейкин-2 представляет собой молекулу, которая переносит биохимические сигналы между лейкоцитами. Он ускоряет рост и размножение иммунных клеток. Этот препарат находит применение при распространенном раке почек, метастатической меланоме. Иногда ИЛ-2 сочетают с химиотерапией и другими цитокинами. При этом его действие усиливается, но повышается риск серьезных побочных эффектов.
В настоящее время ведутся исследования по возможности применения в онкологии других типов интерлейкинов, таких как ИЛ-7, ИЛ-12, ИЛ-21.
Интерфероны – вещества, которые принимают участие в борьбе с вирусами и раковыми клетками. Существует три типа интерферона, названных по буквам греческого алфавита – альфа, бета и гамма. Для лечения рака применяют препараты интерферона-альфа. Они помогают усилить противоопухолевый иммунный ответ, непосредственно замедлить рост раковых клеток и кровеносных сосудов, которые обеспечивают опухоль кислородом и питательными веществами.
Интерферон-альфа применяют при раке почек, меланоме, волосатоклеточном лейкозе, некоторых типах лимфомы, саркоме Капоши.
Иммунотерапия при раке легкого
Рак легких — одно из самых распространенных онкологических заболеваний. По заболеваемости и уровню смертности он занимает первое место у мужчин и третье место у женщин. Почти 20% пациентов, умерших от злокачественных опухолей, погибли от рака легкого. В группе повышенного риска находятся курильщики в возрасте старше 50 лет. На каждые 3–4 миллиона выкуренных сигарет приходится одна смерть от рака легких.
Заболевание часто диагностируют на поздних стадиях, когда многие виды лечения оказываются неэффективны. В таких случаях пользу может принести иммунотерапия.
При раке легкого применяют такие препараты, как ниволумаб (Опдиво), ипилимумаб (Ервой), пембролизумаб (Кейтруда), атезолизумаб (Тецентрик).
В Европейской клинике применяются наиболее современные методы лечения рака легкого, меланомы и других онкологических заболеваний. Благодаря сотрудничеству с зарубежными коллегами, мы может предоставить пациентам возможность пройти курс иммунотерапии, персонализированного лечения в нашем центре иммунотерапии. Мы знаем, как продлить жизнь и избавить от мучительных симптомов при запущенном раке. Мы знаем, как помочь.
Иммунотерапия при меланоме
Меланома — далеко не самая распространенная (всего 2%) форма рака кожи, но она очень агрессивна и чаще других опухолей приводит к смерти. Так, в 2012 году в мире было диагностировано 232 000 новых случаев меланомы, 55 000 больных погибли. Меланома рано метастазирует, после чего многие методы лечения становятся неэффективны.
На поздних стадиях для лечения меланомы применяют пембролизумаб (Кейтруда), ипилимумаб (Ервой), ниволумаб (Опдиво).
Отзыв пациента о лечении меланомы иммунотерапией:
Мне 41, я бывший спортсмен-байдарочник, волосы черные, глаза карие — то есть, я нормально переношу загар, кожа смуглеет быстро, а ожогов у меня не бывает. Я, конечно, слышал, что длительное пребывание на солнце чревато всякими проблемами, а так как основную часть времени я проводил как раз на солнце, регулярно проверялся у дерматолога. От него и узнал, что есть такая беда, как меланома — рак кожи. Но, по его словам, мне она не грозит, как раз ввиду особенностей моей кожи.
Ну, и, конечно, у меня нашли меланому. Причем, что обидно, не на спине или плечах, что было бы логично — эти места постоянно под лучами, а на бедре.
В первую очередь, по совету дерматолога, отправился в одну небезызвестную клинику. Приняли охотно, сказали, что вероятность хорошего исхода большая, так как обнаружена она достаточно рано.
Но, этот выигрыш они благополучно спустили на недельные обследования. По результатам мне назначили операцию ещё через неделю, а потом Интерферон. Я обратился к тому же дерматологу, который послушал меня, и несколько удивился. Ничего толком не сказал, но намекнул на то, что можно бы получить и второе мнение, да побыстрее.
Иммунотерапия при раке желудка
При раке желудка I–III стадии основным методом лечения является хирургическое удаление опухоли, нередко его дополняют курсом химиотерапии и лучевой терапии. На IV стадии, когда опухоль распространяется за пределы органа и дает метастазы, шансы на полную ремиссию стремятся к нулю. В таких случаях проводят лечение, направленное на замедление роста опухоли, сокращение её размеров, продление жизни пациента.
Именно на IV стадии, когда рак желудка не реагирует на другие виды лечения, может принести пользу иммунотерапия. Эффективны такие препараты, как трастузумаб и рамуцирумаб. В настоящее время исследования в отношении иммунотерапии при раке желудка ведутся в четырех основных направлениях: ингибиторы контрольных точек, таргетная иммунотерапия моноклональными антителами, противораковые вакцины и клеточная иммунотерапия.
Иммунотерапия при раке почки
При лечении рака почек иммунотерапией применяет две группы иммунопрепаратов:
- Цитокины — белки, которые активируют иммунную систему и заставляют её бороться с раком. Для лечения применяют искусственно синтезированные аналоги этих белков: интерлейкин-2 (IL-2) и интерферон-альфа.
- Ингибиторы контрольных точек. Контрольные точки — это особые молекулы иммунной системы, которые она использует, чтобы сдерживать себя от атаки здоровых клеток. Иногда они мешают бороться против опухолевых клеток. При раке почек применяют Ниволумаб (Опдиво) — он блокирует PD-1, белок, который находится на поверхности T-лимфоцитов.
Иммунотерапия при раке яичников
В последние годы хирургическое лечение и химиотерапия при раке яичников значительно продвинулись вперед, и все же ситуация пока еще далека от идеальной. У многих женщин опухоль рецидивирует, перестает реагировать на препараты, которые помогали ранее. Из иммунопрепаратов при раке яичников в настоящее время применяется Бевацизумаб (Авастин) — представитель группы моноклональных антител, который блокирует фактор роста эндотелия сосудов. Раковые клетки синтезируют это вещество в большом количестве, чтобы стимулировать рост новых сосудов, обеспечить себя кислородом и питательными веществами. Некоторые методы иммунотерапии при раке яичников в настоящее время находятся на стадии разработки и тестирования: моноклональные антитела, ингибиторы контрольных точек, иммуномодуляторы, противораковые вакцины, иммуноклеточная терапия, онколитические вирусы.
Побочные эффекты иммунотерапии
Лечение иммунотерапевтическими препаратами имеет некоторые общие моменты с химиотерапией. Такое сходство заключается в том, что клетки опухоли погибают в пределах органов и тканей тела, и организму приходится избавляться от них, как от чужеродного вредоносного материала. Это очень ресурсоёмкая задача, поэтому пациент может испытывать симптомы, вызванные перенапряжением различных систем организма.
Иногда иммунотерапия активирует иммунные клетки чрезмерно, и они начинают атаковать нормальные ткани организма. Из-за этого могут возникать некоторые побочные эффекты:
- При поражении слизистой оболочки полости рта и глотки на ней возникают болезненные язвы, которые могут инфицироваться. Обычно они проходят в течение 5–14 дней после окончания лечения.
- Кожные реакции: покраснение, отечность, сухость, повышение чувствительности к свету, трещины на кончиках пальцев.
- Симптомы, напоминающие грипп: слабость, разбитость, повышенная температура, озноб, кашель.
- Тошнота и рвота.
- Головные боли, головокружения.
- Повышение или снижение артериального давления.
- Мышечные боли.
- Одышка.
- Отеки на ногах.
- Увеличение веса из-за задержки жидкости в организме.
- Диарея.
У разных иммунопрепаратов побочные эффекты выражены по-разному. Лучше заранее поговорить с врачом и спросить, каких проблем можно ожидать во время курса лечения, как с ними бороться.
Иммунотерапия: за и против
Однако, не всё так гладко. У иммунопрепаратов есть и минусы. Они работают далеко не у всех пациентов. Иногда опухоль удается уничтожить полностью, а иногда — лишь замедлить её рост. Ученые пока не могут объяснить, почему результаты лечения бывают такими разными. Несмотря на то, что побочные эффекты встречаются не так часто, как при химиотерапии, иногда они могут быть весьма серьезными.
Иммунотерапия — это всегда длительное лечение. Со временем иммунопрепарат, который помогал пациенту ранее, может перестать работать. К минусам можно отнести и достаточно высокую стоимость иммунотерапии при раке. Таким образом, в каждом случае решение нужно принимать индивидуально. Прежде чем назначить иммунотерапию, врач обязательно взвесит все возможные преимущества и риски.
Ещё один минус иммунотерапии — она подходит не для всех типов рака. Существует не так много онкологических диагнозов, для которых разработан препарат, способный точно и эффективно воздействовать на клетки данного рака. Однако это путь, по которому онкология продолжает идти, открывая всё новые и новые препараты и их комбинации, способные воздействовать на новые виды опухоли. Всё остальное — это исключительно преимущества, которые могут отменить остальные виды лечения уже в обозримом будущем.
Сколько стоит иммунотерапия?
Иммунотерапия — это самый современный медикаментозный метод лечения рака. Стоимость иммунотерапии рака немаленькая. Особенно в сравнении с другими известными методами. Стоимость лечения зависит от вида применяемого иммунопрепарата, типа и стадии опухоли, ее степени агрессивности. Высокая цена иммунотерапии связана с тем, что производство иммунопрепаратов — сложный и дорогой процесс.
В России очень немного клиник, которые проводят лечение иммунотерапией. В большинстве случаев, чтобы пройти курс иммунотерапии, россиянину приходится обращаться к посредникам для лечения за границей. В основном это Израиль, Германия и США. В таком случае стоимость перелёта и лечения составит огромную сумму. Но теперь в России есть возможность пройти иммунотерапевтическое лечение рака в Европейской клинике, что делает его доступным для многих пациентов.

Вопросами лечения рака желудка занимаются многочисленные лаборатории, ученые, врачи. И последние десятилетия намечается значительный прогресс в этом вопросе, заметный, правда, больше в теории, чем на практике. Для многих больных заявленные прогнозы все еще остаются не вполне благоприятными. Соответственно, на фоне того, что иммунотерапия при лечении различных видов рака, в том числе почки, молочной и предстательной железы все больше специалистов проявляют интерес к вопросам применения этого метода в лечении рака желудка.
Принципы иммунотерапии
Основная задача иммунной системы – различать “чужие” клетки и организмы и изолировать их от “своих”. Соответственно, иммунотерапия предполагает, что с раковыми клетками будет бороться сам иммунитет. Правда, для этого организму необходима определенная помощь. После того, как впервые была выдвинута подобная теория, далеко не все восприняли ее серьезно, некоторые ученые напрочь отвергали даже возможность проведения экспериментов в этой области. Но вскоре способность иммунитета самостоятельно бороться с раковыми клетками была доказана, теория была полностью подтверждена на практике стала неотъемлемой частью системы иммуноредактирования рака.
Весь процесс иммунного ответа условно делят на три фазы. Это фаза устранения, равновесия и избегания. На первом этапе рост клеток опухоли может привести к некоторым изменениям в окружающих зонах, в том числе и к их локальному повреждению. В это же время иммунная система секретирует цикотины и Ɣ-интерфероны и сдерживает процесс образования новых клеток опухоли. Следующий процесс – антигенпрезентирующие дендритные клетки приступают к поглощению опухолевых антигенов, тем самым активируя Т-лимфоциты, которые и отвечают за иммунный ответ.
Самым сложным и продолжительным этапов в иммуноредактировании является этап равновесия. В этой фазе все клетки имеют динамический баланс. Но, так как в это время наблюдается генетическая нестабильность при которой раковые клетки могут быть вполне устойчивыми, они выживают и приобретают резистентность, следствием чего является фаза избегания.
При изучении иммунотерапии значимым этапом был процесс выделения первого антигена опухоли, который бы распознавался Т-клетками. Для этого был клонирован ген MAGE, который, собственно, и кодирует антигены. Эти опыты и доказали саму возможность использования иммунотерапии для лечения рака, заставив клетки иммунной системы самостоятельно находить и уничтожать “чужие” клетки.
Вакцина против рака
Такая вакцина используется для того, чтобы активировать клетки иммунной системы, улучшить ее способности распознавать раковые клетки и уничтожать их, стимулируя опухолеспецифичные Т-лимфоциты. Весь процесс выглядит примерно следующим образом: используя антиген-презентирующие клетки Т-клетки распознают опухолевые антигены. Как правило, антигены имеют довольно специфические признаки, это пептиды, расположенные внутри клетки, но на поверхности клетки имеются молекулы, которые легко распознаются Т-клетками.
В процессе изучения этого вопроса были обследованы несколько тысяч опухолевых антигенов. Но особое внимание привлек именно ген MAGE, который впервые был обнаружен у больных меланомой. Но он может быть представлен в самых различны опухолях, а также на нормальных, здоровых клетках, где ген совершенно не проявляет себя. Остальные возможные антигены являются пептидами, которые возникли вследствие каких-либо мутаций, могут быть представлены антигенами дифференцировки, избыточной экспрессии и вирусные антигены.
При раке желудка MAGE экспрессируется в 38% случаев. При проведении доклинических исследований было выявлено, каким именно образом Helicobacter pilori осуществляет индуцирование экспрессии МАGE-3. Первые опыты проводились на модели рака желудка мышей. Как следствие – была получена регрессия опухоли. На следующем этапе ученые провели исследование на 22 пациентах, имеющих диагноз рак желудка. В этой фазе исследований использовались пептиды VEGF-R1 и VEGF-R2, которые применялись совместно с цисплатиной и S-1. Итоговый результат – частичная регрессия у 55% пациентов, увеличение общей выживаемости. Дополнительно в ходе исследований было выявлено, что опухолевые антигены, которые связаны с HER2/neu, могут значительно повлиять на развитие иммунотерапии и результативность вакцинации против рака.
Еще одним видом иммунотерапии является адоптивная иммунотерапия, при которой у больного выявляют опухолевые Т-клетки и культивируют их вне организма. Затем они возвращаются пациенту уже генетически модифицированные и в несколько увеличенном количестве. В качестве активированных киллеров используются различные типы клеток, среди которых имеются и лимфоциты, особенностью которых является инфильтрация опухолей.
В одном из последних исследований принимали участие 44 больных раком желудка. Для лечения использовались тумор-ассоциированные лимфоциты, в одном случае применялась химиотерапия, а в другом – нет. Более высокая общая выживаемость наблюдалась в группе, где тумор-ассоциированные лимфоциты использовались вместе с химиотерапией. Здесь же была проверена и теория использования цитокин-индуцированных киллеров, которые были обработаны in vitro. Здесь результат был более высокий, чем при использовании только химиотерапии. При этом отмечается, что большое значение имеет специфика обработки киллеров, благодаря чему значительно уменьшается количество побочных эффектов, которые возможны при применении иммунотерапии, в том числе и жизнеугрожающих последствий лечения.
Ингибиторы иммунных контрольных точек
Для того, чтобы снизить негативные последствия от применяемого лечения, требуется регулировать активность Т-клеток. Для этого в процесс лечения включены несколько контрольных точек, помогающих более явно и своевременно определить возможные проблемы. Ингибирующими рецепторами служат CTLA-4 и РD-1, они возникают на поверхности Т-клеток, где после активации они и передают негативный сигнал. Таким образом, осуществляется блокада этих антител, что влияет на активность самих Т-клеток, которые работают при большинстве разновидностей опухолей.
В геномных атласах рака не так давно были определены 4 опухолевых подтипа адекарциномы желудка:
- позитивные по вирусу Эпштейна-Барр;
- микросателлитные нестабильные;
- геномно-стабильные;
- с хромосомой нестабильности.
Использование подобной классификации значительно упрощает работу врача при выборе наиболее эффективного лечения. Так, подгруппа с вирусом Эпштейн-Барр, к которой относится около 15% больных раком желудка, имеет более высокую экспрессию РD-L1. Этот показатель сигнализирует о выраженном присутствии иммунных клеток, а, значит, применение ингибиторов иммунных контрольных точек будет вполне оправданным.
Тремелимумаб
Вторая фаза исследований проходила для 18 больных с раком желудка. В этом случае использовался тремелимумаб. Результат был не столь ожидаемым, но все же с положительной динамикой. Объективный ответ удалось получить лишь у 5% больных, медиана выживаемости в этом случае – 4,8 месяцев.
На основании проведенных исследований возникло предположение, что одновременное использование двух ингибиторов может обеспечить более высокий результат. В итоге был представлен новый препарат MEDI 4736, который является моноканальным антигеном IgG1. Его задача – связаться с РD-L1, препятствуя его соединению с РD-1 и СD-80. Данные, полученные на предварительном этапе, показали отличный результат, с высокой эффективностью препарата при большом количестве различных опухолей, среди которых имеется и рак желудка. На сегодня все еще продолжаются исследования MEDI 4736, используемого в качестве монотерапии и в связке с иммуномодуляторами.
Ниволумаб
Применение Ниволумаба обеспечило достаточно высокую эффективность лечения при многих видах опухоли. Это антитело является хорошим блокатором, который препятствует взаимодействию РD-1 и РD-L1. Этот препарат изначально был одобрен для лечения меланомы (нерезектабельной или метастатической), после прогрессирования при применении ипилимумабе. Несколько позже Ниволумаб одобрили и в качестве препарата для 2-й линии лечения рака легкого. Как показали исследования, Ниволумаб оказался более эффективным по сравнению с доцетакселом при плоскоклеточном немелкоклеточном раке легкого.
Сейчас активно проводятся исследования по применению ниволумаба в качестве самостоятельного препарата или его использование комплексного применения при лечении рака желудка. Первые полученные данные показали, что использование двойной блокады РD-1 и СТLА-4 обеспечивало повышенный выброс цитокинов и приводило к увеличению пролиферации определенных Т-клеток по сравнению с блокадой лишь одного из рецепторов. Соответственно, такие показатели привели к новым этапам исследования, где ниволумаб может использоваться в монотерапии или в комплексе с ипилимумабом при лечении метастатического рака желудка, мелкоклеточного рака легкого и некоторых других видов опухолей.
Пембролизумаб
Еще один из эффективных препаратов для лечения рака – пембролизумаб. Он является гуманизированным моноклональным IgG4 антителом, роль которого – блокировать совместную работу PD-1 с PD-L1 и PD-L2. На этапе исследований этот препарат показал достаточно высокие результаты. У 135 пациентов с метастатической меланомой общий ответ составил 26%,. К тому же, как показали лабораторные исследования применение пембролизумаба имеет управляемый профиль токсичности. В связи с вышеперечисленным, FDA одобрило пембролизумаб как средство для лечения меланомы. После этого были проведены исследования по применению препарата для лечения больных раком желудка. Исследования проводились среди 165 пациентов. Среди них 65 человек были PD-L1 позитивными, больше половины из них (39 человек) каждые 2 недели получали лечение в виде пембролизумаба. И у 41% в итоге отмечается уменьшение опухоли. При этом было проедено некоторое разделение на азиатскую и неазиатскую группы.
Результат азиатской популяции – 32%, неазиатской – 30%. ПО заверению самих больных и их врачей, пациенты достаточно легко перенесли лечение. Важным фактором в этом случае послужило то, что каждый из них предварительно также проходил различные этапы избавления от раковой опухоли, и, как правило, такое лечение было достаточно серьезным.
Подводя итоги
На данный момент иммунотерапия является одним из основных методов лечения многих видов рака. Несмотря на то, что первые прогнозы были вовсе не оптимистичными, результаты проведенных исследований позволили смело заявлять о том, что именно такой метод лечения может стать передовым. Особенно это касается меланомы, где особо отмечено улучшение выживаемости. А вот лечение рака желудку требует дополнительного изучения, проведения лабораторных исследований, тестирований на различных группах и в различных условиях. К тому же, изучение этого вопроса могло бы помочь в выявлении тех биомаркеров, которые были бы максимально эффективны при использовании иммунотерапии. В этом случае возможно увеличение числа пациентов с положительным результатом от применяемого лечения. К тому же, этот метод поможет выявить больных, у которых более вероятно развитие токсичности, а, значит, определить экономическую выгоду от применяемого лечения будет намного проще.
Читайте также:

