Дексаметазон при онкологии рака молочной железы
Уважаемый Марк Азриельевич!
Чтобы не сбиться, сразу изложу проблему, потом всю информацию.
С уколами дексаметазона – понос, очень частое мочеиспускание, боли в животе (рези).
Без уколов – тошнота, рвота, отказ от пищи и, как следствие, сахар 1,2 и гипогликемическая кома. И сильная одышка.
Можно ли что-то сделать?
Теперь о том, как мы дошли до такой жизни.
Мама, 63 года.
1984г. – Рак правой молочной железы Т1Т0М0 1 ст., III гр. (высокодифференцированный инфильтративный рак из притоков). Радикальная мастэктомия справа. Метастазов в регионарных лимфоузлах нет. Химиотерапия не проводилась.
Иммуногистохимическое исследование: рецепторы эстрогенов – отрицательные, рецепторы прогестерона – отрицательные. Her2 neu 3+
2007г. – обнаружены mts в легких, печени, надключичных лимфоузлах.
8 курсов CAF. Стабилизация. 2008г. - лечение не проводилось.
2009г. июль - отрицательная динамика (легкие, печень, л/у). Диагноз 12.10.2009г.: Ca m. dex. Mts в печень, легкие, кости скелета, головной мозг, л/узлы. Назначен Фторафур в метрономном режиме.
КТ головного мозга 20.08.2009г. По стандартной программе, без в/в контрастирования.
В обеих гемисферах мозжечка и большого мозга, а также стволовых структурах определяются множественные разнокалиберные гиперденсные образования с признаками перифокального отека разной степени выраженности. Наибольшие размеры образований: в правой лобной доле – 12 мм, в левой затылочной – 17 мм. Желудочковая система минимально расширена за счет тел боковых, без признаков гипертензии. Срединные структуры не смещены. Субарахноидальные пространства конвекса незначительно расширены.
Уплотнены стенки основной артерии и обеих ВСА.
Пневматизация основной, лобной пазух и клеток решетчатого лабиринта не нарушена.
В костях свода черепа определяются участки деструкции (до 10 мм в поперечнике).
Заключение: начальная кортикальная церебральная атрофия. Множественные вторичные изменения в суб- и супратенториальных отделах головного мозга, а также костях свода черепа.
КТ органов брюшной полости 20.08.2009. Исследование выполнено в спиральном режиме, инкремент восстановления 5 мм, без в/в контрастирования.
На сканах нижних отделов легких с обеих сторон выявляются множественные округлые образования. Небольшое количество жидкости в обеих плевральных полостях.
На серии КТ печень не увеличена, контуры ровные, структура неоднородная из-за наличия множественных гиподенсных образований без четких контуров. Размеры наибольших: II сегмент – 9 и 10мм, IV – 29мм, V – 32мм, VI – 14 и 23мм, VII – 12 и 15мм, VIII – 23 и 31мм. Внутрипеченочные вены и желчные протоки не расширены. Рентгеноконтрастных конкрементов в проекции желчевыводящих путей нет.
Селезенка не увеличена, контуры ровные, структура однородная.
Надпочечники диффузно увеличены в размерах: правый – 12x35мм, левый – 18x29мм.
Поджелудочная железа не увеличена, контуры ровные, структура однородная. Холедох и вирсунгов проток не расширены. Парапанкреатическая клетчатка прослеживается во всех отделах.
Почки расположены обычно, не увеличены, с четкими, ровными контурами. Полостная система почек не расширена, в проекции нижней группы чашечек правой – микролит (2мм). На уровне нижней трети правой почки определяется субкапсулярное кистовидное образование повышенной плотности (6мм). Мочеточники на исследованных уровнях не расширены.
На уровне тел L 2-5 выявляются множественные мелкие и одиночные, увеличенные до 12мм забрюшинные лимфатические узлы. Свободной жидкости в брюшной полости и забрюшинном пространстве не выявлено. В телах Th 10, 12, L 5 выявляются участки деструкции с частичным разрушением замыкательных костных пластинок.
Заключение: вторичные изменения в легких, печени, грудных и поясничных позвонках. Забрюшинная лимфаденопатия. МКБ, микролит полостной системы правой почки. Осложненная киста нижней трети правой почки.
Рентген легких 02.12.2009: уменьшение крупных очагов в 2-3 раза, исчезновение мелких.
Сопутствующие заболевания: ИБС, стенокардия напряжения 2 ФК, ГБ 2 ст., атеросклеротический кардиосклероз, НК 0 ст., варикозная болезнь вен нижних конечностей, хронический гастрит (биопсия желудка 26.11.2008 – очаговая инфильтративная гиперплазия вер/3 тела желудка), энтероколит, остеохондроз шейно-грудного отдела позвоночника.
Давление 110/80 – 140/92, последнее более частотно. Пульс 80-90.
Сахар натощак 3,9, через 2 часа после еды – от 4,5 до 6,0.
Из анализа крови помню только СОЭ – 58.
Получает Фторафур (1 капсула 2 раза в день), Нурофен при головной боли (не каждый день), Дексаметазон 4 мг в/мыш 1 раз утром, Омез 1шт. утром, Коделак, Супрадин, Эссенциале, Фенюльс, Глюкоза в таблетках.
Сентябрь, октябрь (как пошел Фторафур) – тошнота, рвота, отказ от пищи. 3 октября ушла в кому, сахар 1,2. Вторая кома 22 октября. Есть отказывалась. С середины ноября начали Дексаметазон в/мыш. На нем пошло мочеиспускание каждые полчаса, боли и рези в животе, понос до 6 раз в сутки (и это с Омезом!). Но при этом нормальный аппетит, отсутствие тошноты, рвоты и одышки. Если же его отменять из-за поноса и остального, то возвращается тошнота, рвота, одышка и опять угроза комы.
Что делать? Всё, что будет нужно, сделаю и допишу.
Для психики – Реланиум? Фенозепам? Ивадал? Имован?
Очень буду ждать ответа. Очень. Спасибо Вам.
В онкологии используется большое количество препаратов для этиотропной, патогенетической и симптоматической терапии. Дексаметазон – глюкокортикостероид с противовоспалительным, иммуномодулирующим, антитоксическим и противошоковым действием. У препарата широкий спектр показаний, он эффективен при большинстве аутоиммунных заболеваний, системных патологий соединительной ткани. Дексаметазон при онкологии назначают для устранения отечности, снижения внутричерепного давления и очаговых симптомов.
- Лекарственное средство Дексаметазон: состав, свойства
- Показания к применению
- Противопоказания к применению и побочные эффекты
- Применение Дексаметазона
- Заключение
Лекарственное средство Дексаметазон: состав, свойства
В онкологии используется препарат, содержащий природный гомолог гидрокортизона – дексаметазон. Выпускается в виде таблеток для перорального приема, раствора для парентерального введения, а также в формах для местного применения (капли). Попадая в организм, основная фармацевтическая субстанция взаимодействует с рецепторами на цитоплазме клетки и изменяет синтез протеинов, в том числе тех белков, которые принимают участие в развитии всех стадий воспалительной реакции и аллергии. Снижает проницаемость сосудов микроциркуляторного русла, обладает мембраностабилизирующим эффектом, влияет на все виды обмена в организме.

Благодаря своим фармацевтическим свойствам, лекарство эффективно при онкологии. Дексаметазон при раке головного мозга в онкологии назначают с целью обезболивания, устранения перифокального отека и внутричерепной гипертензии, вызванной объемным образованием. После приема внутрь таблетированной формы основное вещество быстро всасывается в нижних отделах пищеварительного тракта. Максимальная концентрация достигается через 2 часа. Легко проникает через гематоэнцефалический барьер, что позволяет применять лекарственное средство для комплексного лечения опухолей головного мозга. Основной метаболизм лекарства происходит в печени.
Показания к применению
Дексаметазон эффективен при широком спектре патологий:
- Шок, отек мозга, в том числе при онкологии;
- Аутоиммунные заболевания, системные болезни соединительной ткани;
- Аллергические заболевания;
- Тиреоидный криз;
- Хронические воспалительные патологии;
- Отравление кислотами и щелочами;
- Онкология: рак легких, объемные процессы головного мозга в комплексной терапии.
Для чего назначают при онкологии Дексаметазон? При опухоли головного мозга и метастазах медикамент используют как компонент комплексной терапии для улучшения общего состояния больного. Препарат эффективно борется с воспалением, отеком, снижает внутричерепное давление. Если у пациента по данным компьютерной томографии имеется внутричерепная гипертензия, или по результатам МРТ обнаружено объемное образование с отеком окружающих тканей, необходимо назначить Дексаметазон.
Противопоказания к применению и побочные эффекты
Уколы Дексаметазона и пероральный прием таблеток при онкологии противопоказаны при нижеперечисленных состояниях:
- Системные грибковые поражения;
- Заболевания, вызванные вирусами и паразитами;
- Патологии пищеварительной системы;
- Болезни сердечно-сосудистой системы.
С осторожностью, под постоянным наблюдением специалиста, Дексаметазон может применяться в онкологии при болезни Иценко-Кушинга, ожирении, состояниях, сопровождающихся судорогами, снижении уровня альбуминов в крови, открытоугольной глаукоме.

Возможные побочные реакции при использовании средства в онкологии:
- Нарушение сознания, эйфория, галлюцинации, инсомния, головокружение, головные боли различной локализации;
- Повышение артериального давления, прогрессирование сердечной недостаточности, тромбоз, снижение уровня калия;
- Диспепсические расстройства, воспаление поджелудочной железы, снижение аппетита вплоть до анорексии;
- Отеки на нижних конечностях, снижение уровня кальция, повышение веса;
- Снижение функции надпочечников, сахарный диабет, нарушение менструального цикла у женщин;
- Слабость мышц, снижение прочности костей;
- Реакции индивидуальной чувствительности.
В онкологии препарат Дексаметазон противопоказан для назначения на длительный курс лечения. Возможные побочные явления при длительном приеме – отек лица, проксимальная миопатия.
При беременности Дексаметазон используется только в ситуациях, когда польза от приема оправдывает возможный риск для плода и матери.
Применение Дексаметазона
При онкологии принимать Дексаметазон необходимо перед операцией, во время хирургического вмешательства и после него. По показаниям для устранения внутричерепной гипертензии и уменьшения очаговой симптоматики, вызванной опухолевым процессом, Дексаметазон назначают 4 раза в день по 4-8 мг в виде уколов. Положительный эффект наблюдается через 2 дня. Через 4-6 дней дозу препарата снижают до полного прекращения введения через 14 дней.
Заключение
Дексаметазон зарекомендовал себя как эффективное средство при онкологии. Однако принимать Дексаметазон во время болезни нельзя, не проконсультировавшись предварительно с лечащим врачом, так как существуют противопоказания, и возможны побочные эффекты.
Нашли ошибку? Выделите ее и нажмите Ctrl + Enter
В большинстве случаев обследования больных с локализованными опухолями врач приходит к выводу, что болезнь носит преимущественно системный характер, и метастазы разовьются позже. Обнаружение многочисленных метастазов, часто спустя годы после проведения мастэктомии, а также в течение многолетнего наблюдения за больными подтверждает этот вывод.
Обычно появление метастазов приводит к смертельному исходу в пределах трех лет, хотя в случаях, когда лечение оказывается эффективным, пациентки могут жить дольше. Вероятность метастазирования опухоли сильно зависит от степени вовлечения подмышечных лимфатических узлов в патологический процесс, что определяется при гистологическом анализе образцов, взятых во время операции.
Существует взаимосвязь между количеством пораженных подмышечных лимфатических узлов и вероятностью распространения метастазов.
Со времени проведения первой операции терапевтической овариэктомии, проведенной Битсоном в 1896 г., стало очевидно, что при изменении гормонального статуса организма в случаях распространенного опухолевого процесса, по крайней мере для одной трети пациенток достигается симптоматический эффект.
Также применяли анаболические стероиды, глюкокортикоиды и прогестерон, проводили удаление надпочечников или гипофиза и назначали ингибиторы ароматазы (анастрозол или летрозол).
Стандартный подход основан на менструальном статусе пациентки. Для большинства больных с метастазирующими опухолями в пременопаузе и перименопаузе используется хирургическое удаление яичников или их облучение. Однако с появлением антагонистов гонадотропин-рилизинг-гормона эти процедуры стали применять реже.
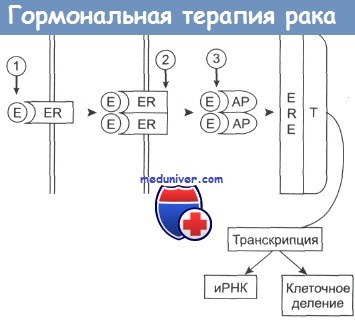
Эстроген (Е) связывается с рецептором (ER), который димеризуется.
Комплекс приобретает активность (АР) и присоединяется к эстроген-зависимым структурам (ERE) клеточного ядра.
Происходит активация таких белков, участвующих в транскрипции (Т), как РНК-полимераза II, что приводит к синтезу белка и делению клетки.
Гозерелин вызывает снижение уровня эстрогенов в плазме крови (1); фульвестран (2) предотвращает процесс димеризации рецептора и его активацию; тамоксифен (3) связывается с активным комплексом, подавляя его способность инициировать транскрипцию.
Антагонисты обеспечивают стойкое снижение уровня эстрогенов и вызывают у пациентки состояние менопаузы, которое длится в продолжении примерно двух месяцев с начала применения гозерелина. Препарат назначается ежемесячно в виде внутримышечных инъекций. Вместе с тем в качестве альтернативы снова стал популярным такой хирургический метод, как лапароскопическое удаление яичников.
Это достаточно безопасная и несложная операция, после которой пациентка на одну ночь остается в стационаре. Следует отметить, что перед операцией больные проходят тщательный отбор по критерию гормональной чувствительности опухоли, и тем, для кого не предполагается проявление лечебного эффекта, операция не проводится.
Для пациенток с опухолью в постменопаузе широко применяется тамоксифен, поскольку он практически не проявляет побочных эффектов. Препарат действует как антиэстроген, но, вероятно, оказывает и прямой цитотоксический эффект. В течение почти 20 лет тамоксифен использовался в качестве стандартного препарата адъювантной терапии.
Тамоксифен назначается перорально в ежедневной стандартной дозе 20 мг. Он обладает медленным кумулятивным действием. Побочные эффекты редки, однако могут наблюдаться приливы, тошнота, гиперкальциемия, тромбоцитопения, удержание жидкости и расстройство менструального цикла. После приема препарата большинство пациенток прибавляют 1-2 фунта в весе и некоторые отмечают ухудшение состояния кожи, волос и ногтей.
Гораздо более существенный эффект получен при назначении гормонотерапии пациенткам с гормонально зависимыми опухолями, в то время как при лечении гормонально независимых опухолей благоприятный эффект наблюдался лишь в редких случаях. Прогноз в случаях гормонально зависимых и независимых опухолей отличается. Для больных с гормонально-зависимыми опухолями характерен более длительный безрецидивный период и большая выживаемость.
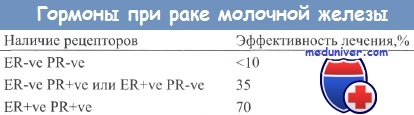
Совместное определение показателей ER и PR обеспечивает более точный прогноз в отношении чувствительности опухоли к гормонотерапии, чем это оказывается возможным при оперировании только показателем ER. Больные с PR-положительными опухолями также характеризуются более длительным безболезненным периодом.
На эффективность гормонотерапии сильно влияет характер распространения метастазов. Костные метастазы проявляют некоторую чувствительность к гормонам, хотя после лечения пациентки живут в среднем около 12-15 месяцев. Тем не менее некоторые больные с гормоночувствительными опухолями и с костными метастазами живут дольше, иногда несколько лет.
В большинстве случаев, при рецидиве опухоли, развившейся в пременопаузе, применяется гозерин (или его аналоги) или лапароскопическая овариэктомия (или облучение яичников). Эти меры эффективны для гормонально чувствительных опухолей. При опухолях в периоде постменопаузы обычно назначают тамоксифен, если пациентки раньше не получали этот препарат в качестве средства адъювантной терапии.
В любом случае можно ожидать, что выживаемость больных составит по крайней мере 30%. Экзогенные гормоны назначают до тех пор, пока не наступит эффект. В дальнейшем гормональную терапию продолжают только тем пациенткам, у которых проявился эффект первичного лечения. Предложены новые противоопухолевые препараты, относящиеся к группе ингибиторов ароматазы.
К числу их относится анастрозол, который блокирует биосинтез предшественников эстрогенов и их последующие превращения в тканях. Анастрозол действует при пероральном применении. Он хорошо переносится больными, так же как и другие родственные соединения, благодаря чему эти препараты быстро заняли место тамоксифена, который оказался неэффективным в лечении пациенток с гормонозависимыми опухолями, развивающимися в период постменопаузы. Рекомендуемая ежедневная доза препарата составляет 1 мг.
Если после первичного лечения возникает рецидив, то назначают другие препараты, например анаболические стероиды, прогестогены и глюкокортикоиды. Анаболические стероиды более эффективны у пациенток с опухолями, развившимися в постменопаузе, и, по-видимому, их особенно необходимо применять в случаях обнаружения костных метастазов.
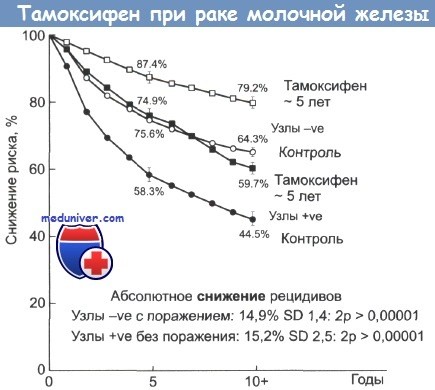
Абсолютное снижение риска возникновения рецидивов рака молочной железы при приеме тамоксифена.
Светлые значки — пациентки без признаков поражения лимфатических узлов; затемненные значки — пациентки с признаками поражения лимфоузлов.
Благоприятный эффект достигается примерно у 20% пациенток, однако недостатком применения стероидов является вирилизация. Удобным для применения является нандролон деканоат (Deca-Durabolin), который назначается в виде внутримышечных инъекций в дозе 50-100 мг каждые 3-4 недели. Если гормонотерапия раньше давала положительные результаты, то можно применять прогестогены. Наиболее часто используется ацетат медроксипрогестерона (МРА, Provera), который обычно назначают перорально в дозе 100 мг три раза в день.
Однако его применение ограничено из-за развития побочного эффекта — прибавления в весе. Такой же эффективностью обладает другое производное прогестерона — мегестрол-ацетат (Megace).
Широко обсуждается вопрос выбора метода лечения первого рецидива опухоли. Следует в этом случае использовать гормональный метод или же химиотерапию с использованием цитотостатиков? Если принимать во внимание количественные показатели, то выбирать надо между гормонотерапией (эффективна в 30% случаев) и комбинационной химиотерапией (эффективность которой в два раза выше). Однако это упрощенное решение вопроса, ответить на который на самом деле сложно.
Реакция опухоли на гормоны обычно носит более продолжительный характер, и у пациентки наблюдаются минимальные токсические проявления. При химиотерапии развивается более кратковременный эффект, который сопровождается токсическими и психологическими осложнениями. Большинство клиницистов в Великобритании в качестве средства первичного лечения предпочитают использовать гормональную терапию. Выбор облегчается все более широким применением метода анализа состояния рецепторов эстрогенов: гормональная терапия должна проводиться только среди пациенток с ER-положительными опухолями. Недавно предложен препарат фульвестрант (Faslodex), подавляющий функции рецепторов эстрогенов. Он может применяться у пациенток с гормоноустойчивыми опухолями, которые развились в постменопаузе. Одним из основных преимуществ этого препарата, по сравнению с агонистом эстрогенов, тамоксифеном, является отсутствие побочных эффектов. Он также не опустошает пул эстрогенов в женском организме, что происходит при применении ингибиторов ароматазы.
Сообщалось, что дексаметазон уменьшает послеоперационные симптомы после различных хирургических процедур. Мы оценили эффективность предоперационного дексаметазона в улучшении послеоперационной тошноты и рвоты (PONV) и боли после мастэктомии.
В этом проспективном, двойном слепом плацебо-контролируемом исследовании 70 пациентов, планировавших мастэктомию с рассечением подмышечных лимфатических узлов, анализировали после рандомизации до лечения 8 мг внутривенного дексаметазона (n = 35) или плацебо (n = 35). Все пациенты прошли стандартизированные процедуры для общей анестезии и хирургии. Эпизоды PONV и оценка боли регистрировались на визуальной аналоговой шкале. Также были зафиксированы анальгезирующие и противорвотные потребности.
Демографические и медицинские переменные были схожи между группами. Заболеваемость PONV была ниже в группе дексаметазона при ранней послеоперационной оценке (28,6% против 60%, p = 0,02) и через 6 ч (17,2% против 45,8%, р = 0,03). Больше пациентов в группе плацебо требовали дополнительных противорвотных препаратов (21 против 8, p = 0,01). Лечение дексаметазоном значительно уменьшало послеоперационную боль сразу после операции (оценка VAS, 4,54 ± 1,55 против 5,83 ± 2,00, p = 0,004), через 6 ч (3,03 ± 1,20 против 4,17 ± 1,24, p 8%); использование опиоидов, седативных средств или любых анальгетиков менее чем за одну неделю до мастэктомии или историю злоупотребления алкоголем или наркотиками. Пациенты с любой историей болезни при движении и / или предыдущей PONV после любой хирургической процедуры были исключены. Все пациенты были госпитализированы за один день до операции и последовали за госпитализацией до 30 дней после хирургической процедуры для выявления любой медицинской или хирургической заболеваемости.
Все пациенты прошли стандартизованную общую процедуру анестезии, и ни один из них не получал никаких преэнестетических препаратов. Индукция использовала внутривенный пропофол (2 мг / кг массы тела) и фентанил (3-5 мкг / кг). Для облегчения интубации трахеи использовали бромид Vecuronium (0,1 мг / кг). Анестезию поддерживали 2-3% севофлюрана и 66% закиси азота в кислороде. Вентиляция контролировалась механически и поддерживалась постоянной во время операции с использованием анестезирующего и дыхательного газоанализатора для мониторинга.
Все пациенты контролировались с косвенным определением артериального давления и частоты сердечных сокращений с использованием стандартных методов, а также с истекшим содержанием СО2 и насыщением кислородом. Впоследствии все пациенты были экстубированы и переданы в непосредственный отдел послеоперационной помощи с сердечно-сосудистым и кислородным контролем.
Все пациенты лечились в соответствии с предоперационной клинической стадией с радикальной мастэктомией или грудной консервативной хирургией с подмышечным расслоением лимфатических узлов той же хирургической группой. У всех пациентов закрытые всасывающие стоки были помещены в область, подвергнутую хирургическому вмешательству, и были удалены в течение следующих дней. Химиотерапию и / или лучевую терапию проводили через 3-4 недели после неосложненных хирургических резекций.
Боль сразу оценивали по возвращении в комнату восстановления и через 6, 12 и 24 ч после операции с использованием визуальной аналоговой шкалы (VAS; 0 = отсутствие боли до 10 = наиболее сильная боль). Анальгезия назначалась как внутривенный кеторолак натрия (30 мг каждые 8 часов), а внутривенная инфузия трамадола (50 мг) использовалась в качестве резервного анальгетика. Заболеваемость PONV регистрировалась немедленно по возвращении в комнату восстановления и через 6, 12 и 24 ч после операции с использованием трехточечной ординальной шкалы (0 = нет, 1 = тошнота, 2 = рвота, 3 = рвота). Тошнота определялась как субъективно неприятное ощущение, связанное с осознанием стремления к рвоте, рвота определялась как тяжелое, судорожное, ритмическое сокращение респираторных мышц без вытеснения содержимого желудка, а рвота определялась как силовое изгнание содержимого желудка из рта. Внутривенный ondasetron (4-8 мг) был дан для противорвотного лечения по запросу.
Послеоперационные осложнения регистрировались во время госпитализации, после чего пациенты получали до 30 дней после выписки. Дополнительные собранные данные включали возраст пациента, индекс массы тела (ИМТ), любую историю курения и неоадъювантную химиотерапию, анестезию и время операции, а также частоту использования обезболивающих и противорвотных препаратов. Эти параметры были суммированы и сопоставлены между группами дексаметазона и плацебо. Конечными точками исследования были послеоперационная тошнота и рвота, а также боль, измеряемая ВАС, и потребность в дополнительных анальгетических и противорвотных средствах.
Тошнота и рвота, обусловленная химиотерапией, относится к числу наиболее тяжело переносимых осложнений для больного. К высокоэметогенным режимам относятся комбинации на основе цисплатина и доксорубицина (АС или FAC), которые широко используются при проведении адъювантной терапии у больных раком молочной железы. Для профилактики острой тошноты и рвоты (в первые 24 часа после введения препаратов) рекомендуется использовать комбинацию антагонистов рецепторов серотонина (например, ондансетрон) и нейрокинина-1 (апрепитант) совместно с дексаметазоном. Эта тройная комбинация успешно справляется с острой тошнотой и рвотой у большинства больных. Проблемой остается отсроченная тошнота и рвота, возникающая на вторые сутки и далее после введения препаратов.
Исторически для купирования отсроченной тошноты и рвоты использовали дексаметазон. В 2006 году Международная организация по сопроводительной терапии при злокачественных опухолях (MASCC) рекомендовала назначение дексаметазона или апрепитанта для купирования отсроченной тошноты и рвоты. Включение апрепитанта было обосновано его способностью уменьшать частоту развития отсроченной тошноты и рвоты по сравнению с ондансетроном при профилактике острой рвоты у больных, получавших цисплатин-содержащие режимы. С учетом того, что ондансетрон оказывает минимальное влияние на профилактику отсроченной тошноты и рвоты, реальная эффективность апрепитанта не была установлена.
Это послужило основанием для проведения исследования для оценки способности апрепитанта в сравнении с дексаметазоном предотвращать развитие отсроченной тошноты и рвоты у больных раком молочной железы, которые получали комбинацию доксорубицина и циклофосфамида (60/600 мг/м 2 ). Все больные получали одинаковую профилактику острой тошноты и рвоты, которая подразумевала назначение апрепитанта в дозе 125 мг внутрь за час до введения химиотерапии, палоносетрона 0,25 мг в/в струйно и дексаметазон 8 мг в/в капельно за 30 минут до введения. В дальнейшем пациенты были рандомизированы в две группы, одна из которых получала дексаметазон 4 мг внутрь 3 раза в день 2-3 дни, а другая апрепитант 80 мг внутрь на 2 и 3 дни. Лечение было двойным слепым. Основным критерием эффективности была частота отсутствия тошноты и рвоты на 2-5 дни после проведения терапии.
В исследование была включена 551 больная, из которых 273 получали дексаметазон, а 278 – апрепитант. Частота полного контроля острой тошноты и рвоты составила 87,6% и 84,9% в группе дексаметазона и апрепитанта соответственно. Частота отсутствия тошноты и рвоты в период 2-5 дней лечения составила 79,5% для обеих групп. Одновременно отмечена тенденция возникновения более выраженной тошноты и рвоты большей продолжительностью с большим числом эпизодов рвоты в группе апрепитанта по сравнению с дексаметазоном. В группе дексаметазона достоверно чаще отмечали развитие бессонницы и сердцебиений, а в группе апрепитанта – потерю аппетита и сонливость. Качество жизни в обеих группах существенно не отличалось.
Результаты исследования убедительно демонстрируют равную эффективность дексаметазона и апрепитанта для профилактики отсроченной тошноты и рвоты у больных, получивших комбинацию доксорубицина и циклофосфамида. Важным итогом данного исследования является изменение рекомендаций MASCC по профилактике отсроченной тошноты и рвоты. Вместо прежней рекомендации использовать дексаметазон либо апрепитант следует использовать дексаметазон. Несмотря на равную частоту полного контроля тошноты и рвоты в обеих группах, в группе дексаметазона отмечено меньшее число эпизодов рвоты с меньшей продолжительностью. Другим преимуществом дексаметазона является цена, которая примерно в 10 раз ниже, чем у апрепитанта. Остается неизвестным, способна ли комбинация дексаметазона и апрепитанта улучшить частоту контроля отсроченной тошноты и рвоты по сравнению с только дексаметазоном.
Ключевые слова: тошнота и рвота, дексаметазон, апрепитант, рак молочной железы.
- Roila F, Ruggeri B, Ballatori E, Del Favero A, Tonato M. Aprepitant versus dexamethasone for preventing chemotherapy-induced delayed emesis in patients with breast cancer: a randomized double-blind study.
J. Clin. Oncol. 2013, vol.32: 101-104.

Гормонотерапия при раке молочной железы сегодня проводится теми же препаратами, что и 20 лет назад, не изменились и основополагающие принципы её назначения, существенное отличие современного подхода в более точном подборе лекарственного средства с ориентировкой на биологические характеристики опухоли и индивидуальные эндокринные показатели пациентки.
- Что такое гормонотерапия?
- Показания для назначения
- Особенности гормонотерапии при раке молочной железы
- Виды гормональной терапии
- Препараты
- Побочные действия
- Диета при гормонотерапии
- Эффективность
- Прогноз при применении гормонотерапии
Что такое гормонотерапия?
Конечная цель гормонотерапии — не допустить поступления половых гормонов в раковую клетку молочной железы, чем нарушается синтез необходимых для её жизни веществ и вынужденно включается программа клеточной гибели — апоптоз.
В качестве гормональных (эндокринных) лекарственных средств при раке молочной железы используют:
- натуральные гормоны и их синтетические аналоги — эстрогены, андрогены и прогестины;
- блокирующие связывание естественного гормона с рецептором опухолевой клетки антигормоны — антиэстрогены;
- нарушающие локальный синтез гормонов в жировой ткани ингибиторы ароматазы;
- гонадотропин-релизинг-гормон — химическое вещество, подменяющее естественный гормон гипоталамуса, который блокирует синтез яичниками собственных половых гормонов.
Аналогично гонадотропин-релизинг-гормону действуют хирургическое удаление придатков или облучение яичников, без них невозможно лечение менструирующих женщин ингибиторами ароматазы.
Показания для назначения
Рак молочной железы возникает на фоне гормонального дисбаланса, но не все опухоли чувствительны к гормональному воздействию, некоторые популяции клеток не используют половые гормоны для своей жизнедеятельности — они гормонально независимы. Как правило, независимой считается опухоль, в которой не больше 1% клеток нуждается в эстрогенах.
Наиболее благоприятно для назначения гормонотерапии при раке молочной железы сочетание максимально высокого уровня ЭР+ с ПР+. Формально гормонотерапия показана всем пациенткам, в опухоли молочной железы которых имеется более 1% клеток ЭР+ без учёта концентрации ПР+.
Особенности гормонотерапии при раке молочной железы
Гормональная зависимость рака молочной железы обещает чувствительность к гормонотерапии, но не гарантирует её.
Во-первых, не все ЭР способны взаимодействовать с лекарственным препаратом, нацеленным на него антиэстрогеном. Результат лечения прогнозирую по объёму популяции чувствительных клеток, считается, что чем больше в раке ЭР+, тем эффективнее будет эндокринная терапия.
Во-вторых, некоторые опухоли формируют устойчивость к лекарству, ускоренно разрушая его в своей цитоплазме или выводя из клетки в межклеточную жидкость. Формирование устойчивости легло в основу поэтапной гормонотерапии, когда при утрате опухолью чувствительности к одному препарату переходят на другую группу лекарственных средств. Особенность рака молочной железы — возможность перехода с одной линии гормонотерапии на другую при снижении клинической эффективности воздействия.
В-третьих, ради собственного выживания на фоне гормонотерапии опухоль постепенно становится нечувствительной к препарату, происходит естественный отбор — реагирующие на гормональные лекарства клетки погибают, выживают и дают потомство нечувствительные. Отчасти на этой особенности рака молочной железы базируется отказ от одновременного использования химиотерапии и гормонотерапии — только последовательно.
И третья особенность — при подборе лекарственного препарата обязательно учитывается гормональный период, в котором пребывает женщина, при недавнем прекращении менструации определяется концентрация производимых гипофизом лютеинезирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов, стимулирующих работу яичников.
Виды гормональной терапии
В зависимости от цели гормонотерапию подразделяют на неоадъювантную, адъювантную и лечебную.
Неоадъювантная ГТ проводится до радикальной операции для уменьшения объема опухолевого узла и уничтожения микрометастазов, попутно выясняется клиническая чувствительность опухоли к конкретному лекарственному препарату и перспективность профилактической антигормональной терапии после операции. Этот вид ГТ назначается при люминальном молекулярно-биологическом подтипе рака молочной железы с ЭР+ и ПР+. Эффект при гормонотерапии отсроченный, в отличии от химиотерапии, поэтому неоадъювантное лечение проводится не менее 4 месяцев, при хорошем результате — 8 месяцев и дольше, соответственно, на такой же срок откладывается операция на молочной железе. Поскольку наименее токсичными считаются ингибиторы ароматазы, их и используют, но они разрешены только для переживших менопаузу женщин.

Адъювантная гормонотерапия назначается для профилактики рецидива и метастазирования, она проводится всем больным с ЭР+, в том числе при карциноме in situ, только цель при 0 стадии иная — предотвращение развития рака в другой молочной железе. Продолжительность терапии — до прогрессирования или 5-10 лет в зависимости от исходного прогноза, а начинают ГТ строго после завершения адъювантной химиотерапии. Выбор препарата зависит от менструального статуса женщины.
Лечебная ГТ применяется при неоперабельном раке молочной железы или метастазах после радикального лечения. Длительность эндокринного воздействия зависит от эффективности, при прогрессировании переходят на следующий по очереди лекарственный препарат, выбор которого определяется по гормональному статусу женщины.
Препараты
Гормональная терапия рака молочной железы проводится антиэстрогенами и ингибиторами ароматазы, применение эстрогенов, прогестинов и андрогенов ограничено высокой частотой осложнений. Каждый препарат в лечебных целях принимают до прогрессирования заболевания, в профилактически — до появления метастазов или не менее 5 лет.
Антиэстрогены представлены двумя препаратами:
- ежедневно принимаемые при всех видах ГТ и в любом гормональном периоде таблетки тамоксифена;
- фулвестрант (Фазлодекс™) используется при распространенном раке молочной железы, ранее прогрессировавшем на тамоксифене, и только после менопаузы, он вводится в мышцу раз в месяц, главный недостаток — стоимость инъекции около 500$.
Ингибиторы ароматазы в таблетках для ежедневного приема применяются при любом виде ГТ у женщин после менопаузы, все лекарства одинаково эффективны:
- анастрозол (Аримидекс™);
- летрозол (Фемара™);
- эксеместан (Аромазин™).
Никогда одновременно не используются лекарственные средства разных групп — только по-отдельности. Некоторые схемы адъювантной ГТ предполагают смену лекарства через определенный срок, например, молодая женщина 5 лет пьет тамоксифен, при прекращении менструальной функции ещё 2 года получает ингибиторы ароматазы. При лечении неоперабельного рака или метастазов смена группы происходит при возобновлении опухолевого роста или появлении выраженных побочных осложнений.
Для временного выключения функции яичников у менструирующих женщин применяются аналоги гонадотропин-рилизинг-гормона (ГРГ), при раке молочной железы Стандарты рекомендуют каждые 28 дней инъекцию одного из одинаково эффективных средств:
- гозерелин (Золадекс™);
- трипторелин (Диферелин™);
- бусерелин (Бусерелин-депо™);
- лейпрорелин (Люкрин-депо™)
Группа ГРГ вспомогательная, используется вместе с ингибиторами ароматазы или антиэстрогенами. Прием таблеток начинают после полутора-двух месяцев инъекций антагонистов гонадотропинов. ГРГ конкуренты удаления или облучения яичников, после прекращения инъекций менструация у молодых женщин восстанавливается в ближайшие 3 месяца.
Побочные действия
Антиэстрогены и ингибиторы ароматазы обладают схожими побочными реакциями, самые опасные из которых: образование тромбов и дисгормональный остеопороз. Тамоксифен активнее влияет на свертываемость крови, и при многолетнем использовании у небольшого процента женщин индуцирует рак эндометрия. Ингибиторы ароматазы чаще осложняются остеопорозом. Одинаково часто обе группы вызывают приливы.
Все гормональные препараты подвергаются трансформации в печени. Тамоксифен может вызвать токсическое поражение печени и привести к застою желчи — холестазу, клиника которого отчасти напоминает острый холецистит, все симптомы исчезают после отмены антиэстрогена.
В настоящее время нет однозначного мнения по выбору лекарственного средства — эффективность их одинаковая, поэтому ориентируются на гормональный возраст и сопутствующую патологию, к примеру, при варикозной болезни или патологии эндометрия целесообразно избегать тамоксифена, при остеопорозе — ингибиторов.
В подавляющем большинстве случаев ГТ хорошо переносится, что позволяет при неблагоприятных прогностических факторах пролонгировать её до 7-10 лет.
На фоне приёма тамоксифена:
Использование препарата группы ГРГ часто сопровождается посткастрационным синдромом с приливами, частыми кольпитами, недержанием мочи, болями в мочевом пузыре и т.д. У женщин в пременопаузе при совместном применении ГРГ с ингибитором ароматазы возможно повышение уровня эстрадиола, что исключает эффект от лечения.
Диета при гормонотерапии
Многие женщины считают, что на фоне гормональных препаратов растет вес тела, клинические исследования на счет ГТ относят всего лишь 1,6% — 4% случаев повышения веса. Избыток веса обусловливается не фармакологическим действием, а изменением ритма жизни после выявления рака молочной железы, нормализацией питания после завершения химиотерапии и снижением уровня стресса после проведения радикальной терапии. На профилактической ГТ женщина успокаивается и бережет себя, избегая физических нагрузок, и вес растет даже без лекарств.
Гормонотерапия не нуждается в особой диете, необходима коррекция питания с учетом ежедневных нагрузок и сопутствующих болезней.
Эффективность
Результат терапии зависит от чувствительности опухолевых клеток к лекарствам, поэтому в обязательном порядке до начала лечения определяется молекулярно-биологический подтип рака молочной железы.
Эффект адъювантной терапии оценивается по времени появления метастазов — на фоне ГТ или в течение года после её завершения. В отсутствии клинически определяемой опухоли косвенно об эффективности свидетельствует уровень эстрадиола в крови.
Результат гормонального воздействия более медленный, нежели химиотерапии, поэтому оценка эффективности при распространенном раке молочной железы проводится каждые 3-4 месяца приема. Общий эффект ГТ — от 15% до 36%, и тем выше, чем больше концентрация ЭР и ПР.
Прогноз при применении гормонотерапии
Распространенность рака молочной железы на момент выявления косвенно свидетельствует об агрессивности и гормональной независимости опухоли. ГТ мало полезна при метастатической стадии, сопровождающейся висцеральным кризом — при множественных злокачественных новообразованиях внутренних органов с нарушением их функции.
При распространенном процессе с высоким уровнем ЭР и ПР на фоне ГТ регрессируют множественные метастазы, особенно в костях, коже и лимфоузлах, даря женщине годы качественной жизни. Эндокринное воздействие бесполезно при прогрессировании рака молочной железы на фоне трех линий ГТ.
Лечение рака должно быть своевременным и адекватным, в нашей Клинике проводится геномный анализ опухоли на чувствительность к лекарствам, что повышает непосредственные результаты терапии и сказывается на продолжительности жизни больных.
Читайте также:

