D amico рак простаты
- Функция и значение системы классификации D'amico
- Как работает система
- Что говорят исследования о системе
The Great Gildersleeve: Bronco's Aunt Victoria / New Secretary / Gildy the Pianist (Июль 2020).
Система классификации D'amico является одним из наиболее широко используемых подходов для оценки риска рака простаты. Первоначально разработанная в 1998 году медицинским исследователем по имени D'amico, эта система классификации предназначена для оценки риска рецидива после локализованного лечения рака предстательной железы. Он разделяет пациентов на три группы рецидивов, основанных на риске: низкий, средний и высокий, используя такие показатели, как уровень ПСА в крови, оценки Глисона и стадии опухоли с помощью T-показателей.
Функция и значение системы классификации D'amico
Система классификации группы риска D’amico была разработана для оценки вероятности рецидива для любого пациента, использующего данный набор параметров, и широко используется в качестве одного из многих индивидуальных инструментов оценки риска. Этот анализ может помочь тем, кто борется с раком простаты, принять более обоснованное решение относительно их лечения.
Определив, что ваш рак предстательной железы входит в одну из этих трех групп, эта система потенциально может помочь вам и вашему врачу принимать более обоснованные решения о лечении. При принятии решения относительно лечения рака предстательной железы необходимо учитывать множество факторов, в том числе долгосрочное качество жизни и другие факторы риска или хронические заболевания, которые могут у вас возникнуть. Все виды лечения рака простаты несут определенный уровень риска осложнений или побочных эффектов.Насколько серьезными могут быть эти осложнения, зависит от человека к человеку, но об этом важно помнить при выборе плана лечения.
Как работает система
Во-первых, важно собрать свои цифры:
- PSA: Вам понадобятся результаты вашего теста PSA, анализа крови, который выявляет простат-специфический антиген - белок, продуцируемый клетками вашей простаты.
- Оценка Глисона: Результаты вашей оценки Глисона, основанные на микроскопическом виде ваших раковых клеток.
- Клиническая стадия Т балл: И ваша стадия T, размер вашей опухоли, как видно на УЗИ или во время ректального исследования.
Используя эти цифры, ваш риск классифицируется как:
- Низкий риск: Те, у кого PSA меньше или равно 10, балл по Глисону меньше или равен 6, или находятся на клинической стадии T1-2a
- Промежуточный риск: Мужчины с ПСА от 10 до 20, баллом по Глисону 7 или находятся в клинической стадии T2b
- Высокий риск: Те, у кого PSA больше 20, балл по Глисону равен или больше 8, или находятся на клинической стадии T2c-3a.
Что говорят исследования о системе
В двух исследованиях, которые включали более 14 000 случаев рака простаты, была рассмотрена способность прогнозировать специфическую для рака и общую выживаемость, а также клиническую значимость такой системы классификации на основе риска в современной медицине.
В исследованиях оценивались показатели выживаемости после операции по методу Каплана-Мейера. Этот анализ рассчитывает биохимическую безрецидивную выживаемость (BRFS), то есть выживаемость от рака простаты без достаточно высокого уровня PSA, чтобы назвать его рецидивом рака, у пациентов с различными стадиями рака. Затем эти прогнозируемые показатели выживаемости сравнивались с фактическими случаями, чтобы выяснить, помогло ли использование системы классификации на основе риска D’amico пациенту принять более обоснованное решение о лечении и, следовательно, повысить шансы на выживание.
Исследования показали, что у мужчин, у которых была более прогностическая информация (например, система классификации на основе риска Д'Амико), общий уровень выживаемости после лечения рака предстательной железы был выше, особенно у мужчин с высоким риском рецидива.
Однако система не может точно оценить риск рецидива у пациентов с множественными факторами риска. Поскольку число случаев рака предстательной железы с множественными факторами риска возрастает, система классификации D’amico может быть не так актуальна для мужчин с раком предстательной железы и их врачей, как другие методы оценки.
Антиандрогенная терапия создаёт хорошие условия для развития устойчивых к ней клеток, которые в итоге занимают большую часть опухоли. Очевидно, в развитии устойчивости ключевую роль играет нарушение передачи сигнала через андрогеновые рецепторы. Возможны мутации апдрогеновых рецепторов, влияющие на экспрессию кодирующих их генов и чувствительность рецепторов к лигандам. Впрочем такие мутации находят лишь в части опухолевых клеток, и едва ли с ними можно связать все случаи устойчивости к гормонот.
Риск рецидива (местного или системного) в течение 10 лет после простатэктомии или лучевой терапии составляет 27—53%. В течение 5 лет после первоначального лечения от 16 до 35% больных получают противорецидивное лечение. Ранее под рецидивом понимали опухоль, пальпируемую через прямую кишку, а также отдалённые метастазы.
Для онкологического больного существенное значение имеет динамический контроль. В понятие динамического наблюдения входит не только контроль онкологических показателей (уровень простатоспецифичного антигена - ПСА, трансректальное ультразвуковое исследование - ТРУЗИ, пальцевое исследование, инструментальное обследование), но и коррекция изменений качества жизни, возникших вследствие проведения лечебных мероприятий (например, протезирование полового члена при эректильной дисфункции или.
Данных сравнительных исследований эффективности лучевой терапии (дистанционной или контактной) и простатэктомии при локализованном раке предстательной железы (РПЖ) до настоящего времени не получено. Считают, что отдалённые результаты лучевой терапии такие же, как при оперативном лечении, и качество жизни при этом не страдает. С 1990 г. возможности лучевой терапии расширены благодаря внедрению методики контактного облучения и объёмного планирования. В последние годы в специализиро.
Клинически различают локализованный (T1-2,N0M0), местнораспространённый (T3-4N0-1M0) и генерализованный рак (T1-4N0-1M1). Больных с клинически локализованными и местнораспространенными стадиями распределяют по степени риска (Д'Амико А.В. и др., 2003).
Основные методы диагностики рака предстательной железы (РПЖ) — пальцевое ректальное исследование, трансректальное УЗИ и определение уровня простатоспецифичного антигена (ПСА). Диагноз подтверждают морфологически (при биопсии, пункции, гистологическом исследовании операционного материала).
Основные цели лечения заболевания: улучшение качества жизни больных, страдающих расстройствами мочеиспускания, обусловленных ДГПЖ; предотвращение прогрессирования ДГПЖ. На современном этапе необходимость в продлении или спасении жизни больных возникает только при осложнённых формах заболевания.
Рак предстательной железы (РПЖ) — уникальная опухоль, при которой биологическая агрессивность опухолевых клеток часто не зависит от степени дифференцировки. Обычно низко- и умереннодифференцированные опухоли созревают медленно, а высокодифференцированные склонны к быстрому метастазированию, однако в большинстве случаев наблюдают прямую зависимость развития РПЖ от градации по Глисону.
Рак предстательной железы — одно из наиболее частых и тяжёлых заболеваний у мужчин в развитых странах мира, особенно в Европе и США, основная причина заболеваемости и смертности. Особенность течения рака предстательной железы (РПЖ) в отличие от других солидных опухолей заключается в длительном латентном течении заболевания.
Общепринятое клиническое определение доброкачественной гиперплазии предстательной железы (ДГПЖ) отсутствует, однако известно, что она возникает у мужчин старше 40 лет и характеризуется наличием симптомов нижних мочевых путей (СНМП), увеличением предстательной железы или её части в размерах и нарушением оттока мочи из мочевого пузыря (инфравезикальная обструкция).
Цели лечения при доброкачественной гиперплазии предстательной железы: улучшение качества жизни больных, страдающих от расстройств мочеиспускания, обусловленных доброкачественной гиперплазией предстательной железы; предотвращение прогрессирования доброкачественной гиперплазии предстательной железы; продление или спасение жизни больных — на современном этапе развития медицины такую цель преследуют редко, только при осложненных формах заболевания.
В статье представлены международные классификации рака предстательной железы, которыми пользуются урологи и онкологи во всем мире. Это международная система TNM, шкала Глисона и система Джюит-Уайтмора, а также прогностические факторы риска по DAmico и таблицам Партина.
Классификация рака предстательной железы по системе TNM
Классификация стадий развития рака была разработана P. Denoix (Франция) в период с 1943 по 1952 года, дальше она претерпела ряд изменений, и в 2002 году было принято международное решение о прекращении внесения изменений, пока не произойдут радикальные перемены в диагностике и лечении злокачественных опухолей. Последняя классификация системе TNM была поддержана всеми национальными комитетами TNM, ей пользуются во всем мире, так как это помогает при исследованиях и интерпретации полученных результатов, а также в выработке алгоритмов лечения. Система TNM используют в постановке диагноза и определение стадии рака простаты.
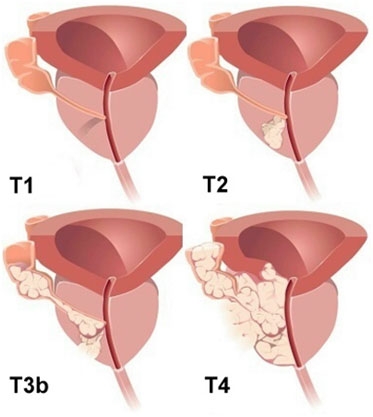
ТХ - недостаточно данных для оценки первичной опухоли.
Т0 - первичная опухоль не определяется.
Т1 - опухоль клинически не проявляется, не пальпируется и не визуализируется специальными методами.
• Т1а - опухоль случайно обнаруживается при гистологическом исследовании и составляет менее 5% резецированной ткани.
• Т1b - опухоль случайно обнаруживается при гистологическом исследовании и составляет более 5% резецированной ткани.
• Т1с - опухоль диагностируется с помощью игольной биопсии простаты (производимой в связи с высоким уровнем ПСА).
Т2 - опухоль ограничена предстательной железой или распространяется в капсулу.
• Т2а - опухоль поражает половину одной доли или меньше.
• Т2b - опухоль поражает более половины одной доли, но не обе доли.
• T2c - опухоль поражает обе доли.
Т3 - опухоль распространяется за пределы капсулы предстательной железы.
• Т3а - опухоль распространяется за пределы капсулы (одно- или двустороннее).
• Т3b - опухоль распространяется на семенной пузырек.
Т4 - несмещаемая опухоль или опухоль, распространяющаяся на соседние ткани и органы, но не на семенные пузырьки: шейку мочевого пузыря, наружный сфинктер, прямую кишку, мышцу, поднимающую задний проход, и/или тазовую стенку.
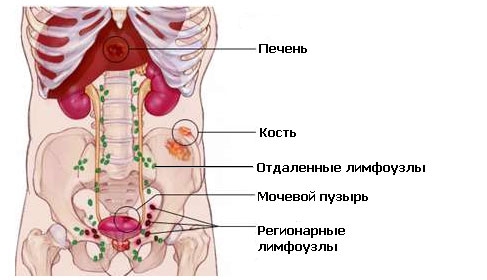
По отношению к предстательной железе регионарными лимфатическими узлами являются узлы малого таза, которые находятся ниже бифуркации общих подвздошных артерий. Категория N не имеет зависимость от стороны локализации регионарных метастазов.
NX - недостаточно данных для оценки регионарных лимфатических узлов.
N0 - метастазы в регионарных лимфатических узлах отсутствуют.
N1 - имеются метастазы в регионарных лимфатических узлах.
МX - определить наличие отдаленных метастазов не представляется возможным.
М0 - признаки отдаленных метастазов отсутствуют.
М1 - есть отдаленные метастазы.
• M1a - поражение нерегионарных лимфоузлов.
• M1b - присутствует поражение костей.
• M1c - присутствуют другие локализации отдаленных метастазов (лёгких, печени и т.д.).
Классификация рака простаты по шкале Глисона (Gleason score)
Шкала Глисона рассчитывает степень злокачественности опухоли, которую обнаружили при биопсии предстательной железы. Чем больше баллов получается по шкале Глисона, тем более агрессивной является опухоль. При оценки опухоли по шкале Глисона в расчет берется отличие раковых клеток, которые были получены в ходе биопсии простаты, от нормальных клеток предстательной железы. Если раковые клетки не отличаются от обычных клеток, то по шкале Глисона опухоль получает 1 балл. В противном случае, при полном различие, опухоли засчитывается максимальное количество баллов - 5.

Сумма Глисона заключается в суммировании баллов по шкале Глисона (от 1 до 5 баллов) по 2 самым большим или злокачественным опухолям, которые обнаружили в тканях предстательной железы.
• low-grade Gleason score (менее злокачественные опухоли) при сумме Глисона ≤ 6 баллам.
• intermediate Gleason score (средне-злокачественные опухоли) при сумме Глисона равной 7 баллов.
• high-grade Gleason score (сильно-злокачественные опухоли) при сумме Глисона от 8 до максимальных 10 баллов.
Для примера возьмем сумму Глисона, которая равна 5 баллам, это будет означать, что 2 самые большие или злокачественные опухоли имеют по 2 и 3 балла. То есть это менее злокачественные опухоли.
Классификация рака простаты по системе Джюит-Уайтмор
По системе Джюит-Уайтмор классификация рака предстательной железы делится на стадии А, В, С и D. Стадии А и В считаются излечимыми, а стадии С и D также лечатся, но прогноз их более неблагоприятный.
Это самая ранняя стадия. Нет никаких симптом. Раковые клетки расположены в простате.
А1 - раковые клетки хорошо дифференцируются, отмечается их умеренная аномалия.
А2 - умеренно или плохо дифференцируемые раковые клетки в нескольких местах простаты.
Опухоль не выходит за пределы простаты. Прощупывается при пальпации и/или определяется повышенный уровень ПСА.
В0 - опухоль в пределах простаты, непальпируется; уровень ПСА повышен.
В1 - одиночный опухолевый узел в одной доле простаты.
В2 - экстенсивный рост опухоли в одной или обеих долях простаты.
Опухоль выходит за пределы капсулы простаты и распространяется на соседние ткани и органы, в том числе и на семенные пузырьки.
С1 - опухоль прорастает за пределы капсулы простаты.
С2 - опухоль перекрывает просвет уретры или мочевого пузыря.
Опухоль дает метастазы в регионарные лимфоузлы или в отдаленные органы и ткани (легкие, печень, кости, желудок и т. д.).
D0 - метастазы, обнаруживаемые клинически, при этом повышается уровень ПСА.
D1 - поражаются регионарные лимфоузлы.
D2 - поражаются отдаленные лимфоузлы, органы и ткани.
D3 - метастазы после лечения.
Классификация прогностических факторов риска по DAmico
По этой классификации смотрится вероятность прогрессирования рака на начальных стадиях до клинических симптомов и/или летального исхода, а также риск возникновения рецидивов после локального лечения рака. По классификации рака предстательной железы Дамико пациентов определяют к одной из групп прогрессирования болезни: низкой, средней или высокой. Для оценки берутся следующие показатели:
- классификация рака по системе ТNM, а именно показатель Т - распространенность первичной опухоли;
- степень рака простаты по шкале Глисона,
- уровень простат-специфического антигена в крови (ПСА).
К группе низкого риска относят пациентов, у которых:
Уровень ПСА ≤ 10 нг/мл,
шкала Глисона ≤ 6 баллов,
клиническая стадия T1-2a.
К группе среднего риска относят пациентов, у которых:
Уровень ПСА 10-20 нг/мл,
Шкала Глисона – 7 баллов,
Клиническая стадия T2b.
К группе высокого риска относят пациентов, у которых:
Уровень ПСА > 20 нг/мл,
Шкала Глисона ≥ 8 баллов,
Клиническая стадия T2c-3a.
Таблицы Алана Партина или номограммы
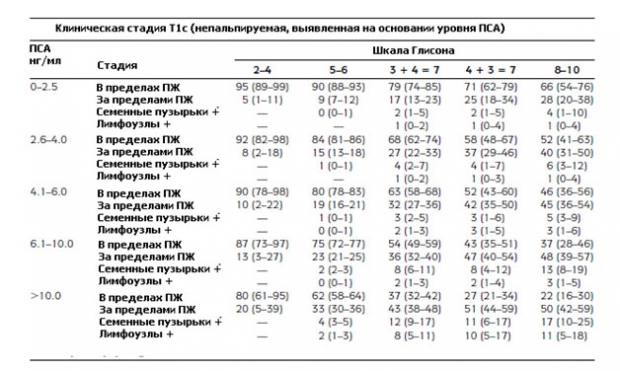
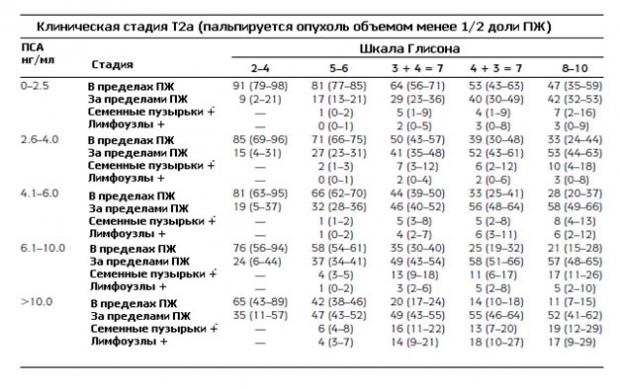
График Партина представляет собой шкалы, которые учитывают математические модели высчитанные на основании значения уровня ПСА, баллов по шкале Глисона и клинической стадии рака простаты по классификации по системе ТNM, а именно показатель Т - распространенность первичной опухоли. График Партина позволяет прогнозировать дальнейшую прогрессию заболевания. Номограммы были составлены на основании исследования данных о мужчинах, которые проходили лечение рака предстательной железы. На основании этих данных были составлены таблицы, которые делятся:
- Степень рака простаты от Т1с до Т2с.
- По уровню ПСА в крови выделяют следующие категории от 0 до 10 нг/мл, и более 10,0 нг/мл.
- Баллы шкалы Глисона делятся на 3 категории от 2 до 4, от 5 до 6, или от 8 до 10.
Вот так выглядят модифицированные номограммы Партина, по которым можно определить вероятность дальнейшего прогрессирования рака простаты.
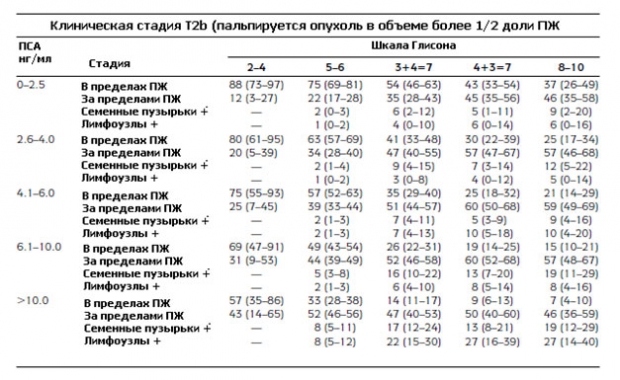
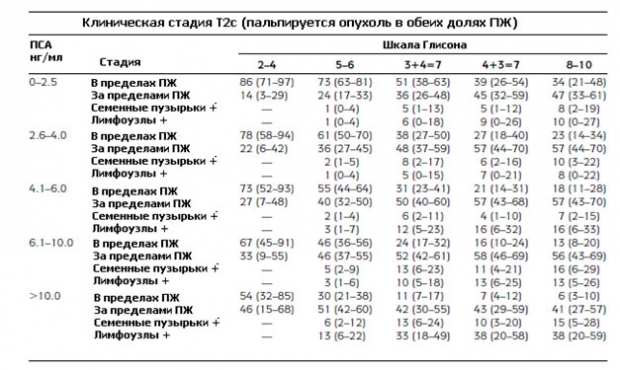
Давайте рассмотрим подробно, как пользоваться таблицами Партина. Например у пациента уровень ПСА 3,1 нг/мл, сумма по шкале Глисона 3+4=7, клиническая стадия Т2a (опухоль пальпируется и поражает меньше половины одной доли). Во второй таблице в значение ПСА ищем диапазон от 2,6-4,0 нг/мл, баллы по шкале Глисона 3+4=7. Смотрим пересечение и на 4-х строках смотрим процент прогрессирования: вероятность развития опухоли, ограниченной пределами предстательной железы составляет 50% (от 43 до 57%), рост за пределы простаты 41% (от 35 до 48%), поражение семенных пузырьков 7% (от 3 до 12%), распространение на лимфоузлы 2% (от 0 до 4%).
Для облегчения получения данных по таблицам Партина существуют компьютерные программы, где надо только ввести исходные данные.
Кроме таблиц Партина существуют номограммы Каттана, которые позволяют прогнозировать результаты лечения рака предстательной железы и делать прогноз по продолжительности жизни.
Выводы
Использование классификации для обозначения стадий рака простаты помогает онкологам определиться с тактикой лечения (сочетание методик или монотерапия: гормональная терапия рака предстательной железы, химиотерапия, лучевая терапия, хирургическая операция), сделать прогноз по прогрессированию заболевания и продолжительности жизни пациента. Кроме этого единая классификация помогает обработать выводы из разных исследований, что в свою очередь ведет к накоплению опыта и усовершенствованию существующих методов лечения и диагностики рака предстательной железы.
Рак предстательной железы — самая частая опухоль мужской мочеполовой системы. Среди всех злокачественных новообразований она находится на 2-м месте после рака легкого [1] . Коварство болезни в ее бессимптомном течении — тревожные проявления появляются только на поздних стадиях. По данным российских врачей, 22% пациентов обращаются к специалисту на 4-й стадии [2] , при которой радикальное лечение невозможно.
Признаки рака простаты и факторы, его провоцирующие
Поскольку заболевание обычно начинается с периферических отделов предстательной железы, опухоль развивается безболезненно и очень долго никак не проявляет себя. Единственный способ обнаружить ее на ранних стадиях — пройти исследование на уровень простатспецифического антигена. Это фермент, который синтезирует клетки предстательной железы, и его уровень может повышаться не только при карциноме, но и при доброкачественной гиперплазии предстательной железы (ДГПЖ) и хроническом воспалении (простатите). Тем не менее именно этот метод скрининга рекомендует американская онкологическая ассоциация (American Cancer Society), оговаривая, что низкий уровень простатспецифического антигена не гарантирует отсутствия злокачественных изменений.
Симптомы болезни можно разделить на 3 большие группы:
- Признаки затрудненного оттока мочи (инфравезикальной обструкции). Эти симптомы сходны с проявлениями аденомы предстательной железы:
- слабая прерывистая струя мочи;
- чувство неполного опорожнения мочевого пузыря;
- стрессовое недержание мочи;
- императивные (внезапные и непреодолимые) позывы к мочеиспусканию;
- учащенное мочеиспускание.
- Проявления, вызванные местным ростом опухоли:
- появление крови в сперме;
- появление крови в моче;
- эректильная дисфункция;
- боль в промежности и надлобковой области.
- Проявления отдаленных метастазов:
- боль в костях;
- если опухоль пережимает мочеточник — боль в пояснице;
- при сдавлении спинного мозга — парез нижних конечностей;
- отеки ног из-за лимфостаза;
- анемия;
- уремия;
- беспричинная потеря веса.
Скрининговые обследования, призванные быстро выявить возможность рака на ранней стадии, рекомендованы не всем подряд, а только мужчинам с уже имеющимися факторами риска, среди которых:
- Генетическая предрасположенность: до 10% всех случаев рака простаты составляют семейные формы [4] .
- Пищевые предпочтения: риск повышается у мужчин, в чьем рационе много животных жиров. Увеличивает вероятность болезни и ожирение.
- Гормональный дисбаланс: повышенный уровень тестостерона, дигидротестостерона и лютеинизирующего гормона.
- Прием ингибиторов 5-альфа-редуктазы. Это фермент, который трансформирует тестостерон в дигидротестостерон. Ингибиторы 5-альфа-редуктазы (финастерид, дутастерид) назначают при доброкачественной гиперплазии (аденоме) предстательной железы для уменьшения объема органа.
- Негроидная раса.
Раньше считалось, что риск карциномы простаты повышают также курение, алкоголь, хронический (особенно нелеченый) простатит и дефицит некоторых витаминов. Сейчас эти представления опровергнуты.
Пациентам с имеющимися факторами риска рекомендуется измерять уровень простатспецифического антигена крови раз в год после 50 лет (имеющим кровных родственников, умерших от рака простаты в молодом возрасте, — после 40 лет). Не имеющим факторов риска можно начинать обследоваться после 70 лет. Регулярное измерение уровня простатспецифического антигена снижает риск смерти от рака простаты на 25–31% [5] .
Диагностикой карциномы простаты занимается врач-уролог, который, если появится необходимость, направляет пациента к онкологу. Для диагностики рака простаты используются:
- Сбор анамнеза, или беседа с больным, позволяющая выявить факторы риска и характерные жалобы.
- Пальцевое ректальное исследование — прощупывание простаты через прямую кишку. Позволяет обнаружить опухоль диаметром от 2 мм [6] при условии, что она располагается на стороне, прилежащей к кишке.
- Определение уровня простатспецифического антигена. Уровень, при котором рекомендована биопсия простаты для мужчин младше 60 лет — 4 нг/мл, после 60 — 2,5 нг/мл.
- Трансректальное УЗИ (ТРУЗИ) позволяет не только обнаружить характерные изменения железы, но и прицельно взять биопсию измененного участка. Материал, полученный при биопсии, предназначен для гистологического исследования — единственного окончательного способа подтвердить или опровергнуть карциному простаты.
- УЗИ брюшной полости, КТ и МРТ позволяют выявить распространенность опухоли, наличие отдаленных метастазов.
Диагностика позволяет определить стадию опухоли и степень злокачественности.
Степень злокачественности по шкале ВОЗ характеризует агрессивность опухоли. Чем менее дифференцирована опухоль (чем сильнее ее клетки отличаются от нормы), тем активней она растет и раньше метастазирует. Всего выделяют 4 степени злокачественности:
- G1 — высокая степень дифференцированности клеток;
- G2 — умеренная;
- G3 — низкая;
- G4 — недифференцированная опухоль.
Стадия опухоли описывает объем новообразования, поражение лимфоузлов и наличие отдаленных метастазов. Для этого используют систему TNM, где:
- T — размер первоначального узла,
- N — вовлеченность лимфоузлов,
- M — наличие отдаленных метастазов.
Более привычные обывателю 4 стадии рака в описании карциномы простаты складываются из стадий по TNM и степени злокачественности опухоли. При этом 1-я стадия подразумевает клинически неопределяемую опухоль объемом не более 5% железы первой степени злокачественности при интактных (неповрежденных, невовлеченных) лимфоузлах. На 2-й стадии новообразование еще не выходит за пределы простаты, на 3-й — прорастает за пределы капсулы железы. Прорастание соседних органов и тканей, или поражение лимфоузлов, или появление отдаленных метастазов означает 4-ю стадию рака простаты, когда удалить новообразование одномоментно невозможно.
Клинические рекомендации по лечению рака предстательной железы предлагают следующие методы:
- хирургическое лечение;
- лучевая терапия;
- гормональная терапия;
- химиотерапия;
- минимально инвазивные методы: криоабляция и абляция ультразвуком — относятся к экспериментальным и пока не имеют длительного (свыше 10 лет) периода наблюдения.
Выбор методики или комбинации методов зависит от стадии опухоли и состояния больного.
Хирургическое лечение. Радикальная простатэктомия — то есть удаление предстательной железы, семенных пузырьков и части мочеиспускательного канала — метод выбора при локализованном раке предстательной железы (опухоль ограничена капсулой органа). Операция позволяет полностью удалить новообразование. Используется либо традиционный открытый доступ, либо менее травматичный — лапароскопический, в том числе один из его вариантов — робот-ассистированная радикальная простатэктомия, которая становится все популярней. Она позволяет уменьшить объем кровопотери, а в восстановительном периоде после робот-ассистированного вмешательства реже возникает недержание мочи и эректильная дисфункция.
Лучевая терапия. Применяется при местнораспространенном раке, когда опухоль вышла за пределы капсулы органа, но еще не имеет отдаленных метастазов. Она может быть дистанционной, когда источник излучения находится вне тела (метод выбора), и внутритканевой, когда радиоактивный источник имплантируется непосредственно в ткань железы. Иногда сочетают оба метода лучевой терапии.
Гормональная терапия, или андрогенная депривация. Чаще всего используется в составе комбинированной противоопухолевой терапии. Как самостоятельное лечение применяется только с паллиативными целями — для улучшения качества жизни. Поскольку тестостерон стимулирует рост опухоли, чтобы его замедлить, нужно уменьшить уровень этого гормона в клетках простаты. Достигнуть этой цели можно двумя путями: уменьшить синтез гормонов яичками либо блокировать их выработку на уровне регуляторных механизмов. Возможные методы гормонотерапии:
В качестве дополнительной терапии могут назначаться антиандрогены (вещества, блокирующие эффекты мужских гормонов) и эстрогены (женские половые гормоны).
Химиотерапию применяют только при метастатическом раке предстательной железы и только в составе комбинированной терапии (чаще всего в сочетании гормонотерапия плюс химиотерапия).
Клинические рекомендации и гайдлайны описывают подходы западной медицины. Но в странах Востока, где сильны собственные традиции, распространен интегративный подход, когда с одним больным работают несколько специалистов, использующих как подходы официальной медицины, так и традиционные методики. Соотношение традиционных и современных способов лечения меняется в разных странах: если в Китае основной упор приходится на восточные методики, то в Южной Корее ведущую роль играет западный подход, но в качестве вспомогательных методов используют:
- фитотерапию;
- ароматерапию;
- иглоукалывание.
Конечно, не все восточные, в том числе корейские, клиники одинаковы. Как и у нас в стране, многое зависит от квалификации и опыта персонала, уровня оснащения клиники. Поэтому прежде чем сделать окончательный выбор, нужно узнать о медицинском учреждении как можно больше.
Медицинский эксперт статьи

Клинически различают локализованный T1-2, N0, M0), местнораспространённый (Т3-4, N0-1, M0) и генерализованный рак (T1-4, N0-1, М1).
Больных с клинически локализованными и местнораспространёнными стадиями распределяют по степени риска (Д’Амико А В. и др., 2003):
- низкая: стадия Т1а-с; уровень ПСА менее 10 иг/мл: градация по Глисону - 2-5; при биопсии - одностороннее поражение менее 50%:
- умеренная: стадия Т2а; уровень ПСА менее 10 нг/мл; градация по Глисону - 3 + 4 = 7; при биопсии - двустороннее поражение менее 50%;
- высокая стадия Т2b , Т3а-b; уровень ПСА - 10-20 нг/мл; градация по Глисону - более 4 + 3 - 7; при биопсии - поражение более 50%, периневральная инвазия;
- очень высокая: стадия Т4; уровень ПСА более 20 нг/мл; градация по Глисону - более 8; при биопсии - лимфоваскулярная инвазия.
После уточнения диагноза и установления распространённости процесса (локализованный, местнораспространенный или генерализованный) врач и пациент стоят перед выбором метода лечения. В современном обществе огромное значение уделяют качеству жизни больных после начала лечения. Качество жизни без лечения соответствует течению основного заболевания и зависит от прогрессирования онкологического процесса. Изменение качества жизни возникает в основном после начала лечения и применения одного из терапевтических или хирургических методов. Чёткое установление стадии процесса позволяет не только выбрать оптимальный метод лечения, но и прогнозировать дальнейшее течение заболевания.
Определение уровня ПСА в сочетании с клинической картиной рака простаты и градацией опухоли по шкале Глисона значительно повышает информативность каждого из перечисленных показателей в установлении патологической стадии рака. А.В. Партин и соавт. (1997) предложили прогностические таблицы, позволяющие прогнозировать дальнейшее распространение опухоли, выбор метода лечения, степень радикальности и прогноз эффективности лечения
Для оценки распространённости опухоли наиболее часто используют ПРИ, ТРУЗИ, определение уровня ПСА и остеосцинтиграфию. При необходимости назначают компьютерную томографию (КТ) или магнитно-резонансную томографию (MPТ) и рентгенографию грудной клетки.
Любой из методов визуализации предназначен для определения стадии и оценки эффективности лечения После верификации диагноза уролог должен уточнить объём первичной опухоли, ее границы, инвазивный или метастатический потенциал опухоли. Все эти показатели имеют большое значение для прогноза заболевания и выбора метода лечения.

[1], [2], [3], [4], [5], [6], [7], [8], [9]
Первичная опухоль (Т)
Прежде всего, следует определить, ограничена опухоль предстательной железой (Т1-2) или выходит за пределы капсулы (Т3-4). Пальцевое исследование часто не позволяет оценить распространённость опухоли. По некоторым данным, результаты ПРИ соответствуют таковым при гистологическом исследовании менее чем у 50% больных. Тем не менее более подробное обследование показано лишь при решении вопроса о радикальном лечении.
Уровень ПСА может отражать распространённость опухоли, однако не позволяет точно определить морфологическую стадию. Сочетание уровня ПСА, индекса Глисона и данных пальпации позволяет лучше предсказать морфологическую стадию, чем каждый из этих параметров в отдельности. Значение свободного ПСА спорно: в одном из исследований определение содержания свободного ПСА помогало уточнить стадию при локализованных опухолях, однако другие работы этого не подтвердили. Разрешить этот вопрос помогут лишь углублённые исследования.
Для изучения состояния предстательной железы чаще всего применяют трансректальное УЗИ. Этот метод позволяет обнаружить лишь 60% опухолей и не всегда показывает прорастание капсулы. Почти у 60% больных со стадией Т3. УЗИ указывает на менее распространённый процесс. Ультразвуковые признаки прорастания капсулы - выпуклость, неровность и разрыв контура железы. Инвазия опухолевых клеток в семенные пузырьки - плохой прогностический признак, но информация о ней крайне важна для выбора метода лечения. При ТРУЗИ следует обращать внимание на эхоструктуру пузырьков (гиперэхогенность), их асимметрию, деформацию и расширение. Также о поражении семенных пузырьков свидетельствует утрата закругленности и уплотнение у основания железы. Эти признаки довольно субъективны, поэтому целиком полагаться на данные УЗИ нецелесообразно. Инвазия семенных пузырьков указывает на высокий риск местного рецидива и метастазов и для уточнения (перед операций) показана их биопсия. Начинать обследование с этой процедуры не следует, но если риск инвазии велик и от результата биопсии зависит выбор лечения, то её выполнение оправданно. Отрицательный результат не исключает микроскопической инвазии. Как правило, биопсию семенных пузырьков проводят при клинической стадии Т2b, и выше и содержании ПСА более 10 нг/мл. Результат считают положительным, если хотя бы один биоптат из основания предстательной железы содержит опухолевые клетки. Повысить точность клинического определения стадии позволяют не только дополнительные исследования, но и тщательный анализ результатов первичной биопсии (играют роль количество и протяжённость опухолевых очагов, инвазия капсулы). Имеет значение и степень дифференцировки: при индексе Глисона менее 6 опухоль в 70% случаев локализована.
Кровоток в предстательной железе при раке выше, чем в нормальной железе или при ее гиперплазии. После кастрации интенсивность кровотока в железе снижена. Перспективна разработка эходопплерографических карт для диагностики и мониторинга РПЖ, однако в настоящее время нет достоверных данных об использовании эходопплерографии в определении стадии местного процесса. Возможно применение этого метода для получения дополнительного материала при прицельной биопсии из очагов патологической васкуляризации.
Результаты визуализации рака простаты прямо зависят от технической оснащённости клиники и опыта специалиста. Именно поэтому все современные методы визуализации носят не определяющую, а уточняющую роль, и выбор метода лечения основан на совокупности данных клинического обследования и инструментальных исследований.
Наилучшими возможностями для визуализации структуры предстательной железы обладает МРТ. Современный стандарт обследования органов малого таза методом MPТ - применение эндоректального датчика, позволяющего получить изображение с максимально возможным пространственным разрешением, составляющим 0,5-1 мм. Нагнетание воздуха в эндоректальный датчик обеспечивает чёткую визуализацию капсулы предстательной железы, ректопростатических углов и ректопростатической фасции Денонвилье. Применение эндоректального датчика при MРТ не ограничивает визуализацию регионарных лимфатических узлов (вплоть до уровня бифуркации брюшной аорты). Раку предстательной железы свойственна низкая интенсивность сигнала на Т-взвешенных изображениях на фоне сигнала высокой интенсивности от неизмененной периферической зоны железы. Неправильная форма, диффузное распространение с масс-эффектом, нечёткие и неровные контуры - морфологические характеристики очагов низкой интенсивности сигнала в периферической зоне предстательной железы, позволяющие предположить неопластический характер поражения. При проведении динамического контрастирования очаги рака быстро накапливают контрастный препарат в артериальную фазу и быстро выводят препарат, что отражает степень ангиогенеза и, соответственно, степень злокачественности опухоли. Низкая интенсивность сигнала также свойственна очагам постбиопсийных кровоизлияний, простатита, стромальной доброкачественной гиперплазии нейтральной зоны железы, фиброзно-рубцовым изменениям, фибромускулярной гиперплазии, последствиям гормональной или лучевой терапии. МРТ без динамического контрастирования не позволяет достоверно дифференцировать большинство перечисленных изменений и заболеваний.
Как отмечено выше, одна из основных задач любого метода визуализации при РПЖ - определение объёма поражения железы и распространения опухоли за пределы капсулы. Определение объема опухоли важно в прогностическом отношении. Объём опухоли менее 4 см 3 свидетельствует об отдалённых метастазах, а 12 см 3 - о крайне высокой вероятности метастазов. По данным исследований, точность МРТ в обнаружении очагов неопластического поражения предстательной железы составляет от 50 до 90%. Чувствительность МРТ при определении локализации РПЖ составляет около 70-80%, при этом микроскопические очаги рака (фокусы) с помощью МРТ обнаружить невозможно.
Важнейшее преимущество эндоректальной MPТ - возможность определения локализации очагов неопластического поражения в зонах, недоступных другим методам диагностики, и уточнения характера и направления роста опухоли. Так, например, МРТ позволяет обнаружить очаги неопластического поражения в передних отделах периферической зоны предстательной железы, недоступных при трансректальной биопсии. В целом МРТ существенно дополняет данные ПРИ и ТРУЗИ о локализации опухоли.
Эндоректальная MPТ позволяет визуализировать капсулу железы, сосудисто-нервные пучки, семенные пузырьки, верхушку железы, перипростатичсское венозное сплетение и определить локальную распространённость опухоли железы. Следует подчеркнуть, что пенетрацию капсулы считают микроскопическим признаком, и даже современные аппараты МРТ (эндоректальная катушка) не способны дать такую информацию. Возможно лишь получение данных о прорастании за пределы капсулы железы.
Критерии диагностики экстракапсулярной экстензии при МРТ:
- наличие собственно экстракапсулярной опухоли;
- неровность контура железы (деформация, ангулярность);
- асимметрия нейроваскулярных пучков;
- облитерация ректопростатических углов;
- широкий контакт опухоли с капсулой.
Самой высокой специфичности (до 95-98%) и точности результата МРТ достигают при обследовании пациентов среднего или высокого риска экстракапсулярной инвазии. Считают, что экстракапсулярная инвазия (по данным МРТ) указывает на нецелесообразность хирургического лечения и неблагоприятный прогноз заболевания. Гормональная или лучевая терапия не влияет на точность обнаружения экстракапсулярного распространения опухоли предстательной железы. Основная трудность в обнаружении очагов рака и экстракапсулярного распространения опухоли - высокая вариабельность интерпретации томограмм разными специалистами. Первостепенная задача специалиста по лучевой диагностике - достижение высокой специфичности диагностики (даже в ущерб чувствительности) для того, чтобы не лишить операбельных пациентов шанса на проведение радикального лечения.
Сходство плотности раковой, гиперплазированной и нормальной ткани предстательной железы при КТ делает этот метод малопригодным для оценки местной распространенности опухоли. Прорастание в семенные пузырьки более важно, чем прорастание в капсулы, но и в этом случае КТ даёт информацию лишь при запущенном процессе. Однако этот метод активно применяют для разметки области воздействия перед лучевой терапией.
Медленное развитие лучевой диагностики в нашей стране привело к поздней диагностике РПЖ и, следовательно, к недостаточной распространённости радикальных методов лечения РПЖ (например, простатэктомии), малой доступности современных томографов и отсутствию соответствующих обучающих программ для специалистов по лучевой диагностике и урологов. Несмотря на то что КТ и МРТ сейчас широко распространены, уровень оснащения кабинетов и образования специалистов по лучевой диагностике недостаточен для того, чтобы полученная информация стала определяющей при выборе метода лечения больных РПЖ.
Регионарные лимфатические узлы (N)
Оценивать регионарные лимфатические узлы следует лишь в тех случаях, когда это напрямую влияет на лечебную тактику (обычно при планировании радикального лечения). Высокий уровень ПСА, опухоли Т2с-Т3а, низкая дифференцировка и периневральная инвазия сопряжены с высоким риском метастазирования в лимфатические узлы. Оценку состояния лимфатических узлов по уровню ПСА считают недостаточной.
Необходимую информацию предоставляет лишь лимфаденэктомия (открытая или лапароскопическая). Недавние исследования расширенной лимфаденэктомии показали, что РПЖ не всегда поражает запирательные лимфатические узлы. При бессимптомных опухолях и уровне ПСА менее 20 кг/мл. КТ подтверждает увеличение лимфатических узлов лишь в 1 % случаев. Применение МРТ или КТ оправдано при высоком риске метастазирования, так как специфичность этих методов достигает 93-96%. Однако даже положительный результат при их применении может быть ложным, и только пункция подозрительного лимфатического узла позволяет отказаться от лимфаденэктомии, По данным ретроспективного анализа, размеры лимфатического узла не всегда свидетельствуют о наличии в нем метастазов, более информативным признаком считают асимметрию пораженных лимфатических узлов. В настоящее время только у 2-3% больных, перенёсших радикальную простатэктомию по поводу локального РПЖ, диагностируют метастазирование в лимфатические узлы на основании послеоперационного гистологического исследования.
В качестве методов обнаружения метастазирования в лимфатические узлы рекомендуют использовать позитронно-эмиссионную томографию (ПЭТ) и сцинтиграфию с мечеными антителами, но их применение пока ограничено в связи с недостаточной чувствительностью.
Для оценки риска поражения регионарных лимфатических узлов можно использовать номограммы Партина (2001). Номограммы - Математические алгоритмы, которые используют для конкретного пациента или для группы больных. Эти таблицы позволяют определить вероятность местного распространения опухоли (на капсулу, семенные пузырьки) и поражения лимфатических узлов на основании клинической стадии, уровня ПСА и индекса Глисона. В частности, они дают возможность выделить группу больных с низкой (менее 10%) вероятностью метастазирования в лимфатические узлы (при уровне ПСА более 20 нг/мд, стадии Т1-2а и индексе Глисона 2-6); в этой группе перед радикальным лечением состояние лимфатических узлов можно не уточнять. Оценить риск метастазировани я в лимфатические узлы позволяет и обнаружение участков опухоли с выраженной анаплазией (4-5 баллов): если такие участки обнаруживают в четырёх биоптатах и более или они преобладают хотя бы в одном биоптате, риск достигает 20-45%. У остальных больных он не превышает 2,5%. Дополнительное обследование в таких случаях не требуется
Отдалённые метастазы (М)
У 85% больных, умирающих от РПЖ, обнаруживают поражения осевого скелета. Костные метастазы возникают вследствие попадания раковых клеток с током крови в костный мозг, что приводит к росту опухоли и лизису костных структур. Распространенность костных метастазов влияет на прогноз, а их раннее обнаружение предупреждает врача о возможных осложнениях. В 70% случаев метастазирование сочетается с повышением активности костного изофермента щелочной фосфатазы (ЩФ). Определение активности ЩФ и уровня ПСА в подавляющем большинстве случаев позволяет обнаружить костное метастазирование. Поданным многофакторного анализа, на эти показатели влияет лишь количество метастазов в кости. Важно, что активность костного изофермента ЩФ отражает степень поражения костей более точно, чем уровень ПСА.
Наиболее чувствительным методом обнаружения метастазов в кости считают сцинтиграфию (превосходит рентгенографию и определение активности щелочной и кислой фосфатазы). В качестве радиофармацевтического препарата лучше использовать дифосфонаты технеция, накопление которых в костях происходит намного активнее, чем в мягких тканях. Показана корреляция между полуколичественной оценкой поражения костей и выживаемостью. Обнаружение отдалённых метастазов возможно в любом органе. Чаще они возникают в нерегионарных лимфатических узлах, легких, печени, головном мозге и коже. При соответствующих жалобах и симптомах для их обнаружения используют рентгенографию грудной клетки, УЗИ, КТ и МРТ. Тактика при подозрении на костное метастазирование представлена на схеме.
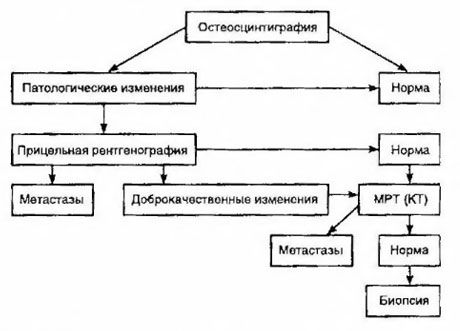
Самым надёжным лабораторным показателем, помогающим в определении степени метастазирования, служит уровень ПСА. Показано, что его увеличение свыше 100 нг/мл - единственный параметр, достоверно указывающий на отдалённые метастазы. Определение уровня ПСА уменьшает число больных, нуждающихся в сцинтиграфии костей. Вероятность обнаружения метастазов в кости при уменьшении уровня ПСА очень низка. При отсутствии жалоб и исходном содержании ПСА менее 20 нг/мл, обнаружении высоко- и умереннодифференцированных опухолей от сцинтиграфии можно отказаться. В то же время при низкодифференцированных опухолях и прорастании капсулы показана сцинтиграфия (независимо от уровня ПСА).
Читайте также:

