Циклопентан с хлором на свету
Циклоалканы (циклопарафины, нафтены) - циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их гомологического ряда - CnH2n.
Названия циклоалканов формируются путем добавления приставки "цикло-" к названию алкана с соответствующим числом: циклопропан, циклобутан и т.д.
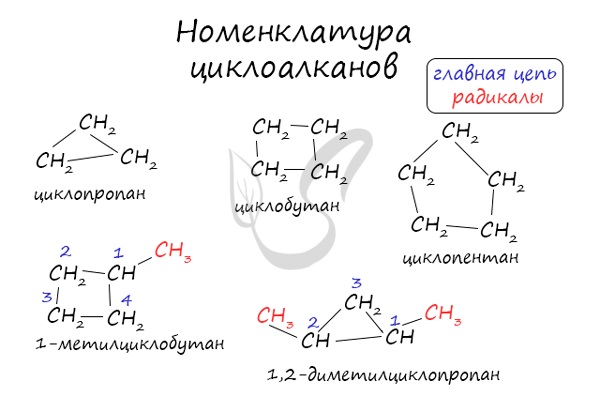
Как и у алканов, атомы углерода циклоалканов находятся в sp 3 гибридизации.
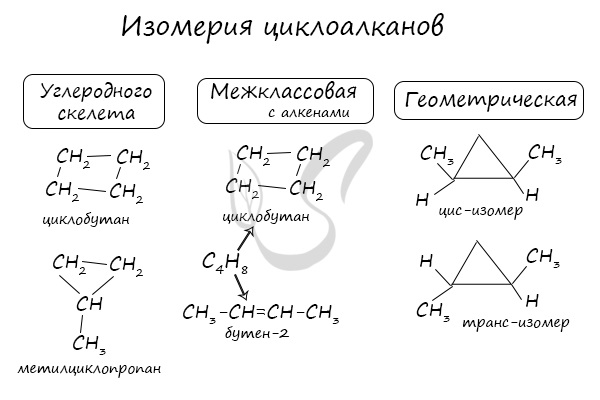
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
В промышленности циклоалканы получают несколькими способами:
-
Из ароматических углеводородов
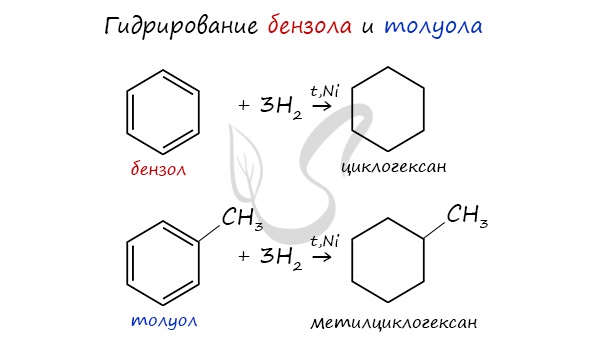
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.
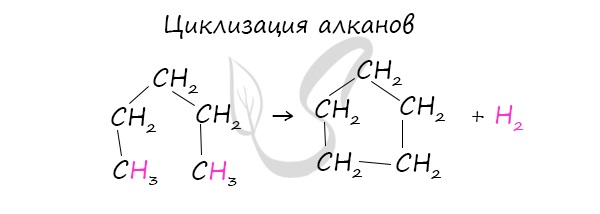
При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
-
Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)

Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования.

Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция идет, как и у алканов, по механизму замещения.
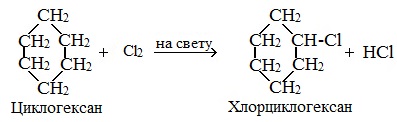
У циклопентана и циклогексана реакция идет только путем замещения.
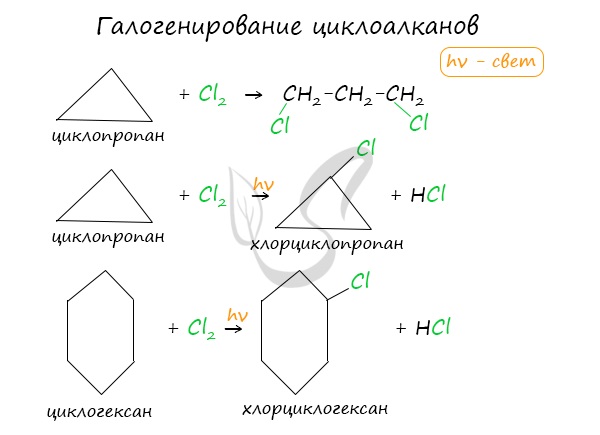
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
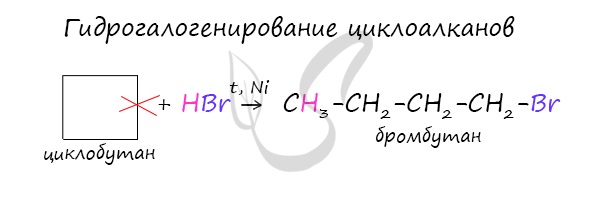
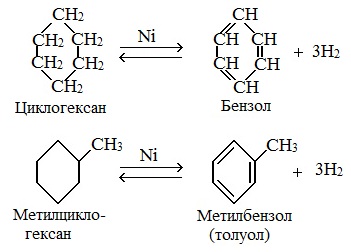
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов - гомологи бензола.
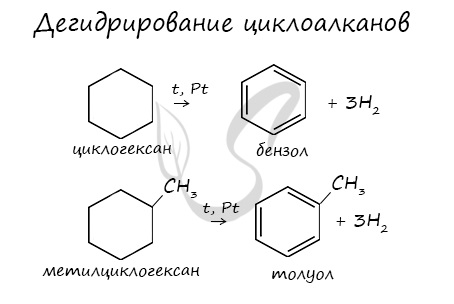
В ходе нагревания с катализатором - AlCl3 циклоалканы образуют изомеры.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Пройдите тест для закрепления знаний
Реакция присоединения характерна для циклопропана, цикл которого неустойчив и легко рвется.
Межклассовыми изомерами циклоалканов являются алкены.
Тип гибридизации атомов углерода у циклоалканов (как и у алканов) - sp 3 .
В результате гидрирования бензола можно получить циклогексан.
Циклогексан не вступает в реакцию присоединения, этой прочный устойчивый цикл.
Циклоалканы – это предельные (насыщенные) углеводороды, которые содержат замкнутый углеродный цикл.
Общая формула циклоалканов CnH2n, где n≥3.
Циклоалканы с малым циклом (циклопропан, циклобутан и их замещенные гомологи) из-за большой напряженности в кольце могут вступать в реакции присоединения.
1. Реакции присоединения к циклоалканам
| Чем меньше цикл и чем больше угловое напряжение в цикле, тем легче протекают реакции присоединения. Способность вступать в реакции присоединения уменьшается в ряду: циклопропан > циклобутан > циклопентан. |
С водородом могут реагировать малые циклы, а также (в жестких условиях) циклопентан. При этом происходит разрыв кольца и образование алкана.
Циклопропан и циклобутан довольно легко присоединяют водород при нагревании в присутствии катализатора:


Циклопентан присоединяет водород в жестких условиях:

Бромирование протекает более медленно и избирательно.
Циклогексан и циклоалканы с большим число атомов углерода в цикле с водородом не реагируют.
Циклопропан и циклобутан реагируют с галогенами, при этом тоже происходит присоединение галогенов к молекуле, сопровождающееся разрывом кольца.
| Например. Циклопропан присоединяет бром с образованием 1,3-дибромпропана: |

Циклопропан и его гомологи с алкильными заместителями у трехчленного цикла вступают с галогеноводородами в реакции присоединения с разрывом цикла.
| Например, циклопропан присоединяет йодоводород. |

| Присоединение галогеноводородов к гомологам циклопропана с заместителями у трехатомного цикла (метилциклопропан и др.) происходит по правилу Марковникова. |
| Например, при присоединении бромоводорода к метилциклопропану преимущественно образуется 2-бромбутан |

2. Реакции замещения
Галогенирование циклопентана, циклогексана и циклоалканов с большим количеством атомов углерода в цикле протекает по механизму радикального замещения.
| Например, при хлорировании циклопентана на свету или при нагревании образуется хлорциклопентан |

При хлорировании метилциклопентана замещение преимущественно протекает у третичного атома углерода:

При взаимодействии циклоалканов с разбавленной азотной кислотой при нагревании образуются нитроциклоалканы.
| Например, нитрование циклопентана. |

При нагревании циклоалканов в присутствии катализаторов протекает дегидрирование – отщепление водорода.
Циклогексан и его производные дегидрируются при нагревании и под действием катализатора до бензола и его производных.
| Например, бензол образуется при дегидрировании циклогексана. |

| Например, при отщеплении водорода от метилциклогексана образуется толуол. |

3. Окисление циклоалканов
Как и все углеводороды, алканы горят до углекислого газа и воды. Уравнение сгорания циклоалканов в общем виде:
| Например, горение циклопентана. |
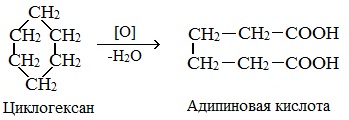
При окислении циклогексана азотной кислотой или в присутствии катализатора образуется адипиновая (гександиовая) кислота:

Этот сайт использует Akismet для борьбы со спамом. Узнайте как обрабатываются ваши данные комментариев.
Циклоалканы
Свойства циклоалканов в зависимости от размера цикла имеют свои особенности, и поэтому целесообразно рассматривать их для каждого цикла отдельно. Строение циклических соединений изучалось еще в прошлом веке, и были попытки найти закономерности, объясняющие своеобразие реакционной способности каждого цикла. Адольфом фон Байером была предложена теория напряжений валентных углов, согласно которой молекула тем стабильнее, чем ближе значения валентных углов к нормальному. Эта теория объясняла, почему циклопропан мало устойчив, но она не смогла объяснить высокую устойчивость циклогексана, потому что исходила из представлений о плоской геометрии циклов. Действительно, в циклопропане валентный угол соответствует углу в равностороннем треугольнике (60°), тогда как нормальный валентный угол sp 3 -С-атома равен 109,5°. Это означает, что циклопропановое кольцо испытывает большое напряжение и стремится раскрыться, поэтому циклопропан ведет себя в некоторых реакциях как алкен.
Структурные измерения и квантово-химические расчеты молекулы циклопропана дают следующие геометрические параметры:
Объяснение строения циклопропана в свете этих данных заставляет предположить, что связи в кольце образованы гибридными орбиталями с вкладом s-характера лишь 17% против 25% при гибридизации sp 3 (об этом можно судить, например, по величине энергии ионизации: циклопропан 10,5 эВ, пропан 11,7 эВ, пропен 9,7 эВ). Внешние орбитали имеют 33% s-вклада (т.е. ближе к sp 2 -гибридизации).
Сравнение величин теплот сгорания ряда циклоалканов в расчете на одну метиленовую группу показывает, что циклопропан является самым богатым энергией циклоалканом (38,5 кДж/моль). За точку отсчета принят циклогексан (0 кДж/моль).
Циклопропан проявляет химические свойства как алканов, так и непредельных соединений. Гидрирование, взаимодействие с бромо- и хлороводором в воде, бромом при нагревании и на свету приводит к раскрытию цикла.
Напротив, при действии хлора на свету он, аналогично алканам, подвергается замещению – хлорированию.
Циклобутан, как и другие циклоалканы с циклом больше трехчленного, имеет неплоское кольцо. Оно представляет собой геометрическую фигуру с перегибом по линии соединяющей противоположные углеродные атомы, что обусловлено внутримолекулярным отталкиванием атомов водорода. Поэтому монозамещенные циклобутаны существуют в двух конформациях, которые, однако, легко переходят друг в друга и не могут быть разделены.
Кольцо циклобутана более устойчиво к действию многих реагентов, чем кольцо циклопропана. Для него более характерными являются реакции замещения, однако каталитическое гидрирование приводит к раскрытию кольца.
Молекула циклопентана образует правильный пятиугольник с внутренним углом 105°, близким по величине к валентному углу тетраэдрического атома углерода. Однако, вследствие внутримолекулярного отталкивания атомов водорода, происходит искажение плоскости молекулы.
Циклопентан проявляет свойства, характерные для алканов и реакции раскрытия цикла для него нехарактерны. Повышенный интерес вызывает циклопентадиен. Он является активным субстратом в реакциях диенового синтеза, при хранении обратимо димеризуется с образованием эндо- и экзо-аддуктов Дильса-Альдера. При перегонке оба димера превращаются в исходный циклопентадиен с примесью полимерных продуктов.
Если бы молекула циклогексана была плоской, как предполагал А. ф. Байер, то в ней наблюдалось бы значительное напряжение валентных углов (120° против 109,5°). Сейчас известно, что циклогексан неплоский, четыре атома углерода находятся в одной плоскости, а два выходят из нее. Возможны три пространственные конформации циклогексана: кресло – С-атомы расположены по разные стороны плоскости, ванна – по одну. Из-за внутримолекулярного отталкивания атомов водорода более выгодна форма кресла (на 29,3 кДж/моль). Промежуточное положение занимает конформация, которую называют твист-формой – это искаженная ванна, она на 6,3 кДж/моль выгоднее ванны.
Кресло Ванна Твист
Когда молекула циклогексана находится в конформации кресла, атомы водорода в ней можно различить на экваториальные (ориентированные ближе к плоскости кольца) и аксиальные.
Однако, в химическом отношении все атомы водорода равноценны, т.к. конформации быстро переходят друг в друга. Реакционная способность циклогексана аналогично алканам и для него характерны реакции свободнорадикального замещения: хлорирование, нитрование по М. Коновалову. Однако в отличие от циклопропана и циклобутана каталитическое гидрирование требует жестких условий
Из всех циклоалканов циклогексан имеет самое устойчивое кольцо: величина теплоты сгорания в расчете на одну метиленовую группу, равная 659 кДж/моль, принята за нулевую при сравнении с другими циклоалканами.
При пропускании циклогексана или его алкилзамещенных через никелевый или платиновый катализатор при 200 °С происходит дегидрирование кольца и его превращение в ароматическую систему. Эта реакция, однако, препаративного значения не имеет, т.к. производные бензола зачастую доступнее производных циклогексана с теми же заместителями.
Циклоалканы - предельные циклические углеводороды.
Общая формула гомологического ряда CnH2n.




Малые циклы
Большие циклы
Строение циклоалканов.
Каждый атом углерода в циклоалканах находится в состоянии sp 3 -гибридизации и образует четыре σ-связи С-С и С-Н.
Углы между связями зависят от размера цикла. В малых циклах С3 и С4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность.
σ -связи в циклопропане называют "банановыми". По свойствам они напоминают ПИ-связи. Поэтому молекулу циклопропана очень легко разорвать и поэтому он способен вступать в реакции присоединения (с разрывом цикла).
Циклобутан в пространстве имеет перегиб по линии, соединяющей 1 и 3 атом С в кольце:



а — кресло б — ванна.
И в конформации кресла, и в конформации ванны связи вокруг каждого атома углерода имеют тетраэдрическое расположение. Отсюда — несравнимо большая устойчивость обычных циклов по сравнению с малыми циклами, отсюда — их возможность вступать в реакции замещения, но не присоединения.
Изомерия:
1 . Структурная изомерия , связанная:
a) с числом углеродных атомов в кольце:
![]()
(этилциклопропан), ![]()
(метилциклобутан);
b) с числом углеродных атомов в заместителях:
![]()
(1-метил-2-пропилциклопентан), ![]()
(1,2-диэтилциклопентан)
c) с положением заместителя в кольце:
![]()
(1,1-диметилциклогексан), ![]()
(1,2-диметилциклогексан)
2. Межклассовая изомерия: циклоалканы изомерны алкенам.
3. Геометрическая цис-транс-изомерия:
Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):

1. Отщепление двух атомов галогена от дигалогеналканов:

2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные: C 6 H 6 + 3 H 2 - t °,р, Ni → C 6 H 12.
Химические свойства.
1. Малые циклы (циклопропан и циклобутан) из-за большой напряженности кольца (малые углы) легко разрываются, вступая в реакции присоединения.
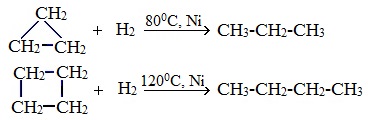
1) Гидрирование . При каталитическом гидрировании трех-, четырех- и даже пятичленные циклы разрываются с образованием алканов.

(циклопропан) + H2 - 120ºC,Ni CH3–CH2–CH3

(циклопентан)+ H2- 300ºC,Pd CH 3– CH 2– CH 2– CH 2– CH 3
Пятичленный цикл разрывается только при высоких температурах.
2) Галогенирование . Циклопропан и циклобутан разрываются, присоединяя атомы галогена.

+ Br 2 BrCH 2 –CH 2 –CH 2 Br (1,3- дибромпропан )
3) Гидрогалогенирование . Циклопропан и замещенные циклопропаны взаимодействуют с галогеноводородами с разрывом цикла.

В случае замещенных циклопропанов реакция идёт в соответствии с правилом Марковникова.
Другие циклоалканы с галогеноводородами не реагируют.
2. Большие циклы – циклопентан и циклогексан – гораздо более устойчивы, цикл в них не разрывается. Они ведут себя подобно алканам, вступая в реакции замещения: галогенирование на свету, нитрование.
1) Галогенирование: циклопентан и циклопентан реагируют с галогенами на свету, вступая в реакцию замещения.

+ Cl2-(свет) 
(хлорциклопентан) + HCl
2) Нитрование.
Циклопентан + HNO 3 –( t , p ) нитроциклопентан + вода.
3. Дегидрирование . Производные циклогексана дегидрируются в производные бензола:


4. Горение. Как и любые органические вещества, циклоалканы горят с образованием углекислого газа и воды .
Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость.
Трех- и четырехчленные циклы (малые циклы), являются насыщенными, но, несмотря на это резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp 3 -гибридизованному атому углерода.
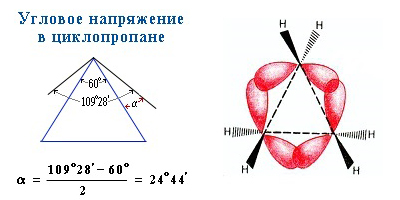
Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду:
циклопропан > циклобутан >> циклопентан.
Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения.
В циклах (начиная с С5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения.
1. Гидрирование
Циклопропан, циклобутан довольно легко присоединяют водород, образуя соответствующие нормальные алканы.
2. Галогенирование
Малые циклы (С3 — С4) способны присоединять бром (хотя реакция и идет труднее, чем с пропеном или бутеном). С алкенами реакция идет при комнатной температуре, для циклоалканов необходимо нагревание.
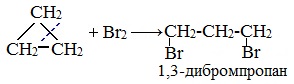
3. Гидрогалогенирование
В реакцию присоединения с галогеноводородами опять де вступают только малые циклы при нагревании.

Присоединение к гомологам циклопропана происходит по правилу Марковникова.
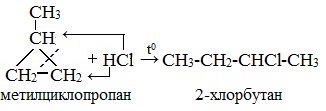
1. Галогенирование
2. Нитрование

1. Дегидрирование
Эти соединения, подобно алканам, вступают в реакции дегидрирования.
Дегидрирования циклогексана (реакция Зелинского-Казанского) и его алкильных производных.
1. Реакция горения
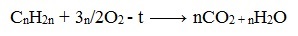
2. Окисление в присутствии катализатора.
При действии сильных окислителей (например, 50%-ной азотной кислоты) на циклогексан в присутствии катализатора образуется адипиновая (гександиовая) кислота.
Сравнение свойств
Столь резкое отличие в свойствах циклоалканов в зависимости от размеров цикла приводит к необходимости рассматривать не общий гомологический ряд циклоалканов, а отдельные их ряды по размерам цикла.
Например, в гомологический ряд циклопропана входят: циклопропан С3Н6, метилциклопропан С4Н8, этилциклопропан С5Н10 и т.д.

Циклоалканы — интересные вещества. С одной стороны, они насыщенные, т.к. связь С-С — одинарная, с другой стороны, общая формула у них как у алкенов — CnH2n. Помимо этого, внутри гомологического ряда есть вещества, имеющие немного разные химические свойства…
Общая формула циклоалканов:
n = числу атомов углерода.
Название углеводородов строятся из двух частей.
Изомерия циклоалканов
Структурная и межклассовая — циклоалканы изомерны алкенам
(есть еще пространственная, но в школьном курсе ее не затрагивают)


первые члены гомологического ряда — циклопропан (с меньшим количеством атомов углерода уже не может быть) и циклобутан имеют довольно маленькие углы между связями — у циклопропана — 60°, у циклобутана — 90°. (Для сравнения — у алканов — 109°28’, у алкенов — 120) Поэтому эти соединения неустойчивы в цикле — при первой же возможности они становятся производными алканов:
Гидрирование: C3H6 + H2 = C3H8 — реакция похожа на реакции алкенов
Галогенирование:
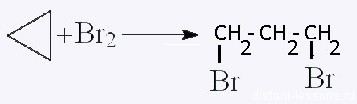
Гидрогалогенирование — аналогично.
Циклоалканы с большим количеством атомов углерода вступают в реакции замещения:

Это реакция замещения — характерная реакция алканов
Реакции окисления: цикл разрывается и по концам образуется группа -COOH:
C5H10 + [O] → HOOC-(CH2)3-COOH
(циклопропан и циклобутан устойчивы к окислению)
Горение: все как обычно — все органические веществ сгорают с образованием CO2 и H2O:
СnH2n + 3n\2 O2 = nCO2 + nH2O
В общем, если подвести итог, то картина такая:
- циклоалканы с небольшим числом атомов углерода: 3 и 4 вступают в реакции присоединения с раскрытием цикла;
- циклоалканы с большим числом атомов углерода вступают в реакции замещения
Получение циклоалканов:
- из линейных соединений — алканов:
Запомните правило — циклизация любых линейных соединений состоит из этапов:
1) активация цепи с двух концов: СH2Cl — CH2 — CH2Cl
2) замыкание в цикл дегалогенированием: СH2Cl — CH2 — CH2Cl + Zn = C3H6 + ZnCl2
- из ароматических соединений гидрированием: С6H6 +3H2 = С6H12
- в ЕГЭ это вопрос А13 и А14— Строение и свойства углеводородов
- в ГИА (ОГЭ) это B2— Первоначальные сведения об органических веществах: предельных и непредельных углеводородах
Читайте также:







