Циклогексан формула с хлором
Циклоалканы (циклопарафины, нафтены) - циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их гомологического ряда - CnH2n.
Названия циклоалканов формируются путем добавления приставки "цикло-" к названию алкана с соответствующим числом: циклопропан, циклобутан и т.д.
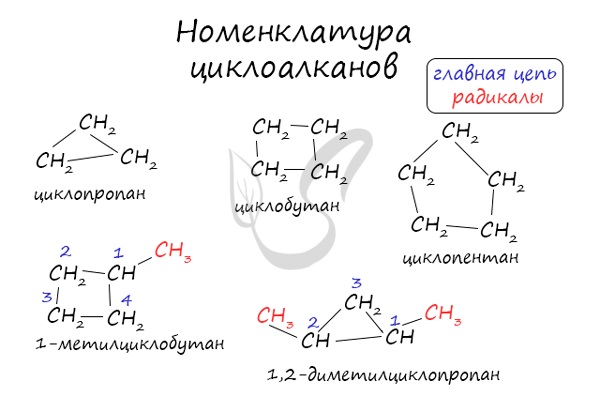
Как и у алканов, атомы углерода циклоалканов находятся в sp 3 гибридизации.
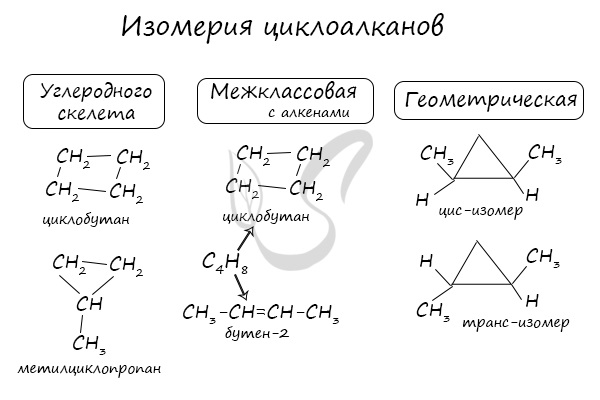
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
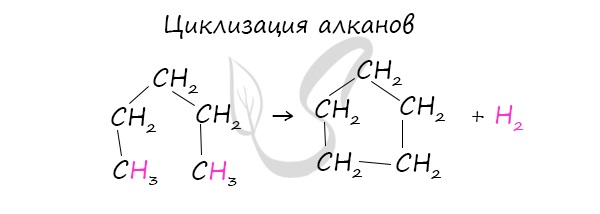
В промышленности циклоалканы получают несколькими способами:
-
Из ароматических углеводородов
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов.

При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород.
В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
-
Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)

Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования.

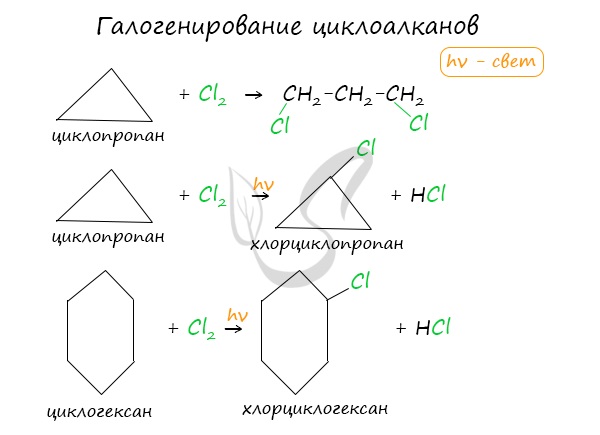
Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция идет, как и у алканов, по механизму замещения.
У циклопентана и циклогексана реакция идет только путем замещения.
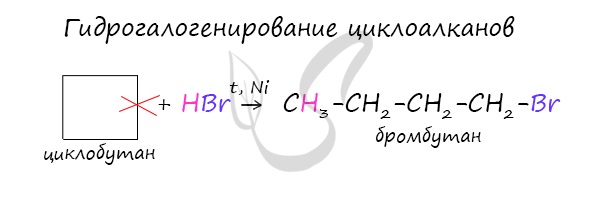
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан.
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов - гомологи бензола.

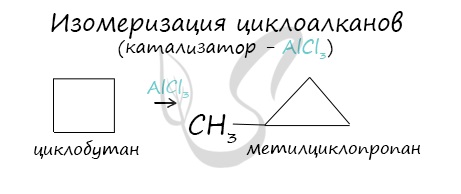
В ходе нагревания с катализатором - AlCl3 циклоалканы образуют изомеры.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Пройдите тест для закрепления знаний
Реакция присоединения характерна для циклопропана, цикл которого неустойчив и легко рвется.
Межклассовыми изомерами циклоалканов являются алкены.
Тип гибридизации атомов углерода у циклоалканов (как и у алканов) - sp 3 .
В результате гидрирования бензола можно получить циклогексан.
Циклогексан не вступает в реакцию присоединения, этой прочный устойчивый цикл.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg + | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | Р | Н | ? | Н | Н | ? | Р | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | ? | ? | ? | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (  Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса " " содержит ошибку, нажмите на кнопку "Отправить". Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений.
Здесь, возможно, указаны не все изомеры данного вещества. Более полный поиск изомеров следует проводить по формуле. Например, чтобы получить изомеры вещества с формулой С6H10O6 , следует сделать запрос так: Изомеры - это соединения с одинаковым количественным составом (то есть одинаковым числом атомов каждого элемента), но разным строением. Циклоалканы – это предельные (насыщенные) углеводороды, которые содержат замкнутый углеродный цикл. Общая формула циклоалканов CnH2n, где n≥3. Циклоалканы с малым циклом (циклопропан, циклобутан и их замещенные гомологи) из-за большой напряженности в кольце могут вступать в реакции присоединения. 1. Реакции присоединения к циклоалканам
С водородом могут реагировать малые циклы, а также (в жестких условиях) циклопентан. При этом происходит разрыв кольца и образование алкана. Циклопропан и циклобутан довольно легко присоединяют водород при нагревании в присутствии катализатора:
Циклопентан присоединяет водород в жестких условиях:
Бромирование протекает более медленно и избирательно. Циклогексан и циклоалканы с большим число атомов углерода в цикле с водородом не реагируют. Циклопропан и циклобутан реагируют с галогенами, при этом тоже происходит присоединение галогенов к молекуле, сопровождающееся разрывом кольца.
Циклопропан и его гомологи с алкильными заместителями у трехчленного цикла вступают с галогеноводородами в реакции присоединения с разрывом цикла.
2. Реакции замещенияГалогенирование циклопентана, циклогексана и циклоалканов с большим количеством атомов углерода в цикле протекает по механизму радикального замещения.
При хлорировании метилциклопентана замещение преимущественно протекает у третичного атома углерода:
При взаимодействии циклоалканов с разбавленной азотной кислотой при нагревании образуются нитроциклоалканы.
При нагревании циклоалканов в присутствии катализаторов протекает дегидрирование – отщепление водорода. Циклогексан и его производные дегидрируются при нагревании и под действием катализатора до бензола и его производных.
3. Окисление циклоалкановКак и все углеводороды, алканы горят до углекислого газа и воды. Уравнение сгорания циклоалканов в общем виде:
При окислении циклогексана азотной кислотой или в присутствии катализатора образуется адипиновая (гександиовая) кислота:
Этот сайт использует Akismet для борьбы со спамом. Узнайте как обрабатываются ваши данные комментариев. Ключевое различие между хлорбензолом и циклогексилхлоридом состоит в том, что хлорбензол имеет делокализованное электронное облако, тогда как в циклогексилхлориде нет делокализованного электронного облака. Хлорбензол имеет бензольное кольцо с атомом хлора, присоединенным к кольцу. Здесь атом хлора заменил один из атомов водорода в кольце. Следовательно, делокализованное электронное облако бензольного кольца также находится там. Однако циклогексилхлорид имеет атом хлора, связанный с молекулой циклогексана. Здесь также атом хлора заменяет атом водорода кольца. Поскольку в циклогексане нет делокализованного электронного облака, циклогексилхлорид также не имеет делокализованного электронного облака.
Хлорбензол представляет собой ароматическое органическое соединение, которое имеет бензольное кольцо с присоединенным атомом хлора. Химическая формула этого соединения — C6H5Cl. Это бесцветная и легковоспламеняющаяся жидкость. У неё миндальный запах. Её молярная масса составляет 112,56 г/моль. Кроме того, температура плавления этого соединения составляет -45 °С, а температура кипения составляет 131 °С. Используется это соединение в качестве промежуточного продукта при производстве таких соединений, как гербициды, каучук и т.д. Кроме того, это высококипящий растворитель, который используется в промышленности. Циклогексилхлорид — это органическое соединение, в котором молекула циклогексана имеет один из атомов водорода, замещенный атомом хлора. Химическая формула этого соединения C6H11Cl. Другое распространенное название этого соединения — хлорциклогексан. Циклогексилхлорид является бесцветной жидкостью и имеет удушающий запах. П риготовить его можно, обработав циклогексанол с HCl. Температура его плавления составляет -44 °С, а температура кипения составляет 142 °С. Хлорбензол является ароматическим органическим соединением и имеет бензольное кольцо с присоединенным атомом хлора. Циклогексилхлорид является органическим соединением и имеет молекулу циклогексана с одним из его атомов водорода, замещенным атомом хлора. Ключевое различие между хлорбензолом и циклогексилхлоридом состоит в том, что хлорбензол имеет делокализованное электронное облако, тогда как циклогексилхлорид не имеет делокализованного электронного облака. Кроме того, еще одно различие между хлорбензолом и циклогексилхлоридом состоит в том, что хлорбензол является ароматическим и проявляет ненасыщенность, тогда как циклогексилхлорид неароматичен и не имеет ненасыщенности (все химические связи насыщены). Т емпература плавления хлорбензола составляет -45 °С, а температура кипения составляет 131 °С, в то время как температура плавления циклогексилхлорида составляет -44 °С, а температура кипения составляет 142 °С. Хлорбензол является ароматическим органическим соединением и имеет бензольное кольцо с присоединенным атомом хлора. Циклогексилхлорид является органическим соединением и имеет молекулу циклогексана с одним из его атомов водорода, замещенным атомом хлора. Таким образом, ключевое различие между хлорбензолом и циклогексилхлоридом состоит в том, что хлорбензол имеет делокализованное электронное облако, тогда как делокализованное электронное облако циклогексилхлорида отсутствует. Читайте также:
|















