Что значит клинически значимый рак
Контекст
Выявление клинически значимого рака предстательной железы (РПЖ) является трудной задачей. Было продемонстрировано, что мультипараметрическая магнитно-резонансная томография (мпМРТ) упрощает выяснение локализации РПЖ и может помочь при выполнении прицельной биопсии простаты.
Цель
Провести систематический обзор литературы, чтобы определить диагностическую точность мпМРТ в выявлении клинически значимого РПЖ.
Сбор материала
Синтез материала
В итоге было отобрано двенадцать статей. Медиана возраста пациентов составила 62-65 лет (диапазон от 39 до 83 лет), медиана уровня простат-специфического антигена (PSA) составила 5.1-13.4 нг/мл (диапазон от 1.2 до 228 нг/мл), сумма баллов Глисона составила от 6 до 10. Применялись различные определения клинической значимости, основанные, главным образом, на максимальной длине столбика злокачественно изменённой ткани и степени дифференцировки на момент выполнения биопсии, количестве положительных столбиков и уровне PSA. Показатель выявляемости клинически значимого РПЖ с помощью мпМРТ варьировал от 44% до 87% у мужчин без предшествующей биопсии и мужчин с предшествующим отрицательным результатом биопсии, при этом в качестве референтного стандарта выступала биопсия предстательной железы или окончательное патогистологическое исследование препарата, полученного при радикальной простатэктомии. Отрицательная предиктивная ценность для исключения значимого заболевания составляла от 63% до 98%.
Заключение
мпМРТ способна выявлять клинически значимый РПЖ у мужчин без предшествующей биопсии и после отрицательного результата предшествующей биопсии. Отрицательная предиктивная ценность мпМРТ важна для клинициста, поскольку мпМРТ можно использовать для исключения значимого заболевания. Это может привести к меньшему количеству или полному исключению систематических или прицельных биопсий у определённого контингента пациентов с уровнем PSA, вызывающим подозрения в отношении рака предстательной железы.
Ключевые слова: рак простаты, систематический обзор, мультипараметрическая МРТ.
Can Clinically Significant Prostate Cancer Be Detected with Multiparametric Magnetic Resonance Imaging? A Systematic Review of the Literature
By: Jurgen J. Futterer a, Alberto Briganti b , Pieter De Visschere c , Mark Emberton d , Gianluca Giannarini e , Alex Kirkham f , Samir S. Taneja g , Harriet Thoeny h , Geert Villeirs c and Arnauld Villers i
- a Radboud University Nijmegen Medical Centre, Nijmegen, The Netherlands
- b Division of Oncology/Unit of Urology, Urological Research Institute, IRCCS Ospedale San Raffaele, Milan, Italy
- c Department of Radiology, Ghent University Hospital, Ghent, Belgium
- d Research Department of Urology, University College London, London, UK
- e Urology Unit, Academic Medical Centre Hospital “Santa Maria della Misericordia”, Udine, Italy
- f Department of Radiology, University College London Hospital, London, UK
- g Division of Urologic Oncology, Department of Urology, NYU Langone Medical Center, New York, NY, USA
- h Department of Radiology, Neuroradiology and Nuclear Medicine, University of Bern, Inselspital, Bern, Switzerland
- i Department of Urology, Lille University Medical Centre, University Lille Nord de France, Lille, France
European Urology, Volume 68 Issue 6, December 2015, Pages 1045-1053
Keywords: Prostate cancer, Systematic review, Multiparametric MRI
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
ВЫЯВЛЕНИЕ И ПРЕДОПЕРАЦИОННЫЙ ПРОГНОЗ КЛИНИЧЕСКИ НЕЗНАЧИМОГО РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Л. Грачева
L. Gracheva
Р ак предстательной железы занимает второе после рака легких место в структуре причин онкологической смертности среди мужчин. Для него характерны безболезненное течение и относительно длительный период удвоения объема опухоли. От 30 до 40% мужчин старше 50 лет имеют рак простаты, но только у 8% он становится клинически значимым. Распространенность этого вида рака далеко превосходит заболеваемость и смертность. Поскольку гораздо больше мужчин умирают с раком простаты,чем от него, необходимы диагностические методы, позволяющие до операции выявить больных с клинически значимым раком, нуждающихся в операции, и тех, для кого предпочтительнее выжидательная лечебная тактика. Определение специфического простатического антигена и трансректальная ультрасонография позволяют выявлять множество предварительно не заподозренных случаев рака, часто на ранней стадии и малых размеров. Ряд исследователей считают, что лучшей терапевтической стратегией при малых формах рака простаты может быть частичная андрогенная депривация. Характеризация клинически незначимого рака простаты у пациентов с предполагаемой небольшой продолжительностью жизни может помочь избежать ненужного хирургического вмешательства или радиационной терапии. Целью данного исследования были изучение клинически незначимого рака предстательной железы с учетом объема опухоли, характера, времени удвоения объема и предполагаемой продолжительности жизни больного , а также определение частоты удаления незначимого рака путем радикальной простатэктомии. Как клинически незначимый рассматривался рак, который не должен увеличиться более чем до 20 см3 в пределах простаты в течение предполагаемой продолжительности жизни больного, с оценкой по шкале Gleason менее 4 для пациентов 40 - 49 лет, 5 для пациентов 50 - 59 лет, 6 для пациентов 60 - 69 лет и 7 для больных 70 - 79 лет. Были сформулированы четыре определения незначимого процесса на основании предполагаемого времени удвоения объема опухоли за 2, 3, 4 года и 6 лет. Используя эти определения, авторы проанализировали 337 тотальных простатэктомий, выполненных в клинике Мейо в 1991 - 1993 гг. по поводу рака предстательной железы в стадии Т1 - Т3. В результате анализа клинически незначимый рак был идентифицирован: по критерию удвоения объема за 2 года - в 1 (0,3%) случае, за 3 года - в 13 (3,9%), за 4 года - в 25 (7,4%) и за 6 лет - в 49 (14,5%) случаях из 337.
Авторы считают, что клинически незначимый рак предстательной железы может быть определен с учетом объема опухоли, характера, времени удвоения объема и предполагаемой продолжительности жизни больного. В соответствии с разработанными определениями у большинства больных, перенесших радикальную простатэктомию, был клинически значимый рак.
Dugan JA, Bostwick DG, Myers RP, et al. The definition and Preoperative Prediction of Clinically Insignificant Prostate Cancer. JAMA 1996;275:288-94.
Общие сведения
Радикальное хирургическое лечение рака предстательной железы (РПЖ) предполагает удаление простаты в промежутке между перепончатой уретрой и шейкой мочевого пузыря, обоих семенных пузырьков, а также двустороннюю резекцию заднебоковых нервно-сосудистых пучков.
Локализованный РПЖ принято разделять на внутриорганный, или локальный, когда опухоль не проникает за пределы простатической капсулы (стадии >Т2), и местно-распространенный (>Т3) выходящий за капсулу, но еще не метастатический.
В случаях локального рака предстательной железы радикальная простатэктомия может быть выполнена по нервсберегающей (одно- или двусторонней) технологии, т.е. не сопровождаться иссечением заднебоковых нервно-сосудистых пучков.
Радикальная простатэктомия (РПЭ) является только одним из методов лечения локализованного РПЖ.
К другим методам относятся:
• бдительное ожидание (активное мониторирование);
• наружная лучевая терапия;
• брахитерапия (внутрипростатическая лучевая терапия);
• гормональная терапия.
В связи с многообразием методов существует проблема выбора лечения, т.е. определения показаний к той или иной терапии рака предстательной железы у конкретного пациента.
Показания к радикальной простатэктомии
Высокие показатели смертности от рака предстательной железы в России объясняются низким качеством диагностики. Несмотря на возрастающие темпы внедрения в клиническую практику современных методов диагностики, в последнее десятилетие число локализованных форм рака предстательной железы не только не ув.
Эпидемиология. Частота рака предстательной железы (РПЖ) неоднородна в разных странах. В США он занимает 2-е место среди злокачественных заболеваний у мужчин, составляет 18% от вновь выявленных опухолей и 10% от всех летальных исходов среди этих больных [Flanders W., 1984]. Выявлена э.
Клиническая картина аденомы простаты определяется тремя компонентами: симптомами нижних мочевых путей, увеличением предстательной железы и дисфункцией мочевого пузыря. Последняя может проявляться инфравезикальной обструкцией, нестабильностью или гипотонией (рис. 1). В клинической картине доброкачест.
К лечению пациентов приступают только тогда, когда патологические изменения достигают стадии клинических проявлений. Вопрос о показанности профилактической терапии сегодня остается открытым, а его целесообразность недоказанной. Если еще 10 лет назад реальной альтернативы операции при аденоме простат.
Наблюдение за больными в послеоперационном периоде является неотъемлемой частью процесса лечения онкоурологических больных. Это обусловлено в первую очередь тем, что у незначительной части больных после операции возникают ранние или отдаленные осложнения (стриктуры, недержание мочи, импотенция и.
Выбор методов лечения рака предстательной железы, последовательность их применения и прогноз зависят от ряда факторов, наиболее значимыми из которых являются стадия заболевания, уровень простатического специфического антигена, степень дифференцировки опухоли по Глисону, наличие периневральной инвази.

Если от рака умирают врачи, есть ли надежда у пациентов?
В социальных сетях 2020 год начался с прощального поста питерского онколога Андрея Павленко, который сам обнаружил у себя рак и в течение полутора лет – на странице в Фейсбуке, в многочисленных интервью, выступлениях на телевидении – рассказывал о своей борьбе с недугом.


Рассказывает заместитель директора НМИЦ онкологии им. Блохина Александр Петровский:
О временах и сроках
– Если говорить обобщённо, то, по статистике, 50% онкологических пациентов излечиваются полностью. При этом прогноз на ожидаемую продолжительность жизни в каждом конкретном случае зависит от вида рака, поскольку общего ответа на этот вопрос не существует. Рак – это не одна болезнь, а множество различных заболеваний. Есть прогностически благоприятные виды рака, при которых даже на продвинутой стадии, при наличии отдалённых метастазов, пациенты имеют высокий шанс либо на выздоровление, либо на переход болезни в хроническую форму. Но есть и такие разновидности болезни, от которых пациенты быстро сгорают, даже если рак был обнаружен на начальной стадии.
Однако каждый год ситуация меняется. Ещё 5 лет назад рак лёгкого считался приговором. Сегодня появились лекарства, благодаря которым люди живут с этим диагнозом достаточно долго.
Что касается таких распространённых видов рака, как рак молочной железы, колоректальный рак, рак яичников, лимфомы и т. д., то с ними пациенты могут жить 10–15 лет и более.

– Врачи говорят, что рак важно обнаружить на ранней стадии. Но при этом в начале заболевания симптомов нет. Как быстро развивается недуг и переходит из одной стадии в другую?
– Есть агрессивные, быстрорастущие опухоли. К ним, например, относятся некоторые виды рака у детей. Но в среднем от появления раковой клетки в организме до формирования клинически значимой опухоли (размером около 1 см) проходит 5–7, иногда 10 лет. Понятно, что шансы обнаружить болезнь на ранней стадии при регулярных осмотрах есть – и они достаточно велики.
Семейная история
– К группе риска относятся люди, у близких родственников которых был выявлен рак?
Поэтому свою семейную историю нужно знать и ни в коем случае не игнорировать. При определённых видах генетической предрасположенности у врачей есть возможность провести превентивные профилактические процедуры, в том числе и хирургические, которые снизят риск появления рака.

– Для молодых рак действительно опаснее, чем для пожилых?
– В целом да. Рак желудка, рак молочной железы, диагностируемые в молодом возрасте, часто очень агрессивны и опасны. Однако детский рак мы сегодня вылечиваем полностью в 80% случаев.
– Врачи часто говорят о том, что многое зависит от индивидуальных характеристик опухоли и её чувствительности к назначаемым препаратам, но при этом назначают лечение по стандартам, одинаковым для всех.
– Стандарты – это экономическое обоснование лечения, а само лечение назначается по клиническим рекомендациям. Практика показывает, что, несмотря на то что каждая опухоль индивидуальна, 80% всех онкологических заболеваний можно описать стандартными подходами. В эти стандартные подходы входит определение индивидуальной чувствительности опухоли к тем или иным противоопухолевым лекарственным препаратам с помощью иммуногистохимических и молекулярно-генетических методов. В остальных случаях всегда есть возможность перейти на индивидуальное лечение – для этого врачу достаточно собрать врачебную комиссию.

Революция отменяется?
– Может ли пациент проверить, правильно ли его лечит врач?
– Все клинические рекомендации есть в открытом доступе, и пациент может их найти, вникнуть и попытаться в них разобраться. Однако без медицинского образования сделать это сложно. Это всё равно что пытаться проконтролировать мастера, который ремонтирует сломанный холодильник. Лучше довериться профессионалу, а система должна делать всё для того, чтобы это доверие было оправданно.
– Каждый день СМИ сообщают о новых случаях заболеваний – в том числе и у известных людей. Заболеваемость раком действительно выросла?
– Выросла как заболеваемость, так и выявляемость онкологических заболеваний. И нужно быть готовым к тому, что пациентов с раком с каждым годом будет всё больше. Сегодня в нашей стране от сердечно-сосудистых заболеваний умирают 50% пациентов, от онкологических – 15%, а в Японии онкологическая заболеваемость уже вышла на первое место, поскольку рак – это болезнь пожилых людей, а продолжительность жизни там одна из самых высоких в мире.
Хорошая новость заключается в том, что выросла не только заболеваемость, но и эффективность лечения. Продолжительность жизни онкологических пациентов постоянно растёт, в том числе и у тех, у кого болезнь была обнаружена уже на продвинутой стадии.

– Ожидается ли появление новых прорывных технологий в лечении рака, сопоставимых с иммунотерапией?
– Не стоит ждать и возлагать все надежды на появление революционных методов и недооценивать возможности проверенных лекарств и технологий. С врачебной точки зрения эволюция – развитие имеющегося метода – лучше, чем революция, которая чаще приносит больше разрушений, чем побед. Уже сегодня у онкологов есть всё необходимое, чтобы помочь большей части пациентов. Дальнейшие исследования в области онкологии необходимы, и они проводятся во всём мире. Онкология – это одна из самых динамично развивающихся отраслей медицины. Только за последний год было зарегистрировано более 50 новых препаратов и показаний для лечения различных видов опухолей. Задача человека – просто прийти к врачу, и желательно сделать это как можно раньше.

Если от рака умирают врачи, есть ли надежда у пациентов?
В социальных сетях 2020 год начался с прощального поста питерского онколога Андрея Павленко, который сам обнаружил у себя рак и в течение полутора лет – на странице в Фейсбуке, в многочисленных интервью, выступлениях на телевидении – рассказывал о своей борьбе с недугом.


Рассказывает заместитель директора НМИЦ онкологии им. Блохина Александр Петровский:
О временах и сроках
– Если говорить обобщённо, то, по статистике, 50% онкологических пациентов излечиваются полностью. При этом прогноз на ожидаемую продолжительность жизни в каждом конкретном случае зависит от вида рака, поскольку общего ответа на этот вопрос не существует. Рак – это не одна болезнь, а множество различных заболеваний. Есть прогностически благоприятные виды рака, при которых даже на продвинутой стадии, при наличии отдалённых метастазов, пациенты имеют высокий шанс либо на выздоровление, либо на переход болезни в хроническую форму. Но есть и такие разновидности болезни, от которых пациенты быстро сгорают, даже если рак был обнаружен на начальной стадии.
Однако каждый год ситуация меняется. Ещё 5 лет назад рак лёгкого считался приговором. Сегодня появились лекарства, благодаря которым люди живут с этим диагнозом достаточно долго.
Что касается таких распространённых видов рака, как рак молочной железы, колоректальный рак, рак яичников, лимфомы и т. д., то с ними пациенты могут жить 10–15 лет и более.

– Врачи говорят, что рак важно обнаружить на ранней стадии. Но при этом в начале заболевания симптомов нет. Как быстро развивается недуг и переходит из одной стадии в другую?
– Есть агрессивные, быстрорастущие опухоли. К ним, например, относятся некоторые виды рака у детей. Но в среднем от появления раковой клетки в организме до формирования клинически значимой опухоли (размером около 1 см) проходит 5–7, иногда 10 лет. Понятно, что шансы обнаружить болезнь на ранней стадии при регулярных осмотрах есть – и они достаточно велики.
Семейная история
– К группе риска относятся люди, у близких родственников которых был выявлен рак?
Поэтому свою семейную историю нужно знать и ни в коем случае не игнорировать. При определённых видах генетической предрасположенности у врачей есть возможность провести превентивные профилактические процедуры, в том числе и хирургические, которые снизят риск появления рака.

– Для молодых рак действительно опаснее, чем для пожилых?
– В целом да. Рак желудка, рак молочной железы, диагностируемые в молодом возрасте, часто очень агрессивны и опасны. Однако детский рак мы сегодня вылечиваем полностью в 80% случаев.
– Врачи часто говорят о том, что многое зависит от индивидуальных характеристик опухоли и её чувствительности к назначаемым препаратам, но при этом назначают лечение по стандартам, одинаковым для всех.
– Стандарты – это экономическое обоснование лечения, а само лечение назначается по клиническим рекомендациям. Практика показывает, что, несмотря на то что каждая опухоль индивидуальна, 80% всех онкологических заболеваний можно описать стандартными подходами. В эти стандартные подходы входит определение индивидуальной чувствительности опухоли к тем или иным противоопухолевым лекарственным препаратам с помощью иммуногистохимических и молекулярно-генетических методов. В остальных случаях всегда есть возможность перейти на индивидуальное лечение – для этого врачу достаточно собрать врачебную комиссию.

Революция отменяется?
– Может ли пациент проверить, правильно ли его лечит врач?
– Все клинические рекомендации есть в открытом доступе, и пациент может их найти, вникнуть и попытаться в них разобраться. Однако без медицинского образования сделать это сложно. Это всё равно что пытаться проконтролировать мастера, который ремонтирует сломанный холодильник. Лучше довериться профессионалу, а система должна делать всё для того, чтобы это доверие было оправданно.
– Каждый день СМИ сообщают о новых случаях заболеваний – в том числе и у известных людей. Заболеваемость раком действительно выросла?
– Выросла как заболеваемость, так и выявляемость онкологических заболеваний. И нужно быть готовым к тому, что пациентов с раком с каждым годом будет всё больше. Сегодня в нашей стране от сердечно-сосудистых заболеваний умирают 50% пациентов, от онкологических – 15%, а в Японии онкологическая заболеваемость уже вышла на первое место, поскольку рак – это болезнь пожилых людей, а продолжительность жизни там одна из самых высоких в мире.
Хорошая новость заключается в том, что выросла не только заболеваемость, но и эффективность лечения. Продолжительность жизни онкологических пациентов постоянно растёт, в том числе и у тех, у кого болезнь была обнаружена уже на продвинутой стадии.

– Ожидается ли появление новых прорывных технологий в лечении рака, сопоставимых с иммунотерапией?
– Не стоит ждать и возлагать все надежды на появление революционных методов и недооценивать возможности проверенных лекарств и технологий. С врачебной точки зрения эволюция – развитие имеющегося метода – лучше, чем революция, которая чаще приносит больше разрушений, чем побед. Уже сегодня у онкологов есть всё необходимое, чтобы помочь большей части пациентов. Дальнейшие исследования в области онкологии необходимы, и они проводятся во всём мире. Онкология – это одна из самых динамично развивающихся отраслей медицины. Только за последний год было зарегистрировано более 50 новых препаратов и показаний для лечения различных видов опухолей. Задача человека – просто прийти к врачу, и желательно сделать это как можно раньше.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Введение. Стандартная биопсия предстательной железы (ПЖ) с последующей гистологической верификацией в настоящее время является неотъемлемой частью диагностики рака ПЖ (РПЖ), однако число ложноотрицательных результатов и случаев недооценки степени агрессивности опухоли остается чрезмерно высоким. Активное и массовое внедрение в клиническую практику мультипараметрической магнитно- резонансной томографии (мпМРТ) в сочетании с использованием гибридной технологии, такой как МРТ/УЗИ fusion-биопсия, может существенно повысить выявляемость опухолей среднего и высокого риска.
Материалы и методы. В рамках настоящей работы были обследованы 33 пациента с подозрением на РПЖ. Всем пациентам выполнена прицельная МРТ/УЗИ fusion-биопсия и стандартная биопсия ПЖ.
Результаты. РПЖ был выявлен у 69,7 % больных. Сравнительные результаты гистологического материала, полученного при выполнении прицельной и стандартной биопсии ПЖ, показали выявляемость клинически значимого рака (сумма баллов по шкале Глисона ≥7), равную 86,7 и 66,7 % соответственно. Результаты прицельной биопсии статистически достоверно (коэффициент корреляции 0,8; p
аспирант кафедры лучевой диагностики
Россия, 125993 Москва, ул. Баррикадная, 2/1, стр. 1
Россия, 125993 Москва, ул. Баррикадная, 2/1, стр. 1
Россия, 115478 Москва, Каширское шоссе, 23
1. Scattoni V., Maccagnano C., Capitanio U. et al. Random biopsy: when, how many and where to take the cores? World J Urol 2014;32(4):859–69. DOI: 10.1007/s00345-014-1335-0. PMID: 24908067.
2. Presti J. C. Prostate biopsy: how many cores are enough? Urol Oncol 2003;21(2):135–40. PMID: 12856642.
3. Bjurlin M. A., Wysock J. S., Taneja S. S. Optimization of prostate biopsy: review of technique and complications. Urol Clin North Am 2014;41(2):299–313. DOI: 10.1016/j.ucl.2014.01.011. PMID: 24725491.
4. Djavan B., Milani S., Remzi M. Prostate biopsy: who, how and when. An update. Can J Urol 2005;12(Suppl 1):44–8. PMID: 15780165.
5. Rodríguez-Covarrubias F., González-Ramírez A., Aguilar-Davidov B. et al. Extended sampling at first biopsy improves cancer detection rate: results of a prospective, randomized trial comparing 12 versus 18-core prostate biopsy. J Urol 2011;185(6):2132–6. DOI: 10.1016/j.juro.2011.02.010. PMID: 21496851.
6. Ploussard G., Nicolaiew N., Marchand C. et al. Prospective evaluation of an extended 21- core biopsy scheme as initial prostate cancer diagnostic strategy. Eur Urol 2014;65(1):154–61. DOI: 10.1016/j.eururo.2012.05.049. PMID: 22698576.
7. Weiner A. B., Patel S. G., Etzioni R. et al. National trends in the management of low and intermediate risk prostate cancer in the United States. J Urol 2015;193(1):95–102. DOI: 10.1016/j.juro.2014.07.111. PMID: 25106900.
8. Pokorny M. R., De Rooij M., Duncan E. et al. Prospective study of diagnostic accuracy comparing prostate cancer detection by transrectal ultrasound-guided biopsy versus magnetic resonance (MR) imaging with subsequent MR-guided biopsy in men without previous prostate biopsies. Eur Urol 2014;66(1):22–9. DOI: 10.1016/j.eururo.2014.03.002. PMID: 24666839.
9. Sonn G. A., Chang E., Natarajan S. et al. Value of targeted prostate biopsy using magnetic resonance-ultrasound fusion in men with prior negative biopsy and elevated prostate- specific antigen. Eur Urol 2014;65(4):809–15. DOI: 10.1016/j.eururo.2013.03.025. PMID: 23523537.
10. Weinreb J. C., Barentsz J. O., Choyke P. L. et al. PI-RADS prostate imaging – reporting and data system: 2015, version 2. Eur Urol 2016;69(1):16–40. DOI: 10.1016/j.eururo.2015.08.052. PMID: 26427566.
11. Barentsz J. O., Richenberg J., Clements R. et al. ESUR prostate MR guidelines 2012. Eur Radiol 2012;22(4):746–57. DOI: 10.1007/s00330-011-2377-y. PMID: 22322308.
12. Somford D. M., Hamoen E. H., Fütterer J. J. et al. The predictive value of endorectal 3 Tesla multiparametric magnetic resonance imaging for extraprostatic extension in patients with low, intermediate and high risk prostate cancer. J Urol 2013;190(5): 1728–34. DOI: 10.1016/j.juro.2013.05.021. PMID: 23680307.
13. Delongchamps N. B., Zerbib M. Role of magnetic resonance imaging before initial biopsy: comparison of magnetic resonance imaging-targeted and systematic biopsy for significant prostate cancer detection. Eur Urol 2012;61(3):622–3. DOI: 10.1016/j.eururo.2011.12.038. PMID: 22289974.
14. Hoeks C. M., Schouten M. G., Bomers J. G. et al. Three-tesla magnetic resonance-guided prostate biopsy in men with increased prostate-specific antigen and repeated, negative, random, systematic, transrectal ultrasound biopsies: detection of clinically significant prostate cancers. Eur Urol 2012;62(5):902–9. DOI: 10.1016/j.eururo.2012.01.047. PMID: 22325447.
15. Rosenkrantz A. B., Verma S., Choyke P. et al. Prostate magnetic resonance imaging and magnetic resonance imaging targeted biopsy in patients with a prior negative biopsy: a consensus statement by AUA and SAR. J Urol 2016;196(6):1613–8. DOI: 10.1016/j.juro.2016.06.079. PMID: 27320841.
16. Cash H., Maxeiner A., Stephan C. et al. The detection of significant prostate cancer is correlated with the Prostate Imaging Reporting and Data System (PI-RADS) in MRI/transrectal ultrasound fusion biopsy. World J Urol 2016;34(4): 525–32. DOI: 10.1007/s00345-015-1671-8. PMID: 26293117.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
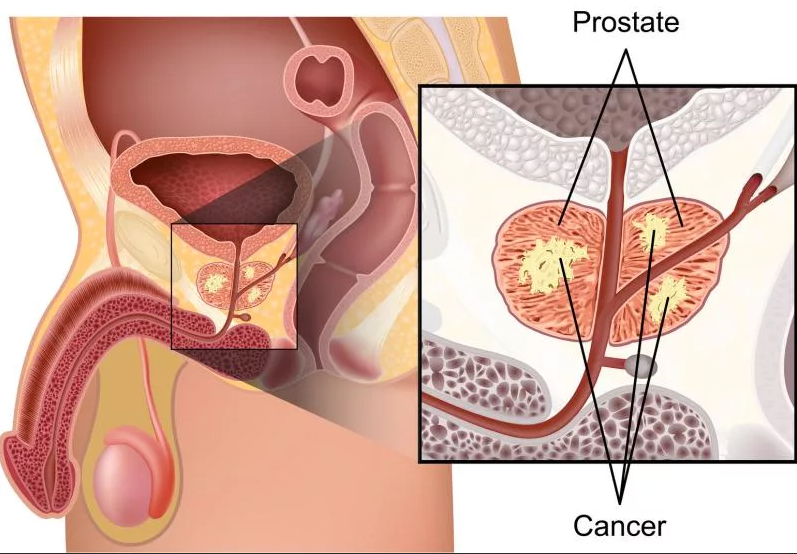
Рак предстательной железы, или простаты (карцинома, аденокарцинома) является одной из самых распространенных онкологических болезней у мужчин. Обычно рак предстательной железы развивается медленно и первоначально ограничивается предстательной железой – на этом этапе опухоль может не вызывать серьезных симптомов. Тогда как некоторые виды карциномы простаты растут медленно и могут нуждаться в минимальном лечении, или даже вовсе не требовать лечения, другие виды отличаются агрессивным ростом и могут быстро распространяться за пределы железы, а также метастазировать в другие органы и ткани. Чем раньше обнаружена аденокарцинома простаты, тем больше шансов на успешное лечение.
На ранних стадиях карцинома предстательной железы может не вызывать никаких симптомов. Рак простаты больших размеров может вызывать следующие симптомы:
- Затрудненное мочеиспускание
- Ослабление струи мочи
- Кровь в моче или эякуляте
- Боли и дискомфорт в области малого таза
- Боли в костях,в особенности в области таза и позвоночника
- Эректильная дисфункция
Как диагностируется рак предстательной железы? Прежде всего, нужно иметь в виду, что диагностика опухолей предстательной железы включает в себя несколько аспектов: скрининг, лучевая диагностика, верификация и определение вида опухоли, оценка распространенности и метастазов, контроль лечения. Рассмотрим все эти моменты подробно.
Скрининг – это обследование внешне здоровых людей с целью выявления скрытой патологии. Вопрос о том, проводить ли скрининг рака простаты, является довольно спорным. Некоторые медицинские организации рекомендуют мужчинам начинать скрининг рака простаты в возрасте 50 лет или раньше, другие отрицают полезность скрининга или утверждают, что он провоцирует лечение слишком большого количества мужчин, а это лечение само по себе может вызывать осложнения. В любом случае, каждую конкретную ситуацию, преимущества и риски скрининга нужно обсуждать с урологом. Вместе вы можете решить, подходит ли вам скрининг рака простаты.
Какие есть методы скрининга рака простаты?
Пальцевое ректальное исследование. Хирург-уролог надевает перчатку и вводит смазанный палец в прямую кишку, чтобы исследовать железу, которая прилегает к прямой кишке. Если ваш врач обнаружит какие-либо отклонения в структуре, форме или размере железы, вам могут потребоваться дополнительные анализы.
Тест на простат-специфический антиген (ПСА, PSA). Кровь на анализ берется из вены и анализируется на наличие специального вещества – ПСА. Простат-специфический антиген естественным образом вырабатывается предстательной железой, и его небольшое количество всегда в норме присутствует в крови. Однако, если уровень ПСА выше нормального, это может указывать на инфекцию предстательной железы, воспаление, доброкачественную гиперплазию или рак. Таким образом, само по себе повышение ПСА не обязательно говорит о раке, но позволяет не пропустить его на ранее стадии.
Если пальцевое исследование или ПСА выявляет отклонения от нормы, назначаются дополнительные обследования, в частности, методы визуализации. Визуализация – это создание изображений того или иного органа, на которых можно увидеть опухоль. В широкую практику вошли такие методы, как УЗИ и МРТ простаты.
УЗИ простаты. Чаще всего применяется трансректальное ультразвуковое исследование – ТРУЗИ. В прямую кишку вводится небольшой датчик толщиной в палец. Он преобразует звуковые волны в изображения, которые отображают патологические изменения в железе. ТРУЗИ позволяет довольно точно выявить рак простаты, однако визуализация мелких опухолей с помощью этого метода может быть затруднена.
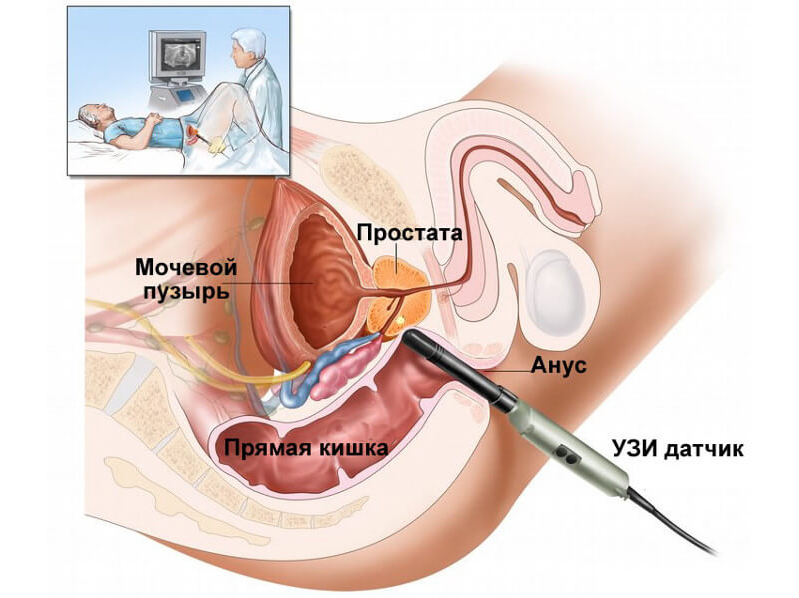
УЗИ предстательной железы тонким трансректальным датчиком.
МРТ предстательной железы. В настоящее время магнитно-резонансная томография простаты применяется все чаще. Это исследование, выполненное на высокопольном томографе с соблюдением нужных стандартов, позволяет не только выявить опухоль на ранних стадиях, но и определить ее размер, расположение и распространенность, а также указать урологу наиболее подходящее место для биопсии. Способность МРТ диагностировать карциному предстательной железы лучше, чем у УЗИ. При этом нужно знать, что МРТ выявляет опухоли размером не менее 5 мм, диагностика более мелких опухолей является недостоверной. В настоящее время мало сделать МРТ простаты на хорошем аппарате – необходима оценка результатов исследования по шкале PI-RADS.
- Стандартизация параметров сканирования. В описании методики указывается, какие режимы сканирования нужно применить для лучшего выявления опухоли
- Упрощение и стандартизация терминологии. Вводится стандартизированный язык, стиль заключений, который одинаково хорошо воспринимается врачами разных специальностей – как урологами, так и рентгенологами
- Разделение пациентов на группы риска. Всего выделено 5 категорий изменений по PI-RADS, по степени возрастания вероятности наличия клинически значимого рака. Таким образом, МРТ может указать, у кого вероятность опухоли минимальная, у кого средняя, а у кого опухоль, скорее всего, есть.
- Снижение числа ненужных биопсий. Раньше урологи часто шли на биопсию у любого пациента с высоким уровнем ПСА. Сейчас, если по МРТ выставлена категория PI-RADS 1 или PI-RADS 2, биопсия не рекомендуется, так как вероятность рака минимальная. Это позволило уменьшить количество инвазивных процедур, и следовательно, сделать диагностику менее болезненной
- Облегчение прицельной биопсии. МРТ может определить расположение опухоли (в заключении по МРТ указывается тот или иной сегмент железы), и благодаря этому уролог знает, в какой точке выполнить биопсию
- Что такое PI-RADS 1? Очень низкий риск; рак практически достоверно отсутствует. Если рентгенолог по результатам МРТ выставляет категорию PI-RADS 1, даже при высоком ПСА можно быть уверенным в том, что опухоли нет, и никаких действий по дальнейшему выявлению опухоли не требуется.
- Что такое PI-RADS 2? Низкий риск; рак, скорее всего, отсутствует. Если в заключении МРТ указано PI-RADS 2, полной уверенности в отсутствии рака нет, хотя вероятность его мала. Биопсия в таких случаях не требуется. Как правило, такие пациенты оставляются под наблюдение уролога, главное при этом – контроль уровня ПСА.
- Что такое PI-RADS 3? Промежуточный риск; возможно наличие рака. В этих случаях вопрос о том, делать биопсию или нет, остается на решение уролога. Имеют значение другие показатели – уровень ПСА, результаты УЗИ, клинические симптомы.
- Что такое PI-RADS 4? Высокий риск; рак, скорее всего, присутствует. По результатам МРТ нет полной уверенности в том, что перед нами рак, хотя вероятность его велика. Обязательно нужно делать биопсию для подтверждения и определения агрессивности опухоли.
- Что такое PI-RADS 5? Крайне высокий риск; рак практически достоверно присутствует. Также необходимо делать биопсию для подтверждения.
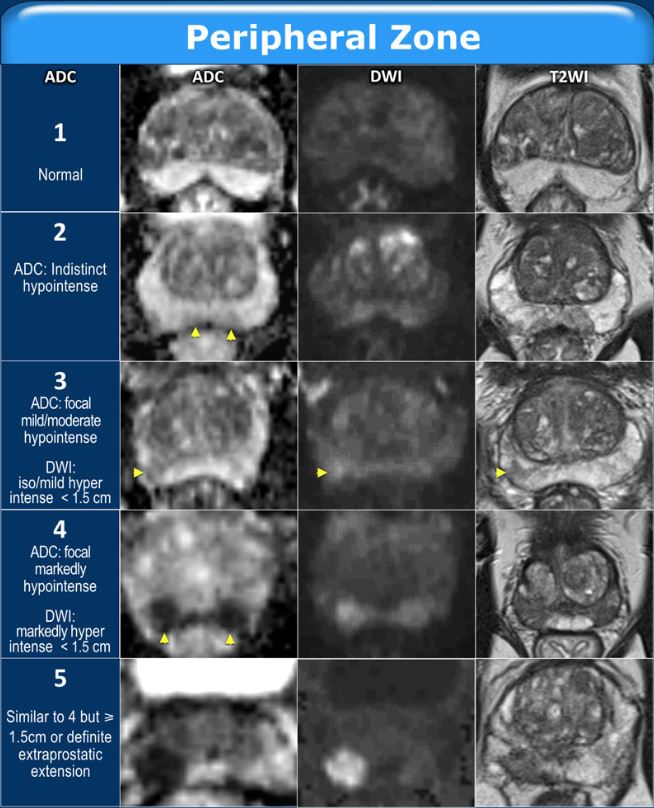
К сожалению, в России распространена ситуация, когда МРТ сделана на хорошей аппаратуре, но врач не сделал описание предстательной железы по PI-RADS. В результате уролог может получить неполную или противоречивую информацию, и алгоритм его дальнейших действий может стать непонятным. В таких случаях не обязательно переделывать исследование другом месте — можно получить экспертную оценку имеющихся снимков МРТ простаты, заказать описание по PI-RADS у рентгенолога, специализирующегося на болезнях простаты. Такую услугу можно получить через сервис Национальной телерадиологической сети, где подобраны высококлассные специалисты по МРТ.
Клинический диагноз рака простаты не ставится без морфологической верификации – гистологического исследования образца ткани. Биопсия простаты – несложная процедура. С помощью иглы делается пункция (прокол) в нескольких местах, затем образцы тканей (столбики) поступают к патоморфологу, который делает заключение о наличии или отсутствии злокачественной опухоли, а также определяет степень ее злокачественности. Более высокая степень указывает на более агрессивную карциному, который с большей вероятностью быстро распространяется. Наиболее распространенная шкала, используемая для оценки агрессивности раковых клеток, называется оценкой Глисона. Оценка по Глисону объединяет два числа и может варьироваться от 2 (неагрессивный рак) до 10 (очень агрессивный рак).
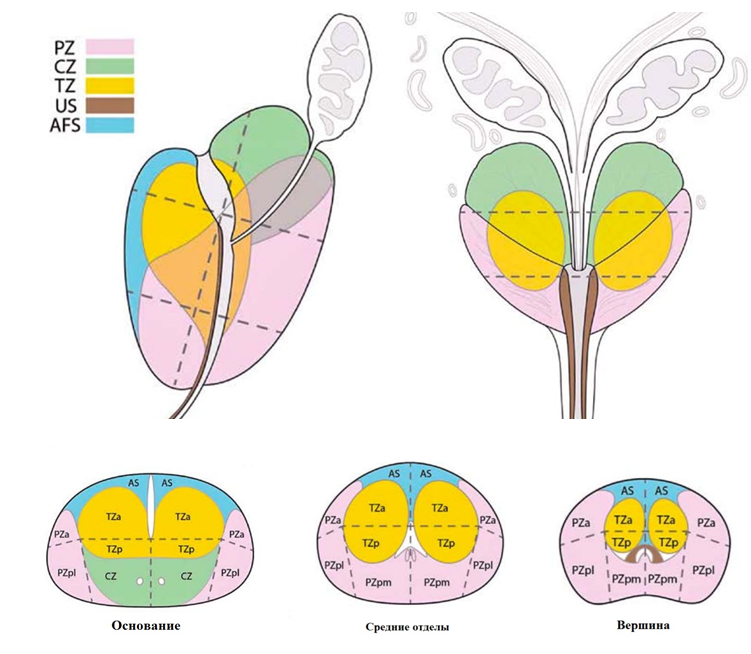
Анатомия предстательной железы. Пораженные опухолью сегменты железы указываются в описании МРТ по PI—RADS.
Как только диагноз рака простаты установлен, необходимо установить стадию рака. Если ваш врач подозревает, что опухоль может распространиться за пределы вашей простаты, применяются следующие исследования:
- Компьютерная томография (КТ) брюшной полости и легких
- Магнитно-резонансная томография (МРТ) малого таза
- Биопсия лимфатических узлов
- Сцинтиграфия скелета
- Позитронно-эмиссионная томография (ПЭТ) всего тела
Все шаги по диагностике и лечению рака предстательной железы необходимо делать только по согласованию с вашим урологом — в этом залог успешного лечения.
Читайте также:

