Что за плюс с хлором
Хлор, можно сказать, уже постоянный спутник нашей повседневной жизни. Редко в каком доме не будет бытовых средств, основанных на обеззараживающем действии данного элемента. Но вместе с тем он очень опасен для человека! Хлор может проникнуть в организм через слизистую оболочку дыхательной системы, пищеварительных путей, кожные покровы. Отравиться им можно и дома, и на отдыхе - во многих бассейнах, аквапарках он является основным средством водоочистки. Влияние хлора на организм человека резко негативное, он может стать причиной серьезных дисфункций и даже смерти. Поэтому каждому нужно быть в курсе симптоматики отравления, методов оказания первой помощи.
Хлор - что это за вещество
Хлор - газообразный элемент желтоватого цвета. Обладает резким специфичным запахом - хлорки (хлорной извести). В газообразном виде, а также в химических формах, что подразумевают его активное состояние, опасен, токсичен для человека.
Хлор в 2,5 раз тяжелее воздуха, поэтому при утечке будет стелиться по оврагам, пространствам первых этажей, по полу помещения. При вдыхании его у пострадавшего может развиться одна из форм отравления. Об этом поговорим далее.
Симптомы отравления
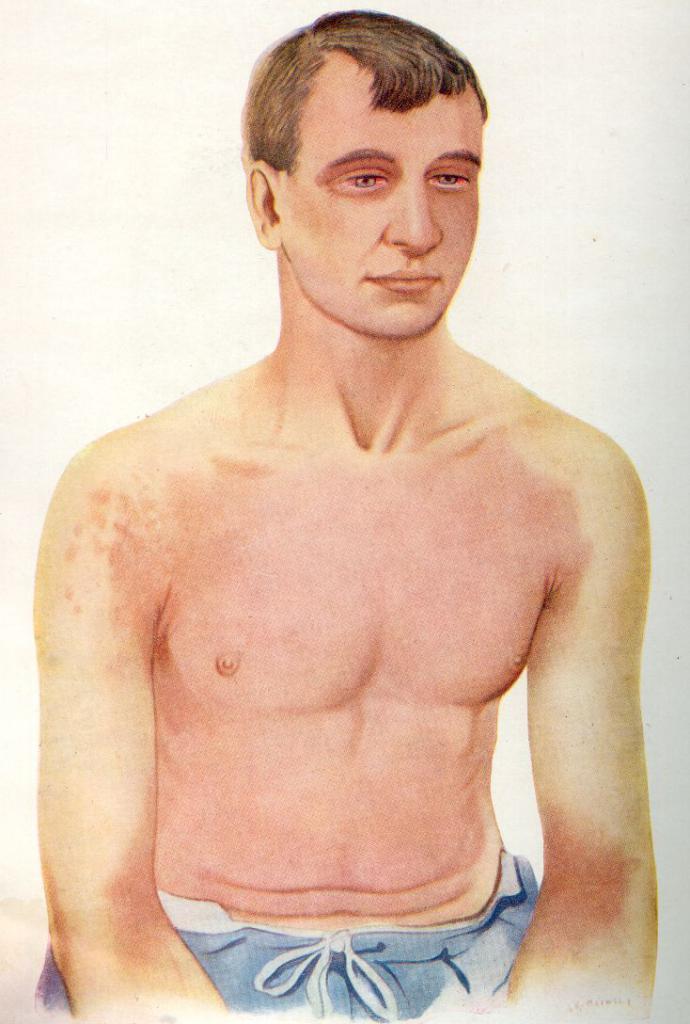
Как длительное вдыхание паров, так и иное воздействие вещества очень опасно. Так как оно активно, то влияние хлора на организм человека проявляется быстро. Токсичный элемент в большей степени поражает глаза, слизистые и кожные покровы.
Отравление может быть как острым, так и хроническим. Однако в любом случае при несвоевременном оказании помощи грозит летальный исход!
Симптоматика при отравлении парами хлора может быть разной - в зависимости от специфики случая, длительности воздействия и прочих факторов. Для удобства мы разграничили признаки в таблице.
| Степень отравления | Симптоматика |
| Легкая. Самая безопасная - проходит самостоятельно, в среднем, за три дня. | Раздражение, покраснение слизистых оболочек, кожных покровов. |
| Средняя. Требуется медицинская помощь и комплексное лечение! | Нарушение сердечного ритма, удушье, боли в области грудной клетки, нехватка воздуха, обильное слезотечение, сухой кашель, чувство жжения на слизистых оболочках. Самый опасный симптом-последствие - отек легких. |
| Тяжелая. Нужны реанимационные меры - летальный исход может наступить через 5-30 минут! | Головокружение, жажда, судороги, потеря сознания. |
| Молниеносная. К сожалению, в большинстве случаев помощь бывает бесполезна - смерть наступает практически мгновенно | Судороги, вздутие вен на лице и на шее, нарушение дыхания, остановка биения сердца. |
| Хроническая. Следствие частой работы с веществом, которое содержит хлор. | Кашель, судороги, хронические заболевания дыхательной системы, частые головные боли, депрессия, апатия, нередки случаи потери сознания. |
Таково влияние хлора на организм человека. Поговорим о том, где можно отравиться его ядовитыми парами и как оказать первую помощь в этом случае.
Отравление на работе
Газ хлор применяют во многих отраслях промышленности. Вы вполне можете получить хроническую форму отравления, если работаете на следующих производствах:
- Химическая промышленность.
- Текстильная фабрика.
- Фармацевтическая индустрия.
Отравление на отдыхе

Хотя многие и знают о влиянии хлора на организм человека (разумеется, в больших объемах), не во всех саунах, бассейнах, развлекательных водных комплексах строго следят за использованием такого бюджетного обеззараживающего средства. А ведь его дозировку очень легко случайно превысить. Отсюда хлорное отравление посетителей, которое случается в наше время достаточно часто.
Как заметить, что в ваш визит доза элемента в воде бассейна превышена? Очень просто - вы почувствуете сильный специфический запах вещества.
- кашель;
- рвота;
- тошнота;
- в редких случаях возникает воспаление легких.
Отравление дома

- Отбеливатели.
- Препараты, предназначенные для борьбы с плесенью.
- Таблетки, моющие жидкости, в составе которых есть данный элемент.
- Порошки, растворы для общей дезинфекции помещения.
Последствия воздействия хлора на организм

Постоянное воздействие даже малых доз хлора (агрегатное состояние может быть любым) на человеческий организм грозит для людей следующим:
- Фарингит.
- Ларингит.
- Бронхит (в острой либо хронической форме).
- Различные заболевания кожных покровов.
- Гайморит.
- Пневмосклероз.
- Трахеит.
- Ухудшение зрения.
Если вы заметили у себя один из недугов, перечисленных выше, при условии, что постоянно или однократно (случаи посещения бассейна сюда тоже относится) подвергались влиянию паров хлора, то это повод для скорейшего обращения к специалисту! Доктор назначит комплексную диагностику для изучения природы заболевания. Изучив ее результаты, затем он назначит лечение.
Первая помощь при отравлении

Хлор – газ, вдыхать который очень опасно, особенно в больших объемах! При средней, тяжелой форме отравления пострадавшему нужно немедленно оказать первую помощь:
- В каком бы ни был состоянии человек, не паникуйте. Вам следует первым делом взять себя в руки, а затем успокоить и его.
- Выведите пострадавшего на свежий воздух или же в проветриваемое помещение, где нет хлорных паров.
- Как можно быстрее вызовите скорую помощь.
- Позаботьтесь, чтобы человек был в тепле и комфорте - накройте его пледом, одеялом или простыней.
- Проследите, чтобы он легко и свободно дышал - снимите тесную одежду, украшения с шеи.
Медикаментозная помощь при отравлении
До приезда бригады скорой медпомощи можно самостоятельно помочь потерпевшему, используя ряд бытовых и медикаментозных препаратов:
Профилактика

Зная, насколько опасен хлор, какое вещество оказывает действие на организм человека, лучше всего заранее позаботиться о снижении или исключении его негативного влияния на свой организм. Добиться этого можно следующими способами:
- Соблюдение санитарных норм на рабочем месте.
- Регулярное прохождение медицинских осмотров.
- Использование средств защиты при работе с хлорсодержащими препаратами дома или на работе - тот же респиратор, плотные защитные резиновые перчатки.
- Соблюдение предписаний техники безопасности при работе с веществом в промышленной среде.
Работа с хлором всегда требует осторожности как в промышленных масштабах, так и в бытовых. Вы знаете, как диагностировать у себя признаки отравления веществом. Помощь же пострадавшему нужно оказывать незамедлительно!
В 1774 году Карл Шееле, химик из Швеции, впервые получил хлор, но считалось, что это не отдельный элемент, а разновидность соляной кислоты (calorizator). Элементарный хлор был получен в начале XIX века Г. Дэви, который разложил поваренную соль на хлор и натрий путём электролиза.
Хлор (от греческого χλωρός – зелёный) является элементом XVII группы периодической таблицы химических элементов Д.И. Менделеева, имеет атомный номер 17 и атомную массу 35,452. Принятое обозначение Cl ( от латинского Chlorum).

Хлор является самым распространённым в земной коре галогеном, чаще всего в виде двух изотопов. В силу химической активности встречается лишь в виде соединений многих минералов.
Хлор является ядовитым жёлто-зелёным газом, имеет резкий неприятный запах и сладковатый вкус. Именно хлор после его открытия предложили называть галогеном, в одноимённую группу он входит как один из самых химически активных неметаллов.
В норме взрослый здоровый человек должен получать в сутки 4-6 г хлора, потребность в нём возрастает при активных физических нагрузках или жаркой погоде (при повышенном потоотделении). Обычно суточную норму организм получает из продуктов питания при сбалансированном рационе.
Основным поставщиком хлора в организм является поваренная соль – особенно, если она не подвергается термической обработке, поэтому лучше солить уже готовые блюда. Также хлор содержат яйца, морепродукты, мясо, горох, фасоль и чечевица, гречка и рис, оливки.

Кислотно-щелочной и водный баланс организма регулируется калием, натрием и хлором.
Нехватка хлора вызвана процессами, приводящими к обезвоживанию организма – сильное потоотделение в жару или при физических нагрузках, рвота, диарея и некоторые заболевания моче-выделительной системы. Признаками недостатка хлора являются вялость и сонливость, слабость в мышцах, явная сухость во рту, потеря вкусовых ощущений, отсутствие аппетита.
Признаками избытка хлора в организме являются: повышение кровяного давления, сухой кашель, боль в голове и в груди, резь в глазах, слезотечение, расстройства деятельности желудочно-кишечного тракта. Как правило, переизбыток хлора может быть вызван употреблением обычной воды из-под крана, которая проходит процесс дезинфекции хлором и случается у работников тех отраслей промышленности, которые напрямую связаны с использованием хлора.
Хлор в организме человека:
- регулирует водный и кислотно-щелочной баланс,
- выводит жидкость и соли из организма в процессе осморегуляции,
- стимулирует нормальное пищеварение,
- нормализует состояние эритроцитов,
- очищает печень от жира.

Основное применение хлора – химическая промышленность, где с его помощью изготавливают поливинилхлорид, пенопласт, материалы для упаковки, также боевые отравляющие вещества и удобрения для растений. Обеззараживание питьевой воды хлором – практически единственный доступный способ очистки воды.
Хлор в чистом виде впервые выделил шведский ученый Карл Шееле в 1774 году. Своё нынешнее название элемент получил в 1811 году, когда Г.Дэви предложил название "хлорин", которое вскоре было сокращено до "хлор" с легкой руки Ж. Гей-Люссака. Немецкий ученый Иоганн Швейгер предложил для хлора название "галоген", но этим термином было решено назвать всю группу элементов, в которую входит и хлор.
Хлор является самым распространенным галогеном в земной коре - на долю хлора приходится 0,025% всей массы атомов земной коры. По причине своей высокой активности хлор не встречается в природе в свободном виде, а только в составе соединений, при этом хлору "по барабану" с каким элементом вступать в реакцию, современной науке известны соединения хлора практически со всей таблицей Менделеева.
Основная масса хлора на Земле содержится в соленой воде Мирового океана (содержание 19 г/л). Из минералов больше всего хлора содержится в галите, сильвине, сильвините, бишофите, карналлите, каините.
Хлор играет важную роль в деятельности нервных клеток, а также в регуляции осмотических процессов, происходящих в организме человека и животных. Также хлор входит в состав зеленого вещества растений - хлорофилла.
Природный хлор состоит из смеси двух изотопов:
- 35 Cl - 75,5%
- 37 Cl - 24,5%
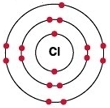
Рис. Строение атома хлора.
Электронная конфигурация атома хлора - 1s 2 2s 2 2p 6 3s 2 3p 5 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 5 электронов, находящихся на внешнем 3p-уровне + 2 электрона 3s уровня (всего 7 электронов), поэтому в соединениях хлор может принимать степени окисления от +7 до -1. Как уже было сказано выше, хлор является химически активным галогеном.
Физические свойства хлора:
- при н.у. хлор является ядовитым газом желто-зеленого цвета с резким запахом;
- хлор в 2,5 раза тяжелее воздуха;
- при н.у. в 1 л воды растворяется 2,5 объема хлора - этот раствор называется хлорная вода.
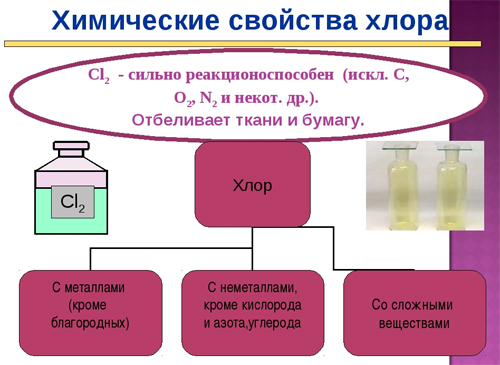
Химические свойства хлора
Взаимодействие хлора с простыми веществами (Cl выступает в роли сильного окислителя):
- с водородом (реакция протекает только при наличии света):
- с металлами с образованием хлоридов:
- с неметаллами, менее электроотрицательными, чем хлор:
- с азотом и кислородом хлор не реагирует непосредственно.
Взаимодействие хлора со сложными веществами:
Одной из самых известных реакций хлора со сложными веществами есть взаимодействие хлора с водой - кто живет в большом городе, наверняка, периодически сталкивается с ситуацией, когда, открыв кран с водой, ощущает стойкий запах хлора, после чего многие сетуют, дескать, опять воду хлорировали. Хлорирование воды является одним из основных способов ее обеззараживания от нежелательных микроорганизмов, небезопасных для здоровья человека. Почему так происходит? Разберем реакцию хлора с водой, которая протекает в два этапа:
- На первом этапе происходит образование двух кислот: соляной и хлорноватистой:
- На втором этапе хлорноватистая кислота разлагается с выделением атомарного кислорода, который окисляет воду (убивая микроорганизмы) + подвергает отбеливающему действию ткани, окрашенные органическими красителями, если их опустить в хлорную воду:
С кислотами хлор не взаимодействует.
Взаимодействие хлора с основаниями:
- на холоде:
- при нагревании:
- с бромидами металлов:
- с йодидами металлов:
- с фторидами металлов хлор не реагирует, по причине их более высокой окислительной способности, нежели у хлора.
Хлор "охотно" вступает в реакции с органическими веществами:
В результате первой реакции с метаном, которая протекает на свету, образуется хлористый метил и соляная кислота. В результате второй реакции с бензолом, которая протекает в присутствии катализатора (AlCl3), образуется хлорбензол и соляная кислота.
Получение и применение хлора
Промышленным способом хлор получают электролизом водного раствора (хлор выделяется на аноде; на катоде - водород) или расплава хлорида натрия (хлор выделяется на аноде; на катоде - натрий):
В лаборатории хлор получают действием концентрированной HCl на различные окислители при нагревании. В роли окислителей могут выступать оксид марганца, перманганат калия, бертолетова соль:
Применение хлора:
- отбеливание тканей и бумаги;
- обеззараживание воды;
- производство пластмасс;
- производство хлорной извести, хлороформа, ядохимикатов, моющих средств, каучуков;
- синтез хлороводорода в производстве соляной кислоты.
Если вам понравился сайт, будем благодарны за его популяризацию :) Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Хлор — элемент 3-го периода и VII А-группы Периодической системы, порядковый номер 17. Электронная формула атома [10Ne ]3s 2 Зр 5 , характерные степени окисления 0, -1, + 1, +5 и +7. Наиболее устойчиво состояние Cl -1 . Шкала степеней окисления хлора:
+ 1 – Cl2O , ClO — , HClO , NaClO , Ca(ClO)2
— 1 – Cl — , HCl, KCl , PCl5
Хлор обладает высокой электроотрицательностью (2,83), проявляет неметаллические свойства. Входит в состав многих веществ — оксидов, кислот, солей, бинарных соединений.
В природе — двенадцатый по химической распространенности элемент (пятый среди неметаллов). Встречается только в химически связанном виде. Третий по содержанию элемент в природных водах (после О и Н), особенно много хлора в морской воде (до 2 % по массе). Жизненно важный элемент для всех организмов.
Хлор С12 . Простое вещество. Желто-зеленый газ с резким удушливым запахом. Молекула Сl2 неполярна, содержит σ-связь С1-С1. Термически устойчив, негорюч на воздухе; смесь с водородом взрывается на свету (водород сгорает в хлоре):
Хорошо растворим в воде, подвергается в ней дисмутации на 50 % и полностью — в щелочном растворе:
Хлор очень сильный окислитель по отношению к металлам и неметаллам:
Сl2 + РЬ→PbCl2 (300 °С)
Реакции с соединениями других галогенов:
Качественная реакция — взаимодействие недостатка СL2 с КI (см. выше) и обнаружение йода по синему окрашиванию после добавления раствора крахмала.
Получение хлора в промышленности:
2NаСl (расплав)→ 2Nа + Сl2 (электролиз)
2NaCl+ 2Н2O→Н2↑ + Сl2↑ + 2NаОН (электролиз)
и в лаборатории:
(аналогично с участием других окислителей; подробнее см. реакции для НСl и NaСl).
Хлор относится к продуктам основного химического производства, используется для получения брома и йода, хлоридов и кислородсодержащих производных, для отбеливания бумаги, как дезинфицирующее средство для питьевой воды. Ядовит.
Качественная реакция на ион Сl — — образование белых осадков АgСl и Нg2Сl2, которые не переводятся в раствор действием разбавленной азотной кислоты.
Хлороводород служит сырьем в производстве хлоридов, хлорорганических продуктов, используется (в виде раствора) при травлении металлов, разложении минералов и руд. Уравнения важнейших реакций:
Получение НСl в промышленности — сжигание Н2 в Сl2 (см.), в лаборатории — вытеснение из хлоридов серной кислотой:
Хлорид натрия NaСl. Бескислородная соль. Бытовое название поваренная соль. Белый, слабогигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, растворимость мало зависит от температуры, раствор имеет характерный соленый вкус. Гидролизу не подвергается. Слабый восстановитель. Вступает в реакции ионного обмена. Подвергается электролизу в расплаве и растворе.
Применяется для получения водорода, натрия и хлора, соды, едкого натра и хлороводорода, как компонент охлаждающих смесей, пищевой продукт и консервирующее средство.
В природе — основная часть залежей каменной соли, или галита, и сильвинита (вместе с КСl),рапы соляных озер, минеральных примесей морской воды (содержание NaСl=2,7%). В промышленности получают выпариванием природных рассолов.
Уравнения важнейших реакций:
NaCl(ж)→2Na+Cl2↑ (850°С, электролиз )
2NаСl + 2Н2O→Н2↑ + Сl2↑ + 2NаОН (электролиз )
2NаСl(р,20%)→ Сl2↑+ 2Nа(Нg) “амальгама”(электролиз ,на Hg-катоде)
Хлорид калия КСl. Бескислородная соль. Белый, негигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, раствор имеет горький вкус, гидролиза нет. Вступает в реакции ионного обмена. Применяется как калийное удобрение, для получения К, КОН и Сl2. В природе основная составная часть (наравне с NаСl) залежей сильвинита.
Уравнения важнейших реакций одинаковы с таковыми для NаСl.
Уравнения важнейших реакций:
СаСl2(ж) → Са + Сl2 ↑(электролиз ,800°С)
Качественная реакция на ион Аl 3+ — образование осадка АlРO4, который переводится в раствор концентрированной серной кислотой.
Применяется как сырье в производстве алюминия, катализатор в органическом синтезе и при крекинге нефти, переносчик хлора в органических реакциях. Уравнения важнейших реакций:
АlСl3 . 6Н2O →АlСl(ОН)2 (100-200°С, —HCl,H2O)→Аl2O3(250-450°С, -HCl,H2O)
2АlСl3→2Аl + 3Сl2↑(электролиз,800 °С ,в расплаве NаСl)
Получение АlСl в промышленности — хлорирование каолина, глинозёма или боксита в присутствии кокса:
Хлорид железа(II) FеСl2. Бескислородная соль. Белый (гидрат голубовато-зеленый), гигроскопичный. Плавится и кипит без разложения. При сильном нагревании летуч в потоке НСl. Связи Fе — Сl преимущественно ковалентные, пар состоит из мономеров FеСl2 (линейное строение, sр-гибридизация) и димеров Fе2Сl4. Чувствителен к кислороду воздуха (темнеет). Хорошо растворим в воде (с сильным экзо-эффектом), полностью диссоциирует на ионы, слабо гидролизуется по катиону. При кипячении раствора разлагается. Реагирует с кислотами, щелочами, гидратом аммиака. Типичный восстановитель. Вступает в реакции ионного обмена и комплексообразования.
Применяется для синтеза FеСl и Fе2О3, как катализатор в органическом синтезе, компонент лекарственных средств против анемии.
Уравнения важнейших реакций:
FеСl2 (конц.) + Н2O=FеСl(ОН)↓ + НСl↑ (кипячение)
FеСl2 + 2NаОН (разб.) = Fе(ОН)2↓+ 2NaСl (в атм. N2)
FеСl2 + Н2 = 2НСl + Fе (особо чистое,выше 500 °С)
5Fе 2+ + 8Н + + МnО — 4 = 5Fе 3+ + Мn 2+ + 4Н2O
6Fе 2+ + 14Н + + Сr2O7 2- = 6Fе 3+ + 2Сr 3+ +7Н2O
Fе 2+ + S 2- (разб.) = FеS↓
FеСl2 →Fе↓ + Сl2↑ (90°С, в разб. НСl, электролиз)
Получение: взаимодействие Fе с соляной кислотой:
(в промышленности используют хлороводород и ведут процесс при 500 °С).
Хлорид железа(III) FеСl3. Бескислородная соль. Черно-коричневый (темно-красный в проходящем свете, зеленый в отраженном), гидрат темно-желтый. При плавлении переходит в красную жидкость. Весьма летуч, при сильном нагревании разлагается. Связи Fе — Сl преимущественно ковалентные. Пар состоит из мономеров FеСl3 (треугольное строение, sр 2 -гибридизация, преобладают выше 750 °С) и димеров Fе2Сl6 (точнее, Сl2FеСl2FеСl2, строение — два тетраэдра с общим ребром, sр 3 -гибридизация, преобладают при 316-750 °С). Кристаллогидрат FеСl . 6Н2O имеет строение [Fе(Н2O)4Сl2]Сl • 2Н2O. Хорошо растворим в воде, раствор окрашен в желтый цвет; сильно гидролизован по катиону. Разлагается в горячей воде, реагирует со щелочами. Слабый окислитель и восстановитель.
Применяется как хлорагент, катализатор в органическом синтезе, протрава при крашении тканей, коагулянт при очистке питьевой воды, травитель медных пластин в гальванопластике, компонент кровоостанавливающих препаратов.
Уравнения важнейших реакций:
FеСl3 + 3NaОН (разб.) = FеО(ОН)↓ + Н2O + 3NаСl (50 °С)
Хлорид аммония NН4Сl. Бескислородная соль, техническое название нашатырь. Белый, летучий, термически неустойчивый. Хорошо растворим в воде (с заметным эндо-эффектом, Q = -16 кДж), гидролизуется по катиону. Разлагается щелочами при кипячении раствора, переводит в раствор магний и гидроксид магния. Вступает в реакцию кон мутации с нитратами.
Качественная реакция на ион NН4 + — выделение NН3 при кипячении со щелочами или при нагревании с гашёной известью.
Применяется в неорганическом синтезе, в частности для создания слабокислотной среды, как компонент азотных удобрений, сухих гальванических элементов, при пайке медных и лужении стальных изделий.
Уравнения важнейших реакций:
Получение: взаимодействие NH3 с НСl в газовой фазе или NН3 Н2О с НСl в растворе.
Гипохлорит кальция Са(СlО)2. Соль хлорноватистой кислоты НСlO. Белый, при нагревании разлагается без плавления. Хорошо растворим в холодной воде (образуется бесцветный раствор), гидролизуется по аниону. Реакционноспособный, полностью разлагается горячей водой, кислотами. Сильный окислитель. При стоянии раствор поглощает углекислый газ из воздуха. Является активной составной частью хлорной (белильной) извести — смеси неопределенного состава с СаСl2 и Са(ОН)2. Уравнения важнейших реакций:
Хлорат калия КСlO3. Соль хлорноватой кислоты НСlO3, наиболее известная соль кислородсодержащих кислот хлора. Техническое название — бертоллетова соль (по имени ее первооткрывателя К.-Л. Бертолле, 1786). Белый, плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (образуется бесцветный раствор), гидролиза нет. Разлагается концентрированными кислотами. Сильный окислитель при сплавлении.
Применяется как компонент взрывчатых и пиротехнических смесей, головок спичек, в лаборатории — твердый источник кислорода.
Уравнения важнейших реакций:
4КСlO3 = ЗКСlO4 + КСl (400 °С)
2КСlO3 = 2КСl + 3O2 (150-300 °С, кат. МпO2)
(диоксид хлора на свету взрывается: 2СlO2(Г) = Сl2 + 2O2)
2КСlO3 + Е2(изб.) = 2КЕO3 + Сl2↑ (в разб. НNO3, Е = Вr, I)
Получение КСlO3в промышленности — электролиз горячего раствора КСl (продукт КСlO3 выделяется на аноде):
Бромид калия КВr. Бескислородная соль. Белый, негигроскопичный, плавится без разложения. Хорошо растворим в воде, гидролиза нет. Восстановитель (более слабый, чем
Качественная реакция на ион Вr — вытеснение брома из раствора КВr хлором и экстракция брома в органический растворитель, например ССl4 (в результате водный слой обесцвечивается, органический слой окрашивается в бурый цвет).
Применяется как компонент травителей при гравировке по металлам, составная часть фотоэмульсий, лекарственное средство.
Уравнения важнейших реакций:
5Вr — + 6Н + + ВrО3 — = 3Вr 2 + 3Н2O
КВr + 3Н2O→3Н2↑ + КВrО3 (60-80 °С, электролиз)
Иодид калия КI. Бескислородная соль. Белый, негигроскопичный. При хранении на свету желтеет. Хорошо растворим в воде, гидролиза нет. Типичный восстановитель. Водный раствор КI хорошо растворяет I2 за счет комплексообразования.
Качественная реакция на ион I — вытеснение иода из раствора КI недостатком хлора и экстракция иода в органический растворитель, например ССl4 (в результате водный слой обесцвечивается, органический слой окрашивается в фиолетовый цвет).
Уравнения важнейших реакций:
10I — + 16Н + + 2МnO4 — = 5I2↓ + 2Мn 2+ + 8Н2O
I — + Аg + = АgI (желт.)↓
Хлор занимает 17 позицию в таблице Менделеева. Хлор имеет очень резкий запах, сравнимый с тем, как пахнет сероводород. В природе хлор встречается только как часть соединения. Хлор водорастворимый, на свету жидкий элемент при взаимодействии с водородом, высвобождаемым при повышении окружающей температуры, начинает дымиться. Смесь инициирует взрыв, как результат может образоваться газ фосген.
Применение хлора и его характеристика
Хлор широко используется в промышленности:
- хлор применяется для обеззараживания воды в бассейнах, водопроводе;
- хлор применяется для отбеливания разных материалов;
- хлор используется в металлургии;
- при производстве пластмасс, каучука;
- для получения клея, растворителей;
- на химическом производстве при изготовлении бертолетовой и других солей, извести, инсектицидов, средств бытовой химии.
Элемент – часть поваренной соли, необходимой для поддержания электролитного баланса, коррекции уровня артериального давления.
Организм человека содержит элемент – 0,25%, это часть желудочного сока, ион, необходимый при формировании артериального давления. У профессиональных пловцов показатель повышен. Поскольку они длительное время находятся в бассейне с обеззараженной водой, элемент проникает в кровоток.
Газ – часть вещества хлорацетофенон, основы слезоточивого газа. Хлор применялся раньше как средство индивидуальной защиты для бытовых нужд. Полицейские пускали газ для разгона демонстрантов. Теперь ввиду опасности и последствий состав вытесняется другими.
Хлорциан – газ, впервые был применён во время Первой мировой войны как боевое отравляющее вещество. Он характеризуется тем, что не сорбируется шихтой угольного противогаза, т. е. даже стандартные меры предосторожности не спасают от летального исхода.
Основные причины отравления хлором
Хлор попадает в организм разными путями. Отравиться можно, даже не работая на химическом или другом производстве, где находит применение элемент.
Отравление парами хлора может происходить по следующим причинам:
- избыточное содержание газа в бассейне или водопроводной воде;
- стирка и отбеливание тканей в помещении без вентиляции, с плотно закрытыми дверями;
- при нарушении правил транспортировки газа, повреждении контейнеров, баллонов, аварии;
- из-за аварии на производстве.
Образование паров хлора с характерным запахом возможно, если бытовые средства дезинфекции применять совместно или использовать на нагретых поверхностях. Отравление хлоркой и дезинфицирующими средствами возможно при случайном проглатывании или вскрытии ёмкости с раствором. Это частая причина отравлений хлором у детей.
Посещение бассейна опасно, если выбрана неправильная пропорция хлорсодержащего раствора или не соблюдено время настаивания. Если вода, которая обрабатывается хлором, не очищена, то при взаимодействии образуются хлорорганические соединения, обладающие канцерогенным эффектом.
Поступление яда возможно несколькими путями: через лёгкие, ЖКТ, кожу. Попадание элемента любым способом вызывает на поверхности химические ожоги.
Механизм поражения дыхательных путей сложный. Пары вещества блокируют антиоксидантную защиту организма и активируют свободные радикалы. Это нарушает работу гормональной системы, эндокринных желез, снижает защиту от вирусов и бактерий.
При вдыхании чувствительная слизистая получает повреждение, пары поражают бронхи и альвеолы, вызывая удушье. Внутри пузырьков лёгких находится жидкость. Хлор легко проникает внутрь тканевого секрета, накопление продуктов обмена дыхательной системы вызывает выброс антигистамина, брадикинина, гепарина (факторов аллергической реакции), моментально вызывая спазм бронхов и лёгких.
Под действием хлора происходит некроз дыхательных путей, то есть омертвение тканей, нарушается работа ворсинок бронхов, выводящих наружу слизь. Постепенно нарастает отёк лёгких, дыхательные пути закрываются.
Если хлор попадает на кожу, то при взаимодействии с водой образуется хлорноватистая и хлористоводородная кислоты. Они разносятся с кровью, вызывая спазм сосудов.
Симптомы отравления хлором
Признаки отравления хлором появляются быстро после контакта с газом, различают несколько степеней отравления хлором. Они зависит от времени и объёма воздействия.
Первые признаки отравления хлором:
- жжение слизистых оболочек;
- першение в горле, затруднение дыхания;
- горечь во рту;
- головная боль;
- дискомфорт за грудиной;
- слабость, головокружение.
Поскольку механизм действия хлора нам знаком, то понятно, откуда появляются симптомы отравления хлором. Резкий запах хлора вызывает раздражение слизистой оболочки, слезотечение и покраснение глаз.
Нарушение метаболизма в тканях вызывает недостаток кислорода, из-за чего появляется головная боль, тошнота, головокружение, дискомфорт в груди. Под кожей могут образовываться мелкие кровоизлияния, имеющие форсу точек или полосок. Деструктивные процессы дыхательной системы провоцируют нарушение её функции.
Отравление хлором может быть острым и хроническим. Острое отравление хлором может протекать в 4 формах.
Виды и формы клинического течения
Острое отравление хлором отличается резким возникновением симптомов отравления, быстрым разворачиванием клинической картины. Отличие от хронического отравления – однократное поступление значимой дозы. Во втором случае люди, чья деятельность связана с хлором, постоянно получают малое количество вещества.
Острое отравление хлором может протекать в нескольких формах:
- лёгкая;
- средняя;
- тяжёлая;
- молниеносная.
Характеристика лёгкой формы отравления хлором: симптомы выражены слабо, лечение не требуется. Беспокоит лёгкое першение во рту и горле, резь в глазах.
Средняя степень отравления хлором требует оказания помощи, характеризуется лающим сухим кашлем, который сложно остановить. Появляется удушье, слезотечение и боль в груди. На этом этапе отравления хлором уже выявляется ожог слизистой оболочки гортани. Через несколько часов развивается отёк лёгких. Проявляются признаки нарушения нервной деятельности: человек становится заторможенным или возбуждённым.
При тяжёлой степени отравления хлором больной не может выдохнуть, появляется цианоз кожи. Человек теряет сознание, впадает в кому, перестаёт реагировать на разговор, прикосновение, болевые раздражители. Затем происходит остановка дыхания, но быстро возобновляется, становясь поверхностным. Полноценного поступления кислорода не происходит, от гипоксии человек умирает через 5–15 минут.
Если в условиях происшествия нет возможности сразу обеспечить врачебный уход, то доврачебная помощь должна быть оказана сразу.
Хроническое отравление хлором чревато развитием ряда заболеваний:
- хронический рецидивирующий бронхит;
- туберкулёз лёгких;
- трахеит и трахеобронхит;
- эмфизема;
- сердечно-лёгочная недостаточность;
- бронхопневмония;
- дерматит;
- бронхоэктатическая болезнь.
Экстренная помощь при отравлении хлором
Сразу после установления факта отравления хлором как можно быстрее нужно организовать помощь:
Санитарно-гигиенические мероприятия подразумевают ограничение опасной зоны в радиусе 200 м, организация оказания помощи с подветренной стороны. Необходимо предупредить всех, что запрещено спускаться в подвалы и отлогие и низкие места.
В рамках неотложной помощи проводятся мероприятия:
- обезболивание слизистой оболочки глаз раствором новокаина или дикаина;
- назначение мази с антибиотиком для профилактики инфекции;
- парентеральное введение преднизолона или гидрокортизона.
Антибактериальную мазь можно заменить раствором альбуцида, борной кислоты или сульфата цинка.
Оказание своевременной неотложной медицинской помощи остановит усугубление состояния больного. Независимо от первых признаков интоксикации, все поражённые должны быть доставлены в стационар.
Лечение при отравлении хлором
Терапия отравления хлором – краткосрочные и долгосрочные мероприятия, позволяющие вывести из организма газ и справиться с последствиями его поступления.
Первое действие – обеспечение проходимости дыхательных путей. Для этого может понадобиться интубация трахеи.
Лечебные мероприятия должны быть направлены:
- на устранение спазма дыхательных путей;
- стабилизацию щелочного обмена;
- профилактику вторичной инфекции;
- борьбу с отёком лёгких.
Некоторое время пострадавшие должны находиться в положении сидя или полусидя. Нужно продолжать ингаляции с содой или минеральной водой, пить молоко с содой. Ингалятор можно заправлять сальбутамолом и другими бронхолитиками.
Одна из проблем больного с отравлением – гипоксия, поэтому противоядие в случае хлора – ингаляция кислорода, подкожное применение атропина, морфина. Препараты расслабляют гладкую мускулатуру, снимают спазм бронхов и сосудов и голосовой щели. Кислород позволяет поддержать состояние организма, обеспечивая вентиляцию в тканях и клетках, снизить гиперфункцию дыхательной и сердечно-сосудистой системы.
Введение унитиола, который применяется при отравлении солями тяжёлых металлов, в этом случае не поможет улучшить состояние человека.
Терапия подразумевает назначение следующих средств:
- обезболивающих;
- кортикостероидных;
- витаминов;
- отхаркивающих;
- бронхолитических (хлористый кальций 10% или эуфиллин 2,4%);
- антибиотиков.
Важная часть терапии – увлажнение дыхательных путей, удаление лишней жидкости.
Как определить наличие хлора в организме
Диагностировать отравление хлором можно по результатам рентгенологических, лабораторных, функциональных исследований. Установить отравление хлором несложно по клиническим проявлениям. Чтобы удостовериться, сводят воедино результаты исследований.
На рентгеновском снимке лёгких видно, что корни лёгких увеличены, края размыты, сосудистый рисунок усилен. По отдельным частям доли лёгкого видны мелкие тёмные очаги. Это признаки начинающегося отёка лёгких. Если состояние больного стабилизируется, то признаки отравления хлором исчезают уже через 6–8 часов.
Когда отёк уже развился, на снимке прозрачность ткани ухудшается, тёмные очаги сливаются между собой. Терминальное состояние характеризуется тем, что верхушку сердца различить практически невозможно, но периферические отделы лёгкого могут быть светлые и чистые.
Контроль гипоксии производится путём измерения сатурации. Если насыщение крови кислородом меньше 70%, назначают оксигенотерапию.
Биохимический анализ крови позволяет выявить концентрацию различных элементов в крови. Исследование покажет, сколько хлорида циркулирует по биологической жидкости.
Профилактика при отравлении хлором
Чтобы не отравится хлором, нужно знать несколько вещей про хлор:
- при выборе бытовой химии лучше отказаться от хлорсодержащих средств;
- раствор должен находиться так высоко, чтобы ребёнок не мог до него дотянуться;
- работать с хлорсодержащими составами с использованием мер предосторожности;
- помещение должно хорошо вентилироваться;
- не злоупотреблять посещением бассейна;
- не пренебрегать техникой безопасности;
- обрабатывать водопроводную жидкость: кипятить, фильтровать.
Профилактика отравления хлором — обращение к врачу при первых признаках ухудшения здоровья.
Читайте также:

