Что такое с 16 рак желудка
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
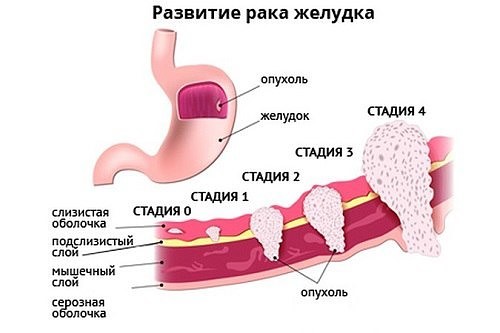
Стадии рака желудка не просто ранжирование болезни по распространению в организме, предусматривающее определённую тактику лечения, это даже больше чем прогноз на будущее. Стадия изменяет всю жизнь больного и его семьи, определяя новую модель жизни.
Между тем, обнаруженный на раннем этапе развития рак — хроническое заболевание, дающее человеку десятилетия жизни. Каждому второму пережившему лечение раннего рака желудка пациенту предстоит умереть от сердечно-сосудистого заболевания без каких-либо признаков злокачественного процесса.
Рак желудка 1 стадия
Первая стадия — это ранний рак, когда опухоль не нарушила границы слизистой оболочки, но по протяжённости может быть несколько сантиметров, главное — раковые клетки не распространились в глубину желудочной стенки.
Возможны варианты распространения:
Операция позволяет практически 95% пациентов жить дальше без каких-либо опасений и, что важно, в большинстве случаев нет необходимости в послеоперационной профилактической химиотерапии.
Рак желудка 2 стадия
Российская онкологическая статистика больных I и II стадий учитывает вместе, и по факту это каждый третий вновь выявленный пациент. Только при второй стадии пятилетку благополучно проживает всего 75% больных, а не более 90% как при первой.
На этом этапе заболевания большинству пациентов выполняется большая, но не обширная операция — резекция в разных модификациях, то есть удаление части органа вместе с лимфатическими узлами, кому-то потребуется полное удаление — гастрэктомия.

- при T4a возможно только N0;
- при Т1 допускается N2 и N3;
- при Т2 только N1 или N2;
- при Т3 исключительно N0 или N1.
Стадия злокачественного процесса не просто цифра для статистики, правильно установленная степень распространения гарантирует выбор оптимальной программы лечения заболевания. Правильно стадировать новообразование позволяет качественное обследование, невозможное без профессионального подхода и личного опыта специалиста.
Рак желудка 3 стадия
У каждого четвёртого пациента заболевание обнаруживают на третьей стадии, когда не во всех случаях на первом этапе возможна операция, потому что опухоль большая и поражённых метастазами лимфоузлов может быть больше 16.
Для третьей стадии характерно ранжирование по трём вариантам:
- прорастающий наружу через серозную оболочку органа процесс, но без вовлечения соседних органов, с единичным или множественным поражением лимфатического коллектора — подтип А;
- опухоль распространяется на соседние структуры и пораженных лимфоузлов не более двух, либо раковая инфильтрация в границах желудочной стенки и увеличенных лимфоузлов более трёх — подтип В;
- выходящее за пределы желудочной стенки с метастазами в большое число лимфоузлов новообразование — подтип С.
Возможность выполнения операции зависит от вовлеченности в раковый конгломерат соседних органов и сосудисто-нервных пучков. Для большинства пациентов программа лечения расширяется на химиотерапию, как до операции, так и после. Если хирургия невозможна из-за слишком большого распространения в брюшной полости, прибегают к лучевой терапии на фоне циклов ХТ.
Рак желудка 4 стадии
Четвёртая всегда означает, что есть метастазы в другие органы или по брюшине, а опухоль может быть любого размера и неважно количество поражённых злокачественными клетками лимфоузлов.
Вероятность обнаружения метастазов тем выше, чем агрессивнее процесс. Злокачественность низкодифференцированной аденокарциномы много выше, чем высокой или умеренной дифференцировки. Поэтому четвёртая стадия возможна при крошечном желудочном новообразовании низкой дифференцировки.
Симптомы рака желудка при разных стадиях
В России неразрешима проблема высокой смертности больных в течение года с момента выявления опухоли, сегодня меньше года живут почти 49% или каждый второй, а причина одна — несвоевременное обращение. Не приходят на обследование из-за того, что признаки болезни совсем не очевидны и нетипичны для злокачественного процесса.

Онкологический пациент, как правило, замечает то, что невозможно игнорировать и свидетельствует о метастатическом процессе:
- обнаруживает увеличение живота за счёт асцита, когда перестаёт сходится пояс на юбке или ремень на брюках;
- находит выпирающее из-под ложечки плотное образование;
- замечает потерю веса, потому что идеально сидевшая одежда становится слишком большой.
У многих азиатских народов карцинома желудка — наследственная болезнь, но только японцам удалось справиться со смертностью от карциномы, потому что рак выявляют исключительно ранним при регулярной, иногда и по два раза на год, гастроскопии. Гражданине Японии считают своевременное выполнение гастроскопии своей обязанностью.
Нет типичных симптомов рака желудка, но есть способ контроля за состоянием слизистой, небрежение обследованием — путь к распространённой стадии заболевания. Сделайте обследование и полгода можете спать спокойно.
- Стойко Ю. М., Вербицкий В. Г., Карачун А. М. Рак желудка: Учебное пособие. — СПб.: ВМедА, 2002. — 26 с.
- В. С. Савельев, Н. А. Кузнецов. Хирургические болезни. Том 1. М., 2006.
- М. И. Кузин, Н. М. Кузин, О. С. Шкроб и др.; под редакцией М. И. Кузина. Хирургические болезни. М.: Медицина, 2002. — 784 с.
- С. С. Харнас, В. В. Левкин, Г. Х. Мусаев. Рак желудка: клиника, диагностика, лечение. М., 2006.
Очень высокая заболеваемость раком желудка зарегистрирована в Японии, где она варьирует в пределах 80-90 (Ямагата: мужчины – 92, женщины – 39; Хиросима: мужчины – 86, женщины – 34). Высокие показатели регистрируются в Китае (Шанхай: мужчины – 32, женщины – 18). В странах Восточной Европы и Южной Америки заболеваемость раком желудка также высока. Самые низкие показатели фиксируются среди белого населения США (мужчины – 5, женщины – 2) и в некоторых западноевропейских странах. В России заболеваемость раком желудка достаточно высока (Санкт-Петербург: мужчины – 39, женщины - 18)
Самая высокая смертность от рака желудка зарегистрирована в Киргизии (мужчины – 47, женщины – 19), России (мужчины – 36, женщины – 15), Казахстане (мужчины – 32, женщины – 14) и Японии (мужчины – 31, женщины – 14). Смертность также велика в большинстве стран Восточной Европы. Самые низкие показатели смертности отмечены в США, Канаде, Новой Зеландии, а также в странах Западной и Северной Европы
Отмечено, что заболеваемость раком желудка снижается у мигрантов, перемещающихся в страны с более низким показателем заболеваемости. Наиболее характерным примером этого феномена является снижение заболеваемости раком желудка у японских и китайских переселенцев в США. Это подтверждает роль факторов образа жизни, в частности, питания в этиологии этого заболевания. В целом же в мире и в отдельных странах отмечается снижение заболеваемости и смертности от рака желудка. Стандартизованная по возрасту заболеваемость раком желудка в мире ежегодно снижается на 4–5%. Однако в ряде развитых стран растет заболеваемость раком кардиального отдела желудка
Средняя 5-летняя выживаемость больных раком желудка в Западной Европе составляет 18%, в США – 21%. Самый высокий показатель 5-летней выживаемости (53%) зафиксирован в Японии, и его можно объяснить проведением в этой стране массового скрининга. В целом 5-летняя выживаемость от рака желудка в мире колеблется в пределах 10-20%
Дескриптивные и аналитические эпидемиологические исследования последних лет свидетельствуют о доминирующей роли факторов образа жизни (и, в большей степени, питания) в этиологии рака желудка. Важным доказанным фактором риска рака является инфекция Helicobacter pylori. Показано также, что риск развития рака желудка повышает потребление крепких спиртных напитков. В ряде исследований выявлена связь между курением и раком желудка
Изучению роли питания в этиологии рака желудка посвящено большое, количество эпидемиологических исследований, как проспективных, так и ретроспективных, методом "случай-контроль". В подавляющем большинстве этих исследований показана обратная связь между потреблением овощей и фруктов, особенно зеленых и желтых овощей, и ОР рака желудка. Риск развития рака желудка был снижен у людей, часто употреблявших лук и чеснок. В исследовании методом "случай-контроль", проведенном в Москве, выявлено, что потребление свежих овощей и фруктов, в т.ч. картофеля, капусты, чеснока и лука, статистически достоверно снижает риск рака желудка. Кроме того, показано, что употребление растительного масла и черного хлеба связано со статистически достоверным снижением ОР рака желудка
Вопрос о влиянии микронутриентов на риск развития рака желудка изучался во многих эпидемиологических исследованиях, однако, к сожалению, ингибирующее влияние некоторых витаминов и минералов на процесс канцерогенеза в желудке еще не установлен. Результаты эпидемиологических исследований, в которых изучалась роль витамина А в профилактике рака желудка, оказались неутешительными. Ни в одном из них не было выявлено ожидаемого протективного эффекта высоких уровней, потребления витамина А на процесс канцерогенеза в желудке. Что же касается предшественников витамина А – каротиноидов, источником которых являются овощи и фрукты, в большинстве эпидемиологических исследований показано снижение ОР рака желудка до 0,3-0,6, связанное с потреблением бета-каротина и других каротиноидов. В эпидемиологических исследованиях, в которых у больных изучалось содержание бета-каротина в крови, выявлена отрицательная связь между его концентрацией и ОР рака желудка. Результаты интервенционных контролируемых исследований в США и Финляндии, в которых оценивалась эффективность приема бета-каротина для профилактики рака, не показали снижения ОР рака желудка в опытной группе. Однако в аналогичном исследовании, проведенном в Китае, в группе, получавшей бета-каротин, альфа-токоферол и селен, было отмечено снижение заболеваемости и смертности от рака желудка. Противоречивость результатов этих двух исследований можно объяснить тем, что у населения с достаточным уровнем потребления каротиноидов дополнительный его прием не оказывает антиканцерогенного влияния. В то же время у населения с недостаточным потреблением продуктов, богатых витамином А, дополнительный его прием способствует снижению риска развития рака желудка, а возможно, и других форм этого заболевания
Данные о протективном влиянии витамина С (аскорбиновой кислоты) на процесс канцерогенеза в желудке более убедительны. Во всех проспективных и ретроспективных исследованиях обнаружено достоверное, снижение риска развития рака желудка, связанное с высоким уровнем употребления витамина С с пищей. Высокая концентрация витамина С в крови ассоциируется со статистически достоверным снижением риска развития рака желудка
Повышает риск рака желудка избыточное потребление соли и соленой пищи. Имеет место выраженная и достоверная корреляция между различными показателями потребления соли и заболеваемостью раком желудка
Эпидемиологические исследования, проведенные во многих странах мира, в т.ч. и в России, подтвердили связь между частым потреблением соленых продуктов питания и риском развития рака желудка. Как известно, соль как таковая не является канцерогенной, однако она повреждает слизистую оболочку и приводит к развитию реактивного воспаления и реактивной регенерации, а соответственно и к пролиферации эпителия и повышению синтеза ДНК. Последнее увеличивает вероятность развития злокачественной опухоли, так как усиление репликации клеток снижает вероятность репарации ДНК. Кроме того, поврежденная слизистая оболочка становится более проницаемой для канцерогенных веществ
Данные о влиянии методов хранения пищи указывают, что риск развития рака желудка снижается с модернизацией методов хранения. Использование в пищевой промышленности низких температур для хранения продуктов питания, а также широкое распространение домашних холодильников снизили заболеваемость раком желудка. Многими исследованиями показано, что отсутствие холодильника в семье приводит к 2-3-кратному повышению риска рака желудка
В проведенном в Москве исследовании избыточное потребление колбас статистически достоверно повышало риск развития рака желудка
Результаты эпидемиологических исследований по изучению роли нитрозосоединений в этиологии рака желудка не дали окончательного ответа, на этот вопрос. В двух исследованиях высокие уровни потребления нитратов привели к снижению риска. Это можно объяснить тем, что основным источником нитратов являются овощи, а, как было указано выше, они обладают защитным эффектом. В двух исследованиях выявлено повышение риска, связанное с потреблением нитритов; в остальных работах не выявлено влияния нитратов и нитритов на риск развития рака желудка. Исследование, посвященное изучению роли концентрации нитратов в воде, не выявило корреляции между высоким содержанием этих соединений в воде и заболеваемостью раком желудка. Нет также данных, указывающих на высокий риск рака желудка у рабочих, занятых в производстве или использовании азотных удобрений
Потребление жареного мяса, в частности приготовленного на открытом огне, повышает риск развития рака желудка. Это было доказано в эпидемиологических исследованиях в Швеции, США и Корее. Канцерогенность мяса, жаренного на открытом огне, можно объяснить образованием на его поверхности гетероциклических аминов, канцерогенность и мутагенность которых показаны в экспериментальных системах. В исследовании, проведенном в Москве, было выявлено статистически достоверное повышение риска, связанное с высоким уровнем потребления мяса, а также молока и масла. Аналогичная зависимость была отмечена в Италии, где избыточное потребление мяса, масла и маргарина среди людей с семейным раком желудка, приводило к повышению риска этой болезни. В ряде исследований, проведенных в основном в Европе и Америке, выявлена положительная связь между избыточной калорийностью питания, потреблением животных белков и жиров и риском развития рака желудка. Кроме того, по данным нескольких исследований, повышение риска связано также с избыточным весом или ожирением. Необходимо подчеркнуть, что влияние высококалорийной диеты, избыточного веса, повышенного потребления животных продуктов на риск развития рака желудка более выражено для рака кардиального отдела. По нашим данным, ОР рака кардии, связанный с высоким уровнем потребления белков животного происхождения, составляет 7, животных жиров – 7, насыщенных жирных кислот – 8, в то время как ОР рака некардиального отдела желудка – 2; 2 и 3 для животных белков, жиров и насыщенных жирных кислот соответственно. Американские исследователи считают, что рост заболеваемости раком кардиального отдела желудка связан с увеличением числа людей с избыточной массой тела
В большинстве эпидемиологических исследований выявлено повышение риска развития рака желудка, связанное с курением сигарет. ОР возникновения рака желудка у курильщиков равен 1,3-1,5. Отмечена дозозависимая связь между количеством сигарет, выкуриваемых в день, длительностью (стажем) курения и риском развития рака желудка, причем, в отличие от бытующего мнения, курение повышает риск как кардиального, так и других отделов желудка. Рабочая группа МАИР (2002 г.) пришла к заключению, что курение приводит к развитию рака желудка
Потребление алкоголя увеличивает риск развития рака желудка. Влияние алкоголя на процесс канцерогенеза в желудке не ограничивается кардиальным отделом. В исследованиях методом "случай-контроль", проведенных в Польше и России, было выявлено статистически достоверное повышение ОР кардиального и некардиального отделов желудка у мужчин и женщин, потребляющих чрезмерное количество алкогольных напитков, особенно водки. Курение усиливает канцерогенное влияние алкоголя. Результат взаимодействия этих двух факторов на риск развития рака желудка аддитивный
С начала 90-х гг. XX в. опубликовано более 40 сероэпидемиологических исследований, в которых выявлена связь между титром антител к IgG Helicobacter pylori и риском развития рака желудка. Ассоциация наиболее выражена для рака дистального отдела желудка, при котором ОР, связанный с инфекцией Helicobacter pylori, повышен в 6 раз. К сожалению, не во всех этих исследованиях скорректированы такие известные факторы риска развития рака желудка, как низкий социально-экономический статус, питание, курение и т.д. Подсчитано, что причиной 60% всех случаев рака желудка в Европе является Helicobacter pylori
Раку желудка обычно предшествуют атрофический гастрит и кишечная метаплазия – состояния, которые развиваются в результате воспалительных изменений в слизистой оболочке желудка. Они, свою очередь, тесно связаны с инфицированностью Helicobacter pylori. В ряде исследований показано значительное (5 раз и выше) увеличение риска развития атрофического гастрита с кишечной метаплазией у людей, инфицированных Helicobacter pylori. Кроме того, имеются данные, указывающие на регрессию этого процесса после эрадикации Helicobacter pylori
Helicobacter pylori вызывает воспаление слизистой оболочки желудка, что влечет за собой увеличение синтеза простагландинов и гиперпролиферацию клеток и ингибирует апоптоз. Наиболее сильное повреждающее действие на слизистую оболочку желудка оказывают цитокинсодержащие линии Helicobacter pylori (СаА+). Инфицированность этим типом Helicobacter pylori, по-видимому, и играет ключевую роль в развитии рака желудка. Эта гипотеза требует подтверждения в серо-эпидемиологических исследованиях
Таким образом, роль Helicobacter pylori в этиологии рака желудка можно считать доказанной на основании эпидемиологических исследований, которые показали, что инфицированность Helicobacter pylori статистически достоверно, примерно в 2 раза, повышает риск развития рака желудка. Однако несомненно, что Helicobacter pylori – не единственная причина рака желудка. Во-первых, известно, что ОР развития злокачественных опухолей, связанный с воздействием инфекционных агентов, обычно значительно выше. Инфицированность вирусами гепатитов В и С, ВПЧ 16 и 18 типа в 20 и более раз повышает риск развития рака печени, шейки матки. Во-вторых, частота инфицированности Helicobacter pylori одинакова среди мужчин и женщин, в то время как раком желудка в 2 раза чаще болеют мужчины. Все вышесказанное подтверждает роль питания и других факторов образа жизни, таких как курение и потребление крепких спиртных напитков, в этиологии рака желудка. В одном эпидемиологическом исследовании рака желудка, проведенном в Москве, выявлено, что инфицированность Helicobacter pylori повышает риск развития рака желудка только у курящих, а курение повышает риск рака желудка только у Helicobacter pylori-положительных мужчин
Инфицированность Helicobacter pylori также, скорее всего, является причиной лимфомы желудка, которая развивается из лимфоидной ткани слизистой оболочки (mucosa associated lymphoid tissue – MALT). Эта достаточно редкая опухоль составляет не более 5% всех злокачественных опухолей желудка. Исследования показали, что более 90% больных MALT-лимфомой желудка Helicobacter pylori-позитивны и что инфицированность этой бактерией в более чем в 3 раза повышает риск развития MALT. Однако ввиду того, что в литературе опубликовано небольшое число наблюдений MALT, этиологическую роль Helicobacter pylori нельзя считать доказанной. Опубликованы результаты успешной антибиотикотерапии лимфом желудка, но по ряду методических причин, в первую очередь, отсутствия в этих исследованиях контрольной группы, не позволяет считать эффективной антибиотикотерапию при MALT доказанной.
Причина развития рака желудка полностью не ясна.
К возможным этиологическим факторам развития рака желудка относят:
- Характер питания и прием канцерогенных веществ.
- Избыточное потребление поваренной соли.
- Заброс желчи в желудок. Развитие кишечной метаплазии.
- Курение и злоупотребление алкогольными напитками.
- Хронический гастрит, ассоциированный с хеликобактериальной инфекцией. Атрофия и дисплазия, развивающиеся на фоне хронического гастрита, рассматриваются в качестве предраковых изменений. Хеликобактер способствует формированию рецепторов на клетках, чувствительных к воздействию различных канцерогенных веществ, усиливающих пролиферацию клеток, иногда по типу раковой. Язвенная болезнь не является предраковым заболеванием.
- Наличие аденоматозных полипов в желудке.
- Воздействие химических факторов на слизистую оболочку желудка.
- Воздействие физических факторов на организм человека – ионизирующее излучение.
- Повышенное содержание селена в почве.
- Наследственный фактор для рака желудка не достаточно изучен.
- Уровень жизни больного. У лиц с низким социально-экономическим уровнем жизни рак желудка встречается в 5 раз чаще, чем у лиц с благополучными условиями жизни. Ряд исследователей объясняет этот факт тем, что у лиц с низким социально-экономическим уровнем жизни часто имеет место распространение хеликобактериоза с раннего возраста.
- Патогенез рака желудка
Патогенез рака желудка не изучен.
На сегодняшний день известно, что рак желудка связан с мутациями генов 53, АРС, k-ras. Потеря гетерозиготности с большой частотой наблюдается на следующих участках хромосом: 17p(локус гена p53), 5q (локус гена АРС) и 18q (локус гена DDC). При раке желудка мутация гена k-ras встречается относительно редко. Как известно,последняя играет большую роль в поддержании опухолевого роста, а появление делеций генов-супрессоров опухолевого роста 17qи 18q происходит обычно на поздних стадиях и служит маркером малигнизации и метастазирования опухоли.
Понимание схемы кровоснабжения желудка помогает предугадать маршруты возможного гематогенного метастазирования. Желудок кровоснабжается чревной артерией. Левая желудочная артерия, ветвь чревной артерии, кровоснабжает верхнюю правую часть желудка. Общая печеночная артерия делится на правую желудочную артерию, снабжающую нижнюю часть желудка, и a. gastroepiploica, снабжающую нижнюю часть большой кривизны.
Зная особенности лимфооттока от желудка, можно предугадать пути возможного распространения метастазов по лимфатическим путям. Основной путь лимфооттока проходит через чревную ось. Малые пути лимфооттока проходят через область селезенки, наджелудочную группу узлов, врата печени и гастродуоденальную область.
Регионарные лимфатические узлы при раке желудка поражаются у 45—65% больных, даже при небольших по диаметру опухо¬лях желудка, и вероятность поражения лимфатических узлов возрастает по мере увеличения инфильтрации стенки желудка. Так, при локализации опухоли в пределах слизистой оболочки метастазы в регионарные лимфатические узлы отмечены у 1,8% больных, при поражении мышечного слоя — у 44,3%, а при распространении опухоли на серозную оболочку желудка регионарные метастазы выявляются у 73,2% больных. После поражения регионарных лимфатических узлов возможно поражение забрюшинных узлов и отдаленное метастазирование. Наиболее часто встречаются отдаленные метастазы в лимфатических узлах левой надключичной области (метастаз Вирхова).
Пример гематогенного пути метастазирования — появление метастазов по системе воротной вены в печени (31,4%), у каждого третьего больного при вторичном поражении печени развивается асцит.
Одновременно возможно метастазирование в кости (0,8%), яичники у женщин (метастаз Крукенберга — 3,4%), брюшину (18,2%) и другие органы.
По В. А. Печатниковой (1967), происхождение некоторых отдаленных метастазов представляется следующим образом. В начале заболевания обычно имеет место ортоградный путь метастазирования, т. е. раковые клетки распространяются по ходу тока лимфы. По мере блокирования лимфоузлов метастазами рака появляются ретроградный лимфоток и ретроградные метастазы (через забрюшинные лимфатические пути — метастазы Крукенберга в яичники, метастазы Шницлера в параректальную клетчатку, метастазы в пупок по круглой связке печени — узелок сестры Мэри Джозеф). При блокировании метастазами парастернальных лимфоузлов лимфа, оттекающая в верхние узлы этой цепочки от нижних глубоких узлов шеи, встречает препятствие, а в надключичных лимфоузлах появляются ретроградно-лимфогенным путем метастазы Вирхова. Происхождение метастазов Вирхова может быть обусловлено и другим путем распространения раковых клеток.
Специфических симптомов рака желудка не существует. Многое в клинической картине зависит от локализации процесса и стадии заболевания. Часто заболевание протекает бессимптомно до поздних стадий.
При раке желудка могут наблюдаться следующие симптомы:
- Боли в эпигастрии.
- Диспепсия.
- Снижение аппетита вплоть до анорексии.
- Похудание.
- Общая слабость.
- Дисфагия.
- Чувство тяжести после еды.
- Регургитация (срыгивание) во время еды.
- Рвота съеденной за несколько часов или накануне пищей.
- Плохой запах изо рта.
- Отрыжка тухлым.
- На поздних стадиях заболевания истощение и обезвоживание больных.
При наличии нескольких из этих симптомов необходимо обратиться к врачу и провести диагностические исследования с целью исключения или подтверждения онкологического диагноза.
Заподозрить наличие рака желудка возможно при наличии диспептических явлений, снижении массы тела больного и ухудшении общего состояния. При малейшем подозрении на заболевание необходимо провести ЭГДС с биопсией.
- Методы диагностики рака желудка
- Сбор жалоб и анамнеза.
- Осмотр больного. Тщательная пальпация пупка, надключичных лимфатических узлов (чаще поражаются левые узлы – вирховские метастазы).
- Эзофагогастродуоденоскопия с биопсией. Важнейшее и обязательное исследование при подозрении на рак желудка.
- Рентгенологические исследования пищевода и желудка.
- Клинический анализ крови. Характерны: Анемия, ускорение СОЭ .
- УЗИ органов брюшной полости. Этот метод помогает исключить наличие метастазов в печени.
- Рентгенография легких. Этот метод помогает исключить наличие метастазов в легких.
- Биохимическое исследование крови. Может наблюдаться неспецифичное повышение активности щелочной фосфатазы , АСТ , АЛТ .
- КТ брюшной полости.
- Диагностическая лапаратомия.
- Ректальное исследование с целью исключения метастазов лимфатических узлов в параректальную клетчатку (шницлеровские метастазы).
- Вагинальное исследование и УЗИ яичников. С целью исключения метастатических опухолей Крукенберга.
- Определение онкомаркеров в крови. Раковоэмбриональный антиген (РЭА) повышается в 45-50% случаев. СА-19-9 повышается в 20% случаев.
- Гистологическое исследование биоптатов слизистой оболочки желудка.
В 90-95% случаев всех злокачественных образований желудка обнаруживается аденокарцинома.Аденокарцинома желудка подразделяется по гистологическим критериям на: тубулярную, папиллярную, муциноидную, перстневидноклеточную, и недифференцированную.
Второе по распространенности новообразовние это лимфома.Гастроинтестинальные стромальные опухоли, обычно классифицируемые как лейомиомы или лейомиосаркомы, составляют 2%.
В остальных случаях диагностируются карциноид (1%), аденоакантомы (1%), и чешуйчатоклеточный рак (1%).
Исследователями были предложены различные способы классификации рака желудка. По системе предложенной Лауреном рак желудка классифицируется на тип I (кишечный) и тип II (диффузный). Эти два типа развития заболевания проявляются у пациентов совершенно по-разному.
- I тип кишечный. Экспансивный, эпидемический, кишечный тип рака желудка. Характеризуется наличием хронического атрофического гастрита, сохраненной функции желез, небольшой инвазивностью и четкими краями. По классификации Лаурена он назван эпидемическим потому, что развивается обычно в результате действия факторов внешней среды, прогноз у него лучше, и отсутствует наследственная предрасположенность.
- II тип диффузный. Диффузный, инфильтративный, эндемический рак. Состоит из разрозненных скоплений клеток со слабой дифференцировкой и нечёткими краями. Края опухоли, которые могли показаться чистыми оперирующими хирургу и исследующему гистологу, часто ретроспективно оказываются обсемененными. Опухоли эндемического типа проникают в ткани желудка на большом протяжении. Этот тип опухолей вероятно не обусловлен влияниями окружающей среды или диеты, чаще развивается у женщин, и поражает относительно молодых пациентов. Отмечена взаимосвязь с генетическими факторами (например Е- кадхерином), группами крови, и наследственной предрасположенностью.
Решение о способе лечения принимается на основании стадии опухоли и желания пациента (некоторые пациенты могут предпочесть более или менее радикальную терапию).
Только хирургическое лечение дает ощутимый эффект при раке желудка.
Вспомогательная химиотерапия или комбинированная химиотерапия, а также радиотерапия не оказывают выраженного эффекта при отсутствии хирургического лечения.
-
Методы лечения
-
Немедикаментозное лечение
Пациенты с раком желудка должны придерживаться основ лечебного питания. Подробнее: Лечебное питание при заболеваниях желудка .
-
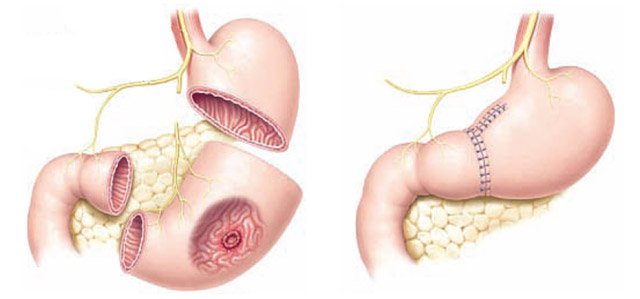
Хирургическое лечение
Существуют радикальные и паллиативные операции при раке желудка. Радикальными считаются 2 типа операций: субтотальная резекция желудка и гастрэктомия. Чаще всего проводят тотальную гастроэктомию (до здоровых тканей), и эзофагогастрэктомию при опухолях кардии и места перехода пищевода в желудок. При опухолях дистальной части желудка проводят субтотальную гастрэктомию.
Радикальные операции - это удаление большей части или всего желудка и прилежащих лимфатических узлов, оправданы у пациентов с патологическим процессом, ограниченным желудком и региональными лимфатическими узлами (менее 50% пациентов). Рекомендуется иссекать ткани на расстоянии 5 см проксимальнее и дистальнее края опухоли, так как сеть лимфатических сосудов желудка хорошо развита и опухоль склонна к метастазированию. Радикальное лечение показано соматически сохранным больным в возрасте до 75 лет, при отсутствии метастазов – примерно 1/3 всех больных.
При резекции локализованного патологического образования наблюдается 10-летняя средняя выживаемость (без резекции 3-4 года). При сравнении субтотальной и тотальной гастрэктомии при дистальном раке желудка в рандомизированном исследовании существенных различий в склонности к рецидивам, смертности и 5-летней выживаемости выявлено не было.
-
Исходы радикального хирургического лечения
Летальность во время операции – 10%. Показатели послеоперационной смертности в течение 30 дней после хирургической операции при раке желудка значительно снизились за последние 40 лет. По данным большинства крупных центров этот показатель составляет 1-2%.
Процент 5-летней выживаемости после радикальной резекции составляет 60-90% у пациентов при первой стадии заболевания, 30-50% у пациентов со второй стадией, и 10-25% у пациентов с 3-ей стадией заболевания.
К сожалению, только небольшая часть пациентов после радикальных операций полностью излечиваются. У большинства пациентов возникают рецидивы.
-
Виды рецидивов
Проводилось несколько исследований по изучению видов рецидивов после хирургической резекции, не сопровождавшейся химио- или радиотерапией. Исследования, основанные только на данных физикального обследования, лабораторных исследованиях и визуализирующих методах обследования, обычно дают завышенные показатели отдаленных рецидивов и заниженные показатели труднодиагностируемых рецидивов. Серия реоперационных исследований, проведенная в Университете Миннесоты, позволяет более точно понять схему дальнейшего развития заболевания. При этих исследованиях проводилась хирургическая ревизия пациентов спустя 6 месяцев после первичной операции, и тщательно фиксировались результаты. При этом частота локальных рецидивов составила 67%. Частота возникновения рецидивов в ложе желудка составила 54% всех случаев, в лимфатических узлах- 42%. Приблизительно у 22% пациентов наблюдались отдаленные рецидивы. Приблизительно у 22% пациентов наблюдались признаки отдаленных рецидивов. Рецидивы наблюдались, на месте локальной опухоли, в ложе опухоли, в регионарных лимфатических узлах и отдаленные рецидивы (например, гематогенные метастазы и брюшинное обсеменение). Первичные опухоли, локализовавшиеся в месте перехода пищевода в желудок, обычно метастазировали в печень и легкие. Опухоли с вовлечением пищевода метастазировали в печень.
-
Осложнения хирургического лечения
- В раннем послеоперационном периоде могут возникать следующие осложнения:
- Недостаточность анастомоза.
- Кровотечения.
- Кишечная непроходимость.
- Непроходимость анастомоза.
- Холецистит (часто приводящий к сепсису, без признаков местного воспаления).
- Панкреатит.
- Легочные инфекции.
- Тромбоэмболия.
- К поздним осложнениям относят:
- Демпинг-синдром.
- Диаррея.
- Язва анастомоза.
- Дефицит витамина B 12 .
- Рефлюкс - эзофагит.
- Нарушения костной ткани, чаще всего остеопороз.
В 15-20% больных после операции развиваются постгастрэктомические расстройства.
-
Вспомогательная терапия
- Комбинация эпирубицина/цисплатина/ 5-фторурацила.
- Комбинация доцетакселя /цисплатина/5-фторурацила.
- Другие схемы включают иринотекан и цисплатину.
- Возможны комбинации с оксалиплатином и иринотеканом.
- При выявлении хеликобактериоза рекомендована эрадикационная терапия .
- Симптоматическая терапия – омепразол ( Лосек МАПС , Ультоп , Омез ), ранитидин ( Ранитидин , Ранисан ), наркотические анальгетики.
После проведения хирургического лечения с целью предотвращения рецидивов больным назначается вспомогательная терапия. Учитывая частоту возникновения рецидивов, в мире был проведен ряд исследований по вспомогательной терапии.
Химиотерапия и лучевое лечение проводятся по особым показаниям, в основном для профиактики рецидивов.
Сравнительные данные при проведении предоперационной и постоперационной химиотерапии и постоперационной терапии в комбинации с радиотерапией противоречивы.
Цель радиотерапии – предотвратить локальное метастазирование.
Moertel и соавторы, в рандомизированном исследовании пациентов с раком желудка, показали, что при применении радиотерапии в дозе 40 Грей (Гр) или радиотерапии в дозе 40 Гр с использованием 5-фторурацила в качестве радиосенсибилизатора, достоверно улучшаются показатели выживаемости при применении комбинированной терапии.
Британские исследователи рака желудка показали снижение риска возникновения рецидивов у пациентов, которым проводилось послеоперационная радиотерапия, по сравнению с пациентами, которым проводилось только хирургическое лечение.
Было выявлено достоверное увеличение 4-хлетней выживаемости у больных с неоперабильным раком желудка, получавшим комбинированную терапию, по сравнению с группой больных, получавших только химиотерапию. (18 и 6% соответственно). В исследованиях, проведенных в клинике Мэйо, было показано достоверное увеличение выживаемости в группе пациентов получавших постоперационную радиотерапию с 5-фторурацилом, по сравнению с группой, не получавшей вспомогательную терапию (23% и 4% соответственно).
Вспомогательная химиотерапия используется с целью радиосенсибилизации и предотвращения системных метастазов. Отдельное проведение химиотерапии малоэффективно. Многочисленные рандомизированные клинические исследования не выявили достоверного улучшения выживаемости при использовании химиотерапии в послеоперационном периоде по сравнению с больными, которым проводилось только хирургическое лечение.
Предоперационная химиотерапия позволяет повысить операбильность опухоли, снизить микрометастазирование, определить чувствительность к химиотерапии и снизить риск местных и системных рецидивов, а также повысить общую выживаемость. В Европейском рандомизированном исследовании было показано достоверное улучшение выживаемости у пациентов получавших 3 цикла предоперационной химиотерапии ( эпирубицин , цисплатин, и 5-фторурацил), затем операция и 3 цикла постоперационной химиотерапии по сравнению с пациентами, получавшими только хирургическое лечение. У пациентов, получавших вспомогательную химиорадиотерапию, наблюдалось увеличение длительности периода без рецидивов (с 32% до 49%), а также увеличение общей выживаемости (от 41% до 52%), по сравнению с теми пациентами, которые не получали вспомогательной терапии.
Химиотерапия препаратами платины. Схемы первого ряда выбора:
- Лечение неоперабельных опухолей в терминальной стадии
У большого числа пациента выявляются неоперабельные опухоли с отдаленными метастазами, карциноматоз, неоперабельные печеночные метастазы, метастазы в легких, или инфильтрация органов, не подлежащих резекции. Данной категории больных рекомендовано проводить паллиативную терапию. Средняя продолжительность паллиативной терапии 4-18 месяцев.
В качестве паллиативного лечения, радиотерапия снижает частоту развития кровотечений, степень обструкции, и выраженность болевого синдрома у 50-75% пациентов.
Хирургическая паллиативная терапия включает в себя локальное иссечение, частичную гастрэктомию, тотальную гастрэктомию, наложение гастроинтестинального анастомоза, с целью дать возможность орального приема пищи.
Стандартная схема паллиативной химиотерапии влкючает в себя химиотерапию основанную на применении цисплатина, но результаты слабоутешительны – среднее время начала ухудшения 3-4 месяца и общая выживаемость 6-9 месяцев.
В 2007 году японскими клиницистами получены данные о некотором улучшении этих показателей при применении флюоропиримидина S-1 в качестве монотерапии или в сочетании с цисплатином (S-1 включает в себя 3 компонента: тегафур , предшественник 5-фторурацила; гимерацил, ингибитор распада фторурацила; отерацил (оксанат калия) для предотвращения побочных эффектов со стороны желудочно-кишечного тракта). На данный момент эти результаты проходят проверку в исследованиях, проводящихся в Европе и Северной Америке..
Читайте также:





