Что такое рфп в онкологии костях
Вопрос №2. Что такое радиофармпрепарат?
Радиофармпрепарат (РФП) – это соединение, состоящее из специального вещества и радионуклида (изотопа, радионуклидной метки). Специальное вещество отвечает за то, в каком органе накопится РФП, а радионуклидная метка позволяет врачу-диагносту увидеть это накопление на изображении.
В настоящее время для производства РФП используется очень широкий спектр как специальных веществ, так и радионуклидных меток. Во всем мире самым часто используемым у онкологических больных соединением специального вещества и радионуклидной метки является 18 F-фтордезоксиглюкоза ( 18 F-ФДГ). В данном соединении 18 F выполняет функцию радионуклидной метки, ФДГ – специального вещества.
Вопрос №3. Что такое физиологическое накопление РФП?
Физиологическое накопление (гиперфиксация) РФП – это повышенное накопление РФП, определяющееся в различных органах и системах в норме.
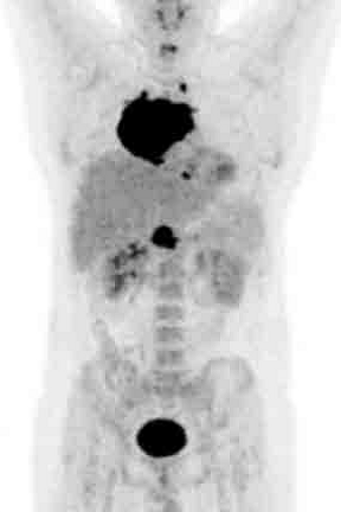
Физиологическое накопление наблюдается при исследованиях со всеми РФП: 18 F-ФДГ, 11 С-холином, 11 С-метионином, 68 Ga-ПСМА и т.д. В зависимости от типа РФП меняется лишь местоположение физиологической гиперфиксации. Например, при ПЭТ и ПЭТ/КТ с самой часто используемой 18 F-ФДГ физиологическое накопление РФП определяется в коре головного мозга, ротоглотке, носоглотке, мышцах гортаноглотки, миокарде левого желудочка, чашечно-лоханочных системах почек, фрагментарно по ходу петель толстой кишки, мочевом пузыре.
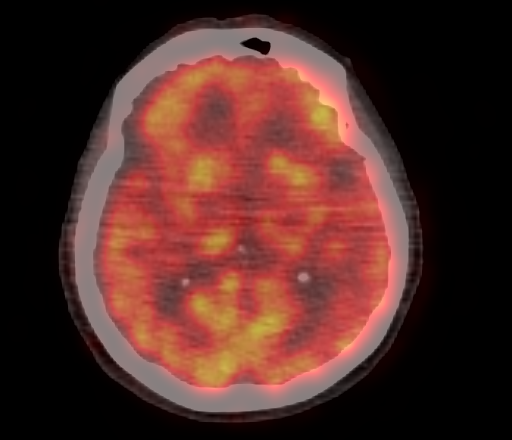 |  |
| Физиологическое накопление 18 F-ФДГ в коре головного мозга. | |
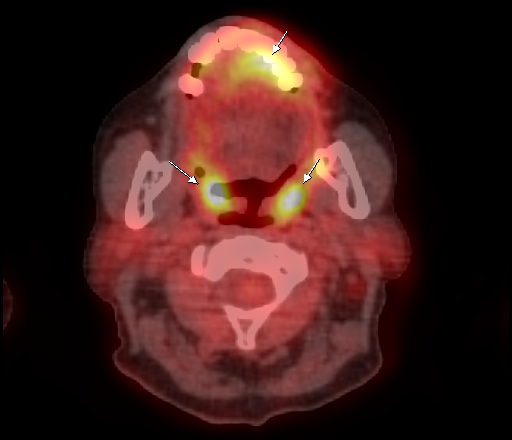 |  |
| Физиологическое накопление 18 F-ФДГ в ротоглотке. | |
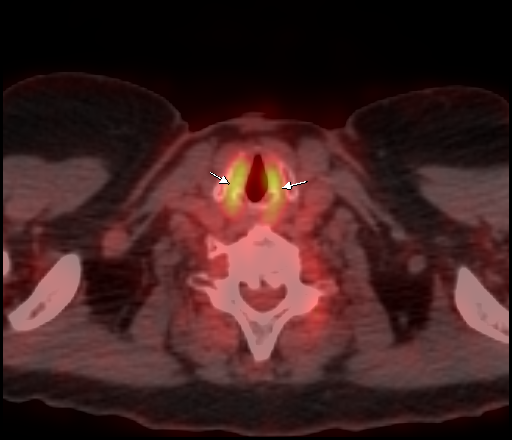 | 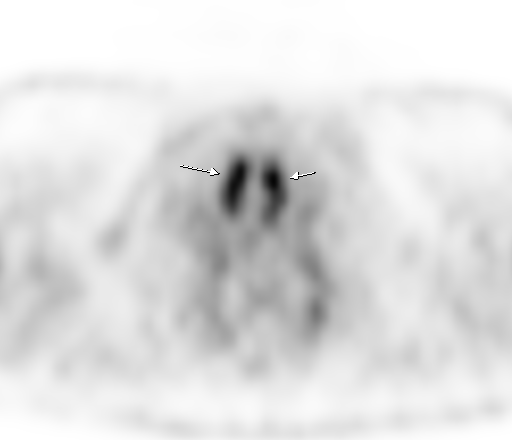 |
| Физиологическое накопление 18 F-ФДГ в мышцах гортаноглотки. | |
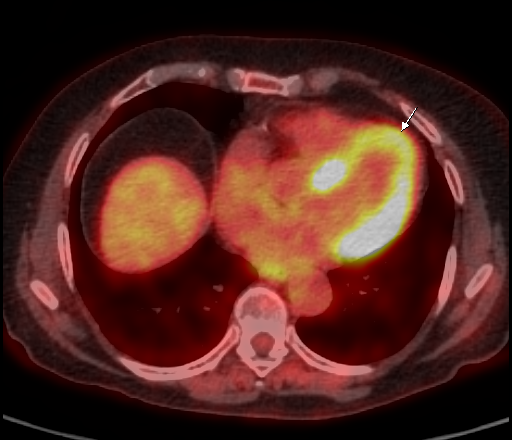 | 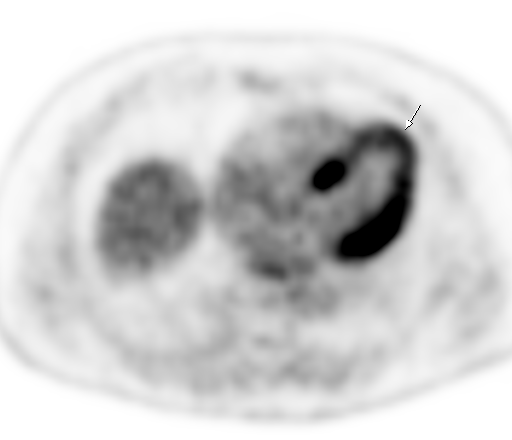 |
| Физиологическое накопление 18 F-ФДГ в миокарде левого желудочка. | |
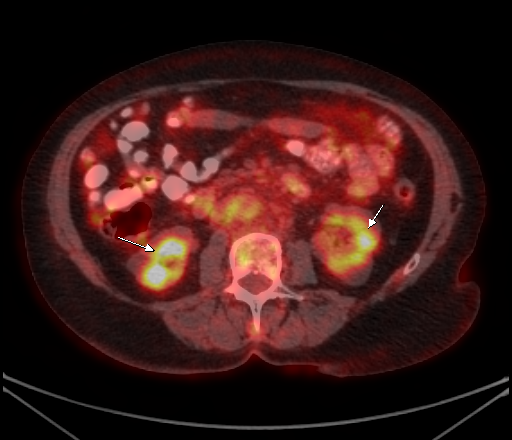 | 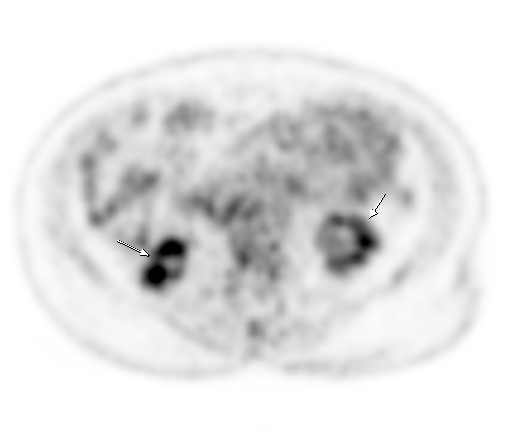 |
| Физиологическое накопление 18 F-ФДГ в чашечно-лоханочных системах почек. | |
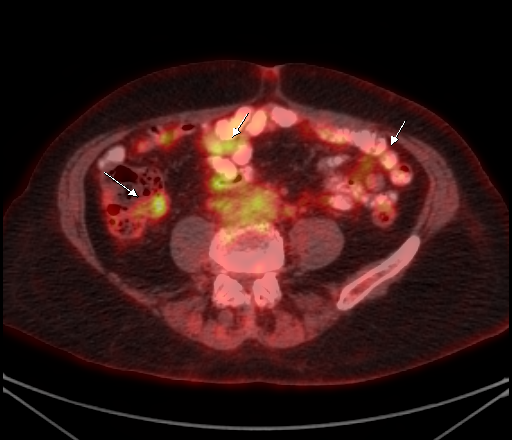 | 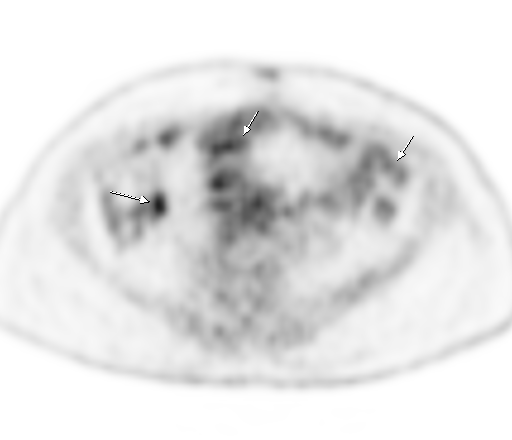 |
| Физиологическое накопление 18 F-ФДГ по ходу петель толстой кишки. | |
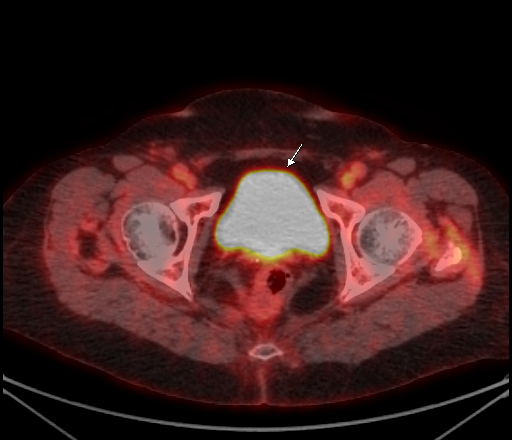 |  |
| Физиологическое накопление 18 F-ФДГ в мочевом пузыре. | |
Вопрос №4. Что такое патологическое накопление РФП?
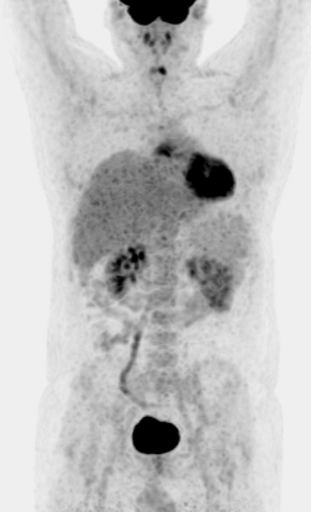
Патологическое накопление РФП – это повышенное накопление РФП в органах и тканях, регистрирующееся при заболеваниях, чаще всего в злокачественных опухолях.
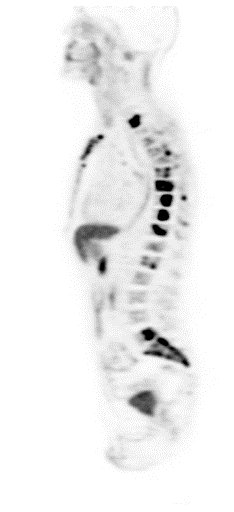
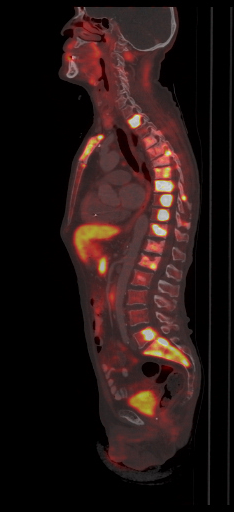
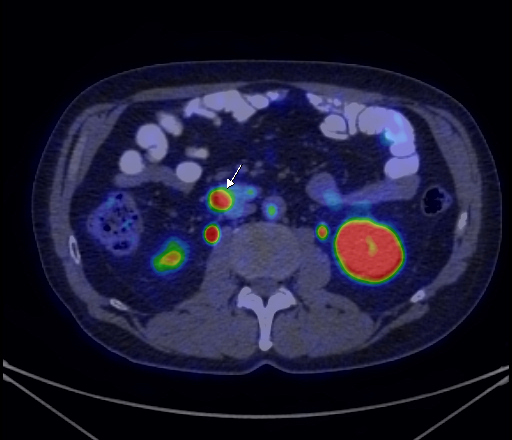 |
| Данные ПЭТ/КТ с 68 Ga-DOTA-TATE у пациента с нейроэндокринной опухолью тощей кишки. В проекции злокачественной опухоли, расположенной в тощей кишке, определяется очаг патологической гиперфиксации РФП. |
 |  |  |
| Данные ПЭТ/КТ с 11 С-холином у пациента с раком предстательной железы. Состояние после простатэктомии. В костях скелета визуализируются множественные очаги патологического накопления РФП (метастазы). | ||
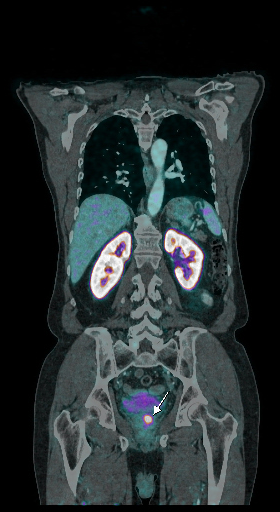 | 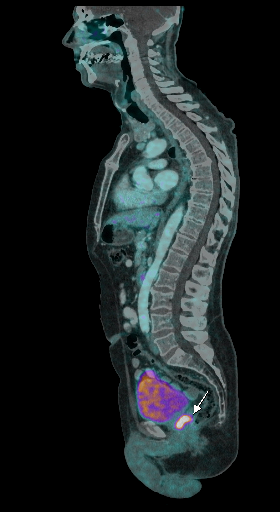 | 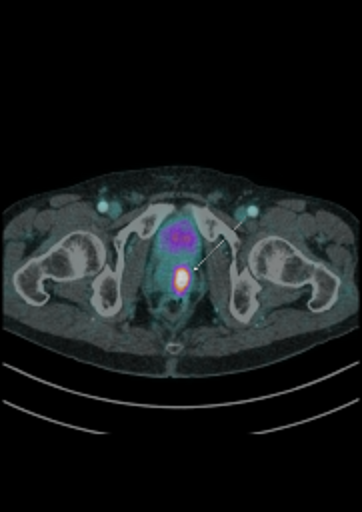 |
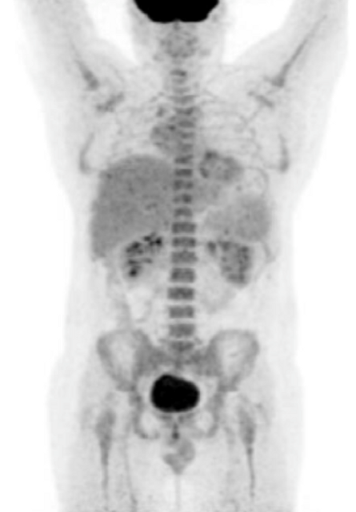
| Данные ПЭТ/КТ с 68 Ga-ПСМА у пациента с местным рецидивом рака предстательной железы. Состояние после лучевой терапии. В левых отделах предстательной железы определяется очаг патологического накопления РФП. | ||
Вопрос №5. Что такое метаболически активное и метаболически неактивное образование?
Метаболически неактивное образование – это образование, которое не накопило РФП. Чаще всего отсутствие повышенного накопления РФП в опухоли свидетельствует о ее доброкачественной природе.
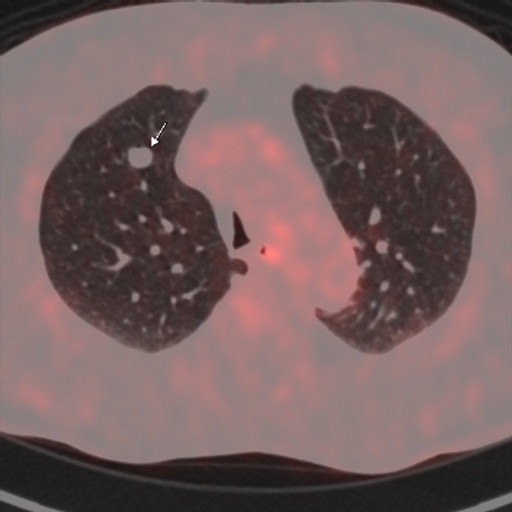 |
| Данные ПЭТ/КТ с 18 F-ФДГ у пациента с метаболически неактивным образованием правого легкого (доброкачественная опухоль - гамартома). |
Метаболически активное образование – это образование, в котором накопился РФП в повышенном количестве. Повышенное накопление РФП в опухоли чаще всего свидетельствует о ее злокачественном характере.
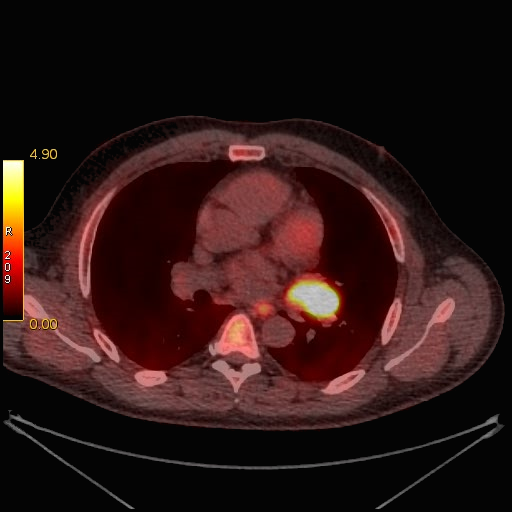 |
| Данные ПЭТ/КТ с 11 С-метионином у больного с метаболически активным образованием корня левого легкого (типичный карциноид). |
Вопрос №6. Что такое SUV?
SUV (Standardized Uptake Value, стандартизированный уровень захвата) – это величина, отражающая интенсивность накопления РФП в зоне интереса, например, в опухоли.
Показатель SUV рассчитывается программным комплексом автоматически и измеряется в различных единицах. В нашем Центре, как и в большинстве отечественных и зарубежных медицинских учреждений, где проводится позитронная эмиссионная томография, в качестве единиц измерения показателя SUV принято использовать г/мл (g/ml).
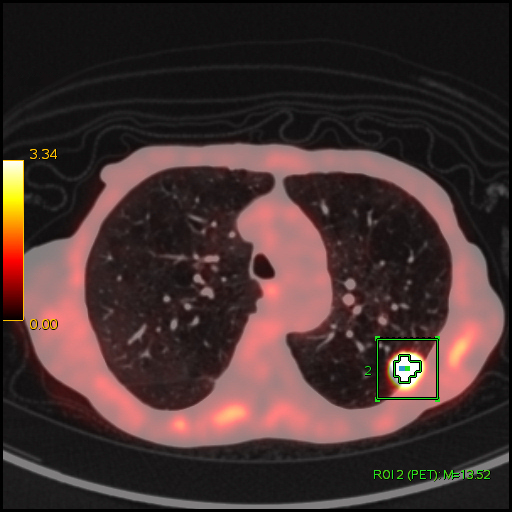 |
| Данные ПЭТ/КТ с 18 F-ФДГ. Оконтуривание метаболически активной злокачественной опухоли левого легкого для измерения показателя SUV. В данном случае величина SUV в опухоли определяется на уровне 13,52 g/ml. |
Вопрос №7. Для чего используется величина SUV?
Величина SUV в основном используется для оценки ответа злокачественной опухоли на проведенное лечение. Важно подчеркнуть, что в ряде клинических ситуаций показатель SUV в опухоли является единственным критерием, позволяющим оперативно получить информацию о чувствительности образования к только что начатой терапии.
Если опухоль чувствительна к лечению, то уровень SUV в ней при повторном ПЭТ-исследовании будет снижаться, если нечувствительна или малочувствительна (резистентна, устойчива) – значение SUV останется без изменений или увеличится. Следует помнить, что своевременная диагностика устойчивости опухоли к лечению позволит скорректировать план лечения, а в некоторых случаях и радикально его изменить.
Как уже было сказано выше, для оценки эффективности терапии врач-радиолог оценивает динамику показателя SUV до и после лечения.
Существует четыре варианта метаболического ответа опухоли на проведенное лечение:
- Частичный метаболический ответ – устанавливается при уменьшении значения SUV в опухоли на 25% и более;
- Полный метаболический ответ – заключается в отсутствии повышенного накопления РФП в опухоли;
- Метаболическое прогрессирование – устанавливается при увеличении SUV на 25% и более и/или при появлении новых очагов патологической гиперфиксации РФП;
- Метаболическая стабилизация – регистрируется при отсутствии достоверных (менее 25%) изменений показателя SUV в опухоли.
 |  |  |
| а | б | в |
Результаты ПЭТ с 18 F-ФДГ у пациента с диффузной В-клеточной крупноклеточной лимфомой до лечения (а), после 2 курса ПХТ (б) и через 13 месяцев после окончания терапии (в).
а – до лечения в средостении визуализируется массивное метаболически активное образование с уровнем SUV=12,6;
б – после 4 курса ПХТ отмечается значительное уменьшение метаболического объема опухоли и снижение показателя SUV до 3,4 (достигнут частичный метаболический ответ, т.е. опухоль чувствительна к выбранной ПХТ);
в – через 13 месяцев после окончания ПХТ очагов патологической гиперфиксации РФП в проекции органов средостения не обнаружено (достигнут полный метаболический ответ).
В настоящее время как никогда актуальна стала ранняя диагностика заболеваний, когда еще нет симптомов заболевания, но уже есть изменения на уровне клеточного обмена веществ. Это неудивительно: чем раньше будет выявлена патология и начато лечение, тем выше вероятность выздоровления для пациента.
Что такое ПЭТ КТ обследование
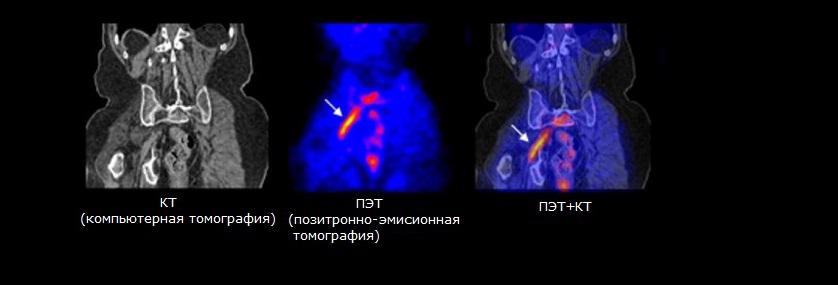
ПЭТ (позитронно-эмиссионная томография) – ядерный метод обследования, который предусматривает введение в организм специальных радиоактивных веществ, испускающих позитроны (элементарные частицы с положительным зарядом). Определенные радионуклиды обычно тропны (обладают способностью избирательно накапливаться) к определенным тканям и органам. Благодаря этому можно провести прицельное обследование интересующей области человеческого тела.
КТ (компьютерная томография) благодаря использованию рентгеновских лучей позволяет получать послойные изображения исследуемой области человеческого тела. Изображение, получаемое при помощи КТ, представляет собой тени отдельных органов и анатомических образований. Интенсивность цвета области снимка, соответствующего определенному органу, зависит от способности этого органа поглощать рентгеновские лучи.
ПЭТ дает врачу информацию о состоянии обменных процессов в организме, но локализовать патологический очаг при помощи данного метода может быть затруднительно. В связи с этим в настоящее время используются комбинированные аппараты для проведения ПЭТ/КТ обследования. ПЭТ позволяет получить сведения о метаболизме тканей, а КТ применяется для локализации патологических изменений.
Что такое радиофармпрепараты (РФП)
ПЭТ КТ с холином применяется для диагностики рака предстательной железы и его метастазов. Для выявления опухолей мозга используется ПЭТ КТ с метионином, так как очень часто исследование, проведенное с использованием меченой фтордиоксидглюкозы, дает неоднозначные результаты из-за вариабельного поглощения глюкозы здоровыми клетками мозга.
До сих пор ПЭТ КТ с метионином многие специалисты рассматривают как экспериментальную методику, которая еще нуждается в исследовании и доработке, однако ряд клиник в крупных городах России уже активно применяет метод для обследования своих пациентов и определения тактики лечения выявленных заболеваний.
Изготавливаются радиофармпрепараты индивидуально для каждого пациента в специальных лабораториях, оснащенных циклотроном – прибором для получения радиоактивного изотопа. Период полураспада используемых изотопов колеблется от 2 до 109 минут. Это значит, что радиофармпрепараты не предназначены для длительного хранения, и они не могут причинить вред здоровью человека, так как быстро распадаются.
Что диагностирует ПЭТ КТ
Чаще всего метод используют для обследования пациентов с онкологическими заболеваниями. ПЭТ КТ позволяет:
- выявить первичный очаг опухоли;
- обнаружить метастазы даже в том случае, если найти первичный очаг не представляется возможным;
- определить стадию опухолевого процесса;
- оценить результаты проведенного лечения (хирургического удаления, радио- или лучевой терапии).
Также ПЭТ КТ диагностика применяется при эпилепсии, когда необходимо выявить эпилептический очаг, сосудистых заболеваниях и травмах головного мозга, деменции и заболеваниях сердца.
Подготовка к ПЭТ КТ всего тела
Для того чтобы подготовиться к исследованию, необходимо будет выполнить несколько простых рекомендаций:
- последний прием пищи вечером накануне обследования;
- в день накануне обследования необходимо исключить сладости, мучное, фрукты и овощи, оптимальные для подготовки продукты – это творог и кефир;
- пить можно чистую негазированную воду без ограничений;
- на процедуру необходимо явиться в теплой по сезону одежде без металлических застежек.
Как делают ПЭТ КТ
Следует быть готовым к тому, что основное время процедуры занимает подготовительный этап, на котором в организм пациента вводится радиофармпрепарат. Перед введением РФП пациенту предлагают занять удобное положение в кресле и выпить некоторое количество чистой воды. Желательно в это время сходить в туалет помочиться. РФП вводится внутривенно с небольшим количеством мочегонного препарата. В зависимости от вида РФП после его введения необходимо будет отдохнуть в течение 30-90 минут для того, чтобы препарат лучше распределился по тканям.
Спустя время пациента помещают на диагностическую кровать на 20-40 минут. Именно столько времени может понадобиться сканеру для того, чтобы собрать необходимую информацию.
После того, как сканирование будет закончено, пациенту разрешают встать с кушетки и отправляют его в комнату отдыха.
Расшифровка полученных результатов
ПЭТ КТ исследование позволяет получить снимки исследуемой области. Расшифровкой полученных данных занимается врач лучевой диагностики. По времени расшифровка может занять от 30 до 60 минут. По истечении этого времени пациент получает на руки снимки и заключение врача.
К патологии костной ткани у онкологических больных относят потерю костной массы на фоне противоопухолевой лекарственной терапии (остеопороз) и метастазы в костях при распространённом опухолевом процессе.
К патологии костной ткани у онкологических больных относят потерю костной массы на фоне противоопухолевой лекарственной терапии (остеопороз) и метастазы в костях при распространённом опухолевом процессе. Метастазы в костях имеют более 1,5 млн. больных со злокачественными опухолями во всем мире, а погибают ежегодно до 500 тыс. человек. Наиболее часто кости поражаются при таких опухолях как рак молочной железы и рак предстательной железы - 75% больных, при немелкоклеточном раке лёгкого - 40% больных, а также при раке щитовидной железы, мочевого пузыря, почки, неходжкинских лимфомах и множественной миеломе.
Поражение костей значительно ухудшает качество жизни онкологических больных и снижает их выживаемость.
Кроме того, лечение больных с метастазами в костях требует существенных экономических затрат.
Условно выделяют несколько типов метастазов в костях:
• остеолитические (преобладает остеолизис);
• остеобластические (характеризуются склеротическими явлениями);
• смешанные (в равной степени присутствует остеолизис и склеротические изменения).
Изучение биопсийного материала показало, что не бывает только остеолитических или остеобластических очагов, поскольку процессы резорбции и восстановления костной ткани идут с разной интенсивностью в обоих типах очагов.
Диагностика метастатического поражения костей осуществляется с помощью остеосцинтиграфии (радиоизотопное сканирование скелета), R-графии, КТ и МРТ.
• Остеосцинтиграфия - рутинный скрининговый метод диагностики метастазов во всем скелете, позволяющий в 59% случаев обнаружить метастазы в костях задолго до появления изменений на рентгенограммах. Данный метод обладает высокой чувствительностью и низкой специфичностью (радиоактивный изотоп технеция Тс 99т является маркёром остеобластической активности и увеличения кровотока). Ложноотрицательные результаты возможны при литических очагах, так как нет субстрата для радиоактивной метки - повышенного притока крови, формирования остеоидов и их повышенной минерализации. Очаги гиперфиксации РФП требуют обязательного подтверждения с помощью R-графии, КТ, МРТ.
• R-графия используется для выявления метастазов в костях (очаги повышенной фиксации радиофармпрепарата) и для оценки эффективности лекарственного лечения. Метод чувствителен при литических и остеобла стических очагах. Отмечено, что около 50% метастазов в костях, подтверждённых данными аутопсии, не определялись на R-граммах.
Причинами ложноотрицательных результатов могут быть применение данного метода
в R-негативной фазе; потеря до 30% минерального состава костной ткани на момент обследования; массивное поражение костного мозга.
• КТ - основной метод в уточняющей диагностике метастазов в кости. Недостатком метода являются лучевая нагрузка на пациента и применение больших доз йодсодержащего контрастного препарата.
• МРТ - уточняющий и высокочувствительный метод выявления R-негативных и минимальных очагов в костях; может быть использован для оценки эффективности лечения. Ограничения при проведении МРТ: наличие у больного конструкций, содержащих металл (кардиостимуляторы, слуховые протезы и стимуляторы, металлические протезы, искусственные клапаны сердца и др.).
Диагностика остеопороза осуществляется при помощи двухуровневой рентгеновской денситометрии.
2. КЛИНИЧЕСКАЯ КАРТИНА
Метастатическое поражение костей может протекать бессимптомно, однако, нередко сопровождается характерными симптомами:
• появление или усиление болевого синдрома;
• патологические переломы, в том числе, компрессионные переломы тел
позвонков;
• компрессия спинного мозга (костными отломками);
• необходимость в проведении паллиативных оперативных вмешательств или лучевой терапии;
Эти осложнения приводят к ухудшению качества жизни больных, препятствуют продолжению специфического противоопухолевого лечения и могут негативно сказываться на выживаемости.
2.2. Лабораторные показатели
Под гиперкальциемией понимают повышение уровня кальция >ВГН, которая составляет 2,6 ммоль/л. Выделяют три степени гиперкальциемии в зависимости от уровня кальция:
• лёгкая: 2,6-3,0 ммоль/л;
• средняя: 3,0-3,38 ммоль/л;
• выраженная: >3,38 ммоль/л.
Гиперкальциемия встречается у онкологических больных при распространённых формах болезни (до 10%); при уровне кальция >3,0-3,2 ммоль/л является жизнеугрожающим состоянием, поскольку может приводить к нарушению функции почек вплоть до почечной недостаточности (полиурия, тошнота/рвота, снижение СКФ, электролитные нарушения, прогрессирующая дегидратация,
вплоть до комы и сердечного коллапса). Такое состояние требует экстренного начала интенсивной инфузионной терапии под контролем общего состояния, уровня электролитов в сыворотке крови и диуреза. Основные принципы лечения гиперкальциемии при злокачественных новообразованиях заключаются в регидратации, которая способствует выведению кальция с мочой, назначении ГКС и антирезорбтивной терапии различными ОМА (бисфосфонаты, деносумаб, кальцитонин).
Остеопороз - системное прогрессирующее метаболическое заболевание скелета, характеризующееся снижением минеральной плотности костной ткани, нарушением микроархитектоники, повышением хрупкости костей и, как следствие, нарастающим риском переломов. Факторами риска являются возраст >65 лет, малотравматичные переломы в анамнезе, приём ГКС, курение и др. У онкологических больных возникновению и развитию остеопороза может способствовать противоопухолевая терапия, снижающая уровень половых гормонов в крови: овариальная супрессия (независимо от способа достижения), особенно ранняя и необратимая менопауза, а также длительный приём ингибиторов ароматазы в качестве адъювантной ГТ при раке молочной железы, при раке предстательной железы - гормондепривационная терапия.
Для профилактики и лечения остеопороза и связанных с ним осложнений также применяются ОМА (бисфосфонаты, деносумаб).
Применение ОМА, наряду со специфической противоопухолевой терапией и другими методами поддерживающей терапии, является частью мультидисциплинарного подхода к лечению онкологических больных, имеющих ту или иную патологию костной системы.
3.1.1. Общая характеристика бисфосфонатов
Бисфосфонаты это аналоги эндогенного пирофосфата костного матрикса, в котором атом кислорода замещён на атом углерода, необходимый для связывания гидроксиапатита. Они действуют на уровне остеокластов, нарушая их метаболизм, адгезию опухолевых клеток к костному матриксу, подавляя их миграцию и инвазию, а также ангиогенез; активируют естественную гибель (апоптоз) остеокластов.
Выделяют два основных класса бисфосфонатов:
• не содержащие азот (этидроновая кислота, клодроновая кислота);
• азотсодержащие бисфосфонаты (алендроновая, ибандроновая, памидроновая, золедроновая кислоты)
Существуют лекарственные формы бисфосфонатов для в/в введения и для приёма внутрь. При метастазах рака молочной железы в костях было доказано преимущество парентеральных лекарственных форм золедроновой, памидроновой и ибандроновой кислоты по сравнению с пероральными препаратами в отношении снижения риска скелетных осложнений.
К основным побочным реакциям в/в лекарственных форм относятся острые реакции (гриппоподобный синдром, артралгия или миалгия) и отсроченные осложнения (гипокальциемия, гипофосфатемия).
Почечная недостаточность, которая зачастую зависит от дозы и длительности введения препаратов, может быть как острой, так и хронической. Одно из серьёзных осложнений азотсодержащих бисфосфонатов — остеонекроз нижней челюсти, чаще наблюдающийся при лечении золедроновой кислотой и зависящий от её кумулятивной дозы.
Для пероральных препаратов характерна низкая всасываемость в желудочно-кишечном тракте (0,5-4%), диарея, эзофагит, тошнота.
По данным непрямого сравнения максимальной активностью среди бисфосфонатов обладает золедроновая кислота.
Для снижения частоты побочных реакций перед началом использования бисфосфонатов необходимо определять уровень кальция и креатинина в сыворотке крови, при необходимости применять гидратацию (500-1000 мл 0,9%раствора NaCl) перед введением препарата.
Требуется также консультация стоматолога и санация полости рта.
В настоящее время бисфосфонаты входят в стандарт лекарственного лечения метастазов в костях и остеопороза, а также гиперкальциемии при различных злокачественных опухолях. Показаниями для назначения бисфосфонатов являются:
• остеолитические, остеобластические и смешанные метастазы в костях;
• профилактика и лечение постменопаузального и лекарственного остеопороза (в т.ч. у больных раком молочной железы, получающих адъювантную ГТ ингибиторами ароматазы).
Противопоказания (общие для бисфосфонатов):
• повышенная чувствительность к препарату;
• одновременный приём других ОМА (бисфосфонатов, деносумаба);
• выраженное нарушение функции почек: при клиренсе креатинина 3 ммоль/л) однократно вводят 4 мг ибандроновой кислоты.
При возникновении неясных болей в различных областях скелета, при неинформативности других методов диагностики, особенно, если в анамнезе имеются онкологические заболевания, пациенту может быть назначено дополнительное обследование — сцинтиграфия костей скелета.
Общие понятия метода обследования
Под остеосцинтиграфией подразумевают метод диагностического изучения костной ткани на предмет развития патологических состояний с помощью радиофармпрепарата, вводимого в организм пациента через вену.
Такой вид обследования позволяет определить участки костных тканей, где происходит распад или построение кости, выявить наличие переломов, атрофии, воспалительных процессов, образование опухолей. Его целью является диагностирование причин болезненных ощущений в области кости, в том числе распространения метастазов у больных онкологическими заболеваниями, мониторинг инфекций и воспалений, выявление травм скелета (трещинки, переломы и т.д.).

Что можно выявить при помощи сцинтиграфии
В основе такого вида диагностирования лежит применение радиоактивных изотопов, применение которых в обследовании позволяет специалистам выявлять патологии в костях скелета. В отличие от прочих способов, таких как рентген, он наиболее информативен и может определить болезнь намного раньше.
При помощи остеосцинтиграфии можно диагностировать:
- Причины неясных болей (при воспалительных реакциях, распаде ткани и т.д.);
- Скрытые переломы, не отражающиеся на снимке рентгена;
- Онкологические процессы в костях;
- Метастазирование, образовавшееся в костях на фоне раковых опухолей прочих органов;
- Остеомиелит.

Когда можно и нельзя делать остеосцинтиграфию
Сцинтиграфия костей скелета рекомендуется лечащим врачом в таких ситуациях:
- Если у больного онкологическим заболеванием возникло подозрение на распространение метастазов за пределы пораженного органа (при наличии симптомов или иных факторов, при которых такое течение болезни имеет место быть);
- Для определения результатов лечения лучевой или гормональной терапией, а также химиотерапии и своевременной корректировки назначенного метода борьбы с заболеванием;
- Подозрение на воспалительные процессы в костях и суставах, которые невозможно определить при простом рентгене;
- Для пациентов, имеющих протезы в суставах и костях, при подозрении на их нестабильность или воспалительные изменения в области их установки;
- Травмы костей, не отражаемые при других методах обследования;
- Заболевания костной ткани, связанные с ее метаболизмом.

Ограничений к сцинтиграфии костей не много, но важно учитывать все эти факторы:
- При беременности сцинтиграфия не проводится ввиду высокого риска поражения плода;
- При грудном вскармливании необходимо от него отказаться на двое или трое суток после введения препарата пациентке;
- При наличии любых видов аллергии следует уведомить врача, проводящего обследование. У людей, склонных к аллергии могут возникнуть реакции различной степени тяжести на препарат РФП, вводимый в вены, поэтому специалисты исследовательского мед. центра должны быть предупреждены для своевременного оказания помощи при необходимости;
- Мужчинам, принимающим лекарства для лечения эректильной дисфункции, необходимо отменить препараты за 2-3 суток до проведения сцинтиграфии костного скелета;
- На сутки (24 часа) ограничить общение с детьми до 14 лет.

Преимущества и недостатки сцинтиграфии костного скелета
Вторым плюсом этого типа обследования является его масштаб и минимально необходимые затраты времени и ресурсов. При остеосцинтиграфии изучается весь скелет человека, а не отдельные его части, позволяя получить полную картину состояния здоровья костной ткани всего за полчаса или час. Это также способствует значительной экономии, ведь гораздо выгоднее и удобнее провести лишь одно полноценное обследование, чем множество на отдельных участках (руки, ноги, поясница, позвоночник, череп и т.д.)
К минусам сцинтиграфии костного скелета относится то, что на основе только одного метода можно лишь предположить диагноз, а не поставить его окончательно. При выявлении отклонений от нормы, лечащий врач дополнительно может назначить биопсию, КТ или МРТ, рентген, а также учесть симптомы и жалобы пациента. Все это в комплексе позволяет сделать заключение и своевременно лечение.
Также, к сожалению, этот метод обследования по степени накопления проявляющего вещества не позволяет различать некоторые типы опухолевых процессов. Можно лишь предположить их доброкачественность или злокачественность, а также, какого типа происхождение опухоли – остеогенного или неостеогенного.

Готовимся к сцинтиграфии скелета
Специальных мер при подготовке к ней не проводится. Нет необходимости как-то чистить свой организм или приходить натощак – все это никак не влияет на конечный итог.
Но при его назначении обратите внимание на факторы, способные исказить результаты диагностики:
- Если за сутки — двое перед остеосцинтиграфией пациенту проводились обследования с использованием взвеси бария, таких как рентген желудка и т.д., диагностику лучше перенести, т.к. препарат повлияет на качество изображения;
- За месяц до обследования нельзя пользоваться йодом для обработки ран, трещин, порезов, т.к. картинка при обследовании будет искажена;
- Людям с заболеванием сердца желательно отказаться от приема препаратов-блокаторов, из-за их способности накопления в организме;
- Исключить прием лекарств с содержанием брома, таких как успокоительные или сиропы от кашля;
- Женщинам, находящимся в репродуктивном возрасте, желательно проводить сцинтиграфию не позднее 10 дня от начала менструации.

Методика проведения процедуры сцинтиграфии и режимы обследования
Данный метод обследования состоит из двух этапов:
- Введение в организм специального препарата (РФП) и ожидание его поглощения костными тканями;
- Непосредственно само обследование при помощи аппарата лучевой диагностики.
Перед процедурой пациенту вводят через вену один из препаратов РФП, после чего необходимо ожидать его распространения в течение 3 часов. В это время можно покинуть диагностический центр либо ожидать начала процедуры в его стенах.
Обязательно надо употребить не меньше 1000 миллилитров воды, в идеале – 1,5 литра. Это позволит ускорить выведение лишних радионуклидов, которые остались в крови и не были поглощены костями скелета. перед началом процедуры обязательно посетить туалет и опустошить мочевой пузырь (даже если не хочется), поскольку даже частичная его наполненность будет мешать обследованию.
Кабинет для проведения процедуры состоит из двух комнат, связанных между собой специальным окном с защитным стеклом. В одном из них находится непосредственно гамма-камера, при помощи которой производится сканирование тканей клиента и кушетка. Во втором — компьютер, на монитор которого выводятся данные обследования. Там же располагается медперсонал, где наблюдает за состоянием исследуемого через защитное окно.
Сам процесс сцинтиграфии костей может проводиться в положении лежа или сидя. От пациента требуется полная неподвижность в течение назначенного специалистами времени (обычно это полчаса или час), не разрешено даже слегка шевелиться или разговаривать.
В зависимости от диагноза, подозрение на который имеется у лечащего врача пациента, может быть выбран один из режимов проведения сцинтиграфии костей. Среди них:
- Проекционно-прицельный метод – если требуется провести дообследование отдельных участков скелета;
- Полное сканирование всего скелета — для выявления метастазирования при различных онкологических процессах, для проверки состояния здоровья в стадии ремиссии и т.д.;
- Однофотонная эмиссионная КТ – в качестве дополнительного обследования, если ранее на МРТ (или КТ) были выявлено значительное широкое поражение костей патологическим процессом;
- Трехфазная съемка – для диагностики воспалительных процессов в костных тканях, а также контроля за установленными костными имплантами.

Результаты обследования и заключения
На следующий день после проведения сцинтиграфии скелета, пациенту выдается медицинское заключение вместе со снимками, на которых виден скелет человека целиком. На основании данных изображения, врач-рентгенолог делает вывод о наличии либо отсутствии метастазирующих поражений и других патологий, их точную локализацию (костная либо мягкая ткань).
Также остеосцинтиграфия позволяет отличить злокачественную опухоль от доброкачественной, определить вид патологического процесса (инфицирование, воспаление или повреждение механическим способом, т.е. трещина и перелом).
Препараты, применяемые в обследовании остеосцинтиграфии кости

Для снижения риска облучения клиентов исследовательских центров, в медицине во время проведения сцинтиграфии костей скелета чаще применяют радионуклиды короткоживущие (всего несколько часов) и ультракороткоживущие (несколько минут). Среди них препараты на основе йода, азота, гелия, углерода, кислорода и фтора.
Обычно препараты вводят внутривенным способом, изредка – внутриартериальным. Данные введенных в организм радионуклидов накапливаются в пораженных злокачественными образованиями участках, в очагах с дегенеративными поражениями, позволяя их визуализировать при обследовании.
Чаще всего используют:
- Оксабифор;
- Золендрон, а также одноименная кислота;
- Пирофосфат;
- Гидроксиэтил.
Когда нужно сделать сцинтиграфию
Данный метод диагностики чаще всего применяют для выявления опухолей и метастазов в костной ткани. Поэтому чаще всего он назначается онкобольным пациентам.
Однако в некоторых случаях желательно самостоятельно провести сцинтиграфию костей, чтобы обезопасить себя и улучшить качество и продолжительность жизни:

Если своевременно обнаружить начало развития процесса метастазирования, его можно значительно затормозить и даже обратить, что позволит повысить продолжительность жизни, улучшить ее качество и избавиться от боли.
Как часто можно проводить процедуру безопасно
Сцинтиграфия костной ткани – процедура безболезненная и достаточно безопасная. Поэтому ее разрешено проводить без вреда для здоровья 1 раз в квартал. А при наличии показаний (болей у онкологического больного, выявлении результатов лечения) иногда диагностика назначается чаще.
При подозрении на ошибочный результат сцинтиграфии костей, дополнительно назначают МРТ, КТ либо рентгенографическое обследование.
Может ли результат обследования быть ошибочным?
Как и все прочие методы обследования, остеосцинтиграфия в некоторых случаях может выдавать как ложноположительные, так и ложноотрицательные заключения. Однако, степень погрешности у этой процедуры значительно ниже, нежели при других типах диагностики и составляет не более 1% среди всех случаев.
В ложноположительных заключениях могут быть выявлены признаки метастазирования в участках, где на самом деле их нет. Это связано с тем, что вводимый препарат распределяется неравномерно и наибольшее количество проявляющей жидкости скапливается в суставах, позвоночнике и лопатках, где чаще всего и локализуются метастазы.
Также ложноположительные признаки злокачественного поражения костной ткани могут проявляться в местах, где ранее были травмы (переломы и трещины), остеопороз. Во избежание лишних волнений, об анамнезе болезней и травм костей необходимо сообщить специалисту до начала обследования, чтобы он смог отфильтровать эти данные.

Безопасность сцинтиграфии костного скелета и возможные осложнения
Процедура сцинтиграфии имеет высокую степень безопасности, при соблюдении рекомендованных периодов между обследованиями не несет риска для здоровья пациента и в целом благополучно переносится.
Однако у некоторых категорий людей могут возникнуть некоторые осложнения:
- У людей, склонных к различного рода аллергиям и имеющих тонкую, чувствительную, не поддающуюся загарам кожу (часто страдающих от солнечных ожогов), могут проявиться кожные высыпания. Они не несут опасности для пациента, купируются приемом антигистаминного препарата в течение пары суток;
- Гипотоники и гипертоники в течение 2-3 дней после процедуры могут ощущать колебания АД.
Что делать после процедуры
Сцинтиграфия костей является достаточно безопасным лучевым методом обследования. Однако для скорейшего избавления от радионуклидов, после нее следует в обязательном порядке искупаться в теплом душе, тщательно вымыть волосы шампунем, а тело протереть мыльной мочалкой. Предметы одежды, которые были на пациенте на обследовании, требуется сразу постирать с большим количеством порошка или мыльного раствора.

Запрещается приносить домой бинты, пластыри и ватные тампоны, которые были использованы для внутривенного введения РФП. От них необходимо избавиться в исследовательском медицинском центре, там имеется урны для радиоактивного мусора.
В течение 24 часов потребуется обязательно ограничить общение с беременными и маленькими детьми. Если в доме с пациентом проживает ребенок, лучше отправить его на сутки к няне или бабушке.
Читайте также:

