Что такое ммг по онкологии

Маммографию или УЗИ лучше делать?
Чтобы определить, чем отличается УЗИ молочных желез от маммографии, разберемся, что это такое:
• Маммографическое исследование работает на основе рентгеновских лучей. Но его не проводят для пациенток младше 35-40 лет.
• УЗИ можно делать, начиная с 18-20 лет.
Основной недостаток ультразвука: не позволяет должным образом проверить протоки желез, а именно в них могут появиться папилломы, не позволяет оценить структуру каждой молочной железы, не позволяет определить микрокальцинаты. Минус ММГ – наличие рентгеновского излучения, которое является противопоказанием для этой процедуры при беременности, кормлении грудью и при возрасте моложе 35. Некоторые специалисты считают, что лучше не делать ММГ до 40 лет, так как ткани желез очень плотные, и исследование будет малоинформативным.
Основной плюс рентгена в том, что лишь так можно обследовать млечные пути и определить, есть ли кальциевые скопления. Если нужен именно такой анализ, то вопрос, маммографию или УЗИ делать, не стоит. Но ультразвук гораздо лучше позволяет выявить наличие новообразований любого типа, хотя и это не всегда точный метод при их диагностике. Поэтому нельзя однозначно ответить, какая процедура лучше. Каждый метод хорош в своей области. Если бы было идеальное для всех ситуаций решение, то все пользовались бы только им.
Вопрос цены тоже в некоторых случаях играет свою роль. И здесь ММГ оказывается в 2-3 раза дешевле, чем ультразвук.
А еще не такая уж и редкость онкология груди у мужчин. И им тоже иногда требуется и маммограмма, и УЗИ, и обследование у маммолога-онколога.
- Личный кабинет
- Специалисты
- Статьи
- Вакансии
Наши пациенты из всех регионов России:
Республики Адыгея, Алтай, Башкортостан, Бурятия, Дагестан, Ингушетия, Кабардино-Балкария, Калмыкия, Карачаево-Черкесия, Карелия, Коми, Крым, Марий Эл, Мордовия, Саха (Якутия), Северная Осетия-Алания, Татарстан, Тыва, Удмуртия, Хакасия, Чечня, Чувашия. Алтайский, Забайкальский, Камчатский, Краснодарский, Красноярский, Пермский, Приморский, Ставропольский, Хабаровский край. Амурская, Архангельская, Астраханская, Белгородская, Брянская, Владимирская, Волгоградская, Вологодская, Воронежская, Ивановская, Иркутская, Калининградская, Калужская, Кемеровская, Кировская, Костромская, Курганская, Курская, Ленинградская, Липецкая, Магаданская, Московская, Мурманская, Нижегородская, Новгородская, Новосибирская, Омская, Оренбургская, Орловская, Пензенская, Псковская, Ростовская, Рязанская, Самарская, Саратовская, Сахалинская, Свердловская, Смоленская, Тамбовская, Тверская, Томская, Тульская, Тюменская, Ульяновская, Челябинская, Ярославская области. Москва, Санкт-Петербург, Севастополь. Еврейская АО. Ненецкий, Ханты-Мансийский-Югра, Чукотский, Ямало-Ненецкий автономные округа.
На основе гистологического заключения. Злокачественность опухоли напрямую влияет на исход болезни: чем выше степень, тем агрессивнее рак, и тем хуже прогноз для выздоровления.
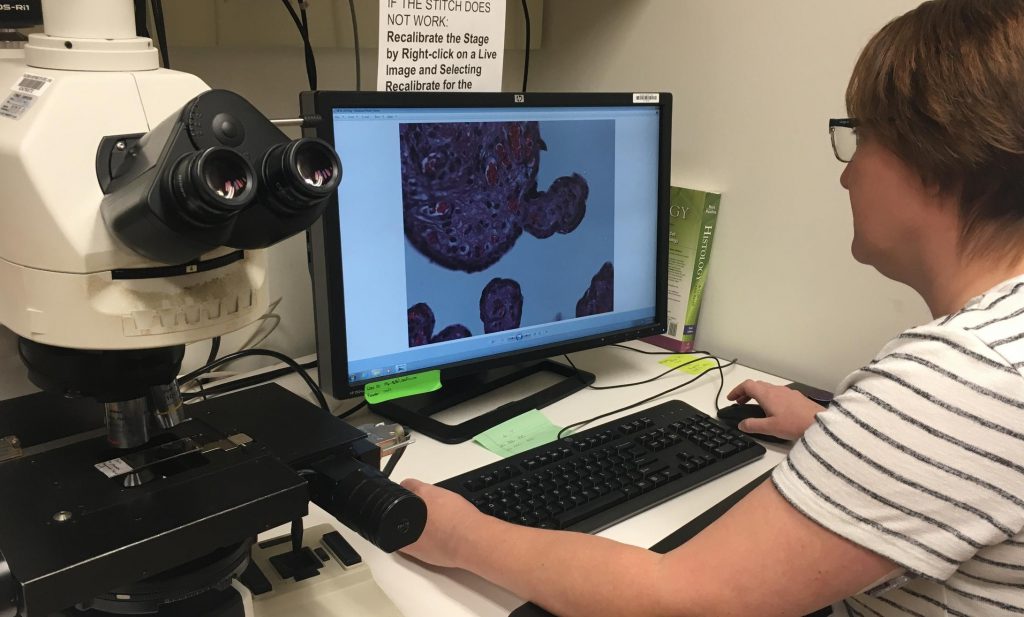
Врач-гистолог оценит степень злокачественности
Злокачественность опухоли
Морфологическое исследование удаленных раковых тканей, как обязательный этап диагностики, помогает определить злокачественность опухоли. В организме человека триллионы клеточных структур, основой которых являются около 100 различных типов клеток: каждая из них может переродиться в раковую. При этом результат перерождения-трансформации может быть морфологически очень близок к исходно нормальной клетке. Или настолько сильно отличаться, что, кажется, и сравнивать не с чем.
Злокачественность опухоли – это степень клеточных изменений, указывающая на агрессивность Карциномы: чем выше цифра после буквы G, тем сильнее отличается злокачественное новообразование от исходной ткани в месте возникновения рака.
Степени злокачественности
Гистологический диагноз – это морфологический вариант опухоли и степень злокачественности. Выделяют 3 степени:
- Высокая степень дифференцировки опухолевой ткани (G1) – клетки первичного очага отличаются от нормальных клеточных структур удаленного органа или ткани, но морфологически похожи: у врача-гистолога нет никаких сомнений в том, что основой злокачественного перерождения стали клетки именно из этого органа или ткани;
- Средняя степень дифференцировки (G2) – схожие черты исходной ткани сохраняются, но различий больше: гистологически опухоль сильно отличается от нормы, но отошла еще не так далеко;
- Низкая степень (G3) – раковые клетки имеют крайне мало сходства с органом или тканью в первичном очаге: гистолог сразу понимает, что это чужеродный и агрессивный зверь.
Необходимо обращать внимание на цифровое значение критерия G в диагнозе: низкодифференцированные опухоли всегда прогностически хуже, при G1 шансы на выздоровление значительно выше.
Значимость клеточных изменений опухоли
Важно понимать: злокачественность опухоли – это одно из значений диагноза, необходимое для реального понимания силы Карциномы. Это вовсе не означает, что при G3 нет никаких шансов для выживания, а при G1 можно радостно подбрасывать чепчики – типа, мы уже почти победили врага.
Высокодифференцированные опухоли – это:
- Сравнительно медленная скорость прогрессирования;
- Низкий риск быстрого и раннего метастазирования;
- Высокая чувствительность к лекарственной терапии;
- Высокие шансы на длительную ремиссию.
Низкодифференцированные раки – это:
- Быстрый рост первичного опухолевого очага;
- Ранние метастазы в лимфоузлы и отдаленные органы;
- Отсутствие положительного ответа на химиотерапию;
- Низкие шансы на выживаемость.
Казалось бы, все просто: G1 – это благоприятно, G3 – это плохо. Но в жизни все значительно сложнее, потому что на прогноз при онкологии влияют масса факторов. Злокачественность опухоли – это важный элемент диагностики, на который надо обращать внимание: низкая степень дифференцировки раковых клеток указывает на то, что враг силен, зол, беспринципен и агрессивен. Война будет изнурительно-длительной, не каждая битва будет успешной, после каждого боя будет казаться, что Карцинома становится сильнее, но, тем не менее, шансы на победу есть всегда.

ИГХ при раке молочной железы — необходимость современной онкологии. Его результаты позволяют подобрать максимально подходящее женщине противоопухолевое лечение.
Что такое иммуногистохимия при РМЖ?
Иммуногистохимический анализ или коротко ИГХ основан на способности иммунитета синтезировать вещества, нейтрализующие инородные агенты — бактерии, вирусы, грибы и выделяемые ими токсины. Инородные агенты — это антигены, в их присутствии иммунные клетки вырабатывают определённое антитело, на каждое антитело имеется свой антиген.
Рак молочной железы умело скрывается от санкций иммунитета, тем не менее раковые клетки и их структурные элементы — антитела, иммунитет их не видит, но ИГХ выявляет эти антитела.
При ИГХ кусочек опухоли обрабатывают реагентами с антигенами, которые находят своё антитело и соединяются с ним, изменяя окраску исследуемого кусочка злокачественной ткани.
Для чего проводят иммуногистохимию при РМЖ?
Иммуногистохимия нужна не для научной работы, а для практического использования:
- Обнаружение в клетках рецептора половых гормонов, чувствительного к эстрогену (ЭР) или прогестерону (ПР), прогнозирует чуть более плавное течение рака с меньшей вероятностью метастазирования, с преимущественной локализацией метастазов в костях, большую продолжительность жизни даже при генерализации процесса;
- Разная концентрация ЭР и ПР позволяет выбрать для конкретной женщины оптимальное лечение, так при высоком уровне ЭР в сочетании с ПР и даже без них можно рассчитывать на хороший результат гормональной терапии, без рецепторов обязательна химиотерапия;
- Наличие в клетке НЕR2 в высокой концентрации указывает на агрессивность рака, что требует химиотерапии и специфического нейтрализатора НЕR2;
- Сочетание позитивного гормонального статуса с НЕR2 вызывает сомнения в результативности гормонотерапии, поэтому в программу лечения включается химиотерапия;
- Высокая концентрация Ki-67 — свидетельство высокой степени злокачественности и, опять-таки, не позволяет избежать химиотерапии.
Показания к иммуногистохимии при РМЖ
При раке молочной железы для ИГХ только одно показания — определение степени агрессивности рака по его структурным компонентам для подбора оптимальной программы лечения.
Обычный морфологический анализ — гистология показывает степень злокачественности опухоли и её клеточный состав, часто неоднородный, но не позволяет определить белковые структуры:
- Чувствительность каждой клетки к лекарствам определяется наличием у нее рецепторов половых гормонов;
- Активность клеточного размножение и скорость роста ракового узла контролирует белок НЕR2, если его слишком много, то рак будет расти быстрее и формировать защиту клетки от лекарств вплоть до полной устойчивости;
- Способность быстро воспроизводить замену погибшим клеткам, захватывая при этом новые территории, определяет маркер пролиферации Ki-67.
Концентрацию всех этих клеточный субстанций и определяет ИГХ.
Подготовка к исследованию
ИГХ при раке молочной железы проводится вне организма больной, но с кусочком её опухоли. Сегодня всем женщинам с впервые обнаруженным новообразованием в железе на этапе диагностики специальной иглой выполняется биопсия — кор-биопсия.
Взятый небольшой столбик раковой ткани подвергается гистологическому исследованию и ИГХ, что позволяет верифицировать, то есть доказать наличие рака, и планировать первичное лечение. Удалённую во время операции на молочной железе опухоль тоже подвергают гистологическому и ИГХ исследованиям для уточнения плана лечения.
Женщине перед биопсией надо только успокоиться, никакой определенной подготовки от неё не требуется.
Проведение исследования
Взятый при биопсии или из удалённых при операции тканей молочной железы кусочек рака в пробирке с формалином (для консервации) отправляется в патоморфологическую лабораторию. Кусочек разрезается на тончайшие пластинки, которые консервируются на очень длительный срок — несколько десятилетий, чтобы при необходимости имелся материал для анализа. Пластинки также подвергают иммуногистохимии.
ИГХ делается двумя способами: внесённые с реактивом антигены напрямую контактируют с антителами или через антиген-посредник, который сначала ищет свое антителом, а затем этот дуэт находится вторым антигеном, концентрация которого и измеряется.
О чем говорят результаты?
Обнаружение в раке молочной железы рецепторов ЭР и ПР предсказывает относительно доброкачественное течение при эффективности гормональных препаратов, но в реальной жизни опухоль может не среагировать на эндокринную терапию, правда процент устойчивости невысок.
Обнаружение Ki-67 прогнозирует неспокойную жизнь и интенсивное лечение с использованием максимальных возможностей химиотерапии для изменения негативного прогноза болезни.
Рецептор НЕR2 — прогностический фактор, предлагающий сосредоточение на химиотерапии без особых надежд на антигормональное воздействие, но с другой стороны, предсказывает необходимость использование таргетного препарата, связывающего патологический белок.
Расшифровка исследования
Формально считается, что 1% ЭР уже положительно, но до 10% ЭР сомнительна надежда на значимый результат эндокринной терапии. Иммуногистохимический анализ рецепторного статуса рака молочной железы предполагает следующие ответы:
- от 0 до 2 баллов — нет гормональной зависимости;
- при 3 — 8 баллах — возможна зависимость от эндокринного воздействия, чем больше баллов, тем выше уровень рецепторов, тогда как при 3 баллах только десятая часть раковых клеток имеет рецептор.
Градации ответов при определении НЕR2:
Белок Ki-67 констатирует:
- меньше 15% — невысокая активность пролиферации;
- 16% — 30% — умеренная агрессивность;
- выше 30% — высокая агрессия.
Определяемые при иммуногистохимии структурные элементы не гарантируют исполнения предначертанного — в процессе лечения рак изменяет свои характеристики. В нашей клинике определяют реальные характеристики злокачественного процесса в конкретный момент времени и подбирают оптимальное лечение по панели из множества генов.
ЧТО ТАКОЕ МАММОГРАФИЯ?
Маммография – рентгеновский метод исследования молочных желез, основанный на способности различных типов живых тканей пропускать рентгеновские лучи в разной степени. При этом нормальные и патологически измененные ткани молочной железы дают разное изображение на рентгенограмме (в нашем случае она называется маммограммой), что позволяет врачу обнаружить различные заболевания.
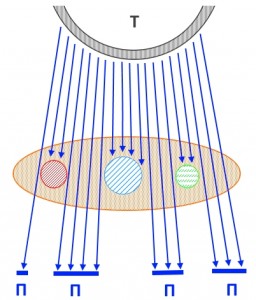
На рисунке – схема прохождения рентгеновских лучей через молочную железу (отмечена светло-коричневым цветом). Буквой Т отмечена рентгеновская трубка, П – участки пленки, подвергшиеся воздействию излучения. Таким образом, объемные образования (условно отмеченные кругами красного, синего и зеленого цветов) не пропускают (или пропускают в гораздо меньшей степени, чем жир) излучение, создавая эффект тени на рентгеновском снимке.
ЧТО ПОКАЗЫВАЕТ МАММОГРАФИЯ?
Молочная железа неоднородна по структуре, плотной соединительной ткани, жидкости и жировой ткани, а также включений кальция и металлов. Жировая ткань задерживает рентгеновские лучи в гораздо меньшей степени по сравнению с соединительной тканью, а жидкость (вода) непроницаема для рентгеновского излучения в еще большей степени. Кальцинаты непроницаемы для рентгеновского излучения практически на 100%. Таким образом, на маммограммах можно увидеть кисты, опухоли, кальцинаты в структуре молочной железы – говоря научным языком, оценить ее архитектонику.
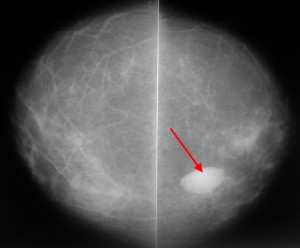
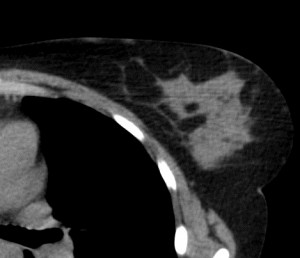
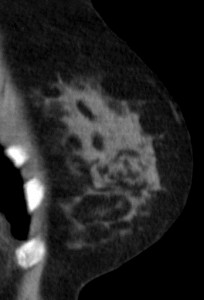
Для сравнения. На изображениях – КТ молочных желез. Посмотрите, насколько изображения отличаются от таковых на классических маммограммах.
КОГДА НУЖНО ДЕЛАТЬ МАММОГРАФИЮ?
Маммография может быть диагностической и выполняться с целью подтверждения уже установленного диагноза для оценки, например, размеров опухолевого узла, темпов его роста в сравнении с ранее выполненными снимками, а также профилактической – скрининговой. Профилактические исследования проводятся всем женщинам старше 40 лет, благодаря им возможно раннее выявление рака.
Диагностическую маммографию может порекомендовать врач УЗИ, гинеколог, хирург, онколог, маммолог – с целью уточнения природы изменений, выявленных им при мануальном исследовании, либо с помощью ультразвукового исследования. Маммограммы с диагностической целью делаются женщинам и мужчинам (!) независимо от возраста, главное – наличие объективных показаний, например, пальпируемого образования в молочной железе.
Профилактическую маммографию необходимо проходить всем женщинам, начиная с 40 лет, т. к. в этот период начинается изменение гормонального баланса, связанное с инволютивными процессами в яичниках. Кроме того, после 40 лет информативность рентгеновских снимков молочных желез гораздо выше, т. к. фиброзно-железистая ткань у женщин старшего возраста развита в меньшей степени, объемные образования не маскируются соединительной тканью, вследствие чего их лучше видно на рентгеновских изображениях.
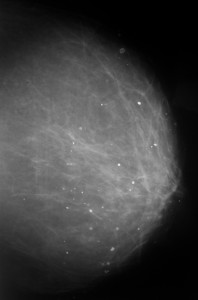
КАК ЧАСТО НУЖНО ДЕЛАТЬ МАММОГРАФИЮ?
Маммография с профилактической целью выполняется 1 раз в год. Если при этом выявлено какое-либо объемное образование в молочной железе, возникает необходимость оценки изменений размеров и структуры данного образования в динамике за определенный период времени – как правило, через 3, 4 или 6 месяцев. При этом врач-рентгенолог может порекомендовать повторный снимок через обозначенный выше срок – с целью убедиться, что образование не меняет свой размер, структуру и форму. При наличии изменений можно заподозрить злокачественную опухоль.
Для маммографии, выполняемой с диагностической целью, периодичности исследований не существует. Можно делать столько снимков, сколько необходимо для того, чтобы прийти к какому-либо однозначному мнению – консенсусу между рентгенологом и маммологом-клиницистом. На практике это означает, что выполняется 4 снимка в стандартных проекциях, а также при необходимости – снимки в дополнительных проекциях (прицельные).
НА КАКОЙ ДЕНЬ ДЕЛАЕТСЯ МАММОГРАФИЯ
Важным является вопрос, на какой день после месячных делать маммографию. По рекомендациям Международного общества маммологов это исследование лучше выполнять в начале менструального цикла до овуляции – на 5-15 день цикла. В это время создаются лучшие условия для визуализации изменений (железы не такие плотные, и все объемные образования визуализируются лучше).
КАК ДЕЛАЕТСЯ МАММОГРАФИЯ?
Маммографическое исследование выполняется в двух проекциях для каждой железы. Вначале выполняются снимки в прямой краниокаудальной проекции. При этом молочная железа помещается на столик аппарата и прижимается сверху специальным устройством. Степень давления может быть высокой – это причина множественных жалоб пациенток на болезненное исследование. Обычно при этом требуется находиться в положении стоя, но для ослабленных женщин предусмотрены специальные сиденья – они нужны для того, чтобы пациентка не получила травму при внезапной потере сознания во время исследования.
Затем лаборант выполняет рентгеновский снимок одной либо обеих желез и приступает к исследованию во второй стандартной – медиолатеральной косой проекции. При этом руку пациентке необходимо согнуть в локте и поднять кверху, обхватив шею. Это необходимо для того, чтобы мягкие ткани конечности не создавали дополнительных теней на изображении.
Иногда врач-рентгенолог назначает снимки в дополнительных проекциях, если видит на полученных изображениях сомнительные изменения. В некоторых случаях необходимо пальпаторное исследование железы и подмышечной области – с целью локализации выявленного на снимке образования, оценки степени увеличения и структуры лимфатических узлов в подмышечной области.
КАК ПОДГОТОВИТЬСЯ К МАММОГРАФИИ?
Для маммографии не требуется специальная подготовка. Необходимо подойти к назначенному времени к рентгеновскому кабинету, при себе иметь сменную обувь, направление, полотенце либо простыню. После приглашения в кабинет необходимо назвать свои паспортные данные лаборанту – для внесения в базу данных. Затем нужно снять верхнюю одежду, обнажив молочные железы, подойти к маммографу и выполнять все указания лаборанта. Разумеется, нужно соблюдать правила гигиены и приходить на исследование, предварительно помывшись – уважайте персонал рентгеновского кабинета.
ВРЕДНА ЛИ МАММОГРАФИЯ?
Маммография – исследование, связанное с облучением молочных желез. Так как объем тканей, подвергающихся облучению, невелик, общее воздействие на организм минимально. В среднем, доза, полученная при одном маммографическом исследовании, составляет 0,03-0,1 мЗв, что схоже с лучевой нагрузкой при флюорографии. Доза зависит от следующих моментов: тип аппарата (у пленочных аппаратов доза выше, у современных цифровых — ниже), объем облученных тканей (чем больше объем – тем выше доза). В целом, маммография относится к исследованиям, сопровождающимся низкой лучевой нагрузкой – в отличие от КТ и некоторых других рентгеновских методов диагностики. Поэтому ответ на вопрос, сколько раз можно делать маммографию, может быть только один — столько, сколько понадобится для точной постановки диагноза. При этом врач, назначающий исследование, должен по возможности стремиться избегать дополнительной лучевой нагрузки и, в случае аналогичной информативности, предпочесть другие, неионизирующие, методы диагностики (УЗИ, МРТ молочных желез).
ОПИСАНИЕ МАММОГРАФИИ И ШКАЛА Bi-RADS
Сегодня при оценке молочных желез применяется классификация – шкала Bi-RADS. Что означает Bi-RADS? Согласно этой шкале, врач-рентгенолог при описании рентгенограмм выставляет определенную категорию изменений.
Если никаких патологических изменений не выявлено, рентгенолог пишет в заключении: Bi-RADS 1. Это означает норму.
Также могут быть выявлены изменения, не относящиеся к абсолютной норме, но допустимые, например, большие единичные кальцинаты, обызвествления стенок сосудов, распространенный фиброз, локальные участки фиброза, возрастная инволюция желез и преобладание в структуре железы жировой ткани. В таком случае рентгенолог может написать Bi-RADS 2. Это означает, что здесь также не о чем беспокоиться.
Если выявлены какие-либо подозрительные изменения, которые врач не может считать стопроцентно доброкачественными, врач сделает заключение о категории Bi-RADS 3 , и порекомендует УЗИ, консультацию другого специалиста (маммолога, онколога, хирурга) либо повторную маммографию через 3-6 месяцев. Например, отличить простую кисту от фиброаденомы либо от раковой опухоли можно, но иногда это затруднительно. В этом случае результат маммографии считается сомнительным.
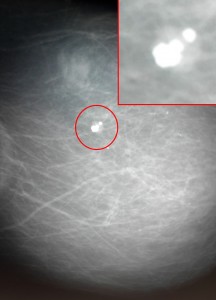
Фиброаденома на маммографии, требующая динамического наблюдения. Видно объемное образование в молочной железе, имеющее неоднородную структуру за счет включения кальция (молочно-белого цвета). Обычно так выглядят организованные фиброаденомы, и у врача-рентгенолога велик соблазн сделать уверенное заключение о доброкачественных изменениях. Однако, это неправильно. При выявлении подобных образований необходимо выставлять категорию Bi-RADS 3 и назначать дополнительно УЗИ либо контроль через 6 месяцев. Это поможет отличить фиброаденому от рака.
Если рентгенолог склоняется к мнению, что выявленные им изменения, скорее всего, обусловлены раком, он выставляет категорию Bi-RADS 4. Это означает, что, скорее всего, речь идет о злокачественной опухоли – чтобы точно удостовериться в ее природе, врач должен назначить биопсию и гистологическое исследование.
Если в заключении написано Bi-RADS 5 , это неблагоприятный результат – врач не сомневается в том, что выявленное им образование действительно злокачественная опухоль. После исследования необходимо решать вопрос о верификации опухоли и о способах лечения.
Категория Bi-RADS 6 означает, что заболевание уже идентифицировано ранее, а пациентка обратилась с целью контроля.
Если в заключении написано Bi-RADS 0 , это означает, что данных недостаточно, чтобы определиться с заключением. Необходимо предоставить архив изображений либо выполнить исследование повторно.
Стандарт Bi-RADS на сегодняшний день является основным в мире. В России также все большее число маммологов переходит на классификацию Bi-RADS.
Если Вам выдали заключение по маммографии без указания категории по Bi-RADS, вы всегда можете получить Второе мнение по снимкам и получить квалифицированное описание по современным стандартам.
КОГДА ЖДАТЬ ЗАКЛЮЧЕНИЕ?
Результат может быть получен через несколько минут после исследования, а может – через несколько суток. Все зависит от загруженности врача. В то же время прослеживается следующая тенденция: в частных клиниках результат готовится быстрее.
При этом нужно понимать, что чем больше времени у врача на подготовку результата, тем более тщательный анализ маммограмм он может провести. Соответственно, и риск сделать ошибку становится меньше.
ВТОРОЕ МНЕНИЕ ПО МАММОГРАФИИ
Сегодня все чаще применяются консультации по системе Второго мнения (second opinion) — пересмотр результатов маммографии в специализированных центрах. Такая расшифровка маммографии является экспертной, ведь проводящий ее рентгенолог имеет большой опыт в диагностике рака молочной железы. Это бывает полезно при сомнительных или противоречивых результатах исследования. Встречаются случаи, когда сам пациент сомневается в выводах врача и хочет перепроверить заключение.
В России существует Национальная телерадиологическая сеть (НТРС) — служба консультаций рентгенологов, куда стекаются все спорные случаи из клиник разных городов России. Любой человек, прошедший маммографию, может перепроверить ее результаты, отправив снимки с диска для описания через сайт НТРС. Консультация осуществляется обычно в течение суток. По истечении этого времени пациент получает на почту официальное заключение с подписью врача.
Василий Вишняков, врач-радиолог
Группа изобретений относится к хирургии, предназначена для определения локализации, размеров, формы опухолевых узлов для последующей визуализации необходимой зоны резекции.
Известно устройство для внутритканевой маркировки опухоли, содержащее пункционную иглу, мандрен, внутритканевой маркер (RU 33855 U1, 20.11.2003).
Известен способ введения маркера в опухоль с помощью устройства, включающего иглу, корпус, переднюю и заднюю кнопки спуска (Биологический маркер молочной железы UltraClip ® Dual Trigger. Инструкции по применению. BARD BIOPSY SYSTEMS. 07.2012).
Известно введение маркера в ткань опухоли с помощью устройства, включающего канюлю, переходник, аппликатор, поршень, введение маркера производится нажатием на поршень (SenoMark UltraCor™ MRI 14 Cauge Tissue Marker And Introducer Kit. Instructions for Use. BARD Biopsy, 05.2015).
Известен способ маркировки опухоли для ее визуализации перед проведением неоадъювантной химиотерапии, включающий введение пункционной иглы в опухолевое образование, установку маркера в просвете пункционной иглы, вталкивание маркера посредством мандрена в опухолевое образование (RU 2242166 С2, 20.12.2004).
К недостаткам известных способов и устройств ввода маркеров относится то, что в случае необходимости установки нескольких маркеров производится несколько проколов. Это способствует дополнительной травматизации, увеличивает риск обсеменения окружающих тканей клетками из опухолевых узлов.
Технической проблемой при маркировке очага опухолевого поражения является дополнительная травматизация опухоли и окружающих тканей, производимая устройствами для маркировки, что способствует обсеменению окружающих тканей опухолевыми клетками.
Техническим результатом предлагаемого способа является обеспечение возможности мультитаргетной разметки как единственного опухолевого узла (интратуморальной - тремя маркерами внутри опухоли; перитуморальной - по контуру опухоли, на границе с неизмененными тканями), так и раздельной разметки мультифокального рака (до 3 опухолевых узлов в пределах одного квадранта молочной железы) через единственный прокол кожи и мягких тканей под инструментальным контролем (при проведении УЗИ, маммографии или МРТ молочных желез). Такая маркировка обеспечивает уменьшение повреждений, наносимых опухолевому узлу при маркировке, обеспечивает значительное сокращение протяженности раневых каналов в области опухолевого поражения, что способствует уменьшению травматизации тканей и улучшению абластики (профилактики обсеменения молочной железы опухолевыми клетками).
Указанный технический результат обеспечивается способом маркировки очага опухолевого поражения молочной железы без наружной переустановки иглы-локализатора, в котором после прокола кожи и мягких тканей иглу-локализатор с тремя маркерами подводят к ближайшему краю опухолевого узла, продвигают иглу-локализатор к первой позиции введения, при достижении которой продвижение иглы-локализатора прекращают и выдавливают первый маркер, а установку второго и третьего маркера осуществляют без наружной переустановки иглы-локализатора, для чего иглу-локализатор подтягивают на себя через раневой ход до тех пор, пока внутренний срез иглы не окажется вновь перед ближайшим краем опухолевого узла, при этом изменяют угол введения иглы-локализатора в опухолевый узел и продвигают иглу-локализатор вглубь опухолевого узла к следующей позиции введения, при достижении которой продвижение иглы-локализатора прекращают и выдавливают маркер во вторую и третью позицию введения соответственно, после введения трех маркеров иглу-локализатор вынимают из раневого хода.
В частном случае осуществления способа интратуморальной маркировки первая позиция введения находится в центральном отделе опухолевого узла.
В частном случае осуществления способа перитуморальной маркировки по контуру опухоли первая позиция введения находится на границе дистального края опухолевого узла и неизмененных тканей, вторая позиция введения находится на границе верхнего края опухолевого узла и неизмененных тканей, а третья позиция введения находится на границе нижнего края опухолевого узла и неизмененных тканей.
Указанный выше технический результат также обеспечивается способом мультитаргетной маркировки до трех опухолевых очагов в пределах одного квадранта молочной железы без наружной переустановки иглы-локализатора, в котором после прокола кожи и мягких тканей иглу-локализатор с включенными в нее тремя маркерами продвигают в центр первого опухолевого узла, при достижении центра первого опухолевого узла продвижение иглы-локализатора прекращают и выдавливают первый маркер, установку второго маркера осуществляют без наружной переустановки иглы-локализатора, для чего иглу-локализатор подтягивают на себя через кожный ход до тех пор, пока игла не выйдет полностью из опухолевого узла, но без выхода наружу из раневого канала, изменяют угол входа иглы-локализатора, продвигают иглу-локализатор ко второму опухолевому узлу и вводят в его центр, при достижении центра второго опухолевого узла прекращают продвижение иглы-локализатора, выдавливают второй маркер в центр второго опухолевого узла, установку третьего маркера осуществляют также без наружной переустановки иглы-локализатора, для чего иглу-локализатор вновь подтягивают на себя через кожный ход до тех пор, пока игла-локализатор не выйдет полностью из второго опухолевого узла, но без выхода наружу из раневого канала, изменяют угол введения иглы-локализатора, продвигают иглу-локализатор в третий опухолевый узел, при достижении центра которого прекращают продвижение иглы-локализатора и выдавливают третий маркер, и после введения маркеров иглу-локализатор вынимают из раневого хода.
Продвижение иглы-локализатора осуществляют под инструментальным контролем.
Для выполнения способа используется устройство (фиг. 1-5).
Фиг. 1: устройство в сборе.
Фиг. 2: рукоятка иглы.
Фиг. 3: рукоятка штока.
Фиг. 4: игла с рукояткой.
Фиг. 5: шток с рукояткой.
Способ маркировки опухолевого поражения показан на фиг. 6-8.
Фиг. 6: мультитаргетная интратуморальная маркировка опухоли.
Фиг. 7: мультитаргетная перитуморальная маркировка опухоли.
Фиг. 8: мультитаргетная маркировка опухоли, состоящей из трех опухолевых узлов.
Устройство для ввода имплантов в биологическую ткань пациента содержит иглу 1 в виде трубки длиной 50-250 мм и внешним диаметром 0,5-2,5 мм, в которой размещены последовательно один за другим три импланта, шток 5 с рукояткой 2 и съемный защитный фиксатор 4 для предотвращения выпадения штока. На одном из концов иглы 1 закреплена рукоятка иглы 3, а другой ее конец выполнен в виде заостренного наконечника. Защитный фиксатор 4 закреплен на рукоятках иглы и штока. Рукоятка иглы 3 выполнена в виде втулки с четырьмя пазами, каждый паз имеет форму параллелепипеда, различной длины, пазы расположены по окружности под углом 90° друг к другу. Рукоятка штока 5 на торце имеет радиальный выступ, выполненный в форме параллелепипеда с возможностью вхождения в упомянутые пазы втулки. Шток 5 выполнен с возможностью возвратно-поступательного движения внутри иглы. Конец штока, противоположный торцу рукоятки штока, выполнен с возможностью выдавливания размещенных в игле имплантов в биологическую ткань. Один из четырех пазов втулки - нулевой паз - предназначен для фиксации штока, например, при его транспортировке. Расположение выступа рукоятки штока в нулевом пазу препятствует случайному срабатыванию устройства и предотвращает преждевременный ввод имплантов. Три других - первый, второй и третий - выполнены разной длины, которая рассчитывается из условия обеспечения выдавливания штоком соответствующего импланта, размещенного в игле. Нулевой паз располагается напротив второго паза и под углом 90° по часовой стрелке к первому пазу и под углом 90° против часовой стрелки к третьему пазу. Таким образом, при попадании выступа рукоятки штока в первый паз рукоятки иглы посредством штока выдавливается первый имплант, находящийся относительно наконечника иглы, при попадании во второй паз - второй имплант, а в третий паз - третий имплант.
Для осуществления способа используются маркеры (метки), расположенные у острия трубки последовательно один за другим и предназначенные для введения в организм человека и длительного пребывания в нем.
Маркеры (метки) изготовлены из рентгеноконтрастного материала (пример: титан, золото), имеют форму цилиндрическую или сферическую, длину от 0,3 до 10 мм, диаметр от 0,3 до 2,0 мм. Допускается вариант другой формы меток, имеющей круглое поперечное сечение с заданным радиусом кривизны продольной оси для улучшения фиксации метки в целевой области биоткани.
Способ осуществляют следующим образом.
Маркировка первичной опухоли проводится перед началом предоперационной лекарственной терапии; в асептических условиях после введения местного анестетика под инструментальным контролем (УЗИ, ММГ или МРТ молочных желез) в непосредственной близости от опухолевого очага (или опухолевых очагов) выполняется прокол кожи и мягких тканей с помощью иглы-локализатора с включенными в него тремя рентгеноконтрастными маркерами.
Дальнейшая маркировка солитарного (единственного) опухолевого узла может проводиться интратуморально (фиг. 6) или перитуморально (фиг. 7). Разметка мультицентричной зоны (до трех опухолевых узлов, расположенных в одном квадранте молочной железы, производится раздельным способом (фиг. 8); каждый из способов выполняется без наружной переустановки иглы-локализатора (через 1 прокол).
Клинические примеры, иллюстрирующие осуществление предлагаемого способа.
Больная А., 38 лет, обратилась по поводу рака правой молочной железы, T2N0M0.
Перед проведением предоперационной химиотерапии выполнена мультитаргетная интратуморальная маркировка опухоли (фиг. 6). Игла-локализатор 1 с включенными в нее тремя титановыми маркерами через единственный прокол 4 подведена к ближайшему краю опухолевого узла 3 под инструментальным контролем датчика УЗИ 2 и путем пенетрационного введения продвинута в центральный отдел опухоли (6а). При достижении необходимой зоны установки первого маркера (определено данными УЗИ) пенетрационное введение иглы-локализатора прекращено и путем продвижения штока выдавлен первый маркер в патологическую зону (6б). Установка второго маркера проведена без наружной перестановки стилета иглы: игла-локализатор подтянута на себя через кожный ход до тех пор, пока внутренний срез иглы не оказался вновь перед ближайшим краем опухолевого узла (6в). Изменен угол входа в опухоль, игла-локализатор продвинута вглубь опухоли к другой зоне необходимой разметки, определяемой по данным УЗИ, при достижении этой зоны прекращен пенетрационный ввод иглы-локализатора, с помощью штока выдавлен второй титановый маркер в патологическую зону (6г). Установка третьего маркера проведена аналогично: игла-локализатор вновь подтянута на себя через кожный ход до тех пор, пока внутренний срез иглы не оказался перед ближайшим краем опухолевого узла (6д). Изменяя угол входа в опухоль, игла-локализатор продвинута в опухолевый узел к третьей зоне необходимой разметки, определяемой по данным УЗИ, при достижении третьей зоны необходимой разметки прекращен пенетрационный ввод иглы-локализатора и с помощью штока выдавлен третий маркер в патологическую зону (6е). После введения маркеров игла-локализатор вместе со штоком вынута из раневого хода (6ж).
Пациентке проведено 6 циклов запланированной предоперационной полихимиотерапии, с полным клинико-рентгенологическим ответом, больной выполнено последующее радикальное органосохраняющее лечение.
Больная Я., 44 года, обратилась по поводу рака правой молочной железы, T2N1M0.
Перед проведением предоперационной химиотерапии выполнена мультитаргетная перитуморальная маркировка опухоли (фиг. 7). От ближайшего края опухолевого узла игла-локализатор 1 через единственный прокол 4 путем пенетрационного введения подведена к дистальному краю опухолевого узла 3 (т.е. к краю опухолевого узла, наиболее удаленному от оперирующего хирурга), определяемому по данным датчика УЗИ 2, при достижении дистального края опухолевого узла ввод иглы остановлен (7а). С помощью штока в опухолевый край на границе с неизмененными тканями из иглы-локализатора выдавлен первый маркер (7б). Установка второго и третьего маркеров проведена без наружной переустановки иглы-локализатора. Игла-локализатор подтянута на себя через кожный ход до тех пор, пока внутренний срез иглы не оказался вновь перед ближайшим краем опухолевого узла (7в). С изменением угла входа в опухоль игла-локализатор продвинута к верхнему краю опухоли под контролем УЗИ, при достижении верхнего края опухоли пенетрационное введение прекращено и с помощью штока из иглы-локализатора выдавлен второй маркер на границу с неизмененными тканями молочной железы (7г). Игла-локализатор подтянута на себя до тех пор, пока кончик иглы не оказался перед ближайшим краем опухоли (7д). Изменяя угол введения, игла-локализатор подведена к нижнему краю опухоли. Третий маркер выдавлен с помощью штока на границу с неизмененной тканью молочной железы (7е), после чего игла-локализатор вместе со штоком вынута из раневого хода (7ж).
Пациентке проведено 8 циклов предоперационной полихимиотерапии с выраженным частичным ответом (сокращение размера опухоли на 80%), больной выполнено последующее органосохраняющее лечение.
Больная Н., 32 года, обратилась по поводу мультифокального рака левой молочной железы, T2N1M0 (3 узла в пределах одного квадранта молочной железы).
Перед проведением предоперационной химиотерапии выполнена мультитаргетная маркировка опухоли (фиг. 8). После единственного прокола 4 кожи и мягких тканей под инструментальным контролем датчика УЗИ 2 игла-локализатор 1 продвинута в центр первого опухолевого узла 3 (8а). При достижении центра узла (определенного при УЗИ) ввод иглы прекращен и с помощью штока в центр первого опухолевого узла выдавлен первый маркер (86). Игла подтянута на себя так, что она полностью вышла из первого опухолевого узла (8в), но без наружного выхода из раневого канала. С изменением угла ввода игла-локализатор продвинута ко второму опухолевому узлу и пенетрационно введена в его центр (8г), при достижении центра второго опухолевого узла продвижение иглы остановлено и с помощью штока в патологическую зону выдавлен второй маркер (8д). Далее игла-локализатор подтянута на себя так, что она полностью вышла из второго опухолевого узла, но без наружного выхода из раневого канала (8е). С изменением угла ввода игла-локализатор подведена к третьему опухолевому узлу и введена в его центр под контролем УЗИ (8ж). После достижения центра третьего опухолевого узла продвижение иглы-локализатора прекращено и в опухолевый узел выдавлен третий маркер (8з). После установки третьего маркера игла-локализатор вместе со штоком удалена из раневого канала (8и).
Пациентке проведено 6 циклов предоперационной полихимиотерапии с полным клинико-рентгенологическим ответом. Больной выполнена запланированная органосохраняющая операция.
Читайте также:

