Что такое лт в онкологии
Как понять это симптомы последствий ЛТ или конец?
Добрый день,
Диагноз рак 3 ст. Поражена матка, шейка матки. поражены подвздошные лимфоузлы. В период с 19 июля по 30 августа была проведена лучевая терапия.
ХТ не возможна, т.к. бабушке 75 лет и почки не выводят химию.
К концу курса ЛТ ухудшилось состояние. На момент выписки не могла сама ходить.
В течение недели после выписки состояние только ухудшается. Она не встает, не может держать ничего в руках. Вчера стала заговариваться и бредить во сне.
Ярко выраженного болевого синдрома нет.
Скажите может это временное состояние -реакция сарого организма на ЛТ, или она умирает?
Уважаемые врачи, прошу проконсультировать возможно ли еще какое-либо лечение? Или только обезболивание?
Эпикриз:
ДАТА РОЖДЕНИЯ: 24.10.1934, Возраст: 75
ОТДЕЛЕНИЕ: 2 радиологическое, с 30.07.2010 по 30.08.2010, проведено койко-дней: 31 ДИАГНОЗ: С53 Злокачественное новообразование шейки матки; Т2Ь Nl М0 ; Стадия IIIС
Эндофитная форма. Маточно параметральный вариант. Метастазы в парааортальные, подвздошные л/узлы. Болевой синдром. Курс сочетанной лучевой терапии (синхронизация с цисплатином).
Дата установления диагноза: 22.06.2010
Сопутствующие патологии: Церебральный атеросклероз. Артериальная гипертензия II, риск III. Ишемическая болезнь сердца. Атеросклеротический кардиосклероз. НК 2. ХСН I, Хронический пиелонефрит. Киста правой почки. НЖО II. S-образный сколиоз, остеохондроз, деформирующий спондилез поясничного отдела позвоночника. Остеохондроз грудного отдела позвоночника, торакалгия слева.
Состояние при поступлении: удовлетворительное
St Localis: осмотр на кресле: слизистая влагалища розовая, на левой стенке в с\3 плотное ярк-красное образование до 7мм; шейка матки бугристая, плотная, полностью замещена опухолью, матка обычного размера, ограничено подвижна, параметрии инфильтрированы с обеих сторон
№ гистологического исследования: 12945-51
Дата гистологического исследования: 22.06.2010
Результат гистологического исследования: в соскобе из полости матки пласты плоскоклеточного, светлоклеточного рака
г.о. N2 20723-24 от 06.07.10г. (биопсия шейки матки) - очаги плоскоклеточного неороговевающего рака с изъязвлением.
ЛУЧЕВОЕ ЛЕЧЕНИЕ, Вид лучевой терапии: Радикальная (лечебная) Метод ЛТ: Сочетанная лучевая терапия
Область облучения: шейка матки и регионарньrе л/у Дата начала курса: 19.07.2010
Дата окончания курса: 31.08.201 О Кратность курса: один раз в день РОД (в Гр): 2
СОД (в Гр): 46
Примечание к лучевой терапии: курс лучевой терапии начат в ХО N 6. дистанционный компонент на РОКУС-АМ с 2 противолежащих полей до 16 Гр, затем подключена внутриполостная гамма-терапия на АГАТ-¬ВУ кольпометростатом по 7 Гр через 5 дней № 7 СОД 49 гр. Дистанционная гамма-терапия продолжена с 4 полей на параметрии и лимфоузлы малого таза. Одновременно проведена дистанционная гамма-терапия на парааортальньrе лимфоузлы с 2 противолежащих полей 8*8см РОД 2 Гр до СОД 40 Гр. За время проведения лучевой терапии выполнено два введения цисплатина 50 мг и 30 мг С целью синхронизации. После введения химиопрепарата отмечено нарастание креатинина крови до 146 мкмоль/л, ухудшение общего самочувствия, слабость, выраженное головокружение. От продолжения введения химиопрепаратов решено воздержаться. Состояние после лечения: удовлетворительное
Пациент полностью информирован о своём заболевании. Проводилась гемостимулирующая, кардиотропная (диротон 2,5 мг в день, кардикет 20мг*2р в день, преп. калия) терапия. Аналъгезирующая терапия (промедол, трамадол, кеторол). Лечение перенесла удовлетворительно. Боли на фоне лучевого лечения уменьшились, сохраняются боли в левой нижней конечности при нагрузке. 06.08 торакалгия слева, проводилось лечение. Сохраняется анемия легкой степени, признаков ХПН нет. При ocмoтpe на кресле - шейка несколько уменьшилась в объеме, покрыта фибрином, подвижность матки увеличилась, инфильтрация сводов уменьшилась.
Рекомендовано: Наблюдение районного онколога, терапевта, гинеколога.
Продолжить вводить в прямую кишку свечи с мелилурацнлом или облепихой по одной 2 раза в день 1-2 мес. Томпоны и свечи с метилурацилом во влагалище один раз в день 1-2 мес. На кожу в области полей облучения наносить метилурацнловую мазь.
Канефрон 2 др*3 раза в день 1 мес. Аевит lк*2 раза в день 1 мес. Препараты железа, витамины. Рентгенография тазобедренных суставов (коксартроз слева?), консультация невропатолога по месту жительства. При болях кеторол или трамадол.
Направить на МСЭК по месту жительства.
Явка через 3 мес к онкогинекологу с ОАК, ОАМ, УЗИ малого таза, забрюшинных, тазовых лимфоузлов, печени.
экг: 06.08.2010, ритм: синусовый, ЧСС (ударов в минуту): 55, ЭОС: полугоризонтальная
3аключение (экг): выраженные диффузныe изменения в миокарде, умеренная нагрузка на правый желудочек
Бабушка с каждым днем слабеет, апетита нет, максимум 2 ложки каши и 2 глотка ряженки.
Полное бессилие: не встает, не садится, плохо говорит. Забывается.
Болей в течение недели после выписки не было вчера появились, не ярко выраженные и не локализованые.
Есть ли шансы на лечвение? Если да то какое лечение показано?
при таком функциональном статусе никакой врач в здравом рассудке никогда не станет лечить больную ни химией, ни операцией, так что если статус не исправится, то речь может идти только об обезболивании, если вообще оно необходимо
Владимир Борисович, спасибо за ответ.
Т.е. я понимаю это ее последние дни.
Она уже тяжело дышит , хрипит, второй день. Даю трамадол и на ночь феназипам.
Онкологические заболевания в современном мире встречаются все чаще. Это связано с особенностями экологии, множеством новых вирусов, а также с большим количеством канцерогенов. Ежегодно ученые вводят новые методы борьбы с раком. Однако прежние способы лечения применяются до сих пор. Одним из них является ПХТ. Расшифровка этой аббревиатуры – полихимиотерапия. Системное введение цитостатических препаратов помогает устранить атипичные клетки, из которых состоит опухоль. Несмотря на то что данный вид лечения нелегко переносится пациентами, он является одним из самых эффективных методов.
ПХТ в онкологии: расшифровка аббревиатуры
В медицинской документации людей, страдающих от раковых заболеваний, часто встречается такое понятие, как химиотерапия. Сокращенно ее называют ПХТ. В онкологии расшифровка данной аббревиатуры - полихимиотерапия, что означает сочетанное воздействие сразу нескольких цитостатических средств. Данный вид лечения направлен на полное устранение опухоли или ее уменьшение.
В большинстве случаев ПХТ сочетают с другими методами лечения. Среди них – хирургическое удаление патологического образования и лучевая терапия. Иногда полихимиотерапия является самостоятельным методом лечения. Выбор ПХТ зависит от расположения и стадии рака, а также от состояния больного. Назначать цитостатические препараты может только врач-онколог.
Виды химиотерапии в онкологии

Противоположным понятием является адъювантная ПХТ в онкологии. Расшифровка аббревиатуры проста. АПХТ – это профилактическое лечение рака после операции. Имеется в виду, что саму опухоль полностью удалили, однако для предотвращения рецидива требуется цитостатическая терапия. Перечисленные виды ПХТ относятся к комбинированному или комплексному лечению злокачественных опухолей. То есть, помимо назначения препаратов, пациенту проводится операция, а иногда – и облучение.
Отдельным видом терапии является самостоятельный (лечебный) курс ПХТ в онкологии. Расшифровка подобного медицинского термина понятна не каждому врачу. Зачастую отличить лечебный курс от профилактической терапии может только онколог. Самостоятельная ПХТ проводится в тех случаях, когда другие методы оздоровления не показаны. Например, при мелкоклеточном раке легкого или наличии метастазов в отдаленные органы.
Показания к проведению терапии
Стоит отметить, что каждая злокачественная опухоль лечится по-разному. Иногда достаточно только оперативного лечения или облучения, в других случаях – требуется химиотерапия. ПХТ назначают лишь по специальным медицинским показаниям, когда это необходимо. Если подобное лечение не было предложено после операции врачом, значит злокачественный процесс был ограничен небольшим участком и не поразил глубокие слои органа. Кроме того, некоторые типы опухолей не поддаются химиотерапии. Выделяют следующие показания для ПХТ в онкологии:
- Злокачественные образования лимфоидной ткани.
- Рак крови.
- Опухоли пищеварительного тракта.
- Мелко- и крупноклеточный рак легкого.
- Новообразования головы и шеи.
Следует отметить, что эффективность химиотерапии зависит от гистологического типа опухоли. К примеру, железистый рак поддается цитостатическому лечению лучше, чем плоскоклеточная карцинома или саркома. Зачастую ПХТ не назначают на первых стадиях болезни, если опухоль можно удалить оперативным путем. Адъювантная терапия показана пациентам, у которых после хирургического лечения была обнаружена 2 или 3 стадия рака. Если опухоль имеет большой размер и проросла в соседние органы, назначают самостоятельный курс ПХТ. Иногда данный вид лечения применяется на поздней стадии рака, когда другие методы бессильны.
Что такое курс химиотерапии?
Большинство людей знает, что химиотерапию принято назначать курсами. Это означает, что цитостатические средства вводятся в организм неоднократно, а на протяжении длительного времени - с определенными промежутками. Подобная схема лечения необходима, потому что препараты разрушают не только саму опухоль, но и другие клетки организма. Введение большой дозы единовременно невозможно, так как цитостатики обладают кардио-, нефро- и гепатотоксичным действием. Чтобы организм восстановился после курса ПХТ, требуется время. В среднем это занимает 2-4 недели. За этот период клетки крови успевают обновиться, и общее самочувствие пациента приходит в норму.
Количество курсов ПХТ в онкологии может быть различным. Оно зависит от переносимости препаратов, состояния больного и эффективности лечения. После 3 курсов проводится обследование, благодаря которому врач делает соответствующее заключение. Если опухоль полностью исчезла или частично уменьшилась, химиотерапию продолжают. В случаях, когда имеется прогрессирование злокачественного процесса, схему ПХТ меняют. При этом отсчет курсов начинается заново.
Подготовка и сопроводительная терапия
Противопоказания к назначению химиотерапии
Несмотря на то что химиотерапия относится к одним из самых эффективных методов лечения рака, ее проведение не всегда необходимо. В некоторых случаях цитостатические средства приносят больше вреда, чем пользы. Проведение ПХТ противопоказано в следующих случаях:
- Старческий возраст (от 70 лет).
- Непереносимость цитостатических средств.
- Наличие тяжелых патологий со стороны сердца.
- Почечная и печеночная недостаточность.
- Прогрессирование заболевания, несмотря на проводимую терапию.
- Наличие множественных метастазов.
- Кахексия.
Перед тем как назначить ПХТ, проводится комплекс обследований. К ним относятся: общий и биохимический анализ крови, ЭКГ, ОАМ, коагулограмма, УЗИ сердца. При выявлении декомпенсированных заболеваний лечение цитостатиками нецелесообразно.
Возможные результаты химиотерапии
Для контроля эффективности ПХТ проводится повторное обследование. Благодаря этому оценивается результат терапии. К благоприятным исходам лечения относятся: полный и частичный регресс опухоли, а также стабилизация. В первом случае новообразование исчезает или уменьшается в размере в 2 раза и более. Стабилизация процесса означает, что опухоль осталась прежней. Однако это расценивается как положительный результат, ведь без лечения рак быстро прогрессирует.
Если при обследовании выявлено, что злокачественное образование растет, или появились метастазы, схему лечения меняют. При удовлетворительном состоянии пациента количество курсов химиотерапии неограниченно. Однако постоянное прогрессирование служит показателем того, что лечение не приносит результата, а только вредит организму. Это служит противопоказанием для назначения ПХТ.

Список лекарственных средств
Облучение после операции

К корпускулярным типам относят:
- α и β — частицы;
- нейтронное;
- ионы углерода;
- протонное,
К волновому относят γ и рентген-излучение.
Метод предусматривает не разрушение опухолевых клеток, как думают многие, то есть некроз, что было бы очень печально для организма и привело бы его неминуемому отравлению, а инактивацию раковых клеток.
Инактивация в данном случае — это прекращение деления атипичной клетки, разрушение связей на уровне молекулы из-за:
- ионизации атомарной структуры ДНК;
- радиолиза воды в жидкой части патологической клетки.
Радиолиз означает, что вода в цитоплазме клетки формирует перекись и свободные радикалы, воздействующие на структуру ДНК.
Повреждает ли здоровые клетки такая терапия? Конечно. Облучение можно использовать потому, что оно наиболее действенно в отношении быстро делящихся и стремительно растущих клеток. Такими качествами обладают:
- раковые клетки;
- нормальные клетки красного костного мозга.
Типы терапии в онкологии
Лучевая терапия в зависимости от времени ее проведения делится:
- на адъювальную (постоперационную);
- неадъювадьную (предоперационную) или индукционную.
Адъювадьное лечение нацелено на предотвращение рецидива болезни. Женщинам после органосохраняющей операции на молочных железах часто назначается ЛТ для предотвращения рецидива.
Неадъювальная терапия проводится до операции. Ее цель облегчить проведение процедуры для врача, снизить скорость роста опухоли на период подготовки к операции и повысить выживаемость пациента.
В лечении онкобольных применяют терапию:
- контактную (брахивальную);
- дистанционную;
- радионулкидную.
В первом случае облучается непосредственно опухоль. То есть источник излучения прикладывается к опухолевым тканям:
- интраоперативно;
- на поверхностную опухоль;
- в интерстициальную (закрытую тканями) опухоль в виде игл, шариков и т.п.
Метод щадящий, но на практике применяется редко. Дистанционное воздействие имеет больше побочных эффектов. Проводится сквозь здоровые ткани ради разрушения глубоко лежащих опухолей. Этот метод самый распространенный. Он универсальный и его можно использовать при разных новообразованиях.
Последний метод предполагает введение радионудлида или составного фармпрепарата в сосуд или через рот. Радионуклид накапливается в опухолевых тканях и разрушает его.
ЛТ может быть элементом комплексного лечения и использоваться после химиотерапии или совместно с ней. Иногда такого курса достаточно, и можно избежать оперативного вмешательства.
Для лечения опухолей локализующихся вне молочной железы могут использоваться и другие методы ЛТ (РТМИ, РТВК, стереотаксическая радиохирургия).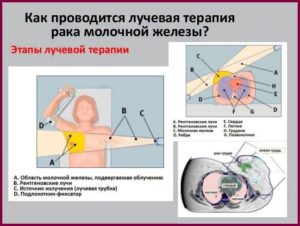
Этапы лечения
В ЛТ входит предлучевой этап (выбор дозы, подготовка к облучению), лучевой и постлучевой. Лучевой этап после операции длится 14-21 день, при самостоятельном лучевом лечении курс пролонгируется до 4-6 недель.
Обычно сеансы проводят ежедневно пять дней подряд с интервалом в два дня ради восстановления тканей. Постлучевой этап начинается сразу после окончания процедур. Этот период требует щадящего режима, правильного питания и позитивного эмоционального настроя.
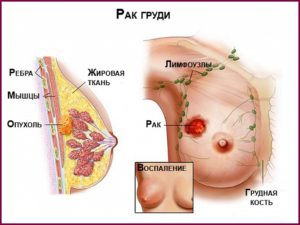
Лечение рака молочной железы обычно предполагает постоперационную ЛТ. Такое лечение должно уничтожить очажки неоплазии, оставшиеся после операции. Если у вас есть метастазы, цель ЛТ — уменьшение размера опухолевого очага и уменьшения боли при развитии рака.
Правила поведения в период ЛТ
Питание при ЛТ своеобразное:
- дробное;
- полноценное;
- высококалорийное;
- витаминизированное;
- с достаточным количеством минералов.
Пить нужно при лучевом лечении много, порядка 3 литров, включая соки, витаминные чаи, минеральную воду.
При ЛТ нельзя курить или принимать алкоголь. Вредные привычки при раке вообще противопоказаны. Также стоит убрать из своего рациона всевозможные сласти. Косметика и парфюмерия в период лечения могут полежать на полочке. Когда принимаете душ, не заливайте водой места облучения и не используйте мыло. Оно сушит кожу.
Если ткани в месте облучения зудят и краснеют, обратитесь к врачу. Не нужно самостоятельных мер (приложения холодных примочек или смазывания мазями). Носите одежду из натуральных тканей, свободного покроя, избегая трения облучаемых мест. Участки, подверженные облучению, нужно защищать от прямого солнечного света.
В процессе лечения, не пренебрегайте обычными рекомендациями для выздоравливающих: гуляйте, полноценно спите. Умеренная физическая активность вам только на пользу.
Последствия ЛТ
Последствия обработки ракового очага при ЛТ в основном связаны с одновременным повреждением здоровых тканей. Побочные эффекты могут быть:
- локальными (местными);
- системными.
- зуд;
- шелушение;
- гиперемию кожи;
- появление волдырей в зоне облучения, затем их изъязвления;
- усиление ломкости сосудов, кровоизлияния.
Системные осложнения развиваются, потому что опухолевые клетки погибают под воздействием излучения, продукты их распада попадают в системный кровоток, развиваются лучевые реакции:
- повышенная утомляемость и слабость;
- ЖКТ-расстройство (тошнота, рвота);
- ухудшение качества кожи и ее придатков (ломкость ногтей и выпадение волос);
- угнетается кроветворение и нарушение системы крови.
Кроме описанного разделения, специалисты делят последствия от ЛМ на лучевые:
- реакции;
- осложнения.
Первые развиваются в течение первых 3 месяцев после лечения, вторые — после трехмесячного рубежа.
После лечения
Реабилитация начинается сразу после окончания терапии. Первая консультация онколога проводится в промежутке с 1 по 3 месяц. Все последующие консультации проводятся раз в полугодие. Сроки реабилитации и специфические меры зависят от степени развития осложнений и интоксикации здоровых тканей.
В этот период важна диета (витамины, минералы и белки), здоровый сон и умеренная физическая активность. Обязателен контроль за состоянием тканей с помощью УЗИ и МРТ методов. Некоторые пациенты не ощущают серьезных последствий после ЛТ. Их беспокоит легкая слабость, которая быстро проходит при правильной диете и полноценном отдыхе. Реже развивается полноценная лучевая реакция.
На этом мы прощаемся с вами. Надеемся, наша статья помогла вам понять суть лучевого лечения при раке молочной железы. Читайте наши новые тексты и приглашайте друзей через социальные сети.
Лучевая терапия
- Лучевая терапия — радиотерапия
- Что же такое радиотерапия?
- Брахитерапия — внутренняя лучевая терапия
- Адъювантное лечение с радиотерапией
- Индукционная радиотерапия
- Комбинированное лечение
- Стереотаксическая радиохирургия
Лучевая терапия — радиотерапия
Лучевая терапия (радиотерапия) является общепринятым безопасным и эффективным методом лечения злокачественных опухолей. Преимущества данного метода для пациентов неоспоримы.
Радиотерапия обеспечивает сохранение анатомии и функции органа, улучшает качество жизни и показатели выживаемости, уменьшает болевой синдром. Уже десятилетия лучевая терапия при раке (ЛТ) широко используется при большинстве онкологических заболеваний. Никакой другой метод лечения рака не способен столь же эффективно заменить ЛТ с целью уничтожения опухоли или облегчения боли и других симптомов.

Лучевая терапия используется при лечении практически всех злокачественных новообразований, в каких бы тканях и органах они не возникали. Облучение при онкологии используется отдельно или в сочетании с другими методами, например хирургической операцией или химиотерапией. Радиотерапия может проводиться с целью полного излечения от рака или облегчения его симптомов, когда исчезновение опухоли невозможно.
В настоящее время полное излечение возможно более чем в 50% случаев злокачественных опухолей, для чего крайне важна радиотерапия. Как правило, радиология на каком-либо этапе заболевания требуется около 60% пациентов, проходящих лечение по поводу рака. К большому сожалению, в российской действительности этого не происходит.
Лучевая терапия в онкологии подразумевает лечение злокачественных новообразований с помощью высокоэнергетического излучения. Онколог-радиолог использует облучение с целью полного излечения от рака или облегчения болевого синдрома и других симптомов, которые вызваны опухолью.
Принцип действия облучения при раке сводится к нарушению репродуктивных возможностей раковых клеток, то есть их способности к размножению, в результате чего организм естественным образом избавляется от них.
Радиотерапия повреждает раковые клетки путем негативного влияния на их ДНК, в результате чего клетки более не способны делиться и расти. Данный метод лечения рака является самым эффективным при уничтожении активно делящихся клеток.
Высокая чувствительность клеток злокачественных опухолей к излучению обусловлена двумя основными факторами:
- они делятся намного быстрее здоровых клеток и
- они не способны к такому же эффективному восстановлению повреждений, как здоровые клетки.
Онколог-радиолог может проводить наружную (внешнюю) радиотерапию, источником излучения при которой является линейный ускоритель заряженных частиц (устройство, ускоряющее электроны с целью формирования рентгеновских или гамма-лучей).
Облучение при раке также возможно с помощью источников радиоактивного излучения, которые помещаются в организм пациента (так называемая брахитерапия, или внутренняя ЛТ).
При этом радиоактивное вещество находится внутри игл, катетеров, зерен или специальных проводников, которые временно или постоянно имплантируются внутрь опухоли или размещаются в непосредственной близости от нее.
Брахитерапия является весьма распространенным методом лучевой терапии при раке предстательной железы, матки и шейки матки или молочной железы. Метод излучения настолько точно воздействует на опухоль изнутри, что последствия (осложнения после лучевой терапии на здоровые органы) — практически исключаются.
Некоторым пациентам, страдающим злокачественной опухолью, радиотерапия назначается вместо хирургического вмешательства. Подобным образом нередко проводится лечение рака предстательной железы и рака гортани.
В некоторых случаях ЛТ является лишь частью плана лечения пациента. В тех случаях, когда облучение при раке назначается после хирургической операции, оно называется адъювантным.
Например, женщине лучевая терапия может быть назначена после органосохраняющей операции на молочной железе. Это позволяет полностью излечить рак молочной железы и сохранить анатомию груди.
Кроме этого, возможно проведение радиотерапии до хирургического вмешательства. В таком случае она носит название неоадъювантной или индукционной и позволяет улучшить показатели выживаемости или облегчить для хирурга проведение операции. Примерами такого подхода служит облучение при раке пищевода, прямой кишки или легких.
В некоторых случаях перед хирургическим удалением рака ЛТ назначается пациенту совместно с химиотерапией. Комбинированное лечение позволяет уменьшить объем оперативного вмешательства, который мог бы потребоваться в противном случае. Например, некоторым пациентам, страдающим раком мочевого пузыря, при одновременном назначении всех трех методов лечения удается полностью сохранить данный орган. Возможно одновременное проведение химиотерапии и радиотерапии без хирургического вмешательства с целью улучшения местного ответа опухоли на лечение и уменьшения выраженности метастазирования (распространения опухоли).
В некоторых случаях, например при раке легких, органов головы и шеи или шейки матки, подобного лечения может оказаться вполне достаточно без необходимости проведения операции.
Поскольку излучение повреждает и здоровые клетки, очень важно, чтобы оно было прицельно направлено на область раковой опухоли. Чем меньше облучение воздействует на здоровые органы, тем меньше возможно негативное последствие лучевой терапии. Именно поэтому при планировании лечения используются различные методы визуализации (отображения опухоли и окружающих ее органов), что обеспечивает точную доставку излучения к опухоли, защиту рядом расположенных здоровых тканей и уменьшение выраженности побочных эффектов и осложнений радиотерапии впоследствии.
Более точное соответствие дозы излучения объему новообразования обеспечивает современный метод трехмерной конформной лучевой терапии под названием радиотерапия с модулированной интенсивностью (РТМИ). Данный метод облучения при раке позволяет безопасно подводить к опухоли более высокие дозы, чем при традиционной ЛТ. Нередко РТМИ используется совместно с радиотерапией под визуальным контролем (РТВК), что обеспечивает крайне точную доставку выбранной дозы излучения к злокачественному новообразованию или даже какой-либо определенной зоне внутри опухоли. Современные разработки в области радиологии в онкологии, такие как РТВК, позволяют подстраивать ход процедуры под особенности органов, склонных к движению, например легких, а также под опухоли, которые расположены близко к жизненно важным органам и тканям.
Лучевая терапия также используется для уменьшения притока крови к опухоли, расположенной в богатых сосудами органах, например, печени. Так, в ходе стереотаксической хирургии применяются особые микросферы, наполненные радиоактивным изотопом, которые закупоривают кровеносные сосуды опухоли и вызывают ее голодание.
Помимо способа активного лечения рака, радиотерапия также является паллиативным методом. Это означает, что ЛТ позволяет облегчить боль и страдание пациентов с прогрессирующими формами злокачественных новообразований. Паллиативное облучение при раке улучшает качество жизни пациентов, испытывающих сильные боли, затруднение при передвижении или приеме пищи на фоне растущей опухоли.

Лучевая терапия — это один из ведущих методов противоопухолевого лечения, основанный на использовании ионизирующего излучения. Может применяться как самостоятельный вид терапии, так и в рамках комбинированного/комплексного лечения (совместно с другими методами), в качестве радикальной, нео- и адъювантной, консолидирующей, профилактической и паллиативной терапии.
- Виды лучевой терапии
- Этапы лучевой терапии
- Побочные эффекты лучевой терапии
- Химиолучевая терапия

Виды лучевой терапии
Уже несколько десятилетий человечество изучает воздействие ионизирующего излучение на организм человека. При этом акцентируется внимание как на положительном, так и отрицательном эффекте, возникающем при его применении. Разрабатываются новые методы, которые позволяют добиваться максимального лечебного эффекта при снижении отрицательного действия на организм. Улучшается оборудование для проведения лучевой терапии, появляются новые технологии облучения.
Сейчас классификация методов лучевой терапии довольно обширна. Мы остановимся только на самых распространенных методиках.
При контактной лучевой терапии источник излучения вводится непосредственно в опухоль или прилегает к ее поверхности. Это позволяет прицельно облучать новообразование с минимумом воздействия на окружающие его ткани.
К контактным видам лучевой терапии относятся:
- Аппликационная лучевая терапия. Применяется при лечении поверхностно расположенных опухолей, например, новообразований кожи, слизистых оболочек гениталий. В этом случае используются индивидуально изготовленные аппликаторы, которые накладываются непосредственно на поверхность новообразования.
- Внутриполостная лучевая терапия. Источник ионизирующего излучения вводится в просвет полого органа, например, в пищевод, мочевой пузырь, прямую кишку, полость матки или влагалища. Для облучения используются специальные аппликаторы (их называют эндостатами), которые заполняются радионуклидами.
- Внутритканевое облучение. Источник ионизирующего излучения вводится непосредственно в ткань опухоли. Для этого используются интростаты, которые могут иметь вид игл, шариков, трубочек, заполненных источником излучения.
Кроме того, существует такой вид лечения, как радионуклидная терапия. В этом случае используются открытые источники излучения в виде растворов радионуклидов (радиофармацевтический препарат — РФП), которые при попадании в организм прицельно накапливаются в опухолевых очагах и уничтожают их. Чаще всего РФП вводится внутривенно. Наибольшее распространение получили следующие виды радионуклидной терапии:
- Терапия радиоактивным йодом. Используется для лечения ряда видов рака щитовидной железы, поскольку йод избирательно накапливается в тиреоидной ткани.
- Применение остеотропных РФП используется для лечения метастазов в костях или костных опухолей.
- Радиоиммунотерапия — радионуклиды присоединяют на моноклональные антитела, чтобы добиться прицельного воздействия на опухолевую ткань.
При дистанционной лучевой терапии источник излучения находится на расстоянии от тела пациента, при этом на пути его прохождения могут лежать здоровые ткани, которые в процессе проведения терапии также подвергаются облучению, что приводит к развитию осложнений разной степени выраженности. Чтобы их минимизировать, разрабатываются различные технологии, позволяющие сконцентрировать максимальную дозу ионизирующего излучения непосредственно на в мишени (опухоли). С данной целью используются:
- Короткофокусная рентгенотерапия. При облучении используется рентгеновское излучение малой и средней мощности, которое способно проникать в ткани на глубину до 12 мм. Метод назван так из-за того, что источник располагается на коротком расстоянии от облучаемой поверхности. Таким способом лечат неглубокие опухоли кожи, вульвы, конъюнктивы и век, ротовой полости.
- Гамма-терапия. Этот вид излучения имеет большую проникающую способность, поэтому может использоваться для лечения более глубоко расположенных опухолей, нежели рентген-терапия. Однако сохраняющаяся большая нагрузка на окружающие органы и ткани приводят к ограничению возможности использования данного метода в современной онкологии.
- Фотонная терапия. Именно этим видом излучения проводится лучевое лечение большинства онкологических пациентов в современном мире. Достаточно высокая проникающая способность в сочетании с высокотехнологичными способами подведения дозы (IMRT и VMAT), достаточно совершенные системы планирования позволяют очень эффективно использовать этот вид излучения для лечения пациентов с приемлемыми показателями токсичности.
- Применение корпускулярного излучения (электроны, протоны, нейтроны). Эти элементарные ядерные частицы получают на циклотронах или линейных ускорителях. Электронное излучение используют для лечения неглубоких опухолей. Большие надежды возлагаются на протонную терапию, с помощью которой можно максимально прицельно подводить высокие дозы излучения к глубоко расположенным опухолям при минимальном повреждении здоровых тканей за счет выделения радиационной дозы на определённом отрезке пробега частиц, однако пока эти виды излучения играют сравнительно небольшую роль в лечении онкологических заболевания из-за своей высокой стоимости и ряда не до конца решённых технологических аспектов реализации метода.
Этапы лучевой терапии
Весь процесс проведения лучевой терапии делят на три этапа:
- Предлучевая подготовка (КТ-симуляция), этап выбора объёмов облучения и критических структур, этап дозиметрического планирования, верификации плана лучевой терапии.
- Этап облучения.
- Постлучевой этап.
Как правило, этап планирования занимает несколько дней. В это время проводятся дополнительные исследования, которые призваны дать возможность врачу более точно оценить границы опухоли, а также состояние окружающих ее тканей. Это может повлиять на выбор вида лучевой терапии, режима фракционирования, разовой и суммарной очаговых доз. Основой же данного этапа является выполнение так называемой КТ-симуляции, то есть компьютерной томографии необходимого объёма с определёнными параметрами и в определённом положении тела пациента. Во время КТ-симуляции на кожу пациента и/или его индивидуальные фиксирующие устройства наносятся специальные метки, призванные помочь правильно укладывать пациента в дальнейшем, а также облегчить задачу навигации по время проведения сеансов облучения.
Затем врач-радиотерапевт рисует объёмы облучения и критических структур (тех, на которые будет предписано ограничение дозы) на полученных срезах КТ с учётом данных других диагностических модальностей (МРТ, ПЭТ). Далее формируется задача для медицинского физика, включающая определение доз, которые должны быть подведены к мишени, мишеням или отдельным её частям, а также тех, которые не должны быть превышены в объёмах здоровых органов и тканей. Медицинский физик разрабатывает дозиметрический план в соответствии с заданными параметрами, при соблюдении которых и успешной верификации данного плана на фантоме, можно считать пациента готовым к лучевой терапии.
На этапе подготовки к лучевой терапии пациенту рекомендуется придерживаться нескольких правил:
- Отказаться от средств, раздражающих кожу.
- Если на коже в месте воздействия имеются повреждения или элементы сыпи, следует проконсультироваться с врачом.
- Если предполагается лучевая терапия в челюстно-лицевой области, требуется санация полости рта.
- Воздержаться от загара.
- Главное правило на любом этапе: обсудить все нюансы предстоящих подготовки и лечения с лечащим врачом-радиотерапевтом и строго придерживаться полученных рекомендаций!
Проведение этапа облучения будет зависеть от выбранного метода лучевой терапии.
Проведение дистанционной лучевой терапии
Продолжительность курса дистанционной лучевой терапии зависит от выбранного режима фракционирования, а также цели лечения. Паллиативные курсы, как правило, короче неоадъювантных и адъювантных, а те, в свою очередь, менее продолжительны, чем радикальные. Однако подведение радикальной дозы возможно и за один-несколько сеансов в зависимости от клинической ситуации. В таком случае курс дистанционной лучевой терапии называется стереотаксической радиотерапией или радиохирургией. Варьирует и кратность сеансов в день и в неделю: чаще всего используются схемы с пятью сеансами в неделю, однако могут быть предложены и 2-3 сеанса в день (гиперфракционирование) и схемы с 1-4 и 6 сеансами в неделю.
Во время облучения пациент в подавляющем большинстве случаев располагается лежа на столе специальной установки. Крайне необходимо соблюдать полную неподвижность во время сеанса облучения. Для достижения этого могут использоваться специальные фиксирующие устройства и системы иммобилизации.
Перед тем как включить установку, медперсонал покидает помещение, и дальнейшее наблюдение осуществляется через мониторы или окно. Общение с пациентом осуществляется по громкой связи. Во время выполнения сеанса, части аппарата и стол с пациентом совершают движения по заданной траектории. Это может создавать шум и беспокойство у больного. Однако бояться этого не стоит, поскольку вся процедура контролируется.
Сам сеанс лучевой терапии может длиться как 5-10, так и 60-120 минут, чаще — 15-30 минут. Само воздействие ионизирующего излучения не вызывает никаких физических ощущений. Однако в случае ухудшения самочувствия пациента во время сеанса (выраженной боли, судороги, приступа тошноты, паники), следует позвать медицинский персонал заранее оговоренным способом; установку сразу отключат и окажут необходимую помощь.
Контактная лучевая терапия (брахитерапия)
Брахитерапия проводится в несколько этапов:
- Введение в облучаемую зону неактивных проводников — устройств, в которые затем имплантируют источник ионизирующего излучения. При внутриполостной лучевой терапии используются приспособления, называемые эндостатами. Их устанавливают непосредственно в полость облучаемого органа и рядом с ним. При внутритканевой лучевой терапии используются интростаты, которые устанавливаются непосредственно в ткань опухоли по заранее просчитанной схеме. Для контроля их установки, как правило, используются рентгенологические снимки.
- Перемещение источника излучения из хранилища в интро- и эндостаты, которые будут облучать опухолевую ткань. Время облучения и особенности поведения пациента будут зависеть от вида брахитерапии и используемого оборудования. Например, при внутритканевой терапии, после установки источника ионизирующего излучения пациент может покинуть клинику и прийти на повторную процедуру через рекомендуемый промежуток времени. Весь этот период в его организме будет находиться интростат с радионуклидами, которые будут облучать опухоль.
Проведение внутриполостной брахитерапии будет зависеть от используемых установок, которые бывают двух типов:
- Установки низкой мощности дозы. В этом случае один сеанс облучения длится около 2-х суток. Под наркозом имплантируются эндостаты. После контроля правильности их установки и введения радионуклидов, пациент переводится в специальное помещение, где должен будет находиться все время, пока длится процедура, соблюдая строгий постельный режим. Разрешается только немного поворачиваться на бок. Вставать категорически запрещено.
- Установки высокой мощности дозы. Время облучения составляет несколько минут. Для установки эндостатов наркоза не требуется. Но во время процедуры все равно необходимо лежать абсолютно неподвижно. Внутриполостная лучевая терапия установкой высокой мощности проводится несколькими сеансами с интервалами от одного дня до одной недели.
При радионуклидной терапии пациент принимает радиофармпрепараты внутрь в виде жидкого раствора, капсул или инъекций. После этого он помещается в специальную палату, имеющую изолированную канализацию и вентиляцию. По истечении определенного срока, когда мощность дозы снизится до приемлемого уровня, проводится радиологический контроль, пациент принимает душ и переодевается в чистую одежду. Для контроля результатов лечения проводится сцинтиграфия, после чего можно покинуть клинику.
Лучевая терапия является серьезным стрессом для организма. У многих пациентов в этот период ухудшается самочувствие. Чтобы его минимизировать рекомендуется придерживаться следующих правил:
- Больше отдыхать. Минимизируйте физическую и интеллектуальную нагрузку. Ложитесь спать, когда почувствуете в этом необходимость, даже если она возникла в течение дня.
- Постарайтесь сбалансировано и полноценно питаться.
- Откажитесь на время проведения терапии от вредных привычек.
- Избегайте плотной обтягивающей одежды, которая бы могла травмировать кожу.
- Следите за состоянием кожи в месте облучения. Не трите и не расчесывайте ее, используйте средства гигиены, которые вам порекомендует врач.
- Защищайте кожу от воздействия солнечных лучей — используйте одежду и головные уборы с широкими полями.

Побочные эффекты лучевой терапии
Лучевая терапия, как и другие методы противоопухолевого лечения, вызывает ряд осложнений. Они могут быть общими или местными, острыми или хроническими.
Острые (ранние) побочные эффекты развиваются во время проведения радиотерапии и в ближайшие недели после неё, а поздние (хронические) лучевые повреждения — через несколько месяцев и даже лет после ее окончания.
Угнетенное эмоциональное состояние
Подавляющее большинство пациентов, проходящих лечение по поводу злокачественного новообразования, испытывают тревожность, страх, эмоциональное напряжение, тоску и даже депрессию. По мере улучшения общего состояния, эти симптомы стихают. Чтобы облегчить их, рекомендуется чаще общаться с близкими людьми, принимать участие в жизни окружающих. При необходимости рекомендуется обратиться к психологу.
Чувство усталости
Чувство усталости начинает нарастать через 2-3 недели от начала терапии. На это время рекомендуется оптимизировать свой режим дня, чтобы не подвергаться ненужным нагрузкам. В то же время нельзя полностью отстраняться от дел, чтобы не впасть в депрессию.
Изменение крови
При необходимости облучения больших зон, под воздействие радиации попадает костный мозг. Это в свою очередь приводит к снижению уровня форменных элементов крови и развитию анемии, повышению риска кровотечения и развития инфекций. Если изменения выражены сильно, может потребоваться перерыв в облучении. В ряде случаев могут назначать препараты, стимулирующие гемопоэз (кроветворение).
Снижение аппетита
Обычно лучевая терапия не приводит к развитию тошноты или рвоты, но снижение аппетита наблюдается довольно часто. Вместе с тем, для скорейшего выздоровления требуется полноценное высококалорийное питание с высоким содержанием белка.
Побочные реакции со стороны кожи
Вероятность развития кожных реакций и их интенсивность зависят от индивидуальных особенностей пациента. В большинстве случаев через 2-3 недели в области воздействия возникает покраснение. После окончания лечения оно сменяется пигментированием, напоминающим загар. Чтобы предотвратить чрезмерные реакции, могут назначаться специальные кремы и мази, которые наносятся после окончания сеанса. Перед началом следующего их необходимо смыть теплой водой. Если реакция выражена сильно, делают перерыв в лечении.
Реакции со стороны полости рта и горла
Если облучают область головы и шеи, могут развиться лучевой стоматит, который сопровождается болью, сухостью во рту, воспалением слизистых, а также ксеростомия вследствие нарушения функции слюнных желез. В норме эти реакции проходят самостоятельно в течение месяца после окончания лучевой терапии. Ксеростомия может беспокоить пациента в течение года и более.
Осложнения со стороны молочной железы
При прохождении лучевой терапии по поводу рака молочной железы могут возникать следующие реакции и осложнения:
- Покраснение кожи груди.
- Отек груди.
- Боль.
- Изменение размера и формы железы из-за фиброза (в некоторых случаях эти изменения остаются на всю жизнь).
- Уменьшение объема движения в плечевом суставе.
- Отек руки на стороне поражения (лимфедема).
Побочное действие на органы грудной клетки
- Воспаление слизистой пищевода, которое приводит к нарушению глотания.
- Кашель.
- Образование мокроты.
- Одышка.
Последние симптомы могут свидетельствовать о развитии лучевого пневмонита, поэтому при их возникновении следует немедленно обратиться к вашему врачу.
Побочные реакции со стороны прямой кишки/петель кишечника
- Расстройство стула — диарея или наоборот, запоры.
- Боли.
- Кровянистые выделения из заднего прохода.
Побочные действия со стороны мочевого пузыря
- Учащенное болезненное мочеиспускание.
- Наличие примеси крови в моче иногда может быть настолько выраженным, что моча приобретает кроваво-красный цвет.
- Наличие патологических примесей в моче — кристаллы, хлопья, гнойное отделяемое, слизь.
- Уменьшение емкости мочевого пузыря.
- Недержание мочи.
- Развитие везиковагинальных или везикоректальных свищей.
Побочные эффекты при облучении опухолей забрюшинного пространства, печени, поджелудочной железы
- Тошнота и рвота.
- Ознобы после сеансов.
- Боли в эпигастрии.
Химиолучевая терапия
Лучевая терапия довольно редко проводится в качестве самостоятельного лечения. Чаще всего она сочетается с каким-либо другим видом лечения: хирургическим, а чаще всего — с лекарственным. Это может быть как вариант одновременной химиолучевой терапии, так и последовательной, а также варианты сочетания лучевой терапии с иммунотерапией, таргетной и гормональной терапии. Такие виды лечения могут иметь ощутимо более высокую противоопухолевую эффективность, однако необходимо тщательно оценить риски совместных побочных эффектов, поэтому принятие решения о любом объёме лечения с онкологической патологией должен принимать мультидисциплинарный онкологический консилиум.
Читайте также:

