Что такое горячая химия онкология
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
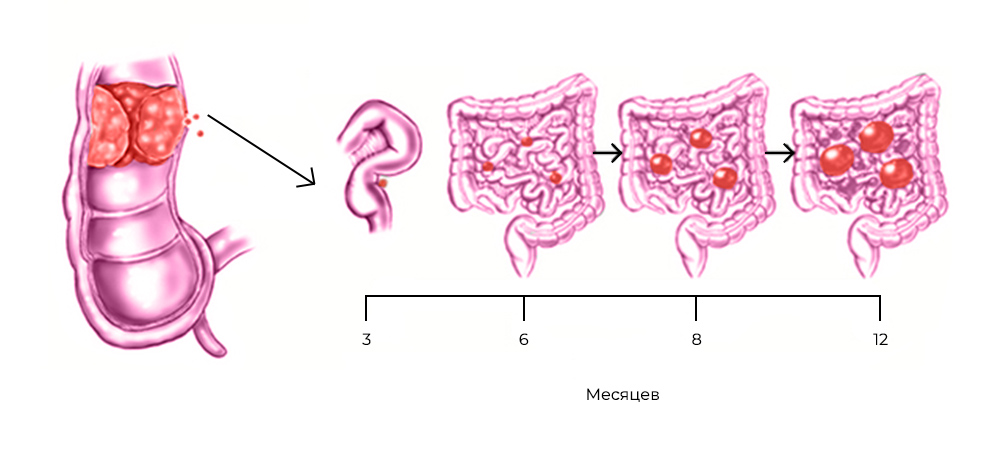
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
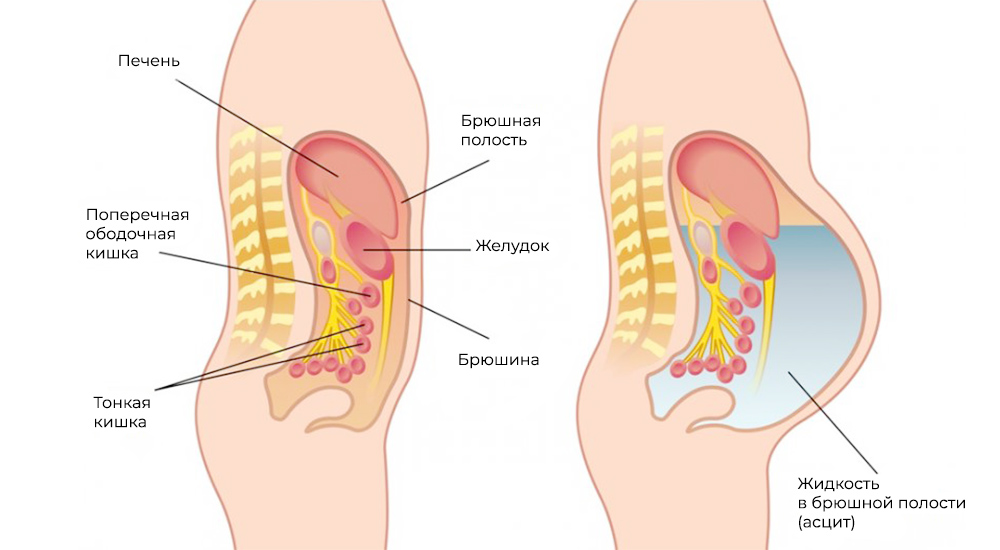
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
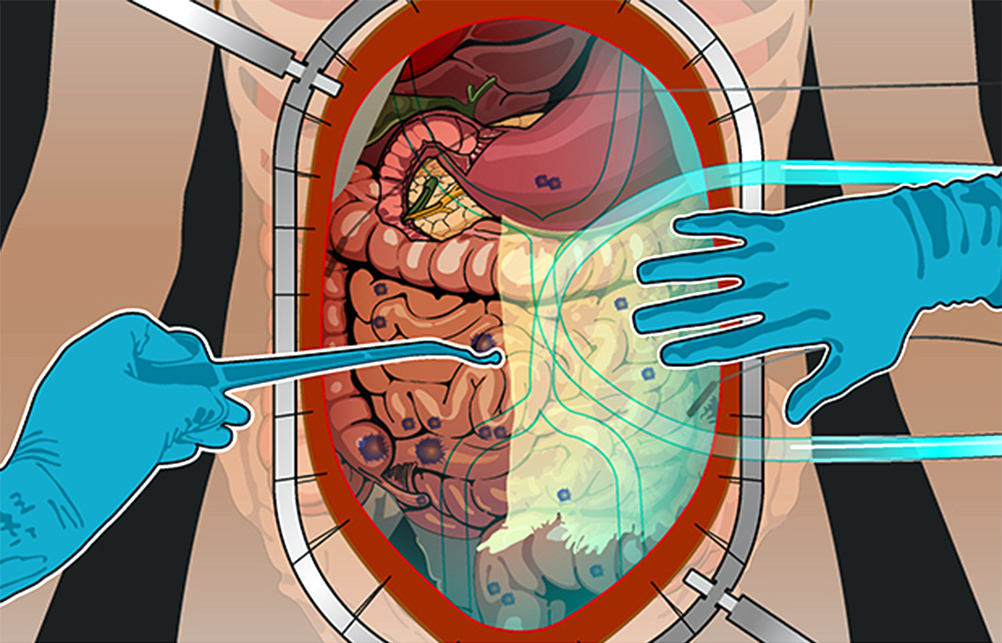
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
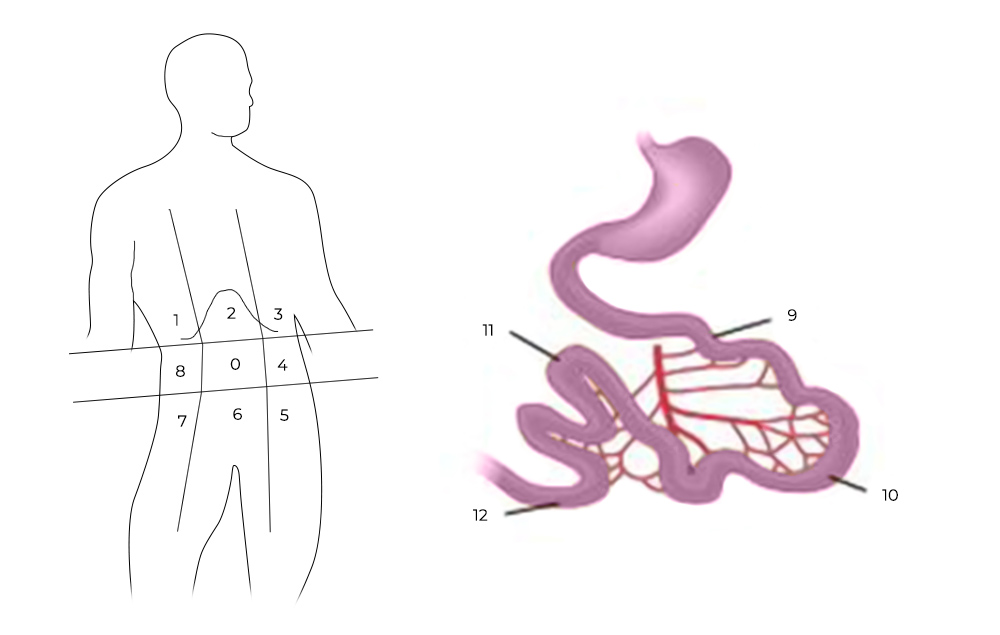
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
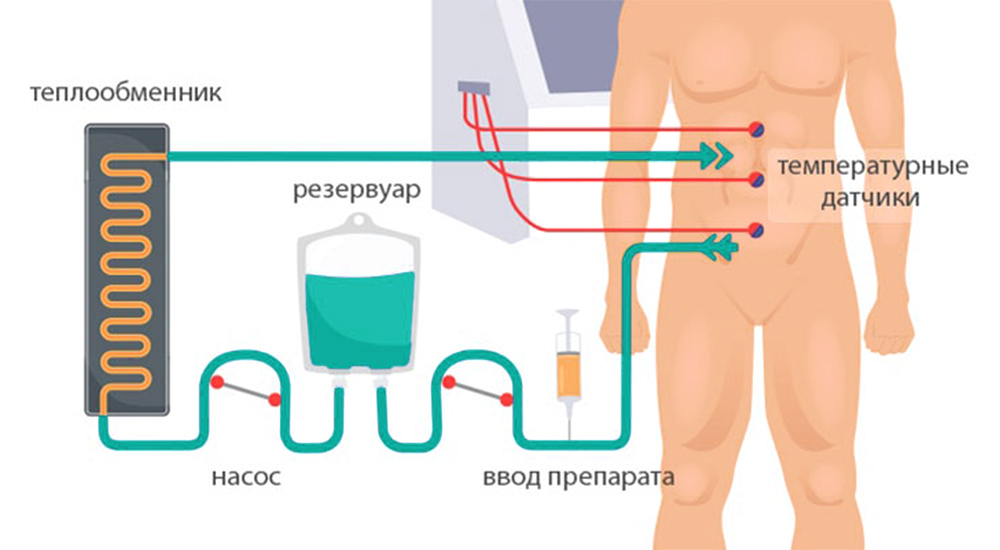
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.
Четвертая стадия онкологического заболевания нередко сопровождается асцитом — патологическим состоянием, при котором метастатические поражения органов брюшной полости нарушают работу лимфатической системы. Это приводит к накоплению жидкости в брюшной полости.
Чаще всего асцит возникает на фоне терминальной стадии рака желудка, рака легкого, колоректального рака, рака яичников.
Асцит мешает органам нормально работать, сдавливает их, что проявляется нарушением сердечной деятельности, вызывает одышку и отёки. Избавление от избытка внутриполостной жидкости улучшает состояние и при большом выпоте жизненно необходимо. Удалить выпот можно лапароцентезом, но приостановить его выработку без проведения курса внутрибрюшинной химиотерапии не представляется возможным.
Что такое внутрибрюшинная химиотерапия?
Чтобы добиться уменьшения асцита необходимо воздействовать на метастазы непосредственным введением химиопрепаратов в брюшную полость.
Для внутрибрюшинной химиотерапии используют концетрированную дозу препарата, в некоторых случаях препарат нагревают до 41 С. Тогда процедура называется гипертермическая химиотерапия.

«Когда мы лечим больных на IV стадии онкологического заболевания, мы всегда говорим о паллиативе, а не избавлении от рака — объясняет главный врач Европейской онкологической клиники Андрей Львович Пылёв. — Мы можем удалить опухоль и все макроскопические признаки опухоли, но если мы понимаем, что вероятность прогрессирования заболевания высочайшая, то всё равно речь идёт о паллиативе. Когда мы лечим терминальных пациентов, мы их лечим для того, чтобы продлить им жизнь и улучшить её качество. Иногда активное вмешательство может привести к тому, что человеку удастся прожить не несколько месяцев, а несколько лет.
Установка порт-системы в брюшную полость
Рекомендуется установка перитонеальной порт-системы в том случае, когда возникает необходимость регулярного проведения процедуры лапароцентеза.
Порт позволит удалять асцит в любое время и вводить химиотерапевтический препарат столько раз, сколько потребуется.
При асците порт устанавливают под местной анестезией.
Введение химиопрепаратов в брюшную полость
Процедура начинается с постепенного удаления лишней жидкости из брюшной полости. Эвакуировать большой объем жидкости за одну процедуру не рекомендуется. Одновременно производится возмещение жизненно необходимых солей и белков.
В осушенную от асцита брюшную полость вводят химиопрепараты. Выбор химиопрепарата зависит от типа рака. Чаще всего используют следующие цитостатики: цисплатин, митомицин, паклитаксел, блеомицин. Через 6–12 часов лекарственные препараты удаляются.
Особенности внутрибрюшинной химиотерапии
Химиопрепараты не вводятся при распространённой спаечной болезни, после давних обширных операций, при воспалительных процессах.
Внутриполостное введение химиопрепаратов не свободно от побочных реакций, интенсивность токсичности индивидуальна и зависит в основном от тяжести состояния пациента. Самые распространенные осложнения: рвота, боль в животе, тошнота.
В Европейской онкологической клинике применяются современные, клинические доказанные методы терапии.
Горячая химиотерапия, горячая химия, гипертермическая внутрибрюшинная химиотерапия (HIPEC), гипертермическая интраперитонеальная химиотерапия – все это названия инновационной процедуры, которая помогает спасать онкологических больных с метастатической стадией заболевания. Как правило, такие заболевания как рак яичников, рак кишечника и некоторые другие дают метастазы в брюшинную полость. Горячая химия помогает справиться с подобными метастазами и значительно продлить жизнь пациентов.
Узнать точную цену на лечение
Что такое горячая химия?
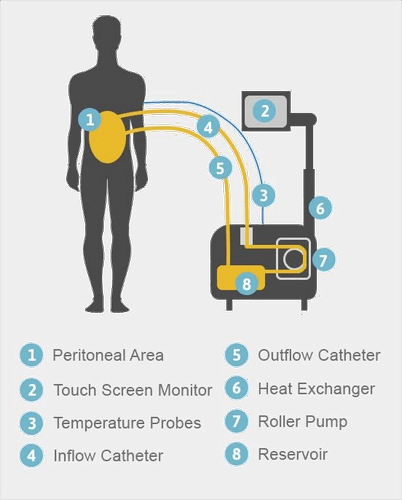
В ходе HIPEC используется высококонцентрированный, подогретый препарат для химиотерапии, который вводится непосредственно в брюшную полость пациента прямо во время операции. В отличие от процедуры обычной химиотерапии, которая циркулирует с током крови, горячая химия взаимодействует непосредственно с раковыми клетками в брюшной полости. Данный подход позволяет использовать более высокие дозы препаратов для химиотерапии. Нагревание препарата до 42 градусов повышает скорость поглощения препарата опухолью и дает возможность уничтожать микроскопические раковые клетки, оставшиеся в брюшной полости после операции.
Как действует горячая химиотерапия?
Перед тем как приступить к использованию горячей химии, хирурги проводят циторедуктивную операцию – удаление большей части опухоли в брюшной полости. После того, как все видимые опухоли удалены, в брюшную полость заливается подогретый до 42-х градусов стерилизованный раствор химиотерапии, который уничтожает остаточные раковые клетки. Раствор циркулирует по брюшной полости в течение полутора часов, затем его сливают и зашивают разрез.
Горячая химия является вариантом лечения пациентов, страдающих прогрессирующей поверхностной формой рака (канцероматозом), не выходящей за пределы брюшной полости.
Внутриоперационная горячая химия проводится в конце операции по удалению опухоли. Процедура направлена на то, чтобы убить все раковые клетки, включая те, которые невозможно увидеть.
Проведение процедуры во время операции дает возможность доставить высококонцентрированное лекарство непосредственно в зону удаления опухоли. Нагревание препарата дает следующие преимущества:
- Разогретый до 42 градусов препарат гораздо эффективнее убивает раковые клетки, не нанося время здоровым клеткам
- Тепло позволяет лекарству убивать невидимые раковые клетки
- Доза горячей химиотерапии может быть гораздо выше, чем внутривенной, так как она не абсорбируется организмом, таким образом, горячая химиотерапия не вызывает побочных эффектов, присущих обычной химиотерапии
- Концентрация лечения именно в брюшной полости – 90% препарата остается в пределах брюшной полости, что делает его менее токсичным для пациента
- Минимальное воздействие на организм и здоровые клетки
- Повышение восприимчивости раковых клеток и улучшение реакции организма на химиотерапию
- Проводится однократно во время операции
Горячая химиотерапия используется для лечения взрослых и детей.
Лечение перитонеальных метастазов с внутриоперационной нагретой химиотерапией (HIPEC): новая надежда для пациентов с неизлечимым раком
Некоторые виды рака очень трудно лечить и до недавнего времени они считались неизлечимыми. Опухоли, которые распространяются в брюшной полости, классифицируются как перитонеальные злокачественные опухоли. Абдоминальная полость — это пространство в животе, которое включает желудок, ободочную кишку, печень, матку, яичники и другие органы брюшной полости. 
Рак в каждом из органов брюшной полости может распространяться на поверхности и внутрь. Этот вид распространения называется перитонеальным карциноматозом или перитонеальными метастазами и традиционно считается неизлечимым заболеванием. Большинство метастаз происходят из органов брюшной полости и включают метастазы рака толстой и прямой кишки, рак аппендикса, рак яичников, рак поджелудочной железы и рак желудка. Хотя первичные раковые заболевания брюшины редки, они включают перитонеальную мезоцелему и первичную перитонеальную карциному.
Эволюция хирургических методов позволила улучшить первичную терапию перитонеальных метастазов. Мы перешли от старой парадигмы паллиативной терапии с химиотерапией или ограниченной хирургией, направленной на снятие симптомов, в новую эпоху радикальной хирургии в сочетании с нагретой химиотерапией (HIPEC), предоставляющей этой пациентке новую надежду на лечение.
Новый подход к раковым заболеваниям, распространяющимся на брюшину, сочетает в себе хирургию и химиотерапию, проводимую во время операции. Этот подход является результатом длительных и обширных исследований, показывающих, что некоторые химиотерапевтические препараты могут достигать очень высоких концентраций в тканях опухоли при введении их непосредственно в брюшную полость. Некоторые из используемых препаратов могут более эффективно убивать раковые клетки при нагревании до температуры 42,0 ° С.
Процедура HIPEC
Было проведено много исследований влияния тепла (гипертермии) на раковые клетки. Было доказано, что тепло может ингибировать рост раковых клеток. Чтобы убить 100% всех раковых клеток, растущих в чашке Петри в лаборатории, нам нужно было нагреть их до 46 градусов по Цельсию в течение 20 минут. Если такое воздействие было бы применено к пациенту, это нанесло бы непоправимый ущерб здоровой ткани. Исследователи обнаружили, что использование тепла в диапазоне 42-44 градусов по Цельсию (в течение 90 минут) убивает раковые клетки с небольшим повреждением здоровых клеток.
Другие исследования показали, что сочетание химиотерапевтических препаратов с этим теплом увеличивает эффект тепла при убийстве раковых клеток. Применение химиотерапии при этих температурах инъекцией через вену пациента вызовет непоправимое повреждение головного мозга. Еще одно осложнение состоит в том, что химиотерапия охлаждается, проникая дальше в брюшину. Поэтому этот метод лучше всего работает на метастазах, которые распространяются по брюшной области.
Ряд исследований, проведенных в США и Европе, показал, что больные раком толстой кишки, получавшие HIPEC-терапию и химиотерапию, увеличили свою продолжительность жизни более чем на пять лет. Важнейшим фактором этого лечения была способность хирурга удалить все опухоли.
Кто кандидат на HIPEC-терапию?
Операция по хирургическому удалению опухолей брюшины длительная, сложная и включает процедуру горячей химиотерапии в течение 90 минут. Поэтому для нас важно убедиться, что кандидаты на этот вид хирургии подходят к процедуре. Для этого лечения будут рассмотрены только пациенты с высоким уровнем работоспособности, у которых нет серьезного сердечного или легочного заболевания.
Поскольку заболевание распространяется по брюшной полости, для хирургов чрезвычайно важно отобразить границы пораженного участка. Вместе с конкретными критериями этот шаг является обязательным для хирургов, чтобы гарантировать, что у кандидатов наибольший шанс для успешной резекции. Трудно оценить размер больной области — даже с использованием самых современных устройств визуализации. Большинство хирургов используют компьютерную томографию для того, чтобы увидеть область заболевания.
Врачи со всего мира решили создать универсальную систему перитонеального рака. Эта система используется сегодня для пациентов во всем мире и называется индексом перитонеального рака. Кроме того, существуют универсальные критерии, которым пациенты должны соответствовать, чтобы считаться кандидатами на операцию.
Операция
Операция проводится под общей анестезией. Из-за времени, сложности и высокой температуры химиотерапии анестезиологи должны быть специально обучены для этой процедуры. Они должны уметь справляться со сложными проблемами, такими как потеря крови и поддержание температуры тела в течение многих часов.
Операция начинается с отделения перитонеального слоя от передних боковых областей брюшной полости до достижения мышц спины. После определения того, что никакие дополнительные метастазы в критических местах не могут предотвратить полную резекцию, хирурги начнут процесс отделения печени и отслаивания метастазов из окружающей ее капсулы. После отшелушивания брюшины от диафрагмы (иногда, требуя частичной резекции диафрагмы или селезенки), желудок высвобождается, а окружающая область проверяется на наличие метастазов. Также проверяется тонкая кишка и толстая кишка. Заключительная часть резекции проводится в области таза, которая в большинстве случаев также имеет метастазы. Резекции матки, яичников (среди женщин) и верхней прямой кишки при необходимости завершают этап резекции операции.
Этап реконструкции сложный и включает в себя реконструкцию и повторное прикрепление частей толстой кишки и пищеварительного тракта. Основываясь на оценке хирурга, этот этап проводится либо до, либо после химиотерапии HIPEC. В некоторых случаях хирург должен создать стому.
Хирургическая процедура продолжается горячей химиотерапией HIPEC. Хирург вставляет трубки в брюшину вместе с термометром (для поддержания оптимальной температуры). Хирурги начинают с введения 3 литров раствора до тех пор, пока механизм потока не будет регулироваться. На этом этапе специальная машина нагревает жидкость для химиотерапии. Температуры регулируются машиной, когда они входят в тело пациента. После достижения оптимальной температуры хирург добавляет жидкость для химиотерапии в специальный контейнер с насосом, который равномерно распределяет жидкость по площади.
Несмотря на то, что рак толстой кишки является системным заболеванием, которое поражает все тело, хирургическое лечение для удаления первичной опухоли является наиболее важным этапом. Когда соседние лимфатические узлы поражаются и удаляются хирургическим путем, врачи добавят химиотерапию в качестве части режима лечения пациента. Это снижает шансы на рецидив. Даже если метастазы обнаружены в печени или легких, некоторые пациенты могут пройти резекцию, чтобы удалить их. Вместе с химиотерапией вероятность того, что этот пациент полностью восстановится, высока (вероятность 30-40%). Среди больных раком толстой кишки с метастазами метастазы в брюшине встречаются среди 15% пациентов. Если метастазы могут быть удалены, у пациента есть те же шансы, что и у пациентов с метастазами в печени.
В отличие от метастазов в печени или других твердых органах, перитонеальные метастазы меньше и разбросаны по всей полости брюшины. Поэтому сложнее определить, могут ли эти метастазы работать с КТ или ПЭТ-сканированием. Чтобы полностью удалить опухоль, хирург должен будет выполнить резекцию на большей площади и, возможно, в других органах в этом районе. Это усложняет операцию и увеличивает риск осложнений.
В последние годы были достигнуты большие успехи в разработке эффективных лекарств для больных раком толстой кишки. Были разработаны новые цитотоксические и биологические препараты, которые удваивают продолжительность жизни пациента с раком толстой кишки и значительно уменьшают рецидив среди пациентов, которые подверглись полной резекции.
Метастазы, которые развиваются в твердых органах, создают новые кровеносные сосуды (ангиогенез), поэтому они могут вырасти в одну опухоль. Это также означает, что химиотерапевтические препараты, которые попадают к ним, должны быть более сконцентрированы. Эти кровеносные сосуды могут быть уничтожены препаратами, останавливающими ангиогенез — процесс производства кровеносных сосудов (например, лекарство Avastin®).
Метастазы, которые развиваются в брюшине, не могут создавать кровеносные сосуды, и поэтому метастазы не могут развиться в большие, твердые массы. Концентрация стандартной внутрипортовой или внутривенной химиотерапии ниже и ее эффективность недостаточна для излечения. Однако препараты, которые непосредственно вводятся в брюшину, могут проникать в мембрану клеток и поглощаться непосредственно в кровоток. Теоретически пациенты могут получать более высокую концентрацию химиотерапии непосредственно в брюшину с меньшим количеством побочных эффектов.
Показатели выживаемости пациентов с 4 стадией с метастазами, зависят от ряда факторов, наиболее важным фактором является первичный источник рака. Пациенты с самыми высокими шансами выживания — это те, у кого первичный рак — рак аппендикса, а у тех, кто страдает раком поджелудочной железы, самые низкие шансы на выживание.
Химиотерапия имеет ограниченную эффективность для этих пациентов. Исследователи провели годы, ища альтернативные терапевтические процедуры. Пионерами в этой области исследований являются американские исследователи Пол Шугарбакер и Джон Спратт и французский исследователь Франсуа Гиллис. Каждый из этих исследователей разработал хирургический метод удаления рака.
Позднее был разработан дополнительный метод лечения, когда химиотерапия проводится во время операции с помощью специального насоса, обычно используемого для шунтирующей хирургии (HIPEC). Ряд медицинских центров по всему миру приняли этот метод лечения. В последние годы после разработки более эффективных насосов этот метод стал признанным методом лечения метастазов в перитонеальной полости в Израиле.
Результаты циторедуктивной хирургии и HIPEC-терапии
Этот новый подход к лечению в настоящее время практикуется во многих медицинских центрах по всему миру. Медицинский центр Шиба был одним из первых учереждений с более чем 350 пациентами, которых лечила команда профессора Ниссана. Наши результаты поставили Израиль в число ведущих центров мира по использованию этой технологии.
Мы смогли поддерживать относительно низкие показатели заболеваемости и смертности. Мы смогли увеличить долгосрочную выживаемость (излечение) или продлить безрецидивную выживаемость у двух третей наших пациентов. У трети наших пациентов наблюдался ранний рецидив заболевания после процедуры HIPEC.
Видео: циторедуктивная хирургия и процедура HIPEC
Читайте также:

