Что такое динамическое наблюдение при раке почки
Что делать после операции? (динамическое наблюдение)
Успешно проведенная операция не всегда гарантирует выздоровление больного. Эффективность хирургического лечения, а также вероятность рецидива заболевания в значительной мере зависит от стадии заболевания и патоморфологических характеристик опухоли.
Своевременная диагностика рецидива опухоли обеспечивает раннее лечение и выздоровление больного. В связи с этим, пациенты, оперированные по поводу рак почки нуждаются в активном диспансерном наблюдении.
Вероятность рецидива рака почки в послеоперационном периоде (Donat M. и соавт., 2013)
| Вероятность рецидива | Критерии |
| низкая | опухоль в пределах почки (рТ1N0) без поражения регионарных лимфатических узлов и отдаленных метастазов. Вероятность рецидива после хирургического лечения составляет 1,3-2,0 % при малых опухолях (до 4,0 см) и до 10,0 % - при опухолях до 7,0 см. Вероятность рецидива увеличивается до 20,0 % при наличии положительного хирургического края, низкой степени дифференцировки опухоли и папиллярной опухоли. |
| умеренная | опухоль ограничена почкой, но больше 7,0 см (рТ2N0) без поражения регионарных лимфатических узлов и отдаленных метастазов. |
| высокая | опухоль прорастает в паранефральную клетчатку, почечный синус, почечную или нижнюю полую вену, на надпочечник (рТ3-4) и/или поражает лимфатические узлы (N1), имеются отдаленные метастазы (M1). |
Вероятность рецидива при локализованной форме рака почки (ESMO Guidelines Working Group, 2012)
| Вероятность рецидива | Прогностические группы | 5-летняя выживаемость | |
| Т | Степень дифференцировки опухоли | ||
| Низкая | 1 | высокая-умеренная | 80,0-91,0 % |
| Умеренная | 1 | низкая | |
| 2 | любая | ||
| 3 | высокая | ||
| Высокая | 3-4 | умеренная-низкая | 55,0 % |
На основании проведенного метода лечения, а также вероятности рецидива определяется частота осмотров и методики обследования наблюдаемых.
| Методы исследования | |
| Клинический осмотр | Выявление клинических признаков местного рецидива или метастатического распространения опухоли |
| Лабораторные анализы | • клинический анализ крови и мочи • биохимические показатели: креатинин, мочевина, скорость клубочковой фильтрации • дополнительно: ЛДГ, печеночные показатели, щелочная фосфатаза, уровень кальция |
| Лучевые методы | Компьютерная и/или магниторезонансная томография |
| Радиоизотопные методы | Остеосцинтиграфия - по показаниям |
Наблюдение пациентов после резекции почки или радикальной нефрэктомии
Что такое рак почки?
Рак почки общий термин, который включает множество вариаций опухолей на различных стадиях заболевания.
Как лечится рак почки?
В современной онкоурологии существует ряд способов для контроля опухолевого процесса в почке. Методы включают следующее:
• удаление части почки (парциальная нефрэктомия);
• радикальная нефрэктомия;
• энуклеация;
• циторедукция опухоли;
• динамическое наблюдение;
• радиочастотная абляция;
• криотерапия;
• лечение таргетными препаратами;
• иммунотерапия;
• введение химиотерапевтических препаратов по схемам;
• радиационная терапия.
Что такое частичная (парциальная) нефрэктомия и когда она рекомендуется?
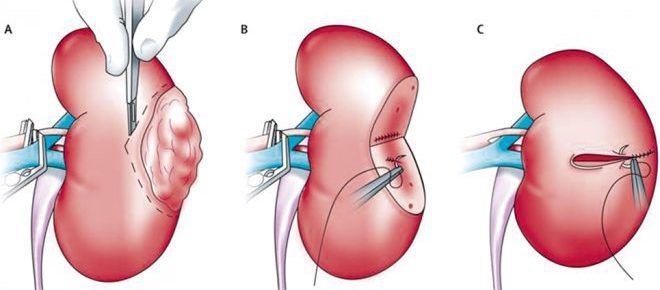
Частичная нефрэктомия – операция при раке почки, подразумевает удаление только опухоли, не затрагивая здоровую ткань.
Способ подходит, если новообразование не проросло за пределы органа. После частичной нефрэктомии при раке почки в дальнейшем проводят динамическое наблюдение. Как минимум, в последующие пять лет выполняют лабораторно-инструментальные исследования.
Какие диагностические мероприятия при раке почки?
Обследование проводится в следующем объеме с учетом показаний:
• общий клинический анализ мочи и крови;
• мочевина, креатинин, щелочная фосфатаза;
• печеночные пробы;
• сканирование костей скелета, КТ головного мозга;
• УЗИ забрюшинного пространства и почек;
• рентгенографическое исследование грудной клетки;
• компьютерное сканирование органов брюшной полости;
• МРТ.
Для каждой стадии предусмотрен свой объем обследований.
• исключение послеоперационных осложнений;
• оценка функциональной способности почек;
• контроль гемоглобина и коррекция анемии;
• исключение местного рецидива или распространения метастазов в лимфатические узлы или легкие;
• диагностика метастазирования в кости.
Что такое радикальная нефрэктомия и когда она рекомендуется?
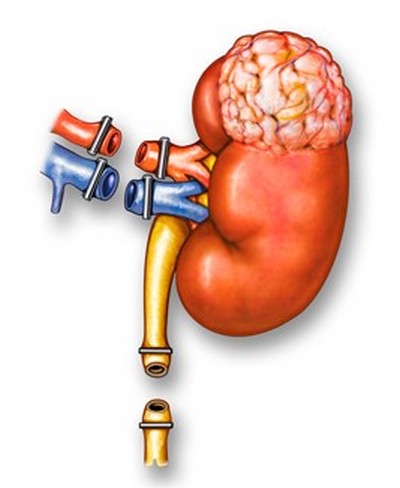
Радикальная нефрэктомия – органоуносящая операция, удаляется орган вместе с объемным образованием, околопочечной клетчаткой с лимфоузлами и надпочечником. Рекомендуется, если новообразование распространилась за пределы почки. Вмешательство также выполняют, если не представляется возможным отделить опухолевую массу от здоровых тканей. Большинство прооперированных пациентов могут полноценно жить и с единственно функциональной почкой без значимых осложнений.
После радикальной нефрэктомии регулярное наблюдение длится как минимум 5 лет и дольше. Стандартный план обследования во время последующих посещений: компьютерная томография брюшной полости, ультразвук, рентгенологическое исследование легких, анализы мочи и крови, биохимические пробы: мочевина и креатинин, АСТ, АЛТ, щелочная фосфатаза (повышение при метастазировании).
Что такое энуклеация при раке почки?
Операция может быть выполнена при окружении опухолевых узлов плотной псевдокапсулой.
Способ отличает бескровность и максимальное сохранение здоровой ткани. Новообразование возможно удалить из любого сегмента почки.
К недостаткам относят сомнительную радикальность из-за возможного прорастания рака за пределы псевдокапсулы.
Что такое циторедуктивная нефрэктомия?
Циторедуктивная нефрэктомия – хирургическое вмешательство, рекомендуемое для рака почки с метастазированием. Цель – максимально возможное удаление новообразования. Для этого может потребоваться органоуносящая операция, а также удаление вовлеченных в патологический процесс соседних органов. Оперативное вмешательство выполняется, чтобы продлить жизнь и улучшить ее качество.
Ведущий симптом рака почки – макрогематурия. На фоне кровотечения часто развивается гемотампонада – закупорка кровяными сгустками мочевыделительных путей. Обструкция приводит к появлению осложнений:
Операция помогает избежать постоянных госпитализаций для решения вопроса об отводе мочи и устранения кровотечения. Кроме этого, пациент меньше страдает от раковой интоксикации.
Что такое активный контроль при раке почки и когда он рекомендуется?
Активное наблюдение – это тактика ведения, при которой контролируется поведение опухоли. Метод рекомендуется, если операция – не лучший вариант из-за сопутствующей патологии, которая не позволяет выполнить хирургическое вмешательство. Размер опухоли не должен превышать 4 см.
Если рак агрессивен, проводят дополнительное лечение.
Визит к онкологу необходим каждые 3 месяца в течение первого года после постановки диагноза. В течение следующих двух лет посещения планируются каждые 6 месяцев, а затем один раз в год.
Что такое радиочастотная абляция и когда она рекомендуется?
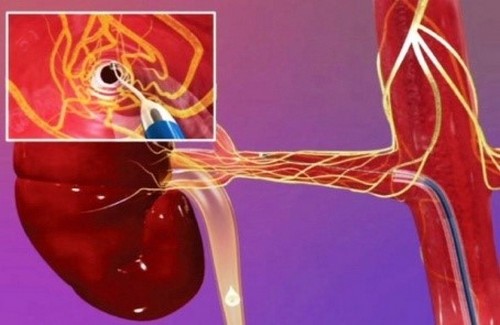
При радиочастотной абляции за счет выделения тепловой энергии наступает некроз атипических клеток.
РЧА может быть выполнена, если опухоль почки менее 4 см, и операция не является лучшим вариантом. Это эффективное и безопасное лечение небольших злокачественных новообразований почки, но существует риск того, что опухолевые клетки остаются и после коагуляции, что увеличивает вероятность рецидива. РЧА может выполняться более одного раза в случае возвращения рака, или если первое лечение не было эффективным.
Основное преимущество радиочастотной абляции – возможность последующей резекции почки, особенно при экзофитных (растущих наружу) опухолях.
После РЧА последующие визиты планируются каждые 3 месяца. Контроль осуществляется с помощью компьютерной или магнитно-резонансной томографии для своевременного выявления возможного рецидива опухоли.
Что такое криотерапия и когда она рекомендуется?
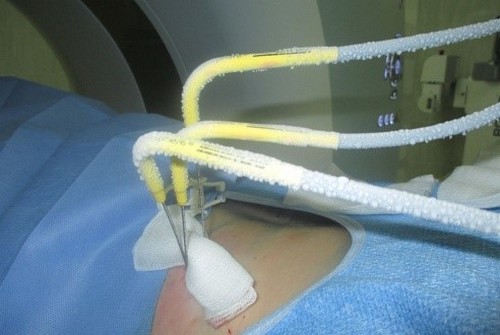
Криотерапия (криоаблация) использует сжиженный газ для быстрого охлаждения опухолевых клеток с последующей гибелью. Исследования показали, что рецидив заболевания регистрируется у 1 из 50 пациентов при наблюдении в течение 3 лет.
Криотерапию можно выполнить, если размер опухоли почки менее 4 см, а проведение операции по каким-либо причинам невозможно. Метод относят к эффективным и безопасным способам лечения небольших опухолей почки, но риск рецидива сохраняется. Криотерапия может проводиться многократно.
После данного вида лечения пациент должен быть осмотрен каждые 3 месяца. Обследование: КТ, МРТ, лабораторная диагностика, рентгенография органов грудной клетки.
Что такое антиангиогенная терапия и когда она рекомендуется?
Есть ряд препаратов, которые замедляют рост опухоли и потенциально уменьшают ее размеры. Они препятствуют образованию новых кровеносных сосудов, питающих рак и позволяющих ему расти. Антиангиогенную терапию часто называют целевой терапией (таргетной), поскольку она преимущественно поражает опухолевые клетки.
Метод рекомендуется, если новообразование находится на стадии метастазирования. Таргетное лечение может быть оптимальным вариантом, если выполнение операции невозможно из-за фоновой патологии, или опухоль достигла таких размеров, что удалить ее уже нельзя. В других случаях антиангиогенная терапия проводится для уменьшения размеров злокачественного новообразования перед планируемым в дальнейшем оперативном вмешательством.
Какие нежелательные эффекты у антиангиогенной терапии?
Препараты обладают определенной токсичностью и влияют на формирование новых кровеносных сосудов по всему телу. Щитовидная железа, сердце и кожа страдают чаще всего.
Таргетная терапия замедляет восстановительную способность тканей, поэтому лечение не проводится, пока не будет сформирован полноценный рубец после оперативного вмешательства.
Прочие распространенные побочные действия:
• слабость;
• диспепсические расстройства;
• нарушение дефекации;
• костно-суставные и мышечные боли.
Большинство пациентов испытывают выраженную усталость в течение 6-12 месяцев после лечения. Астенический синдром может развиться ответом на действия препаратов, но также подобные симптомы появляются при росте опухоли или ее метастазировании. О жалобах необходимо рассказать врачу, есть препараты, которые помогут облегчить состояние.
Что такое иммунотерапия и когда она рекомендуется?
Иммунотерапия – лечение, направленное на стимуляцию собственного иммунитета пациента для борьбы с опухолевыми клетками.
Иммунопрепараты редко назначают при раке почки. При метастатическом процессе они могут применяться в комбинации с антиангиогенными лекарствами.
Каковы побочные эффекты для иммунотерапии?
Иммунотерапия сопряжена с несколькими нежелательными реакциями. Чаще регистрируются астенические и простудоподобные симптомы:
• повышение температуры с ознобом,
• головные, костно-суставные и мышечные боли;
• выраженная слабость.
Изначально эти побочные эффекты присутствуют у всех пациентов. Негативные проявления обычно уменьшаются по мере продолжения курса лечения. Симптомы появляются через несколько часов после введения препарата, их продолжительность – около 12 часов. Для нормализации состояния назначают лекарства на основе Парацетамола.
Другие побочные последствия лечения могут быть более серьезными и включают изменения со стороны кроветворной системы, диспепсию, депрессию, апатию, бессонницу и тревожность.
Что такое химиотерапия и когда рекомендуется?
Химиотерапия подразумевает прием препаратов, оказывающих деструктивное (разрушительное) действие для клеток. Активные вещества атакует любую клетку, которая активно размножается. Кроме опухолевой ткани страдают волосяные фолликулы и костный мозг. Химиопрепараты вводят в вену по определенным схемам.
Исследования продемонстрировали малую эффективность метода при раке почки. Некоторые специалисты считают, что для метастатического процесса химиотерапия с 5-фторурацилом потенциально эффективна в комбинации с приемом иммунопрепаратов после полного удаления первичной опухоли.
Что такое лучевая терапия и когда ее проводят?
Радиационное воздействие уничтожает раковые ткани и ограничивает их способность к размножению. Злокачественные новообразования почек не реагируют на лучевую терапию. Поэтому данный вид лечения выполняют только для уменьшения симптомов, вызванных первичной опухолью или ее метастазами, при невозможности хирургического удаления, в виде паллиативной помощи.
Какие есть дополнительные возможности для лечения рака почки?
Для пациентов с метастатическим раком почки есть возможность участия в клинических испытаниях.
Это исследования, проводимые для оценки эффективности новых способов лечения или действия препаратов, в том числе, связанные с изменением схем терапии и стандартных дозировок.
Как попасть в клинические испытания?

При утрате контроля над ситуацией участие в клинических испытаниях может стать одним из выходов для решения проблемы.
Не всегда есть возможность приобрести нужное лекарство от рака по ряду причин:
• высокая стоимость;
• отсутствие в аптечной сети или в стране;
• у препарата нет регистрации в стране проживания пациента и пр.
Первоначально необходимо собрать все выписки из истории болезни и результаты проведенных обследований. Необходимо учитывать, что для участия в клинических испытаниях существуют строгие критерии отбора (для каждого свои).
Далее можно попытаться самостоятельно найти профильные сайты, которые содержат нужную информацию обо всех клинических исследованиях, проводимых не только в России, но и за рубежом. После беседы со специалистом все документы для рассмотрения вопроса можно отправить по электронной почте.
Оплата за клинические испытания не подразумевается.
Пациенты, пережившие рак, подлежат тщательному наблюдению у специалиста-онколога как минимум первые 5 лет. Динамическое отслеживание состояния здоровья преследует две цели:
График визитов к врачу и набор диагностических исследований будет зависеть в первую очередь от стадии, на которой был обнаружен рак, а также его патоморфологии и локализации.
Чем выше стадия, тем чаще и более тщательно нужно проходить обследование. Так при I и II стадиях онкозаболевания обычно достаточно динамического наблюдения у онколога с примерным графиком визитов каждые 6 мес яцев в первые 5 лет и затем раз в год. При III и IV стадиях визиты к врачу в первые 2-3 года происходят раз в 3-4 месяца, а при назначении так называемой адъювантной терапии, которая предполагает курсы профилактической химиотерапии или других видов лечения, они становятся регулярными.
То же самое касается состава диагностических процедур - чем выше стадия онкозаболевания, тем подробнее будет список лабораторных и инструментальных исследований.
В конечном итоге, и сроки, и диагностический пакет, и сопроводительное лечение - все подбирается под каждого конкретного пациента, исходя из его общего самочувствия, особенностей его заболевания и наличия сопутствующих патологий, образа жизни и других моментов.
Минимальный набор для регулярного обследования пролеченного онкопациента, как правило, включает:
- Осмотр врача-онколога;
- Анализ крови общий и биохимический;
- Анализ мочи общий;
- УЗИ или КТ брюшной полости и тщательное исследование печени для исключения метастазирования в печень;
- Рентгенография в двух проекциях или КТ легких для исключения метастазирования в легкие;
- УЗИ, КТ, МРТ или эндоскопия зоны операции в зависимости от вида и расположения опухоли.
После получения результатов обследования, врач принимает следующие тактики ведения пациента:
- при отсутствии данных за прогрессирование заболевания назначается следующая дата визита к врачу и очередного обследования;
- при недостаточности данных или сомнениях в ремиссии онкопроцесса назначаются дополнительное уточняющее обследование и повторные визиты к врачу;
- при наличии данных за прогрессирование онкологического процесса (рецидив или метастазы) назначается новый курс противоопухолевой терапии.
Пациенту, столкнувшемуся с онкологией, нужно помнить, что половина успеха выздоровления зависит от него самого - это и стойкая вера в исцеление, и внимательное отношение к своему здоровью, наблюдение за самочувствием, ведение дневника симптомов, выполнение всех рекомендаций лечащего врача, а также соблюдение диеты и режима физических нагрузок согласно основному заболеванию.
Будьте бдительны к общим симптомам болезни: потере в весе, снижению аппетита, общей слабости, головной боли, необоснованному повышению температуры. А если заметили боль в области живота или в костях скелета, кашель, одышку, увеличение лимфатических желез и наличие крови в моче не откладывайте визит к врачу. Любое отклонение в вашем здоровье имеет значение. Лучше опровергнуть подозрение, чем пропустить болезнь.


Выжидательная тактика / Наблюдение – с возможностью отсроченного вмешательства
Определение:
Активное наблюдение также известно как выжидательная тактика или наблюдение – это наименее агрессивный метод лечения рака почки. Термин "активное наблюдение" предпочтителен, поскольку это самое точное определение этого процесса.
Активное наблюдение означает, что врач и пациент сотрудничают, чтобы активно наблюдать выявленную опухоль почки. Как только при помощи методов лучевой диагностики выявили поражение подозрительное на рак почки, то через регулярные промежутки времени выполняют компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ) или ультразвуковое исследование (УЗИ), чтобы наблюдать опухоль почки.
Активное наблюдение – это метод лечения для некоторых пациентов с опухолью почки маленьких размеров. Исследования показали, что опухоли почки маленьких размеров растут со скоростью от 0,1 до 0,8 сантиметров в год. Некоторые опухоли почки маленьких размеров с медленным ростом можно наблюдать и лечить отсроченно. С другой стороны, быстро растущие опухоли, должны быть удалены, как можно раньше.
Как правило, после определения опухоли почки как подозрительной на развитие рака почки, последующие радиологические исследования выполняют через каждые 3 – 6 месяцев. Если изменений размеров опухоли почки нет, то Вы и Ваш доктор можете выработать индивидуальный режим наблюдения, который удобен вам обоим. Обычно, активное наблюдение включает ультразвуковое исследование (УЗИ почек), компьютерную томографию (КТ) или магнитно-резонансную томографию (МРТ) каждые 6 – 12 месяцев с последующим осмотром врача.
Активное наблюдение по определению является активным процессом. Сочетание радиологических исследований с осмотром и консультацией врача – это важные составляющие успеха активного наблюдения. Если опухоль почки начинает расти или меняются ее характеристики, то необходимо хирургическое вмешательство.
Кандидаты: Существуют несколько важных характеристик опухоли почки и пациента, которые имеют решающее значение при выборе методов лечения опухоли почки маленьких размеров. Характеристики опухоли и пациента включают: размер и основные радиологические признаки опухоли почки, локальную анатомию опухоли почки, средний возраст и состояние здоровья пациента, функциональное состояние почек, число опухолей почки, личные предпочтения пациента и другие.
Характеристики опухоли: чем меньше размер опухоли почки, тем больше подходит опухоль для активного наблюдения. Маленькие опухоли почки с меньшей вероятность являются злокачественными опухолями и не имеют тенденции к распространению (метастазированию).
Характеристики пациента: лучшими кандидатами для активного наблюдения являются пожилые пациенты, имеющие проблемы со здоровьем. Пожилые пациенты с проблемами со здоровьем находятся в группе высокого риска по развитию осложнений при хирургической операции. Поэтому для пожилых пациентов предпочтительнее наблюдение за ростом опухоли почки при помощи радиологических методов. Если размеры опухоли почки не изменяются или наблюдается минимальное увеличение размеров, то активное наблюдение продолжают. Однако если опухоль почки растет, то возможно проведение минимально-инвазивных хирургических операций, таких как абляция опухоли почки, лапароскопическая резекция почки или радикальная лапароскопическая нефрэктомия.
Главное преимущество активного наблюдения состоит в том, что не требуется проведения никакого агресивного лечения. Все медицинские манипуляции вне зависимости от их объема, то есть и малые операции и минимально-инвазивные процедуры, могут вызвать осложнения. Кроме того, большинство медленно растущих опухолей почки имеют минимальный уровень риска развития рака почки.
Однако активное наблюдение опухоли почки подходит не для всех пациентов. Некоторым пациентам не показано активное наблюдение, если есть высокая вероятность наличия рака почки в их организме. Для некоторых пациентов, во время наблюдения опухоли почки, мысль о наличии возможно злокачественной опухоли в их организме является источником беспокойства. А также, в то время как опухоль почки маленького размера относительно предсказуема по темпу своего роста, существует риск развития рака почки, который может дать метастазы за время наблюдения.
Классификация
Общепринятой системой стадирования почечно-клеточного рака (ПКР) служит классификация TNM, рекомендованная для использования в клинической и научной работе.
Эта классификация периодически претерпевает изменения с учетом накапливаемых знаний.
Последние изменения были внесены в 2009 г. (табл. 2-4).
Таблица 2-4. Классификация почечно-клеточного рака по системе TNM

Выделение подстадии pT1 более не является предметом дискуссий. Деление опухолей стадии Т2 по размерам было недавно включено в классификацию TNM (2009).
Опухоли с инвазией в клетчатку почечного синуса ранее относили к стадии рТ1. Однако с учетом накопленных данных можно предположить, что при инвазии опухоли в почечный синус прогноз хуже, чем при инвазии в паранефральную жировую клетчатку, следовательно, такие опухоли не нужно включать в группу стадирования рТ1.
Известно, что инвазия опухоли в надпочечник — крайне плохой прогностический признак, такие формы рака почки следует классифицировать как опухоли стадии Т4. В предыдущих версиях классификации TNM в ipynny рТ3b включали опухоли с инвазией как в почечную, так и в нижнюю полую вену.
В результате проведения многочисленных исследований прогностическою значения инвазии в нижнюю полую вену по сравнению с инвазией в почечную вену эти две ipyniibi в последнюю версию классификации TNM включены по отдельности. Точность разделения на N1 и N2 обсуждается. Для определения категории М у больных раком почки необходимо выполнять тщательное дооперационное инструментальное обследование, на сегодня включающее компьютерной томографии (КТ) грудной и брюшной полостей.
Прогностические факторы
К гистологическим факторам относятся степень ядерной дифференцировки по Фурману, подтип ПКР, признаки саркоматоидного характера, инвазия в мелкие сосуды, некроз опухоли и инвазия в собирательную систему. Степень дифференцировки по Фурману является общепринятой системой гистологической классификации в случае рака почки, которая служит независимым прогностическим фактором.
Выделяют три основных гистологических подтипа почечно-клеточного рака: свелоклеточный — 80-90%, папиллярный — 10-15%, хромофобный — 4-5% случаев. Более благоприятный прогноз течения заболевания отмечают у пациентов с хромофобным раком по сравнению с таковым у больных папиллярным или светлоклеточным раком ночки. Однако прогностическое значение различий в гистологическом строении нивелируется при учете стадии опухолевого процесса.
Среди больных папиллярным раком было выделено две прогностически различные труппы: тип I — опухоль с низким злокачественным потенциалом, клетки с хромофильной цитоплазмой, благоприятный прогноз; тип II — опухоль высокого злокачественного потенциала, клетки с эозинофильной цитоплазмой, высокая предрасположенность к метастазированию.
В последние годы были разработаны послеоперационные прогностические системы и номограммы, включающие комбинации независимых прогностических факторов. Наиболее распространенные прогностические системы приведены в табл. 2-5.
Таблица 2-5. Наиболее распространенные прогностические модели для локализованного и метастатического рака почки

Динамическое наблюдение после нефрэктомии, резекции почки или аблятивной терапии почечно-клеточного рака
Динамическое наблюдение, проводимое после хирургического лечения, позволяет оценить функции почек, выявить наличие послеоперационных осложнений, местных рецидивов, развившихся после резекции почки или аблятивного лечения, рецидивов в контралатеральной почке, а также проанализировать возможность появления отдаленных метастазов.
Методам и срокам проведения контрольных обследований посвящено множество публикаций. В настоящее время нет единого мнения о необходимости динамического наблюдения за пациентами после лечения по поводу рака почки, и практически отсутствуют данные о том, что раннее выявление рецидива способствует улучшению выживаемости по сравнению с поздним его обнаружением. Однако послеоперационное наблюдение и контроль важны для того, чтобы увеличить объем знаний о ПКР. и урологи должны проводить его и указывать время, прошедшее с момента окончания лечения до наступления рецидива или развития метастазов.
Оценку послеоперационных осложнений и выделительной функции почек проводят на основании анамнеза, физикального обследования, определения концентрации сывороточного креатинина и EGFR. Осуществление регулярного контроля уровня EGFR в течение длительного времени позволяет увидеть, ухудшились функции почек после оперативного вмешательства или еще до операции.
Функционирование почек и выживаемость без признаков рака можно оптимизировать путем выполнения (по возможности) органосохраняющих операций в случае наличия опухолей стадий Т1 и Т2. Частота развития местных рецидивов невысока и составляет 2,9%, однако важно выявлять их на ранних стадиях, поскольку наиболее эффективным методом лечения в этом случае бывает выполнение циторедуктивных операций. Рецидив в контралатеральной почке также встречается редко (1,2%), риск его развития повышается при наличии опухолевой ткани по краю резекции, мультифокальном росте и высокой степе пи клеточной анаплазии.
Основная цель динамического наблюдения — раннее выявление метастазов. В частности, это важно при проведении абляционной терапии, такой как криотерапия или радиочастотная абляция. Даже несмотря на то что частота возникновения местных рецидивов в данном случае выше, чем при обычном хирургическом вмешательстве, больного все же можно вылечить путем повторной аблативной терапии или нефрэктомии.
Большее распространение опухоли при метастатическом течении заболевания может ограничить возможности хирургического лечения, которое служит стандартом при обнаружении резектабельных, особенно солитарных, метастазов. К тому же осуществление ранней диагностики рецидива, когда масса опухолевой ткани еще невелика, может способствовать повышению эффективности системной терапии, в том числе в рамках клинических исследований.
Интенсивное лучевое обследование не считают необходимым для всех пациентов, К примеру, при выполнении операций по поводу опухолей стадии Т1а и новообразований низких стадий почти всегда достигают хороших результатов. В связи с этим в зависимости от риска рецидивирования и метастазирования целесообразно осуществлять дифференцированный режим наблюдения. Данных рандомизированных исследований пока не существует, но результаты исследований прогностических факторов с большим сроком наблюдения больных уже позволяют сделать некоторые выводы.
При низкой вероятности развития рецидива может быть достаточно выполнения рентгенографии грудной клетки и ультразвукового исследования (УЗИ). Однако рентгенография малочувствительна к небольшим метастазам, а диагностическая ценность УЗИ имеет ограничения.
При наличии среднего или высокого риска возникновения рецидива методом выбора становится КТ органов грудной клетки и брюшной полости, хотя при этом следует учитывать побочное действие облучения, возникающее при проведении повторных КТ-исследований.
В зависимости от наличия новых эффективных методов лечения может потребоваться применение более жестких схем послеоперационного контроля и наблюдения, в частности при известном более высоком риске развития местного рецидива после проведения криотерапии или радиочастотной абляции. Проблемой является определение оптимального срока наблюдения за больным.
Существует мнение, что проведение наблюдения при помощи методов визуализации после 5 лег выживаемости уже нецелесообразно. Однако возникновение поздних метастазов возможно, хотя они с большей вероятностью будут одиночными и для их излечения понадобится более агрессивное лечение. Кроме того, пациенты, у которых опухоль дает рецидив в контралатеральную почку, могут быть излечены посредством выполнения органосохраняющей операции, если обнаруженная опухоль имеет небольшие размеры. Более того, для опухолей диаметром менее 4 см в ходе послеоперационного наблюдения не выявлено разницы в частоте возникновения рецидивов после осуществления нефрэктомии или резекции почки.
Некоторые авторы, в частности, M.W. Kattan, J.S. Lam, B.C. Liebovich и P.l. Karakiewicz, разработали системы баллов и номограммы для количественного определения вероятности возникновения рецидива, метастазов и последующей смерти пациента. Эти системы сравнивались и проходили валидацию. Было предложено несколько режимов осуществления динамического наблюдения в зависимости от стадии заболевания с использованием прогностических переменных, но ни один из них не включал применение абляционных методов лечения.
Разработаны послеоперационные номограммы, позволяющие оценить вероятность достижения безрецидивной 5-летней выживаемости. Совсем недавно была опубликована и прошла валидацию дооперационная прогностическая модель, основанная на возрасте, симптомах и стадировании по TNM. Соответственно для осуществления мониторинга больных почечно-клеточным раком необходимо использование алгоритма динамического наблюдения, в котором учитывался бы не только риск развития рецидива или появления метастазов, но также и эффективность проведенного лечения (табл. 2-7).
Таблица 2-7. Алгоритм динамического наблюдения с учетом профиля риска прогрессирования

Примечание: НЭ — нефрэктомия; РП — резекция почки; РГК — рентгенография грудной клетки; крио — криоабляция; РА — радиочастотная абляция.
Динамическое наблюдение, осуществляемое за пациентами после лечения по поводу рака почки, должно быть основано па факторах риска, выявленных для данного пациента, и типа полученного им лечения. Цель такого наблюдения — обнаружение местного рецидива или метастазирования на той стадии, когда больного еще можно излечить путем выполнения оперативного вмешательства.
Читайте также:

