Что такое аплазия при онкологии
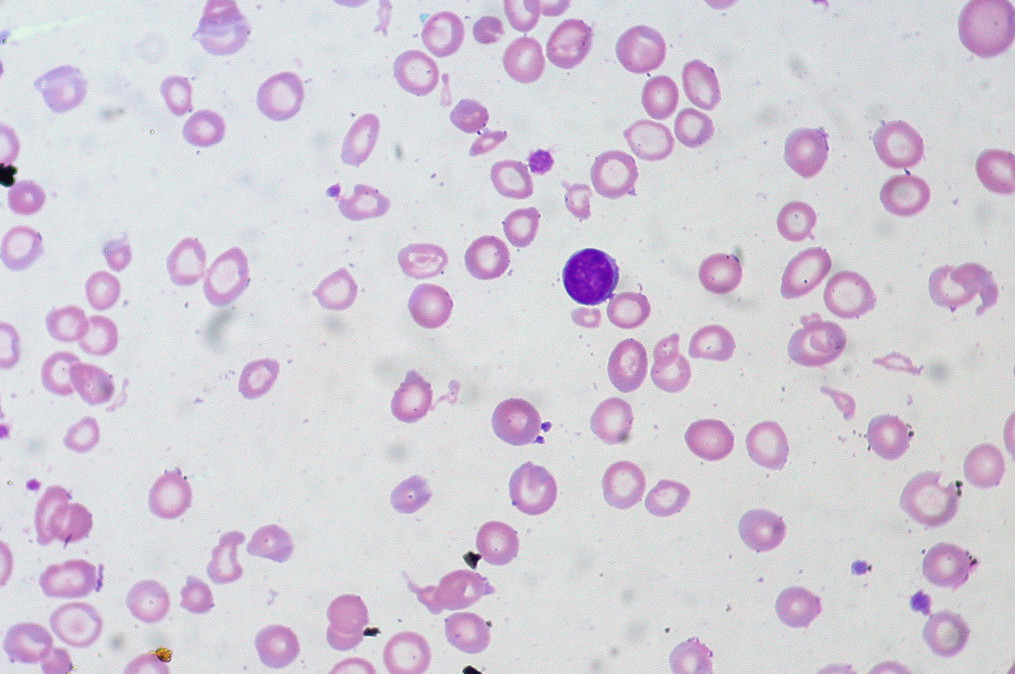
Апластическая анемия – это заболевание, которое включает в себя расстройства функции костного мозга и уменьшение количества элементов крови. Апластическая анемия может повлиять на людей всех возрастов, у некоторых она врожденная, у других – приобретенная.
Анемия иногда появляется внезапно или развивается постепенно, в течение длительного времени, даже в течение нескольких месяцев. Болезнь бывает кратковременная или хроническая. Апластическая анемия может иметь тяжелую форму и привести к смерти.
Причины аплазии костного мозга
На развитие апластической анемии влияние оказывают следующие факторы:
- лучевая терапия и химиотерапия;
- контакт с инсектицидами и гербицидами;
- аутоиммунные расстройства;
- условия труда;
- вирусные инфекции;
- прием некоторых лекарственных препаратов, например, некоторых антибиотиков и средств от ревматоидного артрита;
- гемолитическая анемия;
- заболевания соединительной ткани;
- ночная гемоглобинурия;
- беременность – иногда у женщин, ожидающих ребенка, иммунная система поражает костный мозг.
Симптомы апластической анемии
Симптомы апластической анемии зависят от того, какой компонент крови поврежден.
- слабость и одышка появляются при снижении уровня эритроцитов;
- повышенная восприимчивость к инфекциям и лихорадочное состояние имеет место при снижении уровня лейкоцитов в крови;
- склонность к кровотечению, а также образованию петехий присутствует при пониженном уровне тромбоцитов в крови.
Диагноз ставится при появлении двух из трех изменений в крови. Развитие аплазии костного мозга проходит по-разному, у некоторых пациентов болезнь протекает быстрее, у других медленнее. Иногда наступает период улучшения.
У людей с тяжелой формой заболевания смертность высокая, особенно перед началом лечения. К смерти приводит, как правило, сепсис или грибковая инфекция. Апластическая анемия может перерасти в рак.
Диагностика и лечение аплазии костного мозга
Для диагностики апластической анемии, как правило, требуется исследование крови, а также биопсия костного мозга. После установления диагноза анемии, как правило, проводят дальнейшие исследования, чтобы определить причину анемии.
Основными методами лечения апластической анемии являются: пересадка костного мозга и лечение андрогенами и иммуносупрессивными препаратами. Кроме того, лечение включает в себя переливание тромбоцитов и концентрата эритроцитов. Больным назначают также антибиотики и противогрибковые препараты.
Человек, страдающий от анемии, должен о себе заботиться. Рекомендуется избегать контакта с больными людьми и часто мыть руки в целях профилактики инфицирования.
Больные с анемией чувствуют усталость и трудности с дыханием, даже после минимальных усилий, поэтому они должны отдыхать, как только почувствуют такую необходимость. Следует также избегать занятий спортом, чтобы не допустить риска получения травм или падения.
Аплазия костного мозга (аплазия кроветворения) – синдромы костномозговой недостаточности, которые характеризуются подавлением функций кроветворения. У пациентов наблюдается дефицит всех видов кровяных клеток: лейкоцитов, эритроцитов и тромбоцитов. Первопричина аплазии кроветворения выявляется с помощью лабораторных методов. Способы лечения зависят от болезни, которая вызвала патологию. В международной классификации болезней (МКБ-10) аплазия костного мозга обозначается кодом D61.
Что такое аплазия костного мозга?
Костный мозг – орган кроветворной системы, который содержит как стволовые, так и созревшие клетки крови. Уменьшение количества всех клеток крови из-за приобретенной (часто) или врожденной (редко) аплазии костного мозга называется апластической анемией. Врожденные формы включают анемию Фанкони и синдром Даймонда-Блекфена.
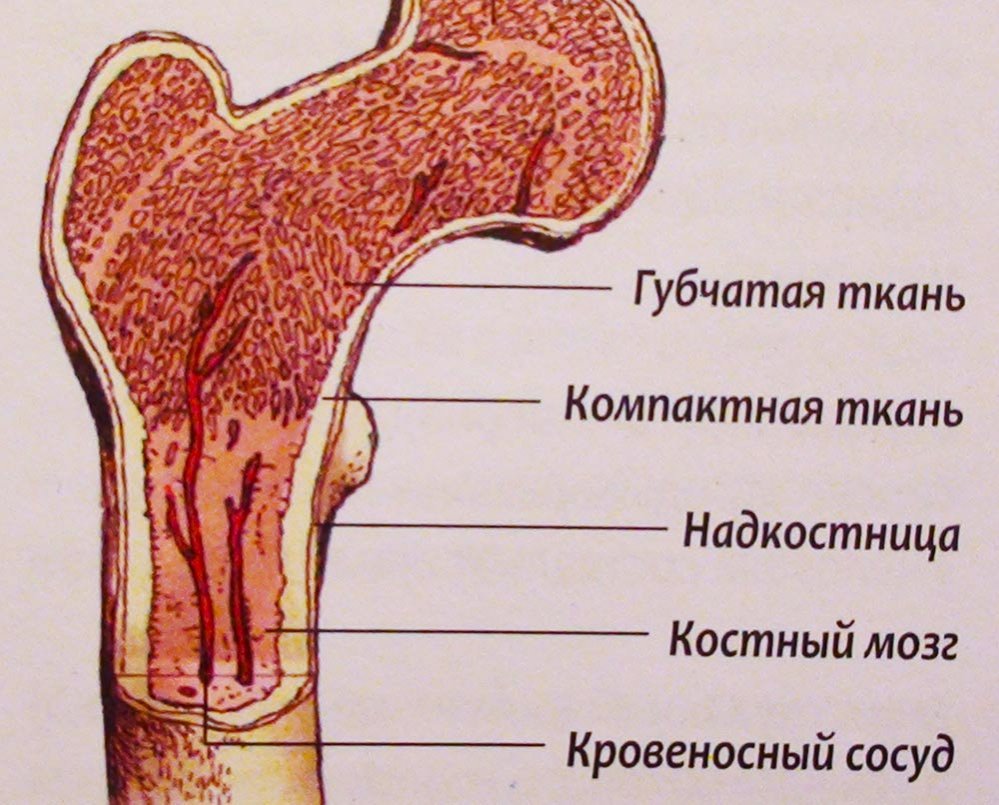
Аплазия костного мозга – состояние, при котором кроветворная функция костного мозга резко подавлена
Ежегодно возникает 0,2-0,3 случая на 100 000 человек. Около 200-300 человек в России страдают аплазией костного мозга. Болезнь опасна для жизни и отражается в измененной картине крови пациентов. Диагноз может затронуть даже здоровых молодых людей.
Если нарушается гемопоэз в костном мозге, могут образовываться дефектные кровяные клетки. Расстройство может затрагивать разные типы клеток (эритроциты, лейкоциты, тромбоциты). Симптомы аплазии кроветворной системы возникают потому, что количество клеток уменьшается настолько, что они не могут выполнять свою функцию в достаточной степени.
По клиническому течению различают острую (до 1 месяца), подострую (от 1 до 6 месяцев) и хроническую форму (от полугода и дольше) заболевания. По тяжести грануло- и тромбоцитопении выделяют 3 степени:
- Легкую (тромбоцитов более 20х109/л, гранулоцитов – более 0,5х109/л).
- Тяжелую (тромбоцитов менее 20х109/л, гранулоцитов – менее 0,5х109/л).
- Очень тяжелую (тромбоцитов менее 20х109/л, гранулоцитов – менее 0,2х109/л).
Уменьшение концентрации эритроцитов вызывает слабость, усталость, одышку и учащенное сердцебиение, особенно во время физических нагрузок. У пациентов с анемией часто наблюдается бледность кожных покровов.

При аплазии костного мозга иммунная система снижается
Из-за уменьшения количества белых кровяных телец повышается восприимчивость к инфекционным заболеваниям. Поскольку иммунная система организма не может оптимально работать с уменьшенным количеством гранулоцитов, инфекция может привести к фатальным последствиям. Поэтому важно обратиться незамедлительно к врачу в таких ситуациях.
При уменьшенном количестве тромбоцитов нарушается свертывающая система крови. В результате возникают так называемые петехии – очень небольшое точечное кровотечение или кровоподтеки (гематома). Они также могут возникать спонтанно, без предварительной травмы. Даже относительно небольшое кровотечение или микротравма (например, при посещении стоматолога) может привести к летальному исходу.
Причины
По этиологии (причине возникновения) выделяют врожденную и приобретенную аплазию костного мозга.
- Анемия Фанкони.
- Синдром Даймонда-Блекфена.
- Идиопатическая (>70% случаев).
- Лекарственная (10%): нестероидные противовоспалительные средства, хлорамфеникол, фенилбутазон, золото, пеницилламин, аллопуринол, фенитоин.
- Токсическая (10%).
- Вирусная (5%): особенно парвовирус B19 и вирус Эпштейна-Барр.
Поскольку во многих ситуациях фактор риска не может быть определен, большинство случаев заболевания следует классифицировать как идиопатические – без известной причины. Однако гипоплазия (или аплазия) костного мозга также может возникать как часть аутоиммунного заболевания, такого как системная красная волчанка.
Известно, что ряд цитотоксических препаратов увеличивает риск развития гипоплазии в области костного мозга. Следует отметить, что антиметаболиты вызывают только острую аплазию, тогда как алкилирующие вещества – хроническую.
Опасные осложнения
Гипоплазия, как и аплазия, костного мозга может протекать остро или хронически. Первыми предупредительными признаками могут быть нейтропения и тромбоцитопения. Иногда возникают клинические признаки анемии: усталость, общее чувство слабости, бледность кожи и слизистых оболочек. При хронической форме развиваются инфекции в области рта и шеи. Иногда увеличивается склонность к кровотечениям.
Диагностика
При физикальном осмотре больного определяют частоту пульса, так как при аплазии чаще всего он учащен
Вначале врач собирает анамнез, а затем проводит физический осмотр пациента. При подозрении на аплазию костного мозга назначают следующие обследования:
- Анализ крови.
- Гистологическое исследование.
- Цитогенетическое исследование.
Однако значительное снижение таких клеток также наблюдается при других заболеваниях. Врожденная недостаточность костного мозга или миелодиспластический синдром – распространенные причины гипоплазии кроветворной системы. Поэтому необходимы дальнейшие исследования, чтобы подтвердить диагноз.
Чтобы исключить лейкоз или миелодиспластический синдром и другие причины, может потребоваться цитогенетическое исследование. Возможные отклонения в количестве, а также в структуре хромосом могут быть обнаружены с помощью этого метода исследования. Приобретенная форма болезни обычно не характеризуется дефектами генетического материала. Выявление изменений в хромосомах, скорее всего, указывает на наличие миелодиспластического синдрома.
Лечение
Если известен фактор, вызывающий анемию – излучение, химические вещества, лекарства, – рекомендуется его устранить. Лечение зависит от тяжести заболевания. Терапия тяжелой и очень тяжелой аплазии кроветворной системы не отличается.
При легкой форме аплазии рекомендуется выжидательная терапия: пациент должен регулярно посещать врача и проходить плановые обследования. Ожидаемая продолжительность жизни этих пациентов не уменьшается даже при отсутствии лечения.
При тяжелой и очень тяжелой аплазии костного мозга назначают следующие терапевтические меры:
- Трансплантация гемопоэтических стволовых клеток.
- Иммунодепрессивная терапия.
- Поддерживающая терапия.
Если имеется донор в семье (например, братья и сестры), пересадку костного мозга следует выполнить как можно скорее. Длительное ожидание перед трансплантацией и большое количество переливаний крови могут ухудшить исходное состояние пациента. Если не найдено подходящего донора, назначается иммунодепрессивная терапия. Предварительное планирование лечения в специализированном центре абсолютно необходимо при аплазии костного мозга.
При аллогенной трансплантации пациент получает стволовые клетки крови от другого человека. Предшественники клеток крови могут принадлежать родственнику или незнакомцу. Аллогенная пересадка незнакомого донора связана с относительно более высокими рисками из-за низкой совместимости тканей.

Иммуносупрессивное лечение проводится, если нельзя провести трансплантацию
Если подходящий донор не найден, рекомендуется проведение иммуносупрессивной терапии. В этом случае комбинация нескольких препаратов подавляет дефектную иммунную реакцию, которая привела к уменьшению кроветворных клеток в костном мозге.
В последние годы назначают комбинацию антитимоцитарного глобулина и циклоспорина. В течение первых 4 дней стационарного лечения антитимоцитарный глобулин вводят через вену. Кроме того, пациенты получают в течение 4 недель глюкокортикоидное средство. Как только у пациента улучшается самочувствие и показатели крови, его можно отпустить домой и давать лекарства в виде таблетки или жидкости.
После иммунодепрессивной терапии у около 30% пациентов возникает рецидив болезни. У около 20% пациентов развивается острый миелоидный лейкоз или пароксизмальная ночная гемоглобинурия. Если в первые 3-6 месяцев после введения препаратов не наблюдается заметного улучшения состава крови или после успешной терапии апластическая анемия снова рецидивирует, необходима трансплантация стволовых клеток. Повторная иммуносупрессивная терапия, как правило, не проводится.
В зависимости от типа лечения (трансплантация костного мозга или применение иммунодепрессивных препаратов) требуется использовать различные поддерживающие меры, которые помогают бороться с побочными эффектами или осложнениями болезни. Иногда назначают симптоматические средства для уменьшения усталости.
Прогноз
Шансы на выздоровление пациента при своевременно начатом лечении достаточно высокие, хотя это опасное для жизни состояние. Аллогенная трансплантация гемопоэтических стволовых клеток приводит к выздоровлению 80-90% пациентов с гипоплазией в области костного мозга. Пересадка клеток от незнакомого донора также может вылечить пациентов с заболеваниями костного мозга. Однако у многих детей и подростков (около 20-30%) по-прежнему развиваются серьезные, а иногда и фатальные осложнения.
После завершения трансплантации пациенты должны обследоваться не реже одного раза в год у специалиста. Плановые обследования помогают своевременно лечить и предотвращать долгосрочные осложнения.
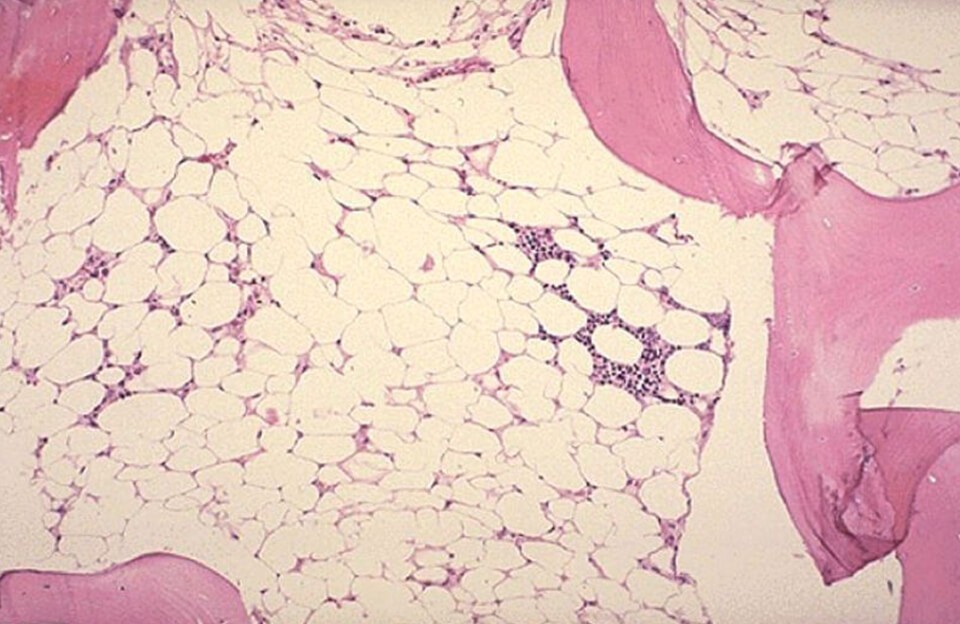
Апластическая анемия – тяжёлое гематологическое заболевание, сопровождающиеся малокровием, резким снижением иммунитета, а также нарушениями процессов свертывания крови. Она возникает вследствие подавления кроветворной функции костного мозг (или аплазии костного мозга).
Болезнь впервые описана известным немецким врачом и ученым Паулем Эрлихом, в 1888 году. Неизвестная ранее патология, обнаруженная у молодой беременной женщины, сопровождалась тяжёлой анемией, снижением числа лейкоцитов, лихорадкой, кровоточивостью и быстро привела к смерти больной. Проведенное патологоанатомическое исследование обнаружило замещение красного костного мозга жировой тканью. Позднее, в 1907 году, Анатоль Шоффар, французский врач, предложил назвать это заболевание апластической анемией.
Апластическая анемия – достаточно редкое заболевание. Средняя заболеваемость – 3-5 на 1 млн. всего населения за год. Большинство больных – дети и молодые люди.
Различают наследственную (генетически обусловленную) и приобретенную апластическую анемию.
80% случаев заболевания обусловлены приобретенной формой патологии, 20% вызваны генетическими факторами.
Медики пользуются классификацией патологии по МКБ-10 (Международная Классификация Болезней 10 пересмотра). Различают следующие виды апластических анемий:
D61.0 Конституциональная апластическая анемия
D61.1 Медикаментозная апластическая анемия
D61.2 Апластическая анемия, вызванная другими внешними агентами
D61.3 Идиопатическая апластическая анемия
D61.8 Другие уточненные апластические анемии
D61.9 Апластическая анемия неуточненная
У детей в большинстве случаев заболевание носит приобретенный характер. Частота встречаемости составляет 2-3 случая на 1 млн. детей (пик заболеваемости приходится на подростковый возраст). В 70% случаев непосредственную причину болезни установить не удаётся, принято считать, что наибольшее значение имеют вирусные инфекции, химикаты и лекарственные препараты.
Чаще всего диагноз устанавливают случайно, при общем анализе крови. При правильном лечении и своевременной диагностике прогноз благоприятный. Апластическая анемия у детей хорошо лечится. Результаты применения трансплантации костного мозга и иммуносупрессивной терапии примерно одинаковы по эффективности, однако следует отдавать предпочтение пересадке костного мозга от подходящего (в идеале брат или сестра) донора. Современные методы лечения апластической анемии в детском возрасте позволяют сохранить здоровье и не влияют на способность иметь детей в будущем.
Генетически обусловленные нарушения кроветворной функции отмечают при некоторых наследственных патологиях, таких как семейная анемия Фанкони, синдром Швахмана-Даймонда, истинная эритроцитарная аплазия, врождённый дискератоз.
Мутации в критически важных генах, отвечающих за регуляцию клеточного цикла, синтез белков, защиту и восстановление повреждений ДНК, ведут к образованию дефектных стволовых (гемопоэтических) клеток. Ошибки в генетическом коде инициируют запуск апоптоза – механизма запрограммированной клеточной смерти. При этом пул стволовых клеток сокращается гораздо быстрее, чем у здоровых людей.
Приобретенная форма патологии возникает в результате прямого токсического воздействия на гемопоэтические клетки. К таким факторам относят:
· Воздействие ионизирующей радиации. От апластической анемии погибла Мария Склодовская-Кюри - физик, дважды лауреат Нобелевской премии, полученной за работы в области исследования радиоактивности и за открытие новых радиоактивных элементов;
· Пестициды, инсектициды, производные бензола, соли тяжёлых металлов, мышьяк обладают прямым токсическим эффектом на костный мозг, угнетают продукцию форменных элементов крови и приводят к гибели стволовых клеток;
· Схожим эффектом обладают некоторые лекарства. Нестероидные противовоспалительные средства, противоопухолевые препараты, анальгин, левомицетин (вызывает наиболее тяжёлую форму заболевания, которая по статистике возникает в 1 из 30 тыс. курсов лечения левомицетином), мерказолил, карбамазепин, хинин способны вызвать апластическую анемию у некоторых людей;
· Пусковым фактором для болезни могут быть вирусы. Вирусные гепатиты, некоторые виды парвовирусов, ЦМВ, вирус Эпштейна-Барр и ВИЧ обладают способностью вызывать сбой в иммунной системе, вследствие чего она начинает атаковать собственные ткани организма. Например, у 2% пациентов с острым вирусным гепатитом - выявляют апластическую анемию;
· Аутоиммунные заболевания (ревматоидный артрит, СКВ) также может сопровождать аплазия костного мозга;
· Апластическая анемия при беременности, предположительно, также возникает из-за нарушений в иммунной системе.
В более 50% случаев непосредственную причину заболевания не находят, тогда говорят об идиопатической апластической анемии.
Красный костный мозг – основной и самый важный кроветворный орган, в котором происходит образование и созревание элементов крови. Стволовые гемопоэтические клетки в нем дают начало эритроцитам (отвечают за перенос О 2 и СО 2 ), лейкоцитам (обеспечивают иммунитет) и тромбоцитам (участвуют в процессах свёртывания крови). Количество гемопоэтических клеток ограничено и постепенно уменьшается на протяжении всей жизни человека.
При апластической анемии происходит массовая гибель стволовых клеток костного мозга, и, как результат, - резкое снижение содержания эритроцитов, тромбоцитов и лейкоцитов в кровеносном русле больного. Недостаток эритроцитов приводит к малокровию, уменьшение количества лейкоцитов вызывает резкое угнетение иммунной системы, уменьшение числа тромбоцитов - причина кровоточивости и, как следствие, повышенного риска неконтролируемого кровотечения.
Результаты последних исследования дают основание полагать, что приобретенная форма заболевания почти всегда - аутоиммунная патология. Ключевой момент в развитии аплазии красного костного мозга – прямое цитотоксическое действие Т-лимфоцитов. Однако причина, по которой Т-лимфоциты начинают распознавать гемопоэтические стволовые клетки как цели для атаки, до сих пор неизвестна. Пусковым фактором могут служить точечные мутации в генах, кодирующих человеческие лейкоцитарные антигены (HLA система), и объясняющий искажённый иммунный ответ (как и при других аутоиммунных патологиях).
Также полагают, что для развития патологии необходима комбинация нескольких факторов – как внутренних (неизвестные дефекты в ДНК стволовых клеток, мутации генов системы HLA, иммунные нарушения), так и внешних (лекарственные препараты, вирусные инфекции, экзотоксины и антигены).
Симптомы, характерные для заболевания:
· Необъяснимая слабость, утомляемость, сонливость;
· Одышка, возникающая даже при легком физическом напряжении;
· Головокружение, головные боли;
· Перебои в сердце, сердцебиение, тахикардия;
· Удлинение времени свертывания крови, кровоизлияния в мягкие ткани, головной мозг, образование синяков и кровоподтёков при незначительном воздействии, кровотечение из носа, затяжные изнуряющие менструации у женщин;
· Мелкоточечные кровоизлияния в кожу и слизистые оболочки, кровоточивость десен;
· Частые инфекции (дыхательных путей, кожи, слизистых оболочек, мочевыводящих путей), сопровождающиеся лихорадкой;
· Безболезненные язвы на слизистой рта;
· Потеря массы тела, похудание.
Течение болезни может быть постепенным или молниеносным (с быстрым развитием крайне тяжелой анемии, иммунодефицита, нарушениям процессов свертывания крови с соответствующими осложнениями).
Для диагностики используют развернутый анализ крови и гистологическое исследование материала, добытого из костного мозга.
Лабораторные признаки патологии, обнаруживаемые в периферической крови:
· Снижение концентрации эритроцитов и гемоглобина в крови без дефицита железа;
· Снижение концентрации лейкоцитов всех видов в крови больного;
· Низкое количество ретикулоцитов – незрелых форм эритроцитов;
· Увеличение скорости оседания эритроцитов (до 40-60 мм/ч).
В очень тяжелых случаях концентрация гемоглобина падает ниже 20-30 гр/л. Цветовой показатель, уровни сывороточного железа, эритропоэтина обычно в норме или повышены. Количество тромбоцитов ниже нормы, в тяжёлых случаях они полностью отсутствуют.
Диагноз подтверждается с помощью биопсии костного мозга. Гистология пунктата показывает большое содержание жира на фоне снижения количества гемопоэтических клеток. Клеточность (общее содержание гемопоэтических стволовых клеток) – ниже 30%, могут отсутствовать мегакариоциты – клетки-предшественники тромбоцитов.
По результатам биопсии различают апластическую анемию лёгкой, тяжёлой и крайне тяжелой степени.
Тяжёлая форма болезни: клеточность – ниже 25%; в периферической крови: нейтрофилов – 9 /л, тромбоцитов – 9 /л, ретикулоцитов – 9 /л.
Крайне тяжелая форма болезни: клеточность – ниже 25; в периферической крови: нейтрофилов – 9 /л, тромбоцитов – 9 /л, ретикулоцитов – 9 /л.
Легкая форма патологии отклонения от нормы не достигают таких критических показателей.
Тактика лечения зависит от нескольких факторов: от степени тяжести, возраста больного, возможности провести пересадку костного мозга от подходящего донора (в идеале – близкие единокровные родственники больного).
Оптимальным методом лечения тяжелой и крайне тяжелой формы патологии принято считать трансплантацию костного мозга от подходящего донора. Максимальный эффект наблюдается у пациентов молодого возраста. При пересадке костного мозга от подходящего донора 10-летняя выживаемость может достигать 85-90%.
При наличии противопоказаний к трансплантации костного мозга или отсутствии возможности провести её (отсутствие подходящего донора) используется иммуносупрессивная терапия.
Основные препараты, использующиеся для консервативной терапии – антитимоцитарный иммуноглобулин (АТГ) и циклоспорин А.
АТГ – это сыворотка, содержащая антитела против человеческих Т-лимфоцитов, полученная из лошадиной крови. Введение приводит к сокращению популяции Т-лимфоцитов в организме больного, в результате снижается цитотоксическое воздействие на стволовые клетки, улучшается кроветворная функция.
Циклоспорин А – селективный иммунодепрессант, избирательно блокирующий активацию Т-лимфоцитов и высвобождение интерлейкинов, включая интерлейкин-2. В результате блокируется аутоиммунный процесс, разрушающий стволовые клетки, улучшается кроветворная функция. Циклоспорин А не подавляет кроветворную функцию костного мозга и не приводит к тотальной иммуносупрессии.
Показания к назначению глюкокортикостероидов при апластической анемии ограничены профилактикой осложнений при терапии АТГ. Во всех остальных случаях стероидные гормоны имеют посредственную эффективность и являются причиной целого ряда осложнений.
Несмотря на высокую эффективность иммуносупрессивной терапии наиболее радикальное лечение - это пересадка костного мозга. Применение АТГ и циклоспорина А увеличивает риск развития миелодиспластического синдрома и лейкозов, не гарантирует отсутствие рецидивов заболевания.
При неэффективности иммуносупрессивной терапии проводится пересадка костного мозга от донора, не состоящего в родстве с больным. Результаты операции могут быть разными. В 28-94% случаев отмечают 5-летняя выживаемость, в 10-40% случаев происходит отторжение трансплантата.
Пациенты с тяжёлой апластической анемией получают препараты крови в качестве экстренной медицинской помощи. Переливание эритроцитарной массы позволяет быстро компенсировать анемию, а переливание тромбоцитарной массы предупреждает угрожающие жизни кровотечения.
Даже при стойкой ремиссии необходимо проходить периодические обследования (прежде всего, сдавать анализы крови) и по возможности - избегать воздействия негативных факторов.
В период лечения следует помнить, что больные с апластической анемией имеют слабую иммунную систему. Необходимо избегать посещения мест массового скопления людей, регулярно мыть руки, не есть приготовленную в сомнительных местах еду (из-за риска инфекции). Своевременная вакцинация может предупредить некоторые заболевания (в том числе гриппа).
Высокий риск кровотечения или кровоизлияния ограничивает занятия спортом, особенно травмоопасными видами. Несмотря на это, активный образ жизни с регулярными дозированными физическими нагрузками положительно влияют на самочувствие и психоэмоциональное состояние больных.
Сбалансированное питание, богатое витаминами, минералами и белками способствует быстрому восстановлению кроветворения. Не следует употреблять скоропортящиеся продукты (из-за риска возникновения пищевых токсикоинфекций). При лечении циклоспорином А следует ограничить потребление соли.
Оппортунистические инфекции (вирусные, грибковые, бактериальные), обусловленные иммунодефицитом;
Кровотечения, кровоизлияния, нарушения свертывания крови (обусловленные низким числом тромбоцитов);
Осложнения, обусловленные побочными эффектами лекарственных средств для лечения апластической анемии (вторичный гемохроматоз, сывороточная болезнь);
Трансформация болезни в миелодиспластический синдром, лейкемию и другие гематологические заболевания.
До выяснения причин и механизмов развития патологии смертность от апластической анемии достигала 90%. За последние 20-30 лет удалось значительно снизить летальность заболевания. Современные методы лечения значительно улучшили прогноз – 85% пациентов достигают 5-летнего порога выживаемости.
У детей и молодых людей при адекватном лечении прогноз благоприятный и пятилетняя выживаемость достигает 90% (для больных старше 40 лет - 75%).
Эффективные меры профилактики генетически обусловленной апластической анемии отсутствуют в настоящее время.
Профилактика приобретенной апластической анемии заключается в адекватной защите от воздействия токсических веществ, пестицидов и ионизирующего излучения. Следует избегать самостоятельного приема лекарственных средств, особенно длительного и в высоких дозах.

Данная патология встречается редко — примерно 4 случая на 1 млн. населения, подвержены ей как мужчины, так и женщины. Пики заболеваемости приходятся на возраст от 10 до 25 и после 60 лет.
Кровь содержит важнейшие для организма клетки: эритроциты, лейкоциты и тромбоциты. Все эти клетки зарождаются в костном мозге и выполняют различные функции по жизнеобеспечению всего организма.
Апластическая анемия — что это такое?

Аплазия костного мозга
Апластическая анемия — неспособность костного мозга производить достаточное число клеток кровеносной системы.
Заболевание сопровождается повреждением кроветворных ростков костного мозга либо изменением микроокружения стволовых клеток, из которых образуются кровяные клетки. При развитии болезни существует большой риск необратимых осложнений, но своевременное лечение позволяет восстановить функции костного мозга.
Причины апластической анемии

Цитостатики способны угнетать гемопоэз в костном мозге
Не всегда есть возможность определить причину данной патологии. В половине случаев апластическая анемия возникает под воздействием сбоя в организме, происхождение которого пока остаётся загадкой. Считается, что возможной причиной является нарушение иммунитета, когда защитные клетки угнетают собственные клетки организма (механизм, идентичный аутоиммунным заболеваниям).
В остальных случаях причинами являются:
- облучение радиацией,
- взаимодействие с химическими соединениями (мышьяк, ртуть, бензол),
- приём медицинских препаратов (антибиотики, противоопухолевые, противовоспалительные),
- заболевания аутоиммунной этиологии,
- врожденные нарушения функций костного мозга,
- вирусные инфекции.
Классификация апластической анемии
Апластическую анемию классифицируют по форме заболевания:
- острая — анемия, протекающая менее 1 месяца,
- подострая — от 1 до 6 месяцев,
- хроническая — более 6 месяцев.
Также патологию разделяют на виды по природе происхождения и тяжести заболевания.

Химиотерапия — причина приобретенной апластической анемии
- Приобретённая. Данная форма заболевания может стать следствием облучения при химиотерапии либо воздействия рентгеновских лучей. Другой причиной является повышенная чувствительность отдельных пациентов к соединениям, входящим в лекарственные препараты. Причина чувствительности чаще всего заложена генетически и проявляется не только у одного члена семьи, но и у его ближайших родственников. Вирусная этиология встречается у пациентов с наличием вирусных гепатитов, вируса Эпштейн-Барра, герпес вируса. Аутоиммунные системные патологии, вызывающие анемию — ревматоидный артрит, красная волчанка.
- Врожденная. Редкое наследственное заболевание анемия Фанкони провоцирует недостаточность производительности костного мозга. Патология определяется в возрасте 4 — 12 лет, её наличие отражается и внешними признаками — физическими дефектами. Сопровождается отставанием в развитии и повышенной склонностью к появлению опухолевых образований. Ещё одно наследственное заболевание, являющееся источником апластической болезни — анемия Блекфена-Даймонда. Характерная особенность — поражение только эритроидного ростка костного мозга. Определяется патология при рождении, максимум в течение первого года жизни. Характерными признаками являются аномалии развития внешних и внутренних органов, выраженная бледность кожных покровов.
- Идиопатическая. Патология возникает по неустановленной причине.

Клеточность костного мозга определеяет степень анемии
- Умеренная. Показатели тромбоцитов составляют > 20 * 10 9/л; нейтрофилы, эозинофилы, базофилы (то есть гранулоциты) превышают значение 0,5 * 10 9/л.
- Тяжёлая. При изучении образца костного мозга определяется клеточность Симптомы

Усталость и разбитость — неспецифические признаки анемии
Апластическая анемия чаще проявляется резко, но в некоторых случаях болезнь развивается незаметно, человек испытывает лишь повышенную утомляемость, вялость. Постепенно начинают ощущаться все характерные признаки патологии. Так как угнетается выработка всех кроветворных клеток, пациент испытывает симптомы, определяющие их недостаток в крови.
- бледность кожных покровов,
- чувство постоянной усталости,
- одышка,
- ломкость волос и ногтей,
- учащённое сердцебиение,
- угнетение иммунитета.
- повышение температуры,
- озноб,
- головные боли,
- стоматит,
- появление язвочек в ротовой полости.
- кровотечения из носа, дёсен,
- подкожные кровоизлияния, кровоподтёки,
- образование синяков при незначительном воздействии.
Апластическая анемия у детей

Часто болеющий ребенок — повод для обследования
Заболевание у детей носит как врожденные, так и приобретённые формы. Врожденные являются наиболее изученными видами апластической анемии. При анемии Фанкони ребёнок рождается с малым весом, физические дефекты проявляются искривлением лучевой кости либо отсутствием большого пальца на кисти рук. В раннем возрасте обнаруживается неправильное развитие внутренних органов.
Анемия Блекфена-Даймонда характеризуется бледной кожей с желтоватым либо сероватым оттенком, увеличенной печенью и селезёнкой. Вес и физическое развитие чаще всего соответствуют норме. Ребёнок проявляет повышенную возбудимость, может отказываться от еды, сон нарушен. Анемия протекает в большинстве случаев в хронической форме.
Патология приобретённого характера может выражаться следующими симптомами:
- жалобы ребёнка на головные боли и боли в костях;
- ломкость волос, возможно появление седых волос;
- слезотечение;
- измененная структура и форма ногтей;
- уплотнения либо трещины в уголках губ;
- наличие отёков в суставах ног;
- бледность кожи, синюшность губ;
- быстрая утомляемость после малейшей физической активности;
- частые инфекционные заболевания.
При обнаружении этих признаков необходимо обратиться к врачу. Также профилактическую диагностику рекомендуют проходить детям, контактировавшим со ртутью, нефтепродуктами; переболевшим вирусным гепатитом, вирусом герпеса и Эпштейн-Барра. Нетяжелые формы имеют благоприятный прогноз и поддаются лечению.
Диагностика

Пункция костного мозга производится под анестезией
Для выявления данного заболевания используется общий клинический анализ крови и морфологическое исследование костного мозга. Процесс извлечения образца костного проводится под общим наркозом. Для исследования получают препараты костного мозга из трёх анатомически разных точек подвздошной кости. У новорожденных осуществляют пункцию большеберцовой либо пяточной кости.
Апластическая анемия определяется следующими показателями:
- стойкое снижение числа гранулоцитов и тромбоцитов;
- пониженный уровень гемоглобина;
- повышенный уровень железа в сыворотке;
- малочисленные очаги кроветворения в костном мозге;
- преобладание жирового костного мозга.
Лечение апластической анемии

Стационарное лечение с целью дообследования пациентов
- Пациента помещают в стационар. При тяжёлых формах необходимо размещение в отдельной палате, где воздух периодически обеззараживается.
- В зависимости от причины назначается лечение, устраняются факторы, вызвавшие анемию.
- Используется переливание донорской крови, исключение — аутоиммунная этиология заболевания.
- При аутоиммунной форме назначаются иммунодепрессанты, кортикостероиды.
- Хороший прогноз при аутоиммунной анемии даёт хирургическое удаление селезёнки.
- Пересадка костного мозга — процедура целесообразна в возрасте до 20 лет.
- Приём медикаментов, стимулирующих кроветворение.
- При кровотечениях показаны кровоостанавливающие средства.
- Назначаются препараты, способствующих выведению лишнего железа из тканей органов.
Возможные осложнения
Без применения терапии риск смертельного исхода составляет 80%. Самыми частыми причинами являются образовавшийся в результате лейкоз, миелодиспластический синдром, сепсис. Также с большой вероятностью пациент умирает от развития грибковых и бактериальных инфекций.
При своевременном лечении прогноз благоприятный, особенно это касается нетяжёлых форм заболевания. Пересадка костного мозга позволяет достичь ремиссии в 80 — 90% случаев. При аутоиммунной форме удаление селезёнки помогает восстановить показатели клеток крови в 80% случаев.
Профилактика заболевания

Регулярное посещение врача — мера вторичной профилактики
Для пациентов с врождёнными видами заболевания необходимо постоянное наблюдение гематолога. Консультация гематолога также обязательна для лиц, чьи ближайшие родственники страдают от апластической анемии, так как нередко предрасположенность заложена генетически.
В остальных случаях профилактические меры заключаются в своевременном обращении к врачу, если в наличии есть симптомы анемии либо в анамнезе вирусные заболевания, провоцирующие апластическую патологию. Профилактика исключает любого рода самолечение при вирусных, бактериальных инфекциях, а также передозировку лекарственных препаратов.
Людям, работающим с химическими веществами, необходим постоянный контроль над состоянием крови, а лучше всего — сменить сферу деятельности.
Читайте также:

