Что означает опухоль без органопринадлежности
Похожие темы научных работ по клинической медицине , автор научной работы — Ерохина О.А., Клюкина Л.Б.
Цитологический скрининг в Алтайском крае в 2012г.
№ Лаборатория Число ж-н, подлежащих осмотру Число ж-н, осмотренных цитол. В т.ч. до 30 лет % охвата Выявленные поражения
SIN SIC Ist. IIst. IIIst. аденокар-цинома
1 Лаборатория КГБУЗ АКОД 127619 82 332 124970 64.5 75 96 37 11 6 3
3 Лаборатория г. Барнаул МУЗ ГБ №5 212500 110228 81 321 51.8 50 15 5 7 —
4 Лаборатория г. Бийска КГБУЗ БОД 167763 104392 62.2 11 10 10 25 7 1
5 Лаборатория г. Рубцовск КГБУЗ РОД 134 830 58 080 43.1 74 12 5 5 4 —
6 Лаборатория КГБУЗ Славгородская ЦРБ 20 810 12 658 3547 60.8 15 4 1 - 1 —
7 КДЛ г. Новоалтайска 1488 1488 100 9 - - - - —
8 КДЛ г. Камень-на-Оби 26 731 15 416 6907 57.7 32 1 3 3 3
9 Алтайский край 848 705 470 597 55.4 251 197 83 54 29 4
тику воспалительных процессов. Неспецифические воспалительные процессы были диагностированы у 27 295 (5.8 %) обследуемых женщин, специфические — у 10 353 (2.2 %). Цитологическая картина кандидозного кольпита отмечена у 1916 женщин (18.5 % специфических воспалительных процессов). Цитологическая картина трихомо-надного кольпита диагностирована в 7671 наблюдении (74.1 % всех специфических воспалительных процессов), вирусного поражения клеток — 766 (7.4 %).
У 297 женщин обнаружены клеточные изменения, характерные для ИРУ инфекции с поражением клеток плоского эпителия легкой степени. Исследуя возрастные особенности женщин с ИРУ-инфекцией, выявленных цитологически, следует отметить, что пик приходится на возраст 18—25 лет (31.9 %). Женщины в возрасте от 26
до 35 лет с признаками ИРУ-инфекции составили 27.0 %; от 36 до 45 лет — 22.6 %; от 46 до 55 лет — 13.3 %; свыше 55 лет — отмечено 5.2 % всех наблюдений. Плоскоклеточный рак шейки матки с признаками ИРУ-инфекции чаще всего отмечен у женщин в возрасте 41 года.
До настоящего времени цитологический скрининг не потерял своей актуальности, является реальной основой раннего выявления не только прединвазивно-го рака шейки матки и предопухолевых поражений, но и позволяет впервые обнаружить косвенные признаки ИРУ-инфекции в шейке матке, что способствует формированию групп повышенного онкологического риска, особенно в возрастной группе 18—25 лет.
CYTOLOCICAL SCREENING OF CARCINOMA COLLI UTERI IN THE ALTAY REGION IN 2012
Grigoruk O.G., Lazarev A.F. Авторы:
Григорук О.Г.- зав. отд. клин. лаб. диагностики (для цитол. иссл) диспансера, старший научн. сотр. Алтайского филиала РОНЦ им. Н.Н. Блохина РАМН, канд. биол. наук; Лазарев А.Ф. — главный врач диспансера, директор Алтайского филиала РОНЦ им. Н.Н. Бло-хина РАМН, доктор мед. наук, проф.
определение органопринадлежности клеток опухоли в выпотных жидкостях
О.А. ЕРОХИНА, Л.Б. КЛЮКИНА
Республиканский научно-практический центр онкологии и медицинской радиологии им. Н.Н. Александрова (г. Минск, Республика Беларусь)
В клинической практике первичная диагностика злокачественного процесса иногда основана на выявлении клеток опухоли в выпотных жидкостях, полноценная оценка которых может помочь установить первичный очаг новообразования и исключить или подтвердить первично-множественный рак.
Оценить значимость использованных антител в уточнении первичного очага метастатической опухоли.
Материал и методы исследования
У 37 пациентов в клеточных блоках из плевральной жидкости выполнено иммунофенотипирование с мо-
ноклональными антителами производства ВюСепех (США) ТТР-1, ССБРР-15, ЕЙ и РИ. Включены наблюдения с диагнозом протокового рака молочной железы (РМЖ) — 10, аденокарциномы легкого (АКЛ) — 12, плоскоклеточного рака легкого (ПКРЛ) — 3, злокачественной мезотелиомы — 1 и экссудаты с реактивно измененным мезотелием — 11. Все случаи злокачественной опухоли подтверждены гистологически. Положительной считали реакцию в 10 % и более оцениваемых клеток вне зависимости от ее интенсивности (ядерная или цитоплазматическая согласно спецификации).
Экспрессия ТТР-1 выявлена в 8 из 15 случаев рака легкого (6 АКЛ и 2 ПКРЛ) и ни в одном из других исследованных случаев (чувствительность 53.3 %, специфичность 100 %). Положительная реакция ССБРР-15 имела место в 6 наблюдениях РМЖ, 4 АКЛ, 1 ПКРЛ и 1 мезотелиомы (чувствительность 60.0 %, специфичность для наблюдений злокачественных опухолей, исключая РМЖ, 62.5 %). В клетках реактивного мезоте-лия (11 случаев) экспрессия ССБРР-15 отсутствовала. При определении гормонального профиля (ЕЙ, РИ) клеток потокового РМЖ установлена экспрессия ЕЙ лишь в 1 из 10 случаев, а реакция РИ не выявлена ни в одном из них. Вместе с тем отмечено слабое окрашивание ядер мезотелиальных клеток антителом РИ в 1 из 11 наблюдений реактивных экссудатов.
Среди 15 наблюдений рака легкого иммуноцитохи-мическое (ИЦХ) исследование с ТТР-1 проводилось у 7 пациентов во время первичной диагностики рака, положительная реакция в клетках метастатического рака в плевральной жидкости выявлена в 3 случаях. В других 8 случаях гидроторакс развился на фоне проводимого лечения, иммунофенотипирование клеток опухоли в выпотной жидкости выполнено после проведения курсов химиотерапии (ХТ); положительная реакция в отмечена в 5 случаях. В 2 из 15 указанных наблюдений проводили иммунофенотипирование в гистологическом материале первичной опухоли, а ИЦХ-исследова-ние проведено в клетках метастатической опухоли из плевральной жидкости, полученной после многочисленных курсов ХТ в течение 5 лет. В обоих случаях яркая экспрессия ТТР-1 выявлена как в первичной, так и в метастатической опухоли. Исходя из этого, полагаем, что отрицательная реакция с ТТР-1 не может быть связана и обусловлена проведением ХТ.
Лишь в 1 из 10 наблюдений РМЖ ИЦХ-исследование в мазках из плевральной жидкости выполнено у пациентки до начала специального лечения. У 9 больных метастатический плеврит развился как прогрессирование процесса на фоне проводимого лечения или после окончания курсов ХТ. Гистологически гормональный статус
первичной опухоли определен у всех женщин. В 7 наблюдениях иммунофенотипирование проводили во время первичной диагностики РМЖ, положительная реакция выявлена в 5, отрицательная в 2 наблюдениях. В 3 наблюдениях хирургическое вмешательство и иммуно-гистохимическое исследование выполнено после 2—4 курсов неоадьювантной ХТ, положительная реакция отмечена в 1 случае, отрицательная — в 2. Сочетанная экспрессия ER и PR определена в 4 случаях (3 случая до ХТ, 1 — после лечения), только ER — в 2 до ХТ. В клетках метастатического рака в плевральной жидкости умеренная экспрессия ER отмечена у пациентки спустя 3 года после начала заболевания (после химиолучевой терапии), у которой ранее в ткани молочной железы, удаленной после 4 курсов неоадьювантной ХТ, гистологически установлена выраженная реакция как ER, так и PR. Возможно, в процессе прогрессирования опухоль теряет первичный положительный гормональный статус вследствие мета-стазирования менее дифференцированного компонента опухоли или под воздействием химиопрепаратов.
TTF-1 является высокоспецифичным маркером рака легкого (100.0 %), однако отрицательная реакция на TTF-1 не исключает этот диагноз (чувствительность 53.3 %). GCDFP-15 не может быть рекомендован для распознавания клеток РМЖ вследствие невысоких показателей чувствительности (60.0 %) и специфичности в отношении других злокачественных опухолей (62.5 %). Экспрессия антител к рецепторам гормонов ER и PR в метастатической опухоли плевральной жидкости определена гораздо реже, чем при гистологическом исследовании первичной опухоли, но отсутствие ее в клетках метастатического рака легкого и злокачественной мезо-телиомы позволяют считать положительную реакцию клеток опухоли с этими антителами маркером РМЖ.
1. Dabbs, D.J. Carcinomatous differentiation and metastatic carcinoma of unknown primary. D.J. Dabbs .Diagnostic Immunohistochemistry; D.J. Dabbs. Churchill Livingstone. 2002. Ch.7,11,15,16: 163-196, 267-312, 486516, 536-558.
2. Koss, L.G. Effusions in the рresence of cancer (L.G. Koss). Diagnostic cytology and its histopathologic bases; L.G. Koss., 4th Ed. J.B. Lippincott Company,1992.Ch. 26: 1116-184.
3. Ng, W.K. Thyroid transcription factor-1 is highly sensitive and specific in differentiating metastatic pulmonary from extrapulmonary adenocarcinoma in effusion fluid cytology specimens. A study of 36 cases. W.K. Ng, J.C.Y. Chow, P.K.H. Ng. Cancer (Cancer Cytophathol.). 2002; 96(1): 43-8.
DETECTION OF PRIMARY SITE TUMORS IN SEROUS EFFUSIONS
Erokhina O.A., Kliukina L.B. Авторы:
Ерохина О.А. — врач лабораторной диагностики ПАО, канд. мед.наук;
Клюкина Л.Б. — главн.научн.сотр. отдела канцерогенеза с морфол. группой, доктор мед.
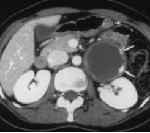
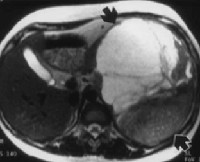
Внеорганные забрюшинные опухоли – группа злокачественных и доброкачественных новообразований мезодермального, нейрогенного и эмбриогенного происхождения, локализующихся в забрюшинном пространстве. Характерно длительное бессимптомное течение. При забрюшинных опухолях большого размера наблюдаются диспепсические расстройства, нарушения мочеиспускания, одышка, неврологические симптомы и отеки нижних конечностей. При злокачественных поражениях на поздних стадиях выявляются признаки раковой интоксикации. Диагноз выставляется с учетом данных КТ, МРТ, УЗИ, биопсии и других исследований. Лечение – операция, радиотерапия, химиотерапия.
- Классификация забрюшинных опухолей
- Причины развития забрюшинных опухолей
- Симптомы забрюшинных опухолей
- Диагностика забрюшинных опухолей
- Лечение и прогноз при забрюшинных опухолях
- Цены на лечение
Общие сведения
Внеорганные забрюшинные опухоли – группа новообразований, происходящих из тканей забрюшинного пространства, в том числе из жировой, мышечной, соединительной и нервной ткани, лимфоузлов, лимфатических и кровеносных сосудов и эмбриональных элементов. Группа забрюшинных опухолей не включает в себя онкологические процессы в органах, расположенных в данном пространстве, а также метастатические поражения забрюшинных лимфоузлов при опухолях других локализаций. Причинами объединения столь разнородных заболеваний в одну группу являются сходные особенности клинического течения, общие методы диагностики и терапии.
Забрюшинные опухоли могут быть как злокачественными, так и доброкачественными. Встречаются редко, по различным данным составляют от 0,03 до 0,3% от общего количества онкологических заболеваний. Некоторые специалисты полагают, что эта цифра занижена из-за диагностических затруднений при выявлении данной патологии. Обнаруживаются преимущественно в возрасте 50 лет и старше. Представители обоих полов страдают одинаково часто. Лечение осуществляют специалисты в области онкологии, неврологии и сосудистой хирургии.

Классификация забрюшинных опухолей
Забрюшинным пространством называют пространство между задним листком брюшины, диафрагмой, мышцами спины, позвоночником и мышцами, выстилающими дно малого таза. В этой анатомической зоне локализуются поджелудочная железа, почки, надпочечники, мочеточники, часть двенадцатиперстной кишки и часть толстого кишечника. Пространство между органами заполнено клетчаткой, в которой располагаются нервные сплетения, лимфоузлы, лимфатические и кровеносные сосуды. Забрюшинная клетчатка разделена фасциями на несколько отделов.
Внеорганными забрюшинными опухолями считаются любые узлы, расположенные в данном пространстве за исключением новообразований, происходящих из перечисленных выше органов, а также метастатических поражений лимфоузлов и опухолей, прорастающих в забрюшинное пространство из других анатомических зон (например, из брюшной полости). В основе наиболее популярной классификации забрюшинных опухолей, созданной Аккерманном в 1954 году, лежат гистогенетические особенности неоплазий. Согласно этой классификации различают три больших подгруппы таких новообразований: мезодермальные, нейрогенные и происходящие из элементов эмбриональных тканей.
Мезодермальные забрюшинные опухоли:
- Происходящие из жировой ткани: липомы (доброкачественные) и липосаркомы (злокачественные).
- Происходящие из гладкомышечной ткани: лейомиомы (доброкачественные) и лейомиосаркомы (злокачественные).
- Происходящие из поперечно-полосатой мышечной ткани: рабдомиомы (доброкачественные) и рабдомиосаркомы (злокачественные).
- Происходящие из соединительной ткани: фибромы (доброкачественные) и фибросаркомы (злокачественные).
- Происходящие из кровеносных сосудов: гемангиомы (доброкачественные) и ангиосаркомы (злокачественные), гемангиоперицитомы (доброкачественные и злокачественные).
- Происходящие из лимфатических сосудов: лимфангиомы (доброкачественные) и лимфангиосаркомы (злокачественные).
- Происходящие из остатков первичной мезенхимы: миксомы (доброкачественные) и миксосаркомы (злокачественные).
- Неясного гистогенеза: ксантогранулемы (доброкачественные).
Нейрогенные забрюшинные опухоли:
- Происходящие из оболочек нервов: нейрофибромы (доброкачественные), нейролемоммы (доброкачественные и злокачественные).
- Происходящие из симпатических нервных ганглиев: ганглионевромы (доброкачественные) и ганглионейробластомы (злокачественные).
- Происходящие из хромаффинных и нехромафинных клеток параганглиев и внеогранно расположенных участков ткани надпочечников: параганглиомы (доброкачественные, злокачественные), феохромоцитомы, рак из клеток надпочечников.
Забрюшинные опухоли из эмбриональных остатков: тератомы, хордомы.
Причины развития забрюшинных опухолей
Причины появления забрюшинных опухолей пока не выяснены. Ученые выделяют ряд факторов, способствующих развитию этой патологии. В числе таких факторов – специфические и неспецифические генетические нарушения, воздействие ионизирующего излучения и некоторых химических веществ. На возможную связь с ионизирующим облучением указывает повышенная вероятность возникновения забрюшинных опухолей у пациентов, ранее получавших радиотерапию в процессе лечения других онкологических заболеваний.
Существуют исследования, свидетельствующие о повышении риска развития некоторых видов новообразований данной локализации при воздействии гербицидов и пестицидов, особенно – диоксина и производных феноксиацетоновой кислоты. Механизм стимуляции роста забрюшинных опухолей в подобных случаях пока не выяснен. Есть версии, как о прямом воздействии, так и об опосредованном влиянии в результате подавления иммунитета при токсическом воздействии химикатов.
Симптомы забрюшинных опухолей
Особенностью забрюшинных опухолей является длительное отсутствие клинической симптоматики, обусловленное наличием большого количества рыхлой клетчатки и относительной подвижностью соседних органов. Некоторые новообразования достигают огромных размеров, не вызывая нарушений функций пищеварительной и мочевыводящей системы. В литературе встречаются описания отдельных узлов массой от 13 до 51 кг.
Еще одним типичным признаком забрюшинных опухолей является отсутствие специфических симптомов. Клиническая картина заболевания обусловлена не видом новообразования, а его локализацией (в нижней, верхней или боковой части забрюшинного пространства), близостью тех или иных органов и анатомических образований (кровеносных сосудов, нервов, лимфатических протоков). Пациенты с забрюшинными опухолями обычно впервые обращаются к врачу в связи с постоянными болями в животе. При пальпации у 80% больных определяются узлы различного размера и консистенции. В половине случаев прощупывание забрюшинной опухоли сопровождается болью различной интенсивности.
Возможны жалобы на тошноту, рвоту, преждевременное появление чувства насыщения и нарушения стула. При новообразованиях, локализующихся в нижней части забрюшинного пространства, могут наблюдаться расстройства мочеиспускания, вызванные сдавлением мочевого пузыря. При высоко расположенных забрюшинных опухолях иногда развивается одышка, обусловленная давлением на диафрагму. На ранних стадиях у многих больных выявляются гипотермия и гипергидроз нижней конечности на стороне поражения. На поздних этапах болезни гипотермия конечности сменяется гипертермией. Развитие этого симптома при забрюшинных опухолях обусловлено начальным раздражением и последующим параличом симпатического нерва.
При сдавлении крупных вен, расположенных в забрюшинном пространстве, наблюдаются отеки и варикоз в области нижних конечностей. У 25-30% пациентов выявляются неврологические расстройства. При злокачественных забрюшинных опухолях на поздних стадиях отмечаются снижение веса, потеря аппетита, лихорадка неясного генеза и общая гипертермия. Новообразования данной локализации часто рецидивируют, но редко метастазируют. Характерно метастатическое поражение печени и легких. Реже встречаются вторичные опухоли в яичниках и лимфоузлах.
Диагностика забрюшинных опухолей
Диагноз устанавливается на основании жалоб, результатов внешнего осмотра и дополнительных исследований. Пациентов с подозрением на забрюшинную опухоль направляют на УЗИ, КТ и МРТ органов брюшной полости и забрюшинного пространства. Перечисленные диагностические методы позволяют определить структуру и локализацию новообразования, оценить степень вовлеченности близлежащих органов и выявить отдаленные метастазы в печени. Учитывая ряд признаков (форма, плотность, наличие или отсутствие капсулы, уровень гомогенности, степень васкуляризации), после проведения УЗИ, МРТ и КТ специалист может оценить злокачественность забрюшинной опухоли и выдвинуть обоснованные предположения о типе новообразования.
Для оценки состояния пищеварительной и мочевыводящей системы применяют рентгенконтрастные методы (ирригоскопию и экскреторную урографию). Для выявления герминогенных новообразований назначают тесты на определение альфа-фетопротеина и хорионического гонадотропина. Поскольку основным методом лечения забрюшинных опухолей является их радикальное удаление, биопсию обычно не проводят из-за высокого риска обсеменения и недостаточной целесообразности исследования. Исключением являются ситуации, когда забор материала осуществляется для планирования операции, определения резектабельности новообразования или исключения метастатического характера онкологического поражения.
Лечение и прогноз при забрюшинных опухолях
Единственным радикальным способом лечения является оперативное вмешательство. В зависимости от локализации удаление забрюшинной опухоли производят с использованием бокового доступа, срединной лапаротомии или торакоабдоминального доступа. Более чем у половины пациентов операция включает в себя резекцию близлежащих органов: почки, поджелудочной железы, двенадцатиперстной кишки или толстой кишки. Эффективность пред- и послеоперационной радиотерапии и химиотерапии при забрюшинных опухолях пока остается под сомнением. Показанием к использованию этих лечебных методик является доказанная злокачественность новообразования при наличии сомнений в его операбельности.
Данные об операбельности забрюшинных опухолей сильно различаются. В литературе встречаются указания как на 25%, так и на 95% резектабельность подобных новообразований. Послеоперационная летальность при удалении забрюшинных опухолей составляет около 5%, вероятность развития местных рецидивов в отдаленном периоде – около 50%. До 5 лет с момента операции доживает менее 10% пациентов, страдающих злокачественными новообразованиями. При доброкачественных забрюшинных опухолях прогноз более благоприятный, однако, высокая вероятность рецидивирования обуславливает необходимость большого количества повторных хирургических вмешательств.

На третьем этапе идентифицируется гистогенетическая принадлежность опухоли путем морфологического исследования материала, полученного при пункции или биопсии опухоли. Пациенты распределяются на группы: нет признаков злокачественного роста; метастазы рака; лимфома; метастазы меланомы; метастазы злокачественной опухоли без уточнения гистогенеза. Больные первой группы из дальнейшего исследования исключаются. При выявлении лимфомы дальнейшее обследование и лечение проводится гематологом. Пациенты с метастазами рака, меланомы, злокачественной опухоли без уточнения гистогенетической принадлежности и других редко встречающихся злокачественных опухолей подлежат дальнейшему обследованию на следующем этапе.
^ Морфологическое исследование является наиболее значимым и должно выполняться как можно раньше. Полученные данные позволяют подтвердить злокачественность процесса, определить гистогенез опухоли, степень дифференцировки клеток, а иногда и предположительную локализацию первичной опухоли, что значительно облегчает поиск первичного очага и сокращает количество диагностических манипуляций.
^ Цитологическое исследование пунктатов метастазов как более простое и быстрое обычно предваряет биопсию, выполнение которой обусловлено необходимостью получения исчерпывающей информации о морфологической структуре опухоли.
Получение материала для морфологического исследования не представляет трудности при поражении периферических лимфоузлов. При изолированном метастазировании в подмышечные лимфатические узлы наряду с гистологическим исследованием целесообразно изучение рецепторного статуса опухолевой ткани, так как прим этой локализации первичный очаг в 60–80% случаев выявляется в молочной железе. Если опухоль положительна по рецепторам эстрогенов и/или прогестерона, специальное лечение может быть дополнено гормонотерапией. В случае поражения медиастинальных или забрюшинных лимфоузлов выполняется чрезкожная пункция под контролем УЗТ или КТ. Если материала недостаточно для всестороннего гистологического исследования, может обсуждаться вопрос о торакоскопии или лапароскопии с биопсией. Аналогичная тактика оправдана и при поражении органов грудной и брюшной полостей, плевры, брюшины, органов и тканей забрюшинного пространства. Если метастазы локализуются в костях, последовательность диагностических процедур такова: пункция, трепанобиопсия, открытая биопсия пораженной кости.
Наряду с выполнением стандартного гистологического исследования существенную помощь в определении характеристик опухоли и уточнении гистогенеза может оказать выполнение иммуногистохимического исследования. Метод показан в случаях низкодифференцированного рака и недифференцированных опухолей для диагностики химиочувствительных потенциально курабельных опухолей. Иммуногистохимическое исследование повышает точность патологоанатомического заключения за счёт более корректного определения или уточнения гистогенеза, направления клеточной дифференцировки и органной принадлежности первичной опухоли. Полученные данные позволяют оптимизировать поиск первичной опухоли и в каждом конкретном случае выработать индивидуальную лечебную тактику
- Брюшная полость и брюшина — что это такое?
- Виды рака брюшной полости
- Симптомы
- Осложнения
- Диагностика рака брюшной полости
- Лечение
- Прогноз и профилактика
Брюшная полость и брюшина — что это такое?
Брюшная полость — это пространство в животе, заполненное кишечником и другими внутренними органами. Сверху она ограничена диафрагмой, снизу — тазом, по бокам и спереди — мышцами брюшного пресса, сзади — позвоночником и поясничными мышцами.
Изнутри полость живота выстилает тонкая пленка из соединительной ткани — брюшина. Ее висцеральный листок, покрывает внутренние органы, париетальный — стенки брюшной полости. Между листками брюшины находится замкнутое щелевидное пространство, а в нем — минимальное количество жидкости, выполняющей функцию смазки и обеспечивающей свободное скольжение органов. В некоторых местах брюшина образует складки: брыжейки, на которых подвешены органы, сальники.
Внутренние органы могут быть расположены по отношению к брюшине по-разному:
- Интраперитонеально — покрыты брюшиной со всех сторон.
- Мезоперитонеально — покрыты частично.
- Ретроперитонеально (забрюшинно) — покрыты только с одной стороны.
Виды рака брюшной полости
Первичные опухоли брюшной полости встречаются редко. Они бывают разных типов: мезотелиальные, эпителиальные, гладкомышечные неопределенные. Особая разновидность злокачественных опухолей брюшины — псевдомиксома. Она развивается из клеток, которые продуцируют большое количество желеобразной жидкости. Чаще всего такие опухоли распространяются на брюшину из аппендикса.
Зачастую первичные злокачественные опухоли брюшной полости имеют строение и ведут себя, как рак яичников. Они вызывают сходные симптомы, и врачи применяют для борьбы с ними примерно одни и те же методы лечения.
Известно, что в целом вероятность развития первичного рака брюшной полости выше у женщин, чем у мужчин. Риски повышаются с возрастом. Есть связь между вероятностью развития заболевания и изменениями в генах BRCA1, BRCA2.
При разных типах рака на поздних стадиях опухолевые клетки отделяются от первичного новообразования, распространяются по организму и образуют новые очаги в различных органах, в том числе в брюшной полости. Этот процесс называется метастазированием. Чаще всего в брюшину метастазирует рак толстой и прямой кишки (в 15% случаев), желудка (в 50% случаев), яичника (в 60% случаев), поджелудочной железы. Иногда метастазы распространяются из органов, которые находятся за пределами брюшной полости: молочной железы, плевры (пленки из соединительной ткани, покрывающей легкие и выстилающей стенки грудной полости), легкого.

Симптомы
Зачастую в течение длительного времени симптомы при раке брюшной полости отсутствуют, поэтому нередко его диагностируют на поздних стадиях. Проявления патологии неспецифичны, их можно легко принять за признаки других заболеваний:
- Дискомфорт, спазмы, вздутие живота.
- Повышенное газообразование в кишечнике.
- Жидкий стул.
- Запоры.
- Тошнота.
- Снижение аппетита.
- Частые мочеиспускания.
- Одышка.
- Быстрый набор или потеря массы.
- Кровотечения из прямой кишки, у женщин — из влагалища.
Если канцероматоз брюшины возник в результате метастазирования злокачественной опухоли из другого органа, сильно ухудшается прогноз. Противоопухолевая терапия начинает работать хуже, потому что многие препараты плохо проникают через брюшину.
Осложнения
Главное осложнение данного заболевания — асцит. Этим термином называют состояние, при котором в животе скапливается жидкость. В норме между листками брюшины ежедневно вырабатывается и всасывается около 1,5 жидкости. При канцероматозе нарушается отток лимфы, и жидкость всасывается хуже. Она начинает скапливаться внутри живота.
Пока жидкости немного, больной не испытывает каких-либо симптомов. Затем начинают беспокоить тяжесть, тупые боли в нижней части живота. Затрудняется дыхание, возникает одышка. Из-за того что жидкость сдавливает органы, больной жалуется на отрыжку, тошноту, проблемы со стулом и мочеиспусканием. Живот увеличивается в размерах, может возникать пупочная грыжа. При выраженном асците развивается сердечная недостаточность, отеки.
Диагностика рака брюшной полости
Злокачественную опухоль помогают выявить следующие методы диагностики:
- Ультразвуковое исследование. Зачастую его назначают в первую очередь, как простой, доступный, безопасный и в то же время информативный метод диагностики.
- Компьютерная и магнитно-резонансная томография помогают оценить состояние брюшины и внутренних органов, выявить патологические образования, оценить степень распространения рака.
- ПЭТ-сканирование в настоящее время является золотым стандартом для поиска отдаленных метастазов.
- Биопсия — самый точный метод диагностики злокачественных опухолей. Врач может получить образец опухолевой ткани во время диагностической лапароскопии — процедуры, во время которой через проколы в брюшной стенке в живот вводят миниатюрную видеокамеру и специальные инструменты. Образец отправляют в лабораторию, проводят его гистологическое, цитологическое исследование, молекулярно-генетический анализ. Это помогает не только диагностировать рак, но и установить природу опухолевых клеток, разобраться, какими препаратами с ними лучше бороться.
- Рентгеноконтрастные исследования помогают оценить состояние пищеварительного тракта, выявить опухолевые очаги и другие патологии.
- Анализ на онкомаркер CA-125 (углеводный антиген 125). Уровень этого вещества повышается в крови при раке брюшины и яичников. Но для диагностики этих заболеваний данный анализ недостаточно точен. Как правило, его применяют для контроля течения рака и эффективности лечения.
- Женщины должны пройти осмотр у гинеколога.
Обычно врачи-онкологи устанавливают диагноз на основании таких признаков, как асцит, утолщение брюшины, появление на ней узелков, смещение, сдавление петель кишки, патологические изменения со стороны печени и складок брюшины — сальников.

Лечение
Выбор тактики лечения зависит от локализации, размеров, стадии злокачественной опухоли, количества узлов. Врач также должен учитывать общее состояние больного, его возраст, наличие сопутствующих заболеваний.
Зачастую при поражении брюшины опухолевых очагов очень много, многие из них мелкие, и полностью их удалить невозможно. Хирургическое лечение направлено на удаление как можно большего числа очагов, как правило, оно предшествует химиотерапии. Обычно удаляют матку, яичники, участки кишечника, — словом, всё, что поражено злокачественной опухолью. Если злокачественное новообразование вызывает кишечную непроходимость или другие осложнения, проводят паллиативные хирургические вмешательства.
Для того чтобы уничтожить опухолевые клетки при первичном раке в полости живота, применяют химиопрепараты, зачастую те же, что при раке яичников. Лекарства вводят внутривенно или в брюшную полость — такая химиотерапия называется интраперитонеальной (внутрибрюшинной).
С 2018 года врачи Европейской клиники практикуют инновационный метод лечения канцероматоза брюшины — гипертермическую интраперитонеальную химиотерапию (HIPEC). Суть ее заключается в том, что хирург удаляет все достаточно крупные опухолевые очаги, а затем промывает полость живота подогретым раствором химиопрепарата. Это помогает уничтожить максимальное количество опухолевых клеток и существенно продлить жизнь больного.
При асците наши доктора проводят лапароцентез (прокол в брюшной стенке и выведение жидкости), устанавливают перитонеальные катетеры для постоянного оттока, проводят хирургические вмешательства, которые препятствуют дальнейшему накоплению асцитической жидкости.
На поздних стадиях проводится паллиативное лечение, которое помогает уменьшить симптомы и продлить жизнь больного.

Прогноз и профилактика
Прогноз при первичном раке брюшины напрямую зависит от того, удалось ли удалить все опухолевые очаги во время хирургического вмешательства. К сожалению, зачастую заболевание диагностируют на поздней стадии, поэтому после лечения часто развиваются рецидивы. Обычно пациентам требуется более одного хирургического вмешательства, курса химиотерапии.
Канцероматоз брюшины при метастазах других типов рака резко ухудшает прогноз. Обычно продолжительность жизни таких больных измеряется месяцами. Но HIPEC может ее существенно продлить, до нескольких лет — в случае, если проведение такого лечения возможно у конкретного пациента.
Специальных мер профилактики данного заболевания не существует. Нужно в целом вести здоровый образ жизни, женщинам — регулярно проходить осмотры у гинеколога. Мера профилактики метастазов в брюшину — своевременная диагностика и лечение злокачественных опухолей.
Читайте также:

