Что характерно для парапротеинемического лейкоза
В группу парапротеинемических лейкозов — хронических лимфоцитарных лейкозов, входят три заболевания – миеломная болезнь, первичная макроглобулинемия Вальденстрема и болезнь тяжелых цепей Франклина.
Парапротеинемические лейкозы также называются злокачественными иммунопролиферативными заболеваниями. Их особенностью является способность опухолевых клеток синтезировать однородные иммуноглобулины или их фрагменты – парапротеины. Опухолевые клетки при парапротеинемических лейкозах дифференцируются по плазмоцитарному типу, сохраняя в извращенной форме осо6енностъ иммунных клеток синтезировать иммуноглобулины.
Миеломная болезнь
Миеломная болезнь (болезнь Рустицкого-Калера, множественная миелома, генерализованная плазмоцитома) встречается в основном у взрослых. Известны редкие случаи у людей моложе 30 лет. Опухолевая ткань разрастается преимущественно в плоских костях (череп, ре6ра, таз) и в позвоночнике, инициируя в них поцессы костеразрушения- остеолизис и остеопороз. На рентгенограмме очаги поражения имеют вид гладкостенных пробоин. Помимо костного мозга, опухолевые инфильтраты могут обнаруживаться и в других органах.
Осложнения миеломной болезни развиваются вследствие разрушения костной ткани – самопроизвольные переломы, боли в костях, а также из-за продукции парапротеинов – амилоидоз, парапротеинемическая кома и парапротеиноз органов.
Иногда обнаруживаются опухоли, исходящие из костной ткани. Вследствие разрушения костей в крови увеличивается количество кальция, который в виде песка и камней откладывается в выделительных органах (почки, лёгкие, слизистая желудка). Поражение почек (миеломная нефропатия) в основном обусловлено поступлением через почечный фильтр парапротеинов. Характерным для миеломной болезни является частота бактериальных инфекций из-за уменьшения количества нормальных иммуноглобулинов и нарушения образования антител.
Для лечения используют препараты цитостатического действия, лучевую терапию, гормональные препараты, переливание эритроцитной массы, цельной крови. При развитии инфекционных осложнений — антибиотики, гамма-глобулин. Большое значение имеет проведение правильных ортопедических мероприятий.
Макроглобулинемия Вальденстрема
Макроглобулинемия Вальденстрема – это опухоль костного мозга, характеризующаяся высокой продукцией иммуноглабулина М. По всем признакам, особенно в начальной стадии заболевания, этот процесс очень похож на хронический лимфолейкоз. Однако из-за системных поражений возникает повышенная вязкость крови, которая может привести к множественным мелким тромбозам, тромбоцитопении, геморрагическому синдрому.
Болезнь тяжелых цепей Франклина
Болезнь тяжелых цепей Франклина. Основные симптомы - увеличенные и болезненные при пальпации лимфоузлы, лихорадка, анемия, недомогание, увеличение печени и селезенки, слабость; отек неба (из-за лейкемического поражения лимфатического кольца Вальдейера).
Обычно наблюдается быстрое ухудшение течения болезни с летальным исходом от инфекции; химиотерапия удлиняет длительность выживания.
Эта группа объединяет опухоли, исходя-щие из клеток В-лимфоцитарной системы (предшественники плазматических клеток), с функцией которых, как известно, связаны реакции гуморального им-мунитета. Главной особенностью парапротеинемических лейкозов, которые называют также злокачественными иммунопролиферативными заболеваниями, является способность опухолевых клеток синтезировать однородные иммуноглобулины или их фрагменты – парапротеины (Pig-патологические, или моноклоновые, иммуноглобулины). Патология иммуноглобулинов определяет как клиническое, так и морфологическое своеобразие парапротеинемических лейкозов, к которым относят миеломную болезнь, первичную макроглобулинемию (Вальденстрема) и болезнь тяжелых цепей (Франклина).
Наибольшее значение среди парапротеинемических лейкозов имеет миеломная болезнь.
Миеломная болезнь – довольно распространенное заболевание, описанное впервые О. А. Рустицким (1873) и Калером (1887). В основе заболевания лежит разрастание опухолевых клеток лимфоплазмоцитарного ряда – миеломных клеток (рис. 136) как в костном мозге, так и вне его. Миеломатоз костного мозга ведет к разрушению костей.
В зависимости от характера миеломных клеток различают плазмоцитарную, плазмобластную, полиморфно-клеточную и мелкоклеточную миеломы [Струков А. П., 1959]. Полиморфно-клеточную и мелкоклеточную миеломы относят к низкодифференцированным опухолям. Миеломные клетки секретируют парапротеины, которые обнаруживаются в крови и моче больных, а также в самих миеломных клетках. В связи с тем что при миеломной болезни в сыворотке крови и в моче биохимически обнаруживают различные виды патологических иммуноглобулинов, различают несколько биохимических вариантов миеломы (А-, D-, Е-миелома, миелома Бене-Джонса). Обнаруживаемый в моче белок Бене-Джонса является одним из видов парапротеина, секретируемого миеломной клеткой, он свободно проходит клубочковый фильтр почек, так как обладает крайне малой молекулярной массой.
Обычно миелома протекает по алейкемическому варианту, но возможно и наличие в крови миеломных клеток.
Морфологически в зависимости от характера миеломных инфильтратов, которые обычно локализуются в костном мозге и костях, различают диффузную, диффузно-узловую и множественно-узловую формы миеломной болезни.
О диффузной форме говорят тогда, когда диффузная миеломная инфильтрация костного мозга сочетается с остеопорозом. При диффузно-узловой форме на фоне диффузного миеломатоза костного мозга появляются опухолевые узлы; при множественно-узловой форме диффузная миеломная инфильтрация отсутствует.
Разрастание миеломных клеток отмечается чаще в плоских костях (ребра, кости черепа) и позвоночнике, реже – в трубчатых костях (плечевая, бедренная кость). Оно ведет к деструкции костной ткани (рис. 137).
Помимо костного мозга и костей, миеломноклеточная инфильтрация почти постоянно отмечается во внутренних органах: селезенке, лимфатических узлах, печени, почках, легких и др.
Ряд изменений при миеломной болезни связан с секрецией опухолевыми клетками парапротеина. К ним относятся:
1. амилоидоз (AL-амилоидоз);
2. отложение в тканях амилоидоподобных и кристаллических веществ;
3. раз-витие парапротеинемического отека, или парапротеиноза органов (парапротеиноз миокарда, легких, парапротеинемический нефроз), что сопровождается их функциональной недостаточностью.
При миеломной болезни в связи с накоплением парапротеинов в крови, белковыми стазами в сосудах развиваются своеобразный синдром повышенной вязкости и парапротеинемическая кома.
В связи с иммунологической беззащитностью при плазмоцитоме нередки воспалительные изменения (пневмония, пиелонефрит), которые возникают на фоне тканевого парапротеиноза и являются выражением аутоинфекции.
Первичная макроглобулинемия – редкое заболевание, которое впервые описано Вальденстремом в 1944 г. Это одна из разновидностей хронических лейкозов лимфоцитарного происхождения, при которой опухолевые клетки секретируют патологический макроглобулин – IgM. Для заболевания характерно увеличение селезенки, печени, лимфатических узлов, что связано с лейкозной инфильтрацией их. Деструкция костей встречается редко. Весьма типичен геморрагический синдром, развивающийся в связи с гиперпротеинемией, резким повышением вязкости крови, функциональной неполноценностью тромбоцитов, замедлением кровотока и стазами в мелких сосудах. Наиболее частыми осложнениями являются геморрагии, парапротеинемическая ретино-патия, парапротеинемическая кома; возможен амилоидоз.
Болезнь тяжелых цепей описана Франклином в 1963 г. Опухолевые клетки лимфоплазмоцитарного ряда продуцируют при этом заболевании своеобразный нарапротеин, соответствующий Fc-фрагменту тяжелой цепи IgG (отсюда и название болезни). Как правило, наблюдается увеличение лимфатических узлов, печени, селезенки в результате инфильтрации этих органов опухолевыми клетками. Изменения костей отсутствуют, поражение костного мозга не является правилом. Больные умирают от присоединившейся инфекции (сепсис) в связи с гипогаммаглобулинемией (иммунодефицитное состояние).
Основной отличительной чертой такого рода заболеваний считается сохранение способности клеток к дифференцировке (развитию) до стадии иммуноглобулинсекретирующих элементов. Однако вырабатываемые ими белки отличаются однообразием своей структуры, являясь моноклональными парапротеинами (РIg), так как все берут происхождение из одного опухолевого клона клеток. Они имеют сходство с нормальными иммуноглобулинами, но в иммунной защите не участвуют, а в виде специфических масс (амилоида) откладываются в различных тканях организма.
Возникает миеломная болезнь у людей пожилого возраста, у лиц старше шестидесяти лет. Известны редкие случаи у людей моложе 30 лет.
Представители мужского пола болеют несколько чаще.
Точная этиология на сегодняшний день пока ещё не установлена. Однако замечена повышенная частота встречаемости этого заболевания среди тех, кто пережил ядерную бомбардировку во времена второй мировой войны, по истечении двадцатилетнего латентного периода. Кроме того, имеются свидетельства об определённой генетической предрасположенности.
Как правило, опухоль проявляется многочисленными очагами, локализующимися сразу в нескольких костях скелета. На фоне избыточного количества плазматических клеток в костном мозге, в периферической крови они отсутствуют (в отличие от лейкозов!), вместо этого здесь определяется вырабатываемый ими специфический белок, который также в ходе обследования обнаруживается в моче и во внутренних органах пациента.
О наличии миеломной болезни в первую очередь можно судить только по косвенным признакам, то есть по уровню атипичного протеина в крови и моче, устанавливаемому посредством электрофореза, и по изменению рисунка нормальной костной ткани на рентгенснимках.
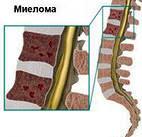
Опухолевая ткань разрастается преимущественно в плоских костях (череп, ре6ра, таз) и в позвоночнике, инициируя в них поцессы костеразрушения- остеолизис и остеопороз. На рентгенограмме очаги поражения имеют вид гладкостенных пробоин. Помимо костного мозга, опухолевые инфильтраты могут обнаруживаться и в других органах.
При постановке диагноза необходимо учитывать, что самые уязвимые в данном случае и наиболее подвержены амилоидозу мышцы и такие жизненно важные для человека органы, как сердце и почки. Симптомы их поражения – это общая мышечная слабость, постепенно нарастающая сердечная и почечная недостаточность.
Сначала довольно продолжительное время заболевание может протекать асимптомно, сопровождаясь лишь повышением СОЭ. Слабость, боли в костях (в основном в рёбрах и позвоночнике), похудание и другие жалобы возникают позже, как и гипохромная анемия, неселективная протеинурия, гипогаммаглобулинемия, снижение продукции нормальных антител и, как следствие ухудшенная сопротивляемость организма различным инфекциям.
Осложнения миеломной болезни развиваются вследствие разрушения костной ткани – самопроизвольные переломы, боли в костях, а также из-за продукции парапротеинов – амилоидоз, парапротеинемическая кома и парапротеиноз органов.
Иногда обнаруживаются опухоли, исходящие из костной ткани. Вследствие разрушения костей в крови увеличивается количество кальция, который в виде песка и камней откладывается в выделительных органах (почки, лёгкие, слизистая желудка). Поражение почек (миеломная нефропатия) в основном обусловлено поступлением через почечный фильтр парапротеинов. Характерным для миеломной болезни является частота бактериальных инфекций из-за уменьшения количества нормальных иммуноглобулинов и нарушения образования антител.
Количество лейкоцитов в анализе периферической крови и лейкоцитарная формула довольно вариабельны: при развёрнутой картине миеломной болезни возможна лейкопения (уменьшение числа нейтрофилов).
Цитологическая картина костномозгового пунктата - для неё характерно более, чем 10%-ное наличие плазматических (то есть миеломных) клеток, которые отличаются большим многообразием своих структурных особенностей (но наиболее специфичны при этом атипические элементы типа плазмобластов).
С учётом картины пролиферации, происходящей в костном мозге, принято различать множественные опухолевые, диффузные и, наконец, диффузно-узловые формы заболевания.
Для лечения используют препараты цитостатического действия, лучевую терапию, гормональные препараты, переливание эритроцитной массы, цельной крови. При развитии инфекционных осложнений — антибиотики, гамма-глобулин. Большое значение имеет проведение правильных ортопедических мероприятий.
На сегодняшний день в борьбе с миеломной болезнью достигнуты очень большие успехи, и шансы на выздоровление, особенно на ранних этапах заболевания, довольно высоки.
Схема и объём лечения зависят от стадии и распространённости процесса.
В среднем у каждого десятого наблюдается медленное прогрессирование процесса на протяжении многих лет. В подобных случаях, при наличии IA или IIА стадии оправдана выжидательная тактика и, как правило, противоопухолевая терапия требуется редко. У лиц с солитарной (одиночной) плазмоцитомой либо экстрамедуллярной миеломой хороший эффект даёт локальная лучевая терапия.
При возникновении признаков, свидетельствующих о нарастании опухолевой массы: анемии, болевого синдрома, увеличения уровня патологического протеина, назначаются цитостатические лекарственные средства.
Стандартное лечение подразумевает применение в индивидуально подобранных дозировках мелфалана, циклофосфамида, хлорбутина в комбинации с преднизолоном в течение 4-7 дней каждые 1-1,5 мес. Эффект при использовании указанных препаратов примерно одинаков, иногда возможно развитие перекрёстной резистентности (устойчивости не только непосредственно к воздействующему, но и к другим факторам).
Если получен положительный ответ на терапию, клинически пропорционально сокращению опухолевой массы отмечается уменьшение болей в костях, в анализах крови повышается гемоглобин, снижается уровень кальция и сывороточного М-компонента (приблизительно спустя 4-6 недель с момента начала лечения).
Относительно продолжительности химиотерапии единого мнения не существует, но в подавляющем большинстве случаев её проводят в течение не менее одного года – двух лет (при условии, конечно, её эффективности).
Помимо назначения цитостатиков и преднизолона, предпринимаются меры, направленные на предупреждение развития осложнений и избавления от них, если они уже есть. Так с целью снижения и профилактики повышения содержания кальция в периферической крови глюкокортикоиды сочетают с обильным питьём.
Для уменьшения явлений остеопороза используют препараты кальция, витамин Д и андрогены, а для того, чтобы защитить почки в схему включают аллопуринол (обязательно при адекватном питьевом режиме).
Если уже имеет место острая почечная недостаточность, обращаются к плазмаферезу и гемодиализоу.
Плазмаферез нужен и при синдроме повышенной вязкости крови.
Лучевая терапия помогает уменьшить сильные боли в костях.
Парапротеинемические лейкозы – разновидность хронического лимфолейкоза, злокачественные иммунопролиферативные заболевания
Виды парапротеинемических лейкозов:
1) Миеломная болезнь (болезнь Рустицкого-Калера)
2) Первичная макроглобулинемия Вальденстрема
3) Болезнь тяжелых цепей Франклина
Общие признаки парапротеинемических лейкозов:
1. Способность опухолевых клеток синтезировать иммуноглобулины или их фрагменты - парапротеины
2. Амилоидоз (AL-амилоидоз)
3. Парапротеинемический отек (миокард, почки, легкие) – парапротеиноз миокарда, легких, парапротеинемический нефроз.
4. Синдром повышенной вязкости крови – парапротеинемическая кома.
Миеломная болезнь (болезнь Рустицкого-Калера, множественная миелома, генерализованная плазмоцитома)– парапротеинемический лейкоз, в основе которого разрастание опухолевых клеток лимфоплазмоцитарного ряда (миеломных клеток) с преимущественной локализацией процесса в костном мозге.
Миеломные клетки секретируют парапротеины, обнаруживаемые в крови и моче (белок Бенс-Джонса)
Виды миеломной болезни:
| по характеру распространения опухолевого инфильтрата в КМ | по клеточному составу | по типу секретируемого протеина |
| диффузная диффузно-узловатая множественно-узловатая | плазмоцитарная плазмобластная полиморфно-клеточная мелкоклеточная миеломы | несекретирующие миеломы диклоновые миеломы миелома Бенс-Джонса G-миелома A-миелома и т.д. |
Патоморфология поражения костей при миеломной болезни:
ü разрастание опухолевой ткани преимущественно в плоских костях (череп, ребра, таз) и в позвоночнике
ü остеопороз, остеолизис костей
ü деструкция костной ткани с патологическими переломами, болями в костях, гиперкалициемией и развитием известковых метастазов
Патоморфология поражения внутренних органов при миеломной болезни:
ü локализация опухолевых инфильтратов: селезенка, л.у., печень, легкие и др.
ü АL-амилоидоз – характерный мезенхимальный диспротеиноз
ü парапротениемический отек миокарда, легких, почек
ü миеломная нефропатия (парапротеинемический нефроз, миеломная сморщенная почка)
ü синдром повышенной вязкости крови (из-за накопления в крови парапротеинов, белковых стазов в сосудах) и парапротеинемическая кома
Осложнения и причины смерти:
а) миеломная нефропатия – причина смерти 1/3 больных
б) воспалительные заболевания (пневмонии, пиелонефрит) на фоне тканевого парапротеиноза и аутоинфекции
3) функциональная недостаточность сердца, легких
61. Лимфогранулематоз: к какой группе опухолей из кроветворных тканей относится, гистологические варианты, диагностические клетки.
Лимфома Ходжкина (лимфогранулематоз) – хроническое рецидивирующее, реже остро протекающее заболевание, при котором разрастание опухоли происходит преимущественно в л.у.
Относится к лимфомам.
Возрастные пики заболеваемости: больные 15-34 лет и старше 55 лет.
Классификация лимфогранулематоза (гистологические варианты):
1. С лимфоидным преобладанием
3. С нодулярным склерозом
4. С лимфоидным истощением – фатальный вариант, генерализация лимфогранулематоза (саркома Ходжкина)
По особенностям распространения опухоли:
а) изолированный вариант – поражение одной группы л.у. (шеные, медиастинальные, забрюшинные)
б) генерализованный вариант – распространение процесса на несколько групп л.у. и, как правило, вовлечение селезенки
Макроскопические изменения лимфоидной ткани:
ü л.у. увеличены в размерах, спаяны между собой
ü характерны процессы некроза и склероза в л.у.
ü порфировая селезенка (желто-серые очажки на фоне красной пульпы)
ü клеточный состав опухоли полиморфен (большие и малые клетки Ходжкина с одним ядром и множеством ядрышек, многоядерные РШ-клетки)
ü массивные скопления и пролифераты неопухолевых клеток на определенной стадии опухолевой прогрессии гематогенного и гистиогенного происхождения
ü некроз и склероз опухолевой ткани
ü пролиферация эндотелия венул
ü малые и большие клетки Ходжкина –
ü клетки Рид-Березовского-Штернбера (РШ-клетки) – необходимы для постановки диагноза, маркер CD30:
б) pop corn клетки
в) лакунарные клетки
Патоморфология стадий заболевания:
1. Вариант с преобладанием лимфоидной ткани – ранняя фаза заболевания (I-II стадия)
МиСк: пролиферация зрелых лимфоцитов и частично гистиоцитов, стирание рисунка л.у.
2. Смешанно-клеточный вариант– генерализация болезни (II-III стадия)
ü пролиферация лимфоидных элементов различной степени зрелости, гиганстких клеток Ходжкина и РШ-клеток
ü скопления лимфоцитов, эозинофилов, плазматических клеток, нейтрофилов
3. Вариант с подавлением (вытеснением) лимфоидной ткани – неблагоприятное течение, генерализация процесса
МиСк – несколько вариантов:
а) диффузное разрастание соединительной ткани , среди волокон – немногочисленные атипичные клетки
б) лимфоидная ткань вытесняется атипичными клетками, склероз отсутствует
некроза ифиброза опухоли
4. Нодулярный (узловатый) склероз– относительное доброкачественное течение, первичная локализация – средостение
МиСк: разрастания фиброзной ткани, окружающей очаги клеточных скоплений (клетки Рид-Березовского-Штернберга, по периферии их – лимфоциты и другие клетки).
Осложнения и причины смерти:
1. Сдавление жизненно важных органов увеличенными л.у.
Это заболевания, в основе которых лежит неопластическая пролиферация плазматических клеток, способных синтезировать иммуноглобулины или их фрагменты (парапротеины). Все заболевания исходят из В-клеток, предшественников плазмоцитов. В зависимости от класса и типа синтезируемых и секретируемых парапротеинов выделяют следующие иммунохимические варианты: G-, A-, D-, E-миелому, миелому Бенс-Джонса (болезнь легких цепей) и др. Клинические и морфологические проявления вариантов сходны. Обычно миелома протекает по алейкемическому варианту, но возможно и наличие в крови миеломных клеток.
Виды:
• Миеломная болезнь (болезнь Рустицкого – Калера)
• Первичная макроглобулинемия Вальденстрема
• Болезнь тяжелых цепей Франклина
Общие признаки парапротеинемических лейкозов
1. амилоидоз (AL-амилоидоз)
2. парапротеинемический отек (миокард, почки, легкие) – парапротеиноз миокарда, легких, парапротеинемический нефроз.
3. синдром повышенной вязкости крови – парапротеинемическая кома
Миеломная болезнь
Характеризуется неопластической пролиферацией плазматических клеток (плазмобластов) с продукцией моноклоновых иммуноглобулинов (парапротеинов) или их фрагментов, которые обнаруживаются в крови и моче (белок Бенс – Джонса).
Формы в зависимости от характера роста:
1.Диффузная 2. диффузно-узловатая 3. множественно-узловатая
Формы в зависимости от характера миеломных клеток:
1. плазмоцитарная 2. плазмобластная 3, полиморфно-клеточная 4. мелкоклеточная миеломы
Морфология миеломной болезни
Миелома может протекать в солитарной форме, в виде одиночного узла, но чаще она бывает множественной. Происходит образование диффузных или очаговых (плазмоцитомы, миеломы) миеломных инфильтратов.
Локализация опухолей:
– плоские кости (ребра, кости черепа)
– позвоночник, реже – трубчатые кости
– внутренние органы – селезенка, лимфоузлы, печень, легкие и др.
В костях – разрастающаяся опухолевая ткань ведет к деструкции костной ткани и развитию патологических переломов. При диффузном разрастании опухолевой кроветворной ткани наблюдается остеолизис и остеопороз — образование гладкостенных, как бы штампованных дефектов.
При миеломной болезни в связи с секрецией опухолевыми клетками парапротеина часто развивается AL-амилоидоз. Наибольшее значение среди парапротеинемических изменений имеет парапротеинемический нефроз, или миеломная нефропатия. В основе парапротеинемического нефроза лежит избыточное накопление в канальцах и в строме мозгового, а затем и коркового вещества парапротеина Бенс-Джонса, ведущее к нефросклерозу. Такие почки получили название “миеломные сморщенные почки”. Развивающаяся уремия является в 30% случаев причиной смерти больных миеломой. Другой частой причиной смерти служит присоединение инфекций.
ЛИМФОМЫ
Лимфомы– это новообразования лимфоидной ткани, которые могут первично возникать в центральных органах иммуногенеза, лимфатических узлах или экстранодально.
Термин был предложен в 1871 г. Т. Бильротом. Все лимфомы условно делят на две группы: лимфогранулематоз (ЛГМ), или болезнь Ходжкина (ЛХ) и неходжкинские злокачественные лимфомы (НХЛ), которые раньше называли лимфосаркомами и ретикулосаркомами. Выделение ЛХ в самостоятельную группу обусловлено своеобразным характером гистологической структуры с крайне скудным содержанием собственно неопластических элементов, а также чувствительностью к особым схемам терапии.
При развитии лимфом очень часто один из первых и главных симптомов – лимфаденопатия – увеличение размеров лимфатических узлов в одной или нескольких зонах. Кроме того, характерны общие симптомы интоксикации (лихорадка > 38 0 C, профузный ночной пот, потеря массы тела).
Выделяют локализванные и генерализованные формы:
• Локализованные – поражение лимфоузлов или экстранодальная локализация (желудок, легкие и др.)
• Генерализованные – поражение лимфоузлов, селезенки, печени, костного мозга и др. органов.
Лимфомы могут лейкемизироваться (более 25 % бластов в КМ соответствует диагнозу лейкемия).
Лимфома Ходжкина
ЛХ – особая форма злокачественных лимфом, которая возникает в центральных и периферических органах иммунной системы и способна к системному распространению с поражением других экстранодальных органов и тканей.
В течение многих десятилетий опухолевую природу ЛХ подвергали сомнению, и лишь в последние годы с помощью современных молекулярно-генетических методов окончательно подтверждены неопластические свойства и лимфоидное происхождение клеток Ходжкина и Рид-Штернберга. Особенности морфологической структуры ЛХ заключаются в том, что микроскопическая картина очагов поражения действительно часто напоминает реактивный гранулематозный процесс, в котором специфические опухолевые клетки встречаются редко и не повсеместно, а преобладают реактивные элементы воспалительного ряда – лимфоидные и плазматические клетки, эозинофильные и нейтрофильные лейкоциты, гистиоциты на гранулематозном фоне в сочетании с ангиоматозом, очагами некроза, пролиферацией фибробластов и разрастаниями соединительной ткани.
Возрастные пики заболеваемости:
– больные 15–34 лет
– и после 55 лет
• Характерно постепенное вовлечение лимфоузлов: шейные, средостение, подвздошная область.
• Клеточный состав опухоли полиморфен. Различают следующие виды опухолевых клеток при ЛХ:
1. Малые и большие клетки Ходжкина -– крупные одноядерные клетки, с оксифильной или слабо базофильной цитоплазмой, похожие на иммунобласты. Ядра крупные, часто двудольчатые или даже многодольчатые, с утолщенной мембраной, везикулярным хроматином и сниженной плотностью хроматина вокруг эозинофильного ядрышка. Одноядерные клетки Ходжкина не считаются диагностическими при постановке первичного диагноза.
2. Клетки Рид – Березовского – Штернберга (РШ-клетки):
классические – клетки больших размеров, имеющие два овальных или округлых ядра с небольшой выемкой с одной из сторон. Ядра располагаются часто рядом, симметрично, создавая впечатление зеркального изображения. В ядрах определяются крупные эозинофильные ядрышки, окруженные просветлением из-за сгущения хроматина к периферии (светлая зона вокруг ядрышка).
pop-corn – это особая разновидность клеток РШ, которые содержат многодольчатые ядра, напоминающие воздушную кукурузу.
Диагноз ЛХ устанавливают только на основании патогистологического исследования лимфатического узла (реже – других тканей) при обнаружении клеток Рид-Штернберга.
В зависимости от количества, расположения опухолевых клеток и их соотношения с неопухолевыми различают следующие гистологические варианты ЛХ:
1. С преобладанием лимфоидной ткан
3. Нодулярный склероз
4. С истощением (подавлением) лимфоидной ткани
Вариант с преобладанием лимфоидной ткани составляет 10%. Встречается в любом возрасте. При этой форме клетки Рид-Штернберга единичны, преобладают многочисленные лимфоциты, гистиоциты.
Смешанноклеточный вариант встречается чаще в среднем возрасте и составляет 40% всех случаев ЛХ. Гистолгически в лимфоузле мы видим различные клетки (лимфоциты, гистоициты, плазматические клетки, эозинофилы), среди которых разбросаны опухолевые клетки. Количество их становится больше, по сравнению с предыдущим вариантом.
Нодулярный склероз – самая частая форма ЛХ, удельный вес ее составляет 45%. Это единственная форма, при которой среди больных преобладают женщины. Данная форма характеризуется своеобразными кольцевидными расположениями коллагена, делящих узел на участки округлой формы (нодули). Характерны лакунарные клетки Рид-Штернберга.
На долю варианта с истощением лимфоидной ткани приходится не более 1 % случае. Чаще встречается у пожилых людей. Характеризуется преобладанием опухолевых клеток (Ходжкина, Рид-Штернберга), которые образуют целые скопления (полосы).
Прогноз при ЛХ определяется прежде всего стадией процесса и наряду с этим он во многом зависит от варианта гистологической структуры опухоли. Внедрение новых методов диагностики и лечения больных ЛХ привело к определенной переоценке прогностической значимости гистологического варианта опухоли, и в настоящее время неблагоприятным в клиническом плане считают главным образом только вариант лимфоидного истощения. При других вариантах применение современных методов комплексного лечения ЛХ позволяет добиться хороших отдаленных результатов у подавляющего большинства больных, и пятилетняя выживаемость при всех стадиях заболевания составляет, по данным разных авторов, от 75 до 90 %.
Причины смерти при ЛХ
1 Сдавление жизненно важных органов увеличенными лимфоузлами 2. Присоединение инфекции 3. Кахексия 4. Амилоидоз 5. Дисфункция органов
Не нашли, что искали? Воспользуйтесь поиском:
В соответствии с МКБ-10, парапротеинемический гемобластоз относят ко 2 классу новообразований (C00—D48), часть C81—C96. Сюда включены злокачественные опухоли кроветворной, лимфоидной и тканей, родственных им.
Они относятся к группе опухолевых болезней кровеносной системы, основным признаком которых считается секреция парапротеинов или/и их фрагментов. У разных пациентов парапротеины могут достигать значительных концентраций в сыворотке крови и относиться к разным классам. Источник опухолевого роста – В-лимфоциты.
Парапротеинемические гемобластозы распространены по всему миру. С возрастом пациента их частота только увеличивается.

Классификация парапротеинемических гемобластозов
Формы гемобластозов выделяют в зависимости от того, какие иммуноглобулины они секретируют, и от того, какая морфологическая характеристика у опухолевого субстрата:
- lg-секретирующие лимфомы;
- множественная миелома;
- болезни тяжелых цепей;
- острый плазмобластный лейкоз;
- макроглобулинемия Вальденстрема;
- солитарная плазмоцитома.
Общие клинические признаки
Какие у парапротеинемических гемобластозов признаки?
Для клинической картины характерно наличие опухоли, которая продуцирует парапротеин, и вторичного гуморального иммунодефицита, развивающегося у всех больных, когда происходит нарастание массы опухоли. По характеру течения болезни выделяется стадия хроническая (развернутая) и острая (терминальная).
Парапротеинемия обусловливает общие для п. г. проявления:
- Периферическая нейропатия.
- Повышение вязкости крови.
- Микроциркуляторные нарушения.
- Геморрагический синдром.
- Поражение почек.
- Криоглобулинемия 1-2 типов, амилоидоз.

Это наиболее распространенная классификация парапротеинемических гемобластозов. Рассмотрим каждый вид более подробно.
Множественная миелома
Множественная миелома считается наиболее распространенным п. г. с неясными причинами ее развития. Морфологическую картину представляют плазматические клетки определенной степени зрелости, часто имеющие черты атипизма. Развернутая стадия характеризуется локализацией опухоли в костном мозге, иногда в лимфатических узлах, селезенке, печени.
Характер распределения в костном мозге очагов позволяет выделить несколько форм множественной миеломы: диффузно-очаговая, диффузная и множественно-очаговая.
Вокруг опухолевых очагов разрушаются кости, потому что множественная миелома стимулирует остеокластовую деятельность. У остеолитического процесса при различных формах имеются особенности. К примеру, диффузно-очаговую форму характеризует остеопороз, вызывающий появление очагов остеолиза; диффузную – наблюдение остеопороза; множественно-очаговую - возможные отдельные очаги остеолитические. Развернутая стадия опухоли обычно не влияет на разрушение кортикального слоя кости. Она его истончает и приподнимает, образуя при этом на черепе, грудине, ребрах вздутия. Терминальная стадия опухоли характеризуется формированием сквозных дефектов и прорастанием в мягкие ткани, находящиеся вокруг.

Виды миеломы
Класс секретируемых иммуноглобулинов влияет на выделение нескольких видов множественной миеломы: А-, D-, G-, E-миелома, Бенс-Джонса типа l или с, несекретирующая.
Миелому делят на 3 стадии, основываясь на анализе показателей креатинина в крови, гемоглобина, содержания в моче и сыворотке крови парапротеинов, рентгенограммы костей.
- 1 стадия – опухоль имеет массу менее 600 г/м 2 .
- 2 стадия – от 600 до 1 200 г/м 2 .
- 3 стадия – больше 1 200 г/м 2 .
Отсутствие или наличие почечной недостаточности влияет на присвоение стадии символа А или В. Каковы при данной форме парапротеинемических гемобластозов симптомы?
Опухоль имеет разнообразную клиническую картину. Появление первых признаков обычно происходит на третьей стадии (слабость, утомляемость, боль). Последствием остеодеструктивного процесса является развитие болевого синдрома. Наиболее часты боли при поражении крестца и позвоночника. Достаточно часто болят ребра, отделы плечевых и бедренных костей, пораженные опухолью. Экстрадуральная локализация очагов характеризуется тем, что сдавление спинного мозга следует за выраженным болевым синдромом.
Диагноз устанавливается на основании данных, полученных после стернальной пункции и выявления моноклональных иммуноглобулинов в моче и/или сыворотке крови. Дополнительным значением обладает рентгенологическое исследование скелета. Если у пациента множественно-очаговая форма, то пункция грудины опухоль может и не выявить.
После того как диагноз парапротеинемических гемобластозов (фото опухоли можно найти в статье) установили, проводится до начала лечения рентгеноскопическое обследование скелета, проверяется функция печени и почек. Не допускается использование экскреторной урографии и прочих агрессивных методов исследования почек, поскольку они могут спровоцировать развитие их необратимой острой недостаточности.
Методы терапии миеломы
Как правило, начинают лечение с гематологического стационара, а затем уже возможно его проведение в амбулаторных условиях.
В случаях когда отдельными очагами остеолиза создается угроза патологического перелома, главным образом опорных частей скелета, если имеются отдельные большие опухолевые узлы любой локализации, первые симптомы спинномозговой компрессии, послеоперационный период после проведения декомпрессивной ламинэктомии, то рекомендуют лучевую терапию.
Солитарная плазмоцитома
Какие еще бывают парапротеинемические гемобластозы?
Солитарная плазмоцитома – локальная опухоль. Клиническая картина находится в зависимости от размеров и локализации. Чаще всего солитарные плазмоцитомы являются множественной миеломой на ранней стадии. Костная солитарная плазмоцитома склонна к генерализации, выявляемой в качестве множественной миеломы через 1-25 лет после того, как была проведена радикальная терапия.
Внекостная солитарная плазмоцитома может быть локализована в любом органе, но в основном в верхних дыхательных путях и носоглотке. 40-50 % пациентов страдают от метастаз в кости.
В основе диагноза данные морфологических обследований биопсийного или пункционного материала. Перед тем как начать лечение, необходимо исключение множественной миеломы. Для лечения используют радикальную операцию или/и лучевую терапию, при помощи которых излечивают полностью 50 % пациентов. Больные солитарной плазмоцитомой пожизненно находятся под наблюдением из-за того, что возможна генерализация процесса.
Это еще не все виды парапротеинемических гемобластозов.
Макроглобулинемия Вальденстрема
Макроглобулинемия Вальденстрема – это хронический в большинстве случаев, сублейкемический или алейкемический лимфолейкоз. Локализация lgM-секретирующей опухоли происходит в костном мозге. Характеризует ее лимфоцитарный состав клеток с примесью плазматических. Помимо моноклонального lgM, опухолевыми клетками примерно у 60 % пациентов секретируется белок Бенс-Джонса. Макроглобулинемия Вальденстрема встречается гораздо реже, чем множественная миелома.
К самым частым клиническим проявлениям относятся кровоточивость и синдром повышенной вязкости. Также можно наблюдать периферическую нейропатию, вторичный иммунодефицит, амилоидоз, поражение почек. Редко развивается почечная недостаточность. Для развернутой стадии характерно увеличение печени, селезенки и/или лимфатических узлов, потеря массы тела у 50 % пациентов. Поздно развивается анемия, лейкоциты могут быть в норме, лейкоцитарная формула без изменений, достаточно часто встречается лимфоцитоз с умеренным лейкоцитозом, возможна некоторая нейтропения. Обычным явлением является резко увеличенный показатель СОЭ.
Диагноз ставится на основании иммунохимического определения моноклонального lgM в крови, данных трепанобиопсии или стернальной пункции, электрофореза белков мочи и сыворотки. Терапия проводится в гематологическом стационаре. Какой еще бывает парапротеинемический гемобластоз?
Болезни тяжелых цепей
Болезни тяжелых цепей по клинической и морфологической характеристике очень разнообразны. К их особенностям относится наличие в моче и/или сыворотке крови аномального белка. Различаются a-, g-, m-болезни тяжелых цепей.
Больше всего распространена а-болезнь, поражающая в основном детей и молодых людей возрастом до 30 лет. Болезнь распространена на Среднем и Ближнем Востоке, в странах бассейна Средиземноморья. Имеет две формы протекания: легочную и абдоминальную (легочная встречается крайне редко). Клиническую картину определяет синдром нарушенного всасывания, аменорея, хроническая диарея, облысение, стеаторея, гипокалиемия, истощение, гипокальциемия, отеки. Возможны боли в животе и лихорадка.
Описание болезни тяжелых цепей g (болезни Франклина) встречается всего у нескольких десятков пациентов. Морфологические данные и клиническая картина разнообразны, малоспецифичны. Наиболее часто отмечают протеинурию, относительную нейтропению, тромбоцитопению, прогрессирующую анемию, неправильную лихорадку, поражение вальдейерова кольца с отеком язычка, мягкого неба и эритемой, увеличение печени, лимфатических узлов и селезенки. Протекает данная болезнь обычно быстропрогрессирующе и тяжело. Уже через несколько месяцев наступает смерть.
Болезнь тяжелых цепей m является самой редкой формой. Как правило, заболеванию подвержены люди пожилого возраста. Проявляется болезнь в виде сублейкемического или алейкемического лимфолейкоза, обычно увеличение лимфоузлов при этом не выражено, но увеличены селезенка и/или печень. У некоторых пациентов отмечают амилоидоз и остеодеструкции. А в костном мозге практически каждого пациента обнаруживают лимфоцитарную инфильтрацию. Множество лимфоцитов вакуолизированы, также может быть примесь плазмо- и лимфобластов, плазматических клеток.
Поставить диагноз по клинической картине крайне затруднительно. Его установление происходит посредством методов иммунохимических, которые выявляют в моче или/и сыворотке крови тяжелые иммуноглобулиновые a-, g- или m-цепи. Лечение парапротеинемических гемобластозов данного вида проходит в гематологическом стационаре.
lg-секретирующая лимфома
lg-секретирующая лимфома – опухоль, которая имеет преимущественно внекостномозговую локализацию, часто они являются высокодифференцированными (лимфоплазмоцитарные, лимфоцитарные), редкобластные, то есть саркомы. Отличие от прочих лимфом – это секреция моноклональных иммуноглобулинов, зачастую М-класса, немного реже класса G и крайне редко А, в т. ч. белка Бенс-Джонса. Диагностируется и лечится по тем же принципам, что и лимфомы, которые не секретируют иммуноглобулины. Если имеются симптомы, которые обусловлены парапротеинемией, то используются методы профилактики и лечения такие же, как при макроглобулинемии Вальденстрема и множественных миеломах.
Далее разберемся в причинах парапротеинемических гемобластозов.
Причины
Основные причины развития патологии:
- Ионизирующая радиация.
- Химические мутагены.
- Вирусы.
- Наследственный фактор.
Диагностика при парапротеинемических гемобластозах
Патологию диагностируют при помощи:
- Лабораторного исследования крови. Будет снижен гемоглобин, бластные клетки в крови, повышен уровень лейкоцитов, СОЭ, тромбоцитов.
- Лабораторных исследований мочи.
- Биохимии массы крови на электролиты, мочекислые элементы, креатинин и холестерин.
- Лабораторного исследования кала.
- Рентгена с упором на лимфоузлы, которые будут увеличены в размерах.
- УЗИ внутренних органов.
- ЭКГ.
- Вирусологической диагностики.
- Костномозговой трепанобиопсии или люмбальной пункции.
- Пункции лимфоузлов.
- Исследования клеточного костномозгового состава.
- Цитологической диагностики.
- Коагулограммы.
Лечение
Профилактика
Необходима во время ремиссии парапротеинемических гемобластозов профилактика обострений, прежде всего, исключение средств, их вызывающих. Профилактика резус-иммунизации – осторожность при переливаниях крови, когда ошибочно вводят резус-положительную кровь. Также проводится предотвращение обострений при помощи длительного, но слабого цитостатического воздействия.
Мы рассмотрели основные парапротеинемические гемобластозы.
Читайте также:

