Chek2 ген рак молочной железы
Мутация в гене CHEK2 (1100delC) встречается у пациентов, имеющих высокий риск развития эстроген-позитивного рака молочной железы, особенно в раннем возрасте. В России данная мутация встречается в 2,7 % случаев у женщин, страдающих этим типом рака. Кроме того, наличие этой мутации повышает риск развития других типов рака: рака желудка, рака почки, саркомы и рака предстательной железы.
CHEK2 (CDS1; CHK2; LFS2; RAD53; hCds1; HuCds1; PP1425).
OMIM
+ 604373.
Локализация гена на хромосоме
Синонимы английские
Analysis of CHEK2*1100delC heterozygosity, Analysis of CHECKPOINT KINASE 2 *1100delC.
Какой биоматериал можно использовать для исследования?
Аллель-специфичная полимеразная цепная реакция в режиме реального времени.
Как правильно подготовиться к исследованию?
- Специальной подготовки не требуется.
Общая информация об исследовании
Ген CHEK2 расположен на длинном плече 22-й хромосомы. Он кодирует белок, который обладает выраженным контролирующим действием на клеточный цикл. Активация данного гена и соответствующего ему белка происходит в случае повреждения ДНК. Это повреждение может быть как вследствие внешних факторов (лекарственная терапия, влияние мутагенов и т.д.), так и вследствие нарушения целостности ДНК после деления клетки. При активации данный ген останавливает клеточный цикл и запускает процессы восстановления целостности поврежденной ДНК. Таким образом, этот белок выступает в роли опухолевого супрессора, или белка, предотвращающего развитие опухоли.
Показано, что мутации в гене CHEK2 увеличивают наследственную предрасположенность к развитию рака. Это связано с тем, что мутации инактивируют способность белка CHEK2 к выполнению своих функций. Таким образом, любые повреждения ДНК передаются после деления дочерним клеткам. Выявлена четкая связь наличия различных типов мутаций с развитием рака различной локализации (рак молочной железы, рак предстательной железы, почек, толстой кишки, щитовидной железы), а также некоторых типов лимфом.
Мутация CHEK2*1100delC является следствием утраты (делеции) цитозина в 1100-м положении гена CHEK2. Хотя эта мутация встречается редко, она значительно повышает риск развития рака молочной железы (РМЖ). Этот риск коррелирует с семейным анамнезом и увеличивается, когда носители имеют родственников с этим диагнозом. У носителей мутации без пораженного родственника риск развития РМЖ составляет приблизительно 20 % и увеличивается до 44 %, когда затрагиваются как родственники первой, так и второй линии.
Мутация CHEK2*1100delC приводит к повышенному риску развития рака молочной железы как у женщин, так и у мужчин, однако степень риска не изменяется, если эти люди являются носителями мутаций генов BRCA1 или BRCA2.
Мутации в гене CHEK2 не только коррелируют с риском развития рака молочной железы, но и участвуют в ответе на терапию. Мутации генов CHEK2 или TP53 были связаны с резистентностью к химиотерапии препаратами на основе антрациклина у пациентов с раком молочной железы.
Для чего используется исследование?
- Для диагностики риска развития рака молочной железы, рака желудка, рака почки, саркомы и рака предстательной железы;
- для подбора рациональной схемы терапии;
- для прогноза течения и исхода заболевания.
Когда назначается исследование?
- На этапе генодиагностики при заболеваниях, в развитии которых может участвовать мутировавший ген CHEK2;
- перед началом химиотерапии и при дальнейшем мониторинге терапии;
- при рецидиве заболевания, ассоциированного с мутацией CHEK2.
Что означают результаты?
Мутации (делеции) не выявлено – риск развития рака молочной железы и рака яичников находится в пределах общепопуляционных значений.
Выявление мутации (делеции) в гене CHEK2 – риск развития рака молочной железы и рака яичников значительно превышает общепопуляционные значения.
Частота наследственной предрасположенности к раку молочной железы составляет около 25 % всех случаев рака. Приблизительно 5-10 % случаев рака молочной железы и яичников вызвано мутациями генов BRCA1, BRCA2, CHEK2. Мутации в CHEK2 и ATM характерны для промежуточного риска возникновения рака молочной железы.
- Отсутствие мутаций по исследуемым генетическим маркерам не исключает рака молочной железы и рака яичников и не отменяет общеклинического обследования (самообследование, ежегодная маммография, осмотр маммолога, гинеколога), особенно в возрасте старше 35 лет.
- Ответственность за принятие клинических решений несет лечащий врач.
Кто назначает исследование?
Онколог, акушер-гинеколог, генетик.
- Solo ABC: Анализ данных о генах BRCA1, BRCA2, CHEK2, ATM
- Риск раннего развития рака молочной железы и яичников
- Анализ на мутацию I157Tгена CHEK2
- Анализ на мутацию Q20Xгена CHEK2
- Анализ на мутацию E85Xгена CHEK2
- Анализ на мутацию генов BRCA1 или BRCA2
Полиморфизм генов, передающийся из поколения в поколение, позволяет оценить риск возникновения онкологического заболевания и скорректировать лечение при уже развившемся онкологическом процессе.


Наследственный синдром рака молочной железы и/или яичников стал предметом для интенсивных исследований в начале 1990-х гг. В 1994 г. открыт первый ген, ассоциированный с данным заболеванием – BRCA1, а годом позже – второй ген - BRCA2. Гены BRCA1 и BRCA2 кодируют аминокислотные последовательности ядерных белков, которые участвуют в регуляции восстановления ДНК и деления клеток. В интактном (немутантном) состоянии оба гена выступают в качестве супрессоров опухоли и обеспечивают целостность генома. Белковые продукты генов репрессируют транскрипционную функцию гена рецептора эстрогенов, сдерживая, таким образом, избыточную пролиферацию клеток молочной железы и других эстрогензависимых органов, в частности, при половом созревании и беременности. Мутации в генах BRCA1 и BRCA2 приводят к повышению уровня хромосомной нестабильности в клетках, что может способствовать их опухолевой трансформации. На сегодняшний день известно более 1000 различных мутаций генов BRCA1 и BRCA2, связанных с повышением риска развития рака молочной железы, яичников, предстательной железы, кишечника, гортани, кожи и др. Для реализации онкогенного эффекта достаточно, чтобы мутация присутствовала хотя бы в одном аллеле. При обнаружении мутации в генах BRCA1 и BRCA2 у женщины риск развития рака молочной железы и/или яичников составляет от 50 до 80%.
Огромные усилия учёных направлены на идентификацию других генов наследственного рака молочной железы и/или яичников. В ходе этих исследований удалось обнаружить новые значимые мутации, приводящие к инактивации генов CHEK2, NBS1, PALB2, TP53, PTEN и другие. Ген CHEK2 кодирует синтез белка-фермента чекпойнт-киназы 2. Белковый продукт гена CHEK2 участвует в поддержании стабильности генома, контролирует процессы клеточного деления и репарации ДНК. Фермент активируется в ответ на повреждение молекулы ДНК, блокируя клеточный цикл в фазе G1 или запуская процесс апоптоза, выступая в качестве супрессора злокачественной трансформации клеток. Мутации гена CHEK2 приводят к синтезу неполноценного укороченного белка и ассоциированы с возникновением наследственных форм рака молочной железы.
Мутации с.1100delC, IVS2+1G>A гена CHEK2 являются наиболее распространенными. Частота аллеля 1100delC в европейской популяции составляет 1,1–1,4%. Среди российских пациентов частота встречаемости аллеля 1100delC составляет 2-5%. Риск возникновения рака молочной железы у женщин–носительниц мутации 1100delC увеличивается в 1,4–4,7 раза. Мутация IVS2+1G>A гена CHEK2 более редкая, по сравнению с c.1100delC, чаще встречается у представительниц Белоруссии, Польши, Германии и Северной Америки. Аллель IVS2+1G>A CHEK2 ассоциирован с возникновением онкологической патологии различной локализации, чаще всего встречается у больных раком молочной железы.
Мутации гена CHEK2 наследуются по аутосомно-доминантному типу, передаются из поколения в поколение с вероятностью 50%. Встречаются с одинаковой частотой у мужчин и женщин. Вероятность возникновения болезни повышается даже при наличии одной мутации в гетерозиготной форме.
Частота наследственной предрасположенности к раку молочной железы составляет около 25% всех случаев рака молочной железы.
Распространенность мутации генов BRCA1 или BRCA2 значительно различается у этнических групп в географических регионах. Специфические мутации и рецидивы мутации в зависимости от популяции описаны в Исландии, Нидерландах, Швеции, Норвегии, Германии, Франции, Испании, Канаде, странах Центральной и Восточной Европы и среди потомков евреев, выходцев из Германии. В середине 1990 х гг. обнаружено, что относительно небольшие, биологически изолированные народности характеризуются выраженным эффектом предшественника – преобладанием, так называемых повторяющихся мутаций в BRCA1 и BRCA2. Например, у евреев европейского происхождения практически все повреждения генов BRCA1 и BRCA2 сводятся к мутациям BRCA1 185delAG, BRCA1 5382insC и BRCA2 6174delT, у жителей Исландии – к аллелю BRCA2 999del5. Особенности спектра мутаций в том или ином географическом регионе в значительной мере отражаются на организации диагностики наследственного рака молочной железы. В странах без выраженного эффекта предшественника генетическому анализу подвергаются преимущественно те случаи онкологического заболевания, при которых вероятность обнаружения мутаций достаточно высока, а именно пациенты с выраженным семейным онкологическим анамнезом и/или больные с первично множественными опухолями и/или молодые женщины с раком молочной железы или раком яичников.
Методом полимеразной цепной реакции в режиме реального времени в препаратах ДНК человека, полученных из периферической крови, выявляется мутация в генах BRCA1, BRCA2, CHEK2. Обнаружение генного дефекта у клинически здоровых женщин позволяет провести своевременную диагностику в случае возникновения онкологических заболеваний молочной железы и/или яичников и предупредить их тяжелые последствия. Для пациенток с уже подтвержденным онкологическим заболеванием данное исследование дает возможность определить его возможную наследственную природу и подобрать более адекватную терапию.
Активные исследования по предрасположенности к раку молочной железы в девяностые годы 20 века увенчались открытием гена BRCA1, а затем гена BRCA2. Впоследствии был обнаружен ген CHEK2.
Установлено, что мутации в генах BRCA1, BRCA2, CHEK2 - причины наследственных форм рака молочной железы и рака яичников. В нормальном состоянии это полезные гены-супрессоры. Они кодируют белок, который подавляет неконтролируемое деление и рост клеток опухоли. Но если в них происходит мутация, то они перестают защищать клетки и риск превращения здоровой клетки в опухолевую увеличивается.
Рак молочной железы - наиболее распространенное в мире онкологическое заболеваний среди женщин. На семейные формы приходится около 10 процентов всех случаев рака молочной железы. Если выявляются мутации в определенных генах, то вероятность развития онкологического заболевания у всех родственников в одной семье на протяжении жизни увеличивается до 90%. Такой же высокий процент риска рака молочной железы или рака яичников выделяется и среди совершенно здоровых людей - носителей мутаций.
Россия приняла участие в исследовании, которое показало такую статистику - на 1000 человек приходятся как минимум 6 человек - носителей мутаций. Заболевших раком молочной железы носителей таких мутаций - более 30 человек на 1000, заболевших раком яичников носителей мутаций - более 150 человек на 1000. Выявить мутации можно только с помощью молекулярно-генетического анализа.
Анализ на выявление мутации в генах BRCA1, BRCA2, CHEK2 достаточно сделать только один раз в жизни. Из него станет понятно - произошла ли передача от родителей поврежденных генов? Положительный ответ - повод сделать такой анализ всем кровным родственникам носителя мутаций.

В чем смысл диагностики генов BRCA1, BRCA2, CHEK2?
Предупреждение о большом риске появления злокачественной опухоли у носителей мутаций позволит вести постоянное диспансерное наблюдение у врача-онколога, чтобы обнаружить опухоль на самой ранней стадии. Потому что сам пациент в силу бессимптомного течения заболевания не знает о его начале.
Раннее выявление и удаление опухоли предотвращает образование метастазов, делает операцию менее травматичной для больного, позволяет вовремя начать эффективное лечение самыми современными препаратами.
Статистика показывает, что более чем в 95 процентах случаев своевременного выявления опухолей молочной железы пациенткам удается избежать тяжелых последствий и вернуться к полноценной жизни.
Кому необходимо пройти процедуру анализа?
Большинству международных исследований показывает, что проведение подобного анализа обязательно для больных раком молочной железы и больных раком яичников, у которых:
• в семье есть хотя бы еще один случай онкологического заболевания;
• заболевание появилось ранее 45 лет;
• обнаружена билатеральная форма рака молочной железы.
Высокая частота обнаружения мутаций в России – повод проведения диагностики для всех больных раком молочной железы и особенно раком яичников. Подтверждение мутаций у онкологических больных поможет выбрать более подходящее лечение. Среди родственников больных технически просто и своевременно обнаружить здоровых носителей мутации.
Материал для исследования – это 0,5 - 1 мл крови. Кровь должна быть собрана в пробирку с ЭДТА, до проведения анализа может долгое время храниться при -20°С.
Онкогенетика. мутации в генах brca1, brca 2 и chek2, ассоцированные с раком молочной железы и яичников
Рак молочной железы (РМЖ) представляет собой важную социально-медицинскую проблему в связи с высокой заболеваемостью и смертностью среди женского населения. В мире ежегодно регистрируется более 1 миллиона случаев РМЖ, а в Российской Федерации - свыше 50 тысяч. Генетическая предрасположенность является одним из факторов риска развития РМЖ и рака яичников (РЯ). Считается, что 5-10% случаев РМЖ и 10-17% случаев рака яичников (РЯ) являются наследственными.
В настоящее время достоверно доказано, что одну из ключевых ролей в развитии наследственных форм РМЖ и РЯ играют мутации в генах BRCA1 и BRCA2 . По данным многочисленных исследований ими обусловлены 20-50% наследственных форм РМЖ, 90-95% случаев наследственных РЯ у женщин, а также 4-40% рака грудных желез у мужчин . Функция белков, кодируемых генами BRCA1 и BRCA2, заключается в регуляции репарации ДНК и поддержании целостности генома. Мутации в генах BRCA приводят к дестабилизации генома, что проявляется развитием опухолей различной локализации. В первую очередь возрастает риск рака молочной железы и яичника. Вероятность РМЖ и РЯ достигает 70-90% к определенному возрасту . Также повышается риск рака желудка, толстой кишки, поджелудочной железы, мочевого пузыря, опухолей головы и шеи, эндометрия, желчевыводящих путей, а также возникновения меланомы.
Показаниями к молекулярно-генетическому тестированию служат : онкологически отягощенный семейный анамнез (два и более кровных родственника с РМЖ и/или РЯ: РМЖ в возрасте до 50 лет, РЯ в любом возрасте, двусторонний РМЖ, первично-множественные злокачественные образования, РМЖ у мужчин) и личный анамнез (РМЖ в возрасте до 45 лет; двусторонний РМЖ; первично-множественные злокачественные образования, в том числе сочетание РМЖ и РЯ; морфологические особенности опухоли: трижды негативный и медулярный РМЖ; РЯ, рак фаллопиевых труб, метастатическое поражение брюшины в любом возрасте, РМЖ у мужчин).
Онкологически отягощенный семейный анамнез является самым важным показанием к генетическому тестированию. Однако в связи с малым размером семей и отсутствием достоверной информации в отношении родственников пациента использование только этого критерия недостаточно. В масштабном российском исследовании неотобранной выборки больных РМЖ (свыше 1000 человек) при медико-генетическом консультировании пациенток с выявленными мутациями в генах BRCA1, BRCA2 установлено, что у 23% пробандов* в семье не было отмечено случаев злокачественных новообразований. Поэтому скрининг на мутации генов BRCA1 и BRCA2 может проводиться по желанию пациента и при отсутствии прямых показаний.
Молекулярно-генетическое исследование проводится один раз в жизни, т.к. генотип не меняется. Определение генетической предрасположенности к развитию РМЖ и РЯ основано на выявлении наиболее часто встречающихся в российской популяции мутаций генов BRCA1 (мутации 185delAG, 4153delA, 5382insC, 3819delGTAAA, 3875delGTCT, 300T>G (Cys61Gly), 2080delA) и BRCA2 (мутация 6174delT)).
• Отсутствие мутаций в генах BRCA1, BRCA2 не позволяет полностью исключить риск онкопатологии, но существенно снижает вероятность наследственного рака.
• При обнаружении мутаций необходимо обращение к врачу-генетику, онкологу-маммологу, или в специализированные онкологические центры, где будет определен индивидуальный план дальнейшего обследования и профилактического лечения, форма которого будет зависеть от возраста пациентки и клинической ситуации.
С предрасположенностью к возникновению синдрома РМЖ/РЯ связано присутствие у таких пациентов мутаций в генах BRCA1 или BRCA2. Мутации являются наследственными – то есть, буквально в каждой клетке организма такого человека есть повреждение, которое передалось ему по наследству. Вероятность возникновения злокачественного новообразования у пациентов с мутациями BRCA1 или BRCA2 к 70 годам достигает 80%.
Однако, в каждой клетке присутствует две копии каждого гена — от мамы и от папы, поэтому вторая копия может компенсировать нарушение работы клеточных систем. Но вероятность выхода ее из строя также очень высока. При нарушении процессов восстановления ДНК в клетках начинают накапливаться и другие изменения, которые, в свою очередь, могут привести к злокачественной трансформации и росту опухоли.
Определение генетической предрасположенности к онкологическим заболеваниям:
На базе лаборатории молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова применяется проведение поэтапного анализа для пациентов:
- сначала исследуется присутствие самых частых мутаций (4 мутации)
- при отсутствии таковых и клинической необходимости возможно проведение расширенного анализа (8 мутаций) и/или анализа полной последовательности генов BRCA1 и BRCA2.
 |  |
На данный момент известно более 2 000 вариантов патогенных мутаций в генах BRCA1 и BRCA2. Кроме того, данные гены являются довольно большими – 24 и 27 экзонов соответственно. Поэтому полный анализ последовательностей генов BRCA1 и BRCA2 является трудоемким, дорогостоящим и длительным по времени процессом.
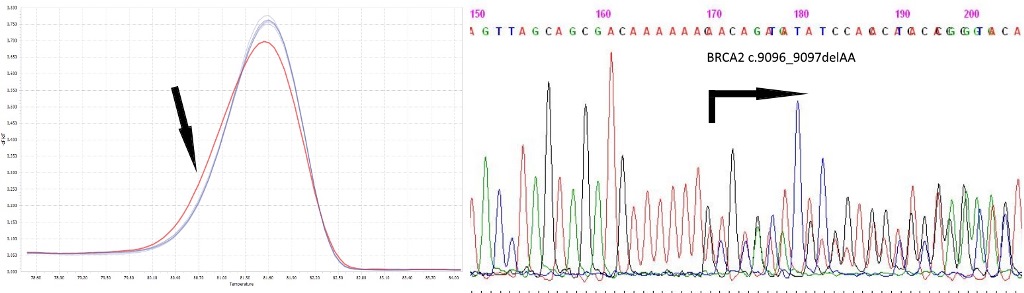
Анализ последовательности гена BRCA2, выявление мутации c.9096_9097delAA
В каких случаях нужно сдать анализ на мутации BRCA1 и BRCA2?
Национальная онкологическая сеть – National Comprehensive Cancer Network (NCCN) рекомендует направлять на генетическое исследование следующих пациентов:
- Пациенты до 45 лет с диагнозом рак молочной железы
- Пациенты в возрасте до 50 лет с РМЖ, если в семье есть хотя бы один близкий кровный родственник с таким диагнозом
- Также в том случае, если у пациента до 50 лет с РМЖ семейная онкологическая история неизвестна
- Если в возрасте до 50 лет диагностировано множественное поражение молочных желез
- Пациенты с РМЖ в возрасте до 60 лет — если по результатам гистологического исследования опухоль является трижды-негативной (отсутствует экспрессия маркеров ER, PR, HER2).
- При наличии диагноза рак молочной железы в любом возрасте — если присутствует хотя бы один из следующих признаков:
- не менее 1 близкой родственницы с РМЖ в возрасте менее 50 лет;
- не менее 2 близких родственниц с РМЖ в любом возрасте;
- не менее 1 близкой родственницы с РЯ;
- наличие не менее 2 близких родственников с раком поджелудочной железы и/или раком предстательной железы;
- наличие родственника-мужчины с раком грудной железы;
- принадлежность к популяции с высокой частотой наследственных мутаций (например, евреи Ашкенази);
- Все пациенты с диагностированным раком яичников.
- Если диагностирован рак молочной железы у мужчины.
- Если диагностирован рак простаты (с индексом по шкале Глисона >7) при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если диагностирован рак поджелудочной железы при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если рак поджелудочной железы диагностирован у уиндивидуума, принадлежащего к этносу евреев Ашкенази.
- Если у родственника обнаружена мутация BRCA1 или BRCA2
Выполнение молекулярно-генетического анализа должно сопровождаться генетическим консультированием, в ходе которого обсуждаются содержание, смысл и последствия тестирования; значение позитивного, негативного и неинформативного результатов; технические ограничения предлагаемого теста; необходимость информировать родственников в случае обнаружения наследственной мутации; особенности скрининга и профилактики опухолей у носителей мутаций и др.
Как сдать анализ на мутации BRCA1 и BRCA2?
Материалом для анализа является кровь. Для генетических исследований используют пробирки с ЭДТА (фиолетовая крышка). Сдать кровь можно в лаборатории НМИЦ или привезти из любой другой лаборатории. Кровь хранится при комнатной температуре до 7 дней.
 |  |
Особая подготовка к исследованию не нужна, на результаты исследования не влияют приемы пищи, прием лекарств, введение контрастных веществ и пр.
Пересдавать анализ через некоторое время или после лечения не потребуется. Наследственная мутация не может исчезнуть или появиться в течение жизни или после полученного лечения.
Что делать, если у женщины обнаружена мутация BRCA1 или BRCA2?
Для носителей патогенных мутаций разработан комплекс мероприятий по ранней диагностике, профилактике и терапии новообразований молочной железы и рака яичников. Если среди здоровых женщин своевременно выявить тех, у кого имеется генный дефект, есть возможность диагностировать развитие заболевания на ранних стадиях.
Исследователями были выявлены особенности лекарственной чувствительности BRCA-ассоциированных опухолей. Они хорошо реагируют на некоторые цитостатические препараты, и лечение может быть весьма успешным.
Для здоровых носителей BRCA-мутаций рекомендовано:
- Ежемесячное самообследование с 18 лет
- Клиническое обследование молочных желез (маммография или магнитно-резонансная томография) с 25 лет.
- Мужчинам-носителям мутации в генах BRCA1/2 рекомендовано проведение ежегодного клинического обследования грудных желез начиная с 35-летнего возраста. С 40 лет целесообразно выполнение скринингового обследования предстательной железы.
- Проведение дерматологического и офтальмологического осмотров c целью ранней диагностики меланомы.
Как предрасположенность к РМЖ и РЯ передается по наследству.
Часто у носителей мутаций BRCA1/BRCA2 возникает вопрос – всем ли детям она передалась и какие генетические причины появления наследственной формы РМЖ? Шансы передать повреждённый ген потомству составляют 50%.
Заболевание одинаково наследуется, как мальчиками, так и девочками. Ген, связанный с развитием рака молочной железы и рака яичников, расположен не на половых хромосомах, поэтому вероятность носительства мутации не зависит от пола ребенка.
Если мутация в нескольких поколениях передавалась через мужчин, очень сложно проводить анализ родословных, так как мужчины довольно редко болеют РМЖ даже при наличии генного дефекта.
Например: носителями были дедушка и отец пациентки, и у них заболевание не проявилось. На вопрос, были ли случаи онкологических заболеваний в семье, такая пациентка ответит отрицательно. При отсутствии других клинических признаков наследственных опухолей (ранний возраст/множественность опухолей), наследственная составляющая заболевания может быть не учтена.
При обнаружении мутации BRCA1 или BRCA2 всем кровным родственникам рекомендуется также пройти тестирование.
Почему при генетическом исследовании важно учитывать этнические корни?
Для многих этнических групп характерен свой набор частых мутаций. Национальные корни обследуемого необходимо учитывать при выборе глубины исследования.



Заболеваемость
Частота наследственной предрасположенности к раку молочной железы составляет около 25% всех случаев рака молочной железы. Приблизительно 5-10% случаев рака молочной железы и яичников вызваны мутациями генов BRCA1, BRCA2, CHEK2, TP53 и PTEN. Гены BRCA1 и BRCA2 высоко чувствительны при раке молочной железы, в то время как мутации в CHEK2, ATM, BRIP1 и PALB2 характерны для промежуточного риска возникновения рака молочной железы. Объединенные исследования идентифицировали другие общие варианты, связанные с низким риском возникновения рака молочной железы. Тем не менее, более 70% генетической предрасположенности к раку молочной железы остаются необъяснимыми.
Распространенность носителей мутации гена BRCA, в общем, по популяции составляет от 1/800 до 1/1000. Это обуславливает повышение риска развития рака молочной железы на 15%-20%. Распространенность мутаций генов BRCA1 или BRCA2 значительно различается у этнических групп в географических регионах. Специфические мутации и рецидивы мутаций в зависимости от популяции были описаны в Исландии, Нидерландах, Швеции, Норвегии, Германии, Франции, Испании, Канаде, странах Центральной и Восточной Европы и среди потомков евреев, выходцев из Германии.
Частота мутаций BRCA1 и BRCA2 у больных раком молочной железы и яичников, изначально не дифференцированных по признаку наследственности либо возраста, в общей массе мала: 25 лет, после получения генетической консультации и информированного согласия. Пациентов с выявленными генетическими мутациями следует поддерживать в вопросах получения генетической консультации для близких членов семьи.
Снижение рисков: нехирургические превентивные меры
Наблюдение
Наблюдение с точки зрения возникновения рака груди у носителей BRCA включает ежемесячные самопроверки, клиническое обследование груди раз или два в год, а также раз в год маммографию и магнитно-резонансную томографию (МРТ) молочной железы, начиная с 25-30 лет [IIa, B]. Пока еще нет доступных данных, чтобы определить, что более эффективно в молодом возрасте – поочередно маммография и МРТ каждые 6 месяцев либо оба обследования раз в год, учитывая высокую степень появления рака в промежутках между обследованиями.
Профилактическая химиотерапия
Адъювантный тамоксифен сокращает риск контралатерального рака груди у носителей мутаций гена BRCA [III, B], тогда как преимущества тамоксифена для предотвращения первичного рака молочной железы не были доказаны [Ib, A].
Снижение рисков: профилактические хирургические методы
Профилактическая двусторонняя мастэктомия — наиболее эффективная из известных на сегодня стратегий по сокращению риска развития рака груди у носителей мутации гена [III, B], хотя не отмечены преимущества в выживании, и многие женщины не считают эту стратегию приемлемой по косметическим соображениям. Контралатеральная профилактическая мастэктомия — вариант к рассмотрению для носителей мутации BRCA с раком груди в раннем возрасте и односторонней мастэктомией [IV, C].
Типы профилактической мастэктомии могут быть от тотальной мастэктомии до кожесохраняющей и сосковосохраняющей мастэктомии. Различные варианты реконструкции молочной железы должны быть обсуждены с пациентом и включая преимущество и риски для каждого.
На сегодняшний день недостаточно доказательств для рутинного выполнения биопсии сторожевого лимфатического узла у пациентов, подвергшихся профилактической мастэктомии.
Профилактическая двусторонняя сальпингоовариэктомия
Операция связана со снижением риска рака молочной железы у носителей мутации гена BRCA в пременопаузе, риска снижения рецидива ипсилатерального рака молочной железы после органосохранной операции и лучевой терапии, риска снижения рака яичников и гинекологических опухолей, а также имеются доказательства снижения общей смертности.[III, B]. Двусторонняя сальпингоовариэктомия рекомендована после 35 лет и в тех случаях, когда беременность больше не планируется [IV, C].
Кратковременная гормонозаместительная терапия после двусторонней сальпингоовариэктомии, по-видимому, не снижает общих преимуществ данной стратегии для уменьшения риска заболевания раком молочной железы [III, B].
Модификаторы риска
Риск BRCA-ассоциированного рака молочной железы может быть изменен внешними факторами. Гормональные и репродуктивные факторы, такие как беременность (количество беременностей и возраст в первую беременность), грудное вскармливание и оральные противозачаточные средства связаны с риском модификации у носителей мутации BRCA. Количество родов в анамнезе, кажется, снижает риск развития рака молочной железы у женщин с мутациями BRCA в общей популяции. [III, B].
Органосохранная операция и лучевая терапия у носителей BRCA мутаций, которые подверглись профилактической овариэктомии, ассоциирована с подобной формой развития рецидивного рака молочной железы по сравнению с контролем в течение 10 лет. Риск развития контралатерального рака молочной железы у носителей BRCA выше по сравнению со спорадическим контролем, независимо от гормонального вмешательства.
Решение о хирургическом лечении рака молочной железы у носителей мутации BRCA должно основываться на тех же параметрах, как и при спорадических случаях диагностики рака, при этом принимая во внимание более высокую степень риска двустороннего рака молочной железы, и ипсилатерального рецидива если за органосохранным оперативным лечением следует лучевая терапия без выполнения овариэктомии [III, B].
Системное лечение
Согласно последним данным, общий прогноз рака молочной железы у носителей BRCA мутаций такой же, как и при спорадическом раке молочной железы, а отсутствие мутации BRCA1/2, считается прогнозирующим фактором химиочувствительности опухоли [III, B].
Продолжается II фаза рандомизированного клинического исследования по изучению чувствительности к платино-содержащей химиотерапии при BRCA ассоциированных метастатических опухолях по сравнению с таксан-содержащими режимами.
Ингибиторы PARP используются как единственные терапевтические агенты для пациентов с BRCA ассоциированным раком молочной железы и яичников. Эти препараты ингибируют путь репарации однонитевого разрыва ДНК и приводят к апоптозу в BRCA дефицитных опухолевых клетках, которые уже имеют дефицит в гомологичной рекомбинантной репарации. Некоторые клинические исследования II фазы изучают недостаток специфической репарации ДНК в BRCA ассоциированных опухолях с использованием ингибиторов PARP при метастатическом процессе.
Два клинических исследования II фазы с применением орального ингибитора PARP — олапариба при местно распространенном раке молочной железы и раке яичников с BRCA мутацией недавно показали поддерживающий клинический эффект при применении 400мг препарата непрерывно (процент ответивших: 41% и 33%, и безрецидивная выживаемость составила 5.7 и 5.8 месяцев, соответственно).
До сих пор не имеется окончательных выводов о лучших режимах химиотерапии для пациентов с BRCA ассоциированным раком молочной железы [III, B]. В настоящее время при выборе адъювантного лечения для больных раком молочной железы с наличием BRCA мутации должны использоваться стандартные прогностические факторы.
Читайте также:

