Цепочки превращения с хлором
Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращений
Cl2 -> HCl -> NaCl -> AgCl.
Укажите основные физические и химические свойства хлорида серебра. Приведите способы получения этого соединения.
Цепочка превращений:
Cl2 -> HCl -> NaCl -> AgCl.
В результате сгорания водорода в токе хлора или при взаимодействии этих веществ на свету происходит образование сложного соединения — хлороводорода:
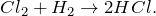
При действии на разбавленную соляную кислоту разбавленного раствора гидроксида натрия происходит образование средней соли хлорида натрия:
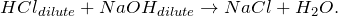
Получение хлорида серебра из хлорида натрия возможно несколькими способами: путем смешения насыщенных растворов нитрита серебра и хлорида натрия (1), а также разбавленного раствора хлорида натрия с нитратом серебра (2):
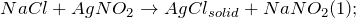
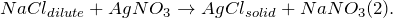
Хлорид серебра разлагается на свету с образованием металлического серебра:
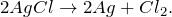
Реагирует с концентрированными растворами щелочей, гидратом аммиака.
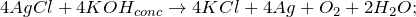
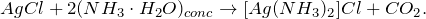
Переводится в раствор за счет комплексообразования.
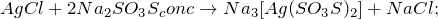
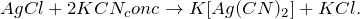
При сплавлении с карбонатом натрия (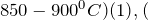
> 324^<0>C$) (2):
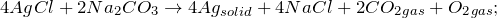
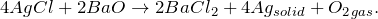
Хлорид серебра получают по реакциям обмена, сокращенное ионное уравнение которых соответствует указанному ниже:

Рассмотрим её на нескольких примерах.
Пример 1. Взаимосвязь соединений железа.
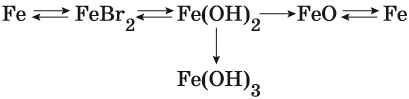
Переход из железа в бромид железа (II) возможен при реакции железа с бромоводородной кислотой:
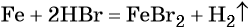
Получить из бромида железа (II) чистое железо можно при электролизе расплава:
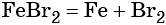
При добавлении к бромиду железа (II) щёлочи образуется гидроксид железа (II):
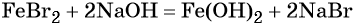
Обратный переход возможен при взаимодействии гидроксида железа (II) с бромоводородной кислотой:
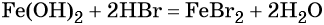
Окисление гидроксида железа (II) приводит к гидроксиду железа (III):
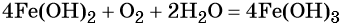
При нагревании гидроксид железа (II) теряет воду, превращаясь в оксид железа (II):
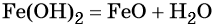
Восстановление оксида железа (II) приводит к железу:
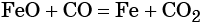
Пример 2. Взаимосвязь соединений железа.
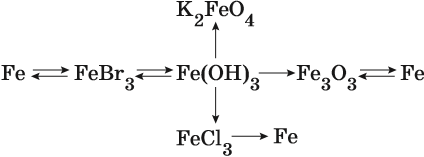
Реакция железа с бромом приводит к бромиду железа (III):
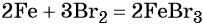
Получить из этого соединения железо можно электролизом расплава:
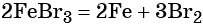
Переход из бромида железа (III) в гидроксид железа (III) возможен под действием щёлочи:
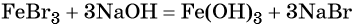
При нагревании гидроксид железа (III) теряет воду, превращаясь в оксид железа (III):
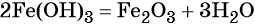
Восстановлением оксида железа (III) можно получить железо:
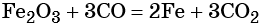
Железо в степени окисления +6 можно получить из гидроксида железа (III) по реакции:
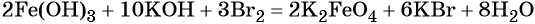
Гидроксид железа (III) под действием соляной кислоты переходит в хлорид железа (III):
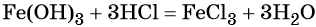
Из хлорида железа (III) электролизом можно получить железо:
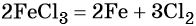
Пример 3. Взаимосвязь соединений серы.
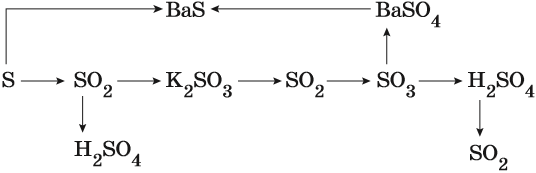
Сера окисляется кислородом воздуха до оксида серы (IV):
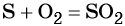
Взаимодействие серы с водородом приводит к сероводороду:
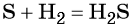
Оксид серы (IV) может вступить в окислительно-восстановительную реакцию с образованием серной кислоты или в обменную реакцию с образованием сульфита калия:
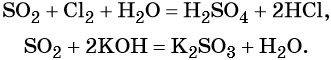
Под действием сильных кислот сульфит калия разлагается до SO2:
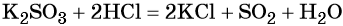
Каталитическое окисление SO2 приводит к оксиду серы (VI):
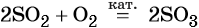
Из оксида серы (VI) можно получить как серную кислоту, так и сульфат бария:
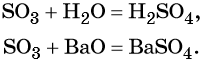
Из сульфата бария восстановлением углём можно получить сульфид бария:
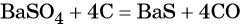
Восстановление SO2 приводит к сере:
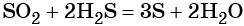
Пример 4. Осуществить следующую цепочку превращений: N2 → NH3 → (NH4)2SO4 → NH4Cl.
Азот взаимодействует с водородом при повышенной температуре в присутствии катализатора с образованием аммиака:
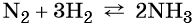
Реакция газообразного аммиака с серной кислотой приводит к сульфату аммония:
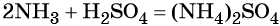
При взаимодействии водных растворов сульфата аммония и хлорида бария образуется нерастворимый сульфат бария, эта реакция идёт до конца. После отделения осадка и упаривания водного раствора можно выделить чистый хлорид аммония:
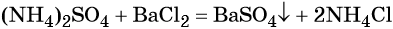
Пример 5. Осуществить следующую цепочку превращений: NO2 → HNO3 → NH4NO3 → N2O.
Оксид азота (IV) при взаимодействии с кислородом и водой даёт азотную кислоту:
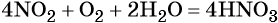
При реакции азотной кислоты с аммиаком образуется нитрат аммония:
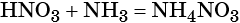
Контролируемое разложение нитрата аммония приводит к образованию оксида азота (I) и воды:
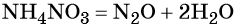
Пример 6. Осуществить следующую цепочку превращений: NaBr → NaCl → Cl2 → KClO.
Хлор способен вытеснять бром из бромидов:
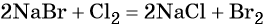
Электролиз расплава хлорида натрия приводит к образованию молекулярного хлора:
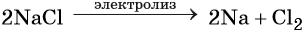
Гипохлорид калия образуется при взаимодействии газообразного хлора с водным раствором гидроксида калия при охлаждении:
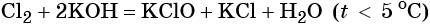
Особенностью заданий, в которых требуется определить неизвестное вещество Х как промежуточный продукт в цепочке химических превращений, является принципиальная возможность наличия нескольких правильных ответов. Вам нужно обосновать свой выбор.
Пример 7. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте этот выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
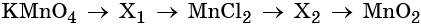
Каким же может быть вещество X1? Возможны несколько вариантов. Предположим, что марганец в этом соединении имеет степень окисления +2, тогда этим веществом будет, например, сульфат марганца (II). Почему? Из него удобно получит хлорид марганца (II) с помощью обменной реакции:
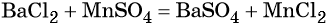
Данная реакция пойдёт до конца, потому что сульфат бария выпадет в осадок.
Перманганат калия — сильный окислитель, который при реакции с восстановителем в кислой среде может понизить свою степень окисления до +2. Чтобы получить сульфат марганца (II) из перманганата калия, можно использовать окислительно-восстановительную реакцию:
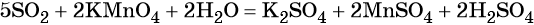
Другой вариант ответа:
Из хлорида марганца (II) можно получить нитрат марганца (II) с помощью обменной реакции с нитратом серебра. Эта реакция идёт до конца благодаря образованию нерастворимого хлорида серебра:
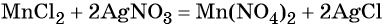
Термическое разложение нитрата марганца (II) — обычный способ получения оксида марганца (IV):
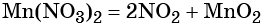
Пример 8. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте этот выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
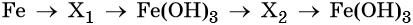
Наиболее рациональным вариантом будет следующий. Вначале железо под действием хлора окисляется до хлорида железа (III) (вещество X1), из которого по обменной реакции получают гидроксид железа (III):
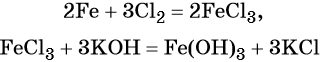
Веществом (X2) может быть любая растворимая соль железа (III), например сульфат, нитрат и т. д.:
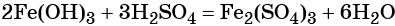
Под действием расчётного количества щёлочи в осадок выпадает гидроксид железа (III):
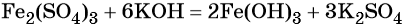
Тренировочные задания
Общее задание 1. Составьте уравнения реакций, с помощью которых можно осуществить следующие цепочки превращений:
12. Cl2 → NaCl → HCl → AlCl3.
13. KCl → Cl2 → NaClO → NaClO3.
14. HBr → NaBr → Br2 → HBr.
15. KBr → Br2 → HBr → NaBr.
16. NaCl → HCl → Cl2 → KClO3.
Общее задание 2. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте ваш выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
4. SiO2 → Si → X → BaSiO3.

Рассмотрим её на нескольких примерах.
Пример 1. Взаимосвязь соединений железа.
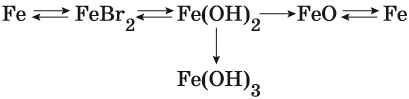
Переход из железа в бромид железа (II) возможен при реакции железа с бромоводородной кислотой:
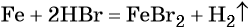
Получить из бромида железа (II) чистое железо можно при электролизе расплава:
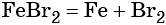
При добавлении к бромиду железа (II) щёлочи образуется гидроксид железа (II):
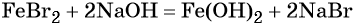
Обратный переход возможен при взаимодействии гидроксида железа (II) с бромоводородной кислотой:
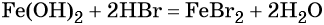
Окисление гидроксида железа (II) приводит к гидроксиду железа (III):
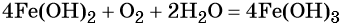
При нагревании гидроксид железа (II) теряет воду, превращаясь в оксид железа (II):
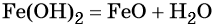
Восстановление оксида железа (II) приводит к железу:
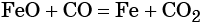
Пример 2. Взаимосвязь соединений железа.

Реакция железа с бромом приводит к бромиду железа (III):
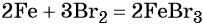
Получить из этого соединения железо можно электролизом расплава:
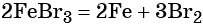
Переход из бромида железа (III) в гидроксид железа (III) возможен под действием щёлочи:
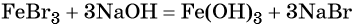
При нагревании гидроксид железа (III) теряет воду, превращаясь в оксид железа (III):
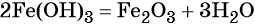
Восстановлением оксида железа (III) можно получить железо:
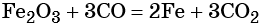
Железо в степени окисления +6 можно получить из гидроксида железа (III) по реакции:
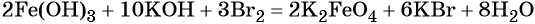
Гидроксид железа (III) под действием соляной кислоты переходит в хлорид железа (III):
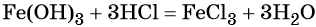
Из хлорида железа (III) электролизом можно получить железо:
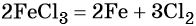
Пример 3. Взаимосвязь соединений серы.

Сера окисляется кислородом воздуха до оксида серы (IV):
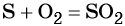
Взаимодействие серы с водородом приводит к сероводороду:
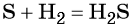
Оксид серы (IV) может вступить в окислительно-восстановительную реакцию с образованием серной кислоты или в обменную реакцию с образованием сульфита калия:
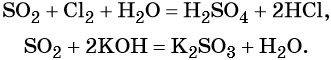
Под действием сильных кислот сульфит калия разлагается до SO2:
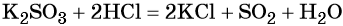
Каталитическое окисление SO2 приводит к оксиду серы (VI):
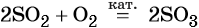
Из оксида серы (VI) можно получить как серную кислоту, так и сульфат бария:
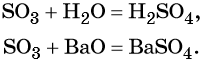
Из сульфата бария восстановлением углём можно получить сульфид бария:
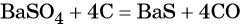
Восстановление SO2 приводит к сере:
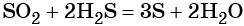
Пример 4. Осуществить следующую цепочку превращений: N2 → NH3 → (NH4)2SO4 → NH4Cl.
Азот взаимодействует с водородом при повышенной температуре в присутствии катализатора с образованием аммиака:
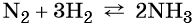
Реакция газообразного аммиака с серной кислотой приводит к сульфату аммония:
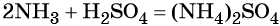
При взаимодействии водных растворов сульфата аммония и хлорида бария образуется нерастворимый сульфат бария, эта реакция идёт до конца. После отделения осадка и упаривания водного раствора можно выделить чистый хлорид аммония:
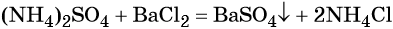
Пример 5. Осуществить следующую цепочку превращений: NO2 → HNO3 → NH4NO3 → N2O.
Оксид азота (IV) при взаимодействии с кислородом и водой даёт азотную кислоту:
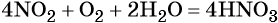
При реакции азотной кислоты с аммиаком образуется нитрат аммония:
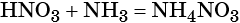
Контролируемое разложение нитрата аммония приводит к образованию оксида азота (I) и воды:
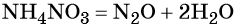
Пример 6. Осуществить следующую цепочку превращений: NaBr → NaCl → Cl2 → KClO.
Хлор способен вытеснять бром из бромидов:
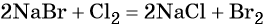
Электролиз расплава хлорида натрия приводит к образованию молекулярного хлора:
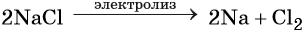
Гипохлорид калия образуется при взаимодействии газообразного хлора с водным раствором гидроксида калия при охлаждении:
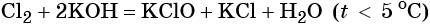
Особенностью заданий, в которых требуется определить неизвестное вещество Х как промежуточный продукт в цепочке химических превращений, является принципиальная возможность наличия нескольких правильных ответов. Вам нужно обосновать свой выбор.
Пример 7. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте этот выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
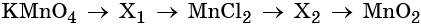
Каким же может быть вещество X1? Возможны несколько вариантов. Предположим, что марганец в этом соединении имеет степень окисления +2, тогда этим веществом будет, например, сульфат марганца (II). Почему? Из него удобно получит хлорид марганца (II) с помощью обменной реакции:
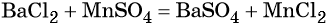
Данная реакция пойдёт до конца, потому что сульфат бария выпадет в осадок.
Перманганат калия — сильный окислитель, который при реакции с восстановителем в кислой среде может понизить свою степень окисления до +2. Чтобы получить сульфат марганца (II) из перманганата калия, можно использовать окислительно-восстановительную реакцию:
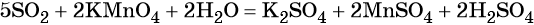
Другой вариант ответа:
Из хлорида марганца (II) можно получить нитрат марганца (II) с помощью обменной реакции с нитратом серебра. Эта реакция идёт до конца благодаря образованию нерастворимого хлорида серебра:
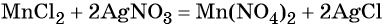
Термическое разложение нитрата марганца (II) — обычный способ получения оксида марганца (IV):
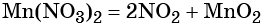
Пример 8. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте этот выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
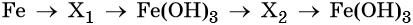
Наиболее рациональным вариантом будет следующий. Вначале железо под действием хлора окисляется до хлорида железа (III) (вещество X1), из которого по обменной реакции получают гидроксид железа (III):
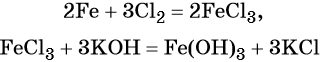
Веществом (X2) может быть любая растворимая соль железа (III), например сульфат, нитрат и т. д.:
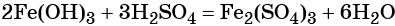
Под действием расчётного количества щёлочи в осадок выпадает гидроксид железа (III):
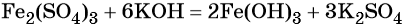
Тренировочные задания
Общее задание 1. Составьте уравнения реакций, с помощью которых можно осуществить следующие цепочки превращений:
12. Cl2 → NaCl → HCl → AlCl3.
13. KCl → Cl2 → NaClO → NaClO3.
14. HBr → NaBr → Br2 → HBr.
15. KBr → Br2 → HBr → NaBr.
16. NaCl → HCl → Cl2 → KClO3.
Общее задание 2. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте ваш выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
4. SiO2 → Si → X → BaSiO3.
Хлор в чистом виде впервые выделил шведский ученый Карл Шееле в 1774 году. Своё нынешнее название элемент получил в 1811 году, когда Г.Дэви предложил название "хлорин", которое вскоре было сокращено до "хлор" с легкой руки Ж. Гей-Люссака. Немецкий ученый Иоганн Швейгер предложил для хлора название "галоген", но этим термином было решено назвать всю группу элементов, в которую входит и хлор.
Хлор является самым распространенным галогеном в земной коре - на долю хлора приходится 0,025% всей массы атомов земной коры. По причине своей высокой активности хлор не встречается в природе в свободном виде, а только в составе соединений, при этом хлору "по барабану" с каким элементом вступать в реакцию, современной науке известны соединения хлора практически со всей таблицей Менделеева.
Основная масса хлора на Земле содержится в соленой воде Мирового океана (содержание 19 г/л). Из минералов больше всего хлора содержится в галите, сильвине, сильвините, бишофите, карналлите, каините.
Хлор играет важную роль в деятельности нервных клеток, а также в регуляции осмотических процессов, происходящих в организме человека и животных. Также хлор входит в состав зеленого вещества растений - хлорофилла.
Природный хлор состоит из смеси двух изотопов:
- 35 Cl - 75,5%
- 37 Cl - 24,5%
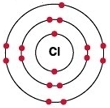
Рис. Строение атома хлора.
Электронная конфигурация атома хлора - 1s 2 2s 2 2p 6 3s 2 3p 5 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 5 электронов, находящихся на внешнем 3p-уровне + 2 электрона 3s уровня (всего 7 электронов), поэтому в соединениях хлор может принимать степени окисления от +7 до -1. Как уже было сказано выше, хлор является химически активным галогеном.
Физические свойства хлора:
- при н.у. хлор является ядовитым газом желто-зеленого цвета с резким запахом;
- хлор в 2,5 раза тяжелее воздуха;
- при н.у. в 1 л воды растворяется 2,5 объема хлора - этот раствор называется хлорная вода.
Химические свойства хлора
Взаимодействие хлора с простыми веществами (Cl выступает в роли сильного окислителя):
- с водородом (реакция протекает только при наличии света):
- с металлами с образованием хлоридов:
- с неметаллами, менее электроотрицательными, чем хлор:
- с азотом и кислородом хлор не реагирует непосредственно.
Взаимодействие хлора со сложными веществами:
Одной из самых известных реакций хлора со сложными веществами есть взаимодействие хлора с водой - кто живет в большом городе, наверняка, периодически сталкивается с ситуацией, когда, открыв кран с водой, ощущает стойкий запах хлора, после чего многие сетуют, дескать, опять воду хлорировали. Хлорирование воды является одним из основных способов ее обеззараживания от нежелательных микроорганизмов, небезопасных для здоровья человека. Почему так происходит? Разберем реакцию хлора с водой, которая протекает в два этапа:
- На первом этапе происходит образование двух кислот: соляной и хлорноватистой:
- На втором этапе хлорноватистая кислота разлагается с выделением атомарного кислорода, который окисляет воду (убивая микроорганизмы) + подвергает отбеливающему действию ткани, окрашенные органическими красителями, если их опустить в хлорную воду:
С кислотами хлор не взаимодействует.
Взаимодействие хлора с основаниями:
- на холоде:
- при нагревании:
- с бромидами металлов:
- с йодидами металлов:
- с фторидами металлов хлор не реагирует, по причине их более высокой окислительной способности, нежели у хлора.
Хлор "охотно" вступает в реакции с органическими веществами:
В результате первой реакции с метаном, которая протекает на свету, образуется хлористый метил и соляная кислота. В результате второй реакции с бензолом, которая протекает в присутствии катализатора (AlCl3), образуется хлорбензол и соляная кислота.
Получение и применение хлора
Промышленным способом хлор получают электролизом водного раствора (хлор выделяется на аноде; на катоде - водород) или расплава хлорида натрия (хлор выделяется на аноде; на катоде - натрий):
В лаборатории хлор получают действием концентрированной HCl на различные окислители при нагревании. В роли окислителей могут выступать оксид марганца, перманганат калия, бертолетова соль:
Применение хлора:
- отбеливание тканей и бумаги;
- обеззараживание воды;
- производство пластмасс;
- производство хлорной извести, хлороформа, ядохимикатов, моющих средств, каучуков;
- синтез хлороводорода в производстве соляной кислоты.
Если вам понравился сайт, будем благодарны за его популяризацию :) Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Читайте также:

