Центральная лимфодиссекция при раке щитовидной железы

Клиника рака щитовидной железы на своих начальных этапах является весьма скудной. Можно определить только локально размещенное уплотнение внутри щитовидки, как правило, только в одной доле.
В случаях, когда опухоль начинает развитие на фоне зоба, кроме "зобного" анамнеза определяют: быстрый рост онкоопухоли, повышение ее плотности, снижение подвижности, прорастание рака в гортань, трахею, мышцы, пищевод, сосудисто-нервный шейный пучок, что стает причиной изменения голоса, дисфагии, венозного застоя.
Клиническую диагностику рака щитовидной железы также нелегко проводить. Поводом к беспокойству должно быть любое уплотнение в теле железы, появление узла и его рост, ограниченная подвижность щитовидки, увеличение в объеме регионарных лимфоузлов. При этом врачи учитывают проживание эндемичной по зобу или радиологически загрязненной местности.
Рак щитовидной железы: операция
Нужно заметить, что объем радикальной терапии на щитовидке поддается значительным изменениям в зависимости от вида заболевания этой железы. Наиболее применяемыми в настоящее время являются такие виды операций при раке щитовидной железы:
- Тиреоидэктомию, то есть полную резекцию щитовидной железы. Применяют при терапии онокоопухоли щитовидки, многоузлового и диффузного токсического зоба;
- Субтотальную резекцию щитовидной железы или удаление тканей щитовидной железы с оставлением ее небольших участков. Делают в некоторых случаях многоузлового или диффузного токсического зоба, а также при гипертрофической форме аутоиммунного тиреоидита (тиреоидита Хашимото);
- Гемитиреоидэктомии (удалении одной из доль щитовидной железы). Подвергаются пациенты, болеющие узловым токсическим зобом или фолликулярными опухолями щитовидки;
- Операцию при раке щитовидной железы на перешейке осуществляют при лечении больных узловым зобом, имеющим локализацию узла в перешейке.
Виды лимфодиссекций при раке щитовидной железы
Разные методы лимфодиссекций (резекций жировой клетчатки с расположенными в ней лимфоузлами) применяют в лечении рака щитовидной железы. Стандартными видами лимфодиссекции являются:
- удаление рака щитовидной железы центральной шейной лимфодиссекцией (селективной шейной лимфодиссекцией VI уровня) - удаление претрахеальной, паратрахеальной, прегортанной жировой клетчатки с лимфоузлами;
- боковая лимфодиссекция шейной области (шейная селективная лимфодиссекция II, III и IV уровня) - удаление жировой клетчатки вместе с лимфоузлами, которые расположены вдоль сосудисто-нервного основного шейного пучка;
- лимфодиссекцию шейного бокового треугольника (селективную шейную лимфодиссекцию V уровня), то есть резекцию жировой клетчатки с лимфоузлами, которые расположены на боковых поверхностях шеи, также считают действенным методом по удалению рака щитовидной железы.
Если у больного рак щитовидной железы после операции не возвращается, то есть, нет рецидива болезни, длительное время наблюдается сохранение работоспособности, то в таких случаях на инвалидность при раке щитовидной железы пациента не переводят. Верный метод диагностики и реабилитации после радикальной терапии делает последующую жизнь после рака щитовидной железы вполне полноценной и здоровой.
Тиреоидэктомия – это операция, направленная на полное или частичное удаление щитовидной железы. При некоторых заболеваниях, например, раке, хирургическое вмешательство сопровождается удалением лимфатических узлов (лимфодиссекцией) в области трахеи. Проведение комбинированной операции позволяет добиться высокой эффективности лечения рака и снизить риск развития рецидивных явлений.
Опытные хирурги Центра используют передовые методики и успешно проводят операции по удалению щитовидной железы в сочетании с лимфодиссекцией.

Хирурги Центра обладают значительным клиническим опытом проведения тиреоидэктомии с лимфодиссекцией и регулярно совершенствуют свои навыки
Применение современного оборудования и малоинвазивных способов хирургического вмешательства повышает эффективность лечения и сокращает период восстановления
Отличный эстетический результат
Послеоперационные шрамы на передней поверхности шеи практически не заметны
- Злокачественные опухоли щитовидной железы
- Выявленные в ходе операции увеличенные или измененные лимфоузлы
Комплексное хирургическое вмешательство по удалению щитовидной железы и лимфоузлов требует тщательного предоперационного обследования. Все диагностические процедуры наши пациенты могут пройти на базе Центра за несколько дней.
Для оценки характера патологии, стадии заболевания необходимо пройти специфические исследования. В Центре подобная программа включает в себя:
- консультации эндокринолога и хирурга;
- выполнение УЗИ щитовидной железы;
- исследование крови на гормоны щитовидной железы;
- проведение тонкоигольной биопсии.
Помимо этого в Центре вы можете пройти и стандартную предоперационную подготовку: получить консультации кардиолога, анестезиолога, стоматолога и терапевта, сделать ЭКГ и рентгенографию органов грудной клетки, сдать комплекс анализов крови и мочи (общий, биохимический, на инфекции, группу крови и резус-фактор, свертываемость и др.).
Данные полного обследования пациента позволяют нам спланировать операцию, подобрать анестезию и препараты для нее, определить объем хирургического вмешательства, оценить общее состояние организма, выявить противопоказания к тиреоидэктомии.


Техника проведения операции
В нашем Центре операцию по удалению щитовидной железы и лимфоузлов в области трахеи проводят с использованием комбинированного эндотрахеального наркоза. В ходе подготовки к операции опытные анестезиологи подбирают оптимальные препараты и их дозировку, а во время хирургического вмешательства контролируют жизненно-важные показатели организма пациента.
Суть тиреоидэктомии с лимфодиссекцией – в удалении тканей щитовидной железы вместе с капсулой и лимфатическими узлами, расположенными возле трахеи. Операция проводится традиционным – открытым доступом, при котором хирург выполняет на передней поверхности шеи разрез длиной не более 4 см. В первую очередь врач удаляет щитовидную железу вместе с капсулой, а затем приступает к лимфодиссекции. Удаление лимфоузлов производится слева и справа по ходу возвратно-гортанных нервов, то есть удаляют клетчатку, расположенную между щитовидной и вилочковой железой. Операция завершается наложением шва с использованием саморассасывающихся нитей.
Тиреоидэктомия с лимфодиссекцией – технически сложная операция, требующая от хирурга виртуозного мастерства. Наши врачи – настоящие профессионалы, в совершенстве владеющие современными методиками лечения патологий щитовидной железы. Одно из преимуществ проведения тиреоидэктомии в Центре – использование хирургами бинокулярным луп, в 3 раза увеличивающих изображение операционного поля. Это позволяет избежать повреждений возвратно-гортанных нервов и сохранить пациенту голос, а также радикально удалить лимфоузлы на шее, чтобы не допустить развития метастазов.
Кроме того, мы используем ультразвуковой скальпель Harmonic Focus, который моментально останавливает кровотечение из мелких и крупных сосудов. Это позволяет избежать послеоперационного неконтролируемого течения лимфы и развития серьезных осложнений: медиастенита, послеоперационной серомы, нагноения послеоперационной раны.


Не нашли ответ на свой вопрос?
Оставьте заявку и наши специалисты
проконсультируют Вас.
Благодаря применению современных методик лечения существенно сокращается реабилитационный период даже после таких сложных операций, как тиреоидэктомия с лимфодиссекцией. После удаления щитовидной железы и лимфоузлов вы проведете в стационаре Центра 1–2 дня под наблюдением медперсонала, а через 2 недели сможете вернуться к полноценной жизни. В первые несколько дней после операции возможны несильные боли в области шеи, охриплость или осиплость голоса. В большинстве случаев эти симптомы проходят самостоятельно и без последствий.
В зависимости от диагноза врач (онкологический консилиум СМ-Клиники определит дальнейшую тактику лечения) дату контрольной сдачи анализов на гормоны щитовидной железы (обычно через месяц после операции). При необходимости может быть проведено УЗИ щитовидной железы и другие обследования.
Почему именно мы?
Высокая квалификация и опыт врачей
Хирурги Центра — высококвалифицированные специалисты, имеющие значительный опыт работы в России и за рубежом.
Крупный хирургический центр
В Центре хирургии – 10 операционных и более 80 оперирующих специалистов по всем направлениям современной хирургии.
Современные малотравматичные методики
Выполняются эндоскопические и лапароскопические операции через мини-проколы, а также радиоволновая бескровная хирургия.
Специалисты Центра разрабатывают тактику хирургического лечения и программу реабилитации для каждого пациента.
Каждый пациент находится под наблюдением лечащего врача и медицинских специалистов до самой выписки. Стационар оснащен палатами интенсивной терапии.
Круглосуточный комфортабельный стационар
Круглосуточное медицинское наблюдение, высокая квалификация врачей и медицинских сестер, комфортабельные палаты, индивидуальное меню.
Комплексное лечение с использованием современных возможностей восстановительной медицины значительно сокращает процесс реабилитации.
Транспортировка пациента из любых регионов
Собственная Служба скорой помощи обеспечивает медицинскую транспортировку и госпитализацию пациентов в наш стационар из любых городов и регионов.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Актуальность. Клиническое течение папиллярного рака щитовидной железы характеризуется частым метаста-зированием в регионарные лимфатические узлы, к которым относятся лимфоузлы центральной клетчатки шеи и глубокие яремные лимфоузлы. Выявление метастатического поражения паратрахеальных лимфоузлов при высокодифференцированном раке щитовидной железы с первичной опухолью, соответствующей T1-2, сопровождается высокой частотой ложноотрицательных результатов. Выполнение повторных оперативных вмешательств на этой зоне является технически сложным и сопровождается определенным числом осложнений. Таким образом, профилактическое удаление клетчатки центральной зоны предотвращает локальный рецидив и дальнейшее метастатическое распространение в регионарные лимфатические узлы, а также помогает правильно стадировать процесс и, следовательно, сформировать тактику дальнейшего лечения пациента.
Цель работы. Определение оптимального объема хирургического вмешательства при папиллярном раке щитовидной железы.
Материалы и методы. В исследование включено 60 больных, прооперированных по поводу папиллярного рака щитовидной железы. Набор клинического материала осуществлялся на базе ГБУЗ МКНЦ им. А.С. Логинова ДЗМ с 2015 по 2017 гг.
Результаты. Регионарные метастазы в лимфатических узлах центральной клетчатки шеи после выполнения профилактической центральной шейной лимфодиссекции выявлены в 41,5% случаев. При динамическом наблюдении в сроки до 18 месяцев ни у одного пациента не отмечалось рецидива в виде регионарных и отдаленных метастазов.
Выводы. Клиническое течение папиллярного рака щитовидной железы характеризуется высоким индексом регионарного метастазирования в лимфатические узлы центральной клетчатки шеи, что диктует необходимость выполнения вместе с тиреоидэктомией центральной ипсилатеральной лимфодиссекции, не увеличивающей частоту послеоперационных осложнений.
Михаил А. Кропотов - доктор медицинских наук, ведущий научный сотрудник отделения опухолей головы и шеи
Евгений А. Гривачев - студент
Лилия П. Яковлева - кандидат медицинских наук, заведующая отделением опухолей головы и шеи
Артем В. Ходос - врач отделения опухолей головы и шеи
Михаил С. Тигров - аспирант отделения опухолей головы и шеи
1. Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin (2011) 61 (2):61-90. doi:10.3322/caac.20
2. Hundahl SA, Fleming ID, Fremgen AM, Menck HR, et al. A national cancer data base report on 53,856 cases of thyroid carcinoma treated in the U.S. 1985-1995. Cancer (1998) 839 (12):2638-48. doi:10.1002/(SICI)1097-0142(19981215)83:12 3.0.CO;2-1
3. Kitamura Y, Shimizu K, Nagahama M, Sugino K, Ozaki O, Mimura T, et al. Immediate cuases of death in thyroid carcinoma: clinicopathological analysis of 161 fatal cases. J Clin Endocrinol Metab (1999) 84 (11):4043-94. doi:10.1210/jcem.84.11.6115
4. Grebe S.K., Hay I.D. Thyroid cancer nodal metastases: biologic significance and therapeutic considerations. Surg.Oncol.Clin.North Am., 1996, 5, 43-46.
5. Kouvaraki M.A., Shapiro S.E., Fornage B.D., et al. Role of preoperative ulthrasonography in the surgical management of patients with thyroid cancer. Surgery, 2003, 134, 946-954.
7. Bhattacharyya N. Surgical treatment of cervical nodal metastases in patients with papillary thyroid carcinoma. Arch. Otolaryngol. Head Neck Surg. 2003, 129 (10), 1101-1104.
8. Scheumann G.F., Gimm O., Wegener G. et al. Prognostic significance and surgical management of locoregional lymph node metastases in papillary thyroid cancer. World J. Surg. 1994;18 (4):559-567.
9. Mazzaferri EL, Jhiang SM. Long-term impact of initial surgical and medical therapy on papillary and follicular thyroid cancer. Am J Med (1994) 97 (5):418-28. doi:10.1016/0002-9343(94)90321-2
10. Podnos YD, Smith D, Wagman LD, Ellenhorn JD. The implication of lymph node metastasis on survival in patients with well-differentiated thyroid cancer. Am Surg (2005) 71 (9):731-4.
11. Zaydfudim V, Feurer ID, Griffin MR, Phay JE. The impact of lymph node involvement on survival in patients with papillary and follicular thyroid carcinoma. Surgery (2008) 144 (6):1070-7. doi:10.1016/j.surg.2008.08.034
12. Mazzaferri EL. A vision for the surgical management of papillary thyroid carcinoma: extensive lymph node compartmental dissections and selective use of radioiodine. J Clin Endocrinol Metab (2009) 94 (4):1086-8. doi:10.1210/jc.2009-0298
13. Zaydfudim V., Feurer I.D., Griffin M.R. et al. The impact of lymph node involvement on survival in patient with papillary and follicular thyroid carcinoma. Surgery, 2008, 144, 1070-1077.
14. Popadich A, Levin O, Lee JC, Smooke-Praw S, Ro K, Fazel M, et al. A multicenter cohort study of total thyroidectomy and routine central lymph node dissection for cN0 papillary thyroid cancer. Surgery (2011) 150:1048-57. doi:10.1016/j.surg.2011.09.003
15. So YK, Seo MY, Son YI. Prophylactic central lymph node dissection for clinically node-negative papillary thyroid microcarcinoma: influence on serum thyroglobulin level, recurrence rate, and postoperative complications. Surgery (2012) 151:192-8. doi:10.1016/j.surg.2011.02.004
16. Sywak M, Cornford L, Roach P, Stalberg P, Sidhu S, Delbridge L. Routine ipsilateral level VI lymphadenectomy reduces postoperative thyroglobulin levels in papillary thyroid cancer. Surgery (2006) 140 (6):1000-5. doi:10.1016/j.surg.2006.08.001
17. Shan CX, Zhang W, Jiang DZ, Zheng XM, Liu S, Qiu M. Routine central neck dissection in differentiated thyroid carcinoma: a systematic review and meta-analysis. Laryngoscope (2012) 122 (4):797-804. doi:10.1002/lary.22162
18. Roh JL, Kim JM, Park CL. Central compartment reoperation for recurrent / persistent differentiated thyroid cancer: patterns of recurrence, morbidity, and prediction of postoperative hypocalcemia. Ann Surg Oncol (2011) 18 (5):1312-8. doi:10.1245/s10434-010-1470-9.
19. Coatesworth AP, MacLennan K. Cervical metastasis in papillary carcinoma of the thyroid: a histopathological study. Int J Clin Pract (2002) 56:241-2.
20. Ducci M, Appetecchia M, Marzetti M. Neck dissection for surgical treatment of lymph node metastasis in papillary thyroid carcinoma. J Exp Clin Cancer Res (1997) 16:333-5.
21. Lee YS, Shin SC, Lim YS, Lee JC, Wang SG, Son SM, et al. Tumor location-dependent skip lateral cervical lymph node metastasis in papillary thyroid cancer. Head Neck (2014) 36 (6):887-91. doi:10.1002/hed.23391
22. Chisholm EJ, Kulinskaya E, Tollery NS. Systematic review and meta-analysis of the adverse effects of thyroidectomy combined with central neck dissection as compared with thyroidectomy alone. Laryngoscope (2009) 119 (6):1135-9. doi:10.1002/lary.20236
23. Cooper DS, Doherty GM, Haugen BR, Kloos RT, Lee SL, Mandel SJ, et al. American Thyroid Association (ATA) guidelines taskforce on thyroid nodules and differentiated thyroid cancer: revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid (2009) 19 (11):1167—214. doi:10.1089/thy.2009.0110
24. Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association Guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid (2016) 261:1-133. doi:10.1089/thy.2015.0020
25. Caronia LM, Phay JE, Shah MH. Role of BRAF in thyroid oncogenesis. Clin Cancer Res (2011) 17 (24):7511-7. doi:10.1158/1078-0432.CCR-11-1155
26. Kim SJ, Lee KE, Myong JP, Park JH, Jeon YK, Min HS, et al. BRAFV600E mutation is associated with tumor aggressiveness in papillary thyroid cancer. World J Surg (2012) 36:310-7. doi:10.1007/s00268-011-1383-1.
27. Tufano RP, Bishop J, Wu G. Reoperative central compartment dissection for patients with recurrent/ persistent papillary thyroid cancer: efficacy, safety, and association of the BRAF mutation. Laryngoscope (2012) 122:1634-40. doi:10.1002/lary.23371
28. Xing M, Tufano RP, Tufaro AP, Basaria S, Ewertz M, Rosenbaum E, et al. Detection of BRAF mutation on fine needle aspiration biopsy specimens: a new diagnostic tool for papillary thyroid cancer. J Clin Endocrinol Metab (2004) 89 (6):2867-72. doi:10.1210/jc.2003-032050
29. Howell GM, Nikiforova MN, Carty SE, Armstrong MJ, Hodak SP, Stang MT, et al. BRAF V600E mutation independently predicts central compartment lymph node metastasis in patients with papillary thyroid cancer. Ann Surg Oncol (2013) 20 (1):47-52.doi:10.1245/s10434-012-2611-0
30. Han PA, Kim HS, Cho S, Fazeli R, Najafian A, Khawaja H, et al. Association of BRAF V600E mutation and microRNA expression with central lymph node metastases in papillary thyroid cancer: a prospective study from four endocrine surgery centers. Thyroid (2016) 26 (4):532-42. doi:10.1089/thy.2015.0378
31. Kim SK, Woo JW, Lee JH, Park I, Choe JH, Kim JH, et al. Role of BRAF V600E mutation as an indicator of the extent of thyroidectomy and lymph node dissection in conventional papillary thyroid carcinoma. Surgery (2015) 158 (6):1500—11. doi:10.1016/j.surg.2015.05.016
32. Xing M, Liu R, Liu X, Murugan AK, Zhu G, Zeiger MA, et al. BRAF V600E and TERT promoter mutations cooperatively identify the most aggressive papillary thyroid cancer with highest recurrence. J Clin Oncol (2014) 32 (25):2718-26. doi:10.1200/JC0.2014.55.5094
33. Ywata de Carvalho, A., Chulam, T.C., and Kowalski, L.P. Long-term results of observation vs prophylactic selective level VI neck dissection for papillary thyroid carcinoma at a cancer center. JAMA Otolaryngol Head Neck Surg. — 2015.-pp 141: 599-606
34. Ma, B., Wang, Y., Yang, S., and Ji, Q. Predictive factors for central lymph node metastasis in patients with cN0 papillary thyroid carcinoma: a systematic review and meta-analysis Int J Surg.2016.-pp 289: 153-161

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Наиболее предпочтительным лечением больных с операбельной опухолью и признаками метастатического поражения регионарных лимфатических узлов шеи является полное иссечение опухоли в сочетании с одно- или двусторонним удалением шейных лимфатических узлов вместе с жировой клетчаткой (шейная лимфодиссекция) с последующей лучевой терапией. В качестве альтернативы проводят лучевую терапию в качестве самостоятельного метода лечения или в сочетании с химиотерапией.
Хирургическое иссечение лимфатических сосудов, в которые дренируется лимфа из пораженной зоны, играет основополагающую роль при опухолях головы и шеи. Отсутствие клинических признаков поражения регионарных лимфатических узлов, расцениваемое как NO, является исключением, так как пока нет единого мнения о том, надо ли выполнять в таких случаях лимфодиссекцию.
Если последнюю при NO предполагается все же выполнить, следует учесть целый ряд параметров, характеризующих опухоль (гистологический тип, локализацию, степень распространения) и больного (возраст, общее состояние, приверженность лечению). Необходимо продолжить обследование больного, чтобы решить, придерживаться ли активно-выжидательной тактики, тщательно наблюдая больного, или выполнить плановую лимфодиссекцию, учитывая, что примерно у 30% больных имеются скрытые метастазы в регионарных лимфатических узлах.
Суть шейной лимфодиссекции состоит в одно- или двустороннем методичном иссечении жировой клетчатки с находящимися в ней лимфатическими узлами в пространстве между поверхностной и глубокой шейной фасцией. С целью более полного удаления скрытых метастазов можно иссечь и ряд других анатомических образований и тканей.
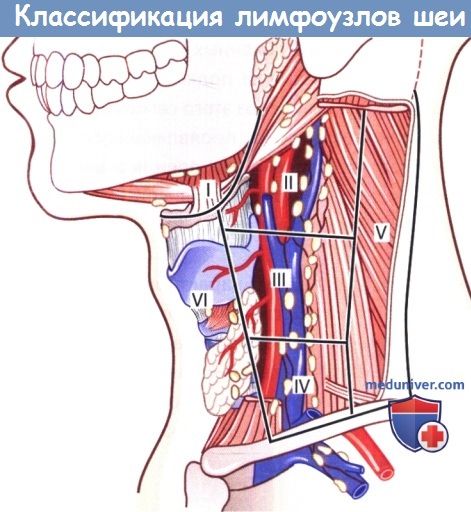
Классификация лимфатических узлов шеи.
Общее пространство шеи с расположенными в нем лимфатическими узлами делят на 6 пространств, или отделов.
Поверхностной границей этих пространств служит поверхностная шейная фасция, расположенная под подкожной мышцей шеи (m. platysma).
Глубокая плоскость соответствует предпозвоночной и висцеральной фасциям.
I - подбородочная и поднижнечелюстная группа; II - верхняя яремная группа; III -средняя яремная группа;
IV -нижняя яремная группа; V - группа заднего треугольника шеи; VI -группа переднего ложа. 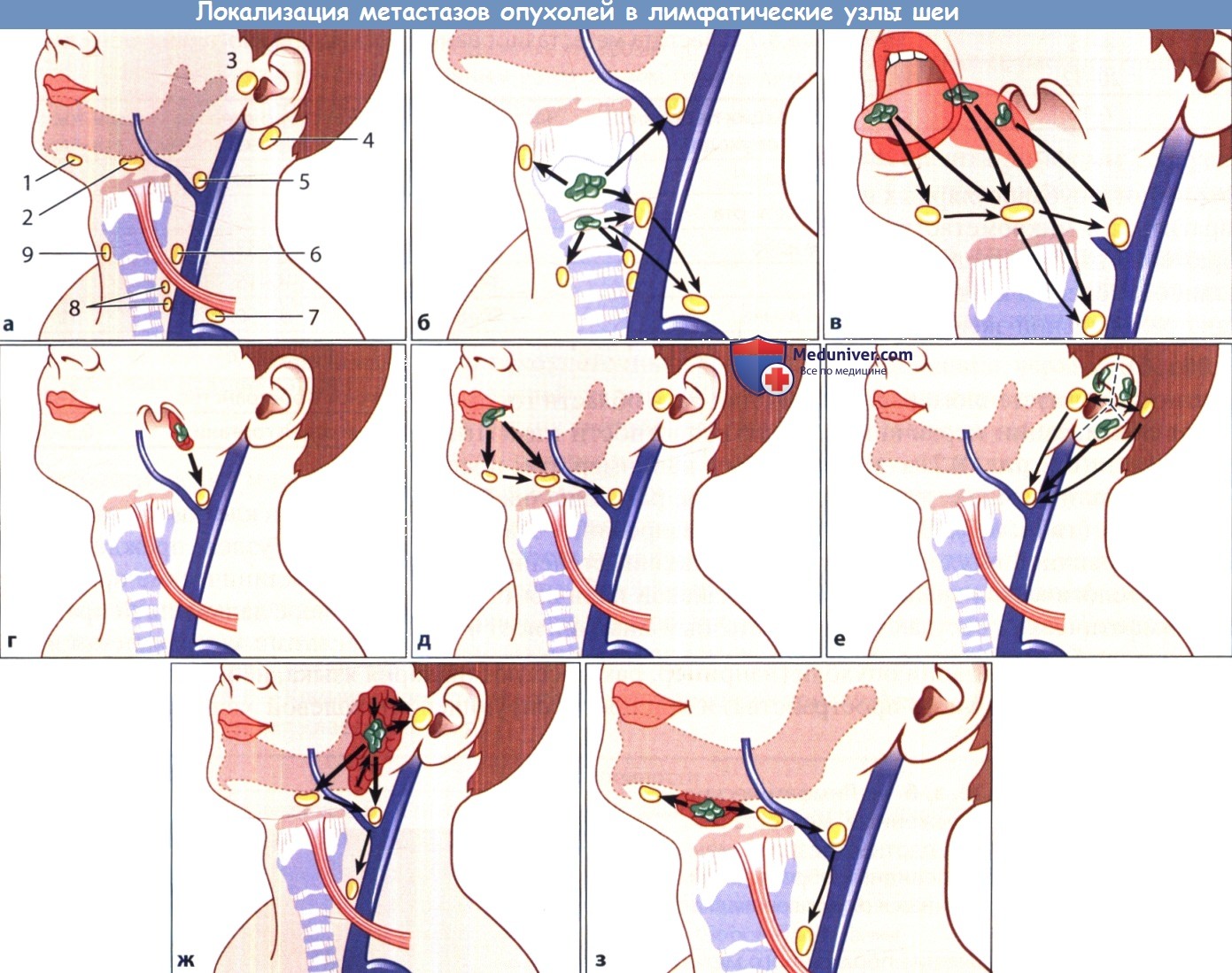
а Типичная локализация пораженных метастазами лимфатических узлов шеи.
1 - подподбородочные лимфатические узлы; 2 - подчелюстные лимфатические узлы; 3 - околоушные и предушные лимфатические узлы;
4 - позадиушные лимфатические узлы; 5 - лимфатические узлы яремно-лицевого венозного угла; 6 - глубокие шейные лимфатические узлы;
7 - лимфатические узлы области яремно-ключичного угла: нижние глубокие шейные и надключичные лимфатические узлы; 8 - претрахеальные и перитрахеальные лимфатические узлы; 9 - предгортанные лимфатические узлы.
б Рак гортани. в Рак языка различной локализации. г Рак нёбной миндалины.
д Рак нижней губы. е Рак наружного уха. Обратите внимание на сегментарный тип дренирования лимфы.
ж Рак околоушной железы (следует помнить о метастатическом поражении внутрижелезистых лимфатических узлов). з Рак подчелюстной железы.
Для выработки единой терминологии Комиссия по хирургии головы и шеи Американской академии оториноларингологии и хирургии головы и шеи (AAO-HNS, American Academy of Otolaryngology - Head and Neck Surgery) в 1991 г. опубликовала классификацию вариантов лимфодиссекции, которая была недавно (2008 г.) доработана. Согласно этой классификации различают следующие варианты:
• Радикальная шейная лимфодиссекция: стандартная классическая операция, направленная на удаление лимфатических узлов шеи на уровне I-V от основания черепа до уровня ключицы. Для обеспечения должной радикальности операции одновременно иссекают также грудино-ключичнососцевидную мышцу, резецируют внутреннюю яремную вену, добавочный нерв и поднижнечелюстную железу.
• Расширенная радикальная шейная лимфодиссекция: в дополнение к описанной выше операции удаляют также лимфатические узлы VI уровня и нелимфоидные образования, такие как сонная артерия, подъязычный и блуждающий нервы.
• Модифицированная радикальная шейная лимфодиссекция: этот вариант лимфодиссекции, описанный когда-то как функциональный, состоит в удалении лимфатических узлов I-V уровней и сохранении одного или более нелимфоидного образования, в частности добавочного нерва и внутренней яремной вены. Хотя сохранение нелимфоидных образований шеи при выполнении радикальной лимфодиссекции происходит в ущерб онкологической целесообразности, оно, тем не менее, существенно снижает частоту осложнений после операции.

В зависимости от локализации первичной опухоли в объем иссекаемой ткани включают лишь лимфатические узлы, в которых могут оказаться скрытые метастазы, что позволяет снизить частоту осложнений, связанных с операцией.
В классификации также отмечено, что при всех вариантах шейной лимфодиссекции иссечение лимфатических узлов I уровня подразумевает также удаление поднижнечелюстной железы.
P.S. Предпосылкой для выполнения шейной лимфодиссекции являются резектабельность первичной опухоли и отсутствие отдаленных метастазов. Важно собрать анамнез и выполнить полное клиническое обследование, выбрать оптимальный вид хирургического вмешательства и обеспечить эффективное обезболивание.
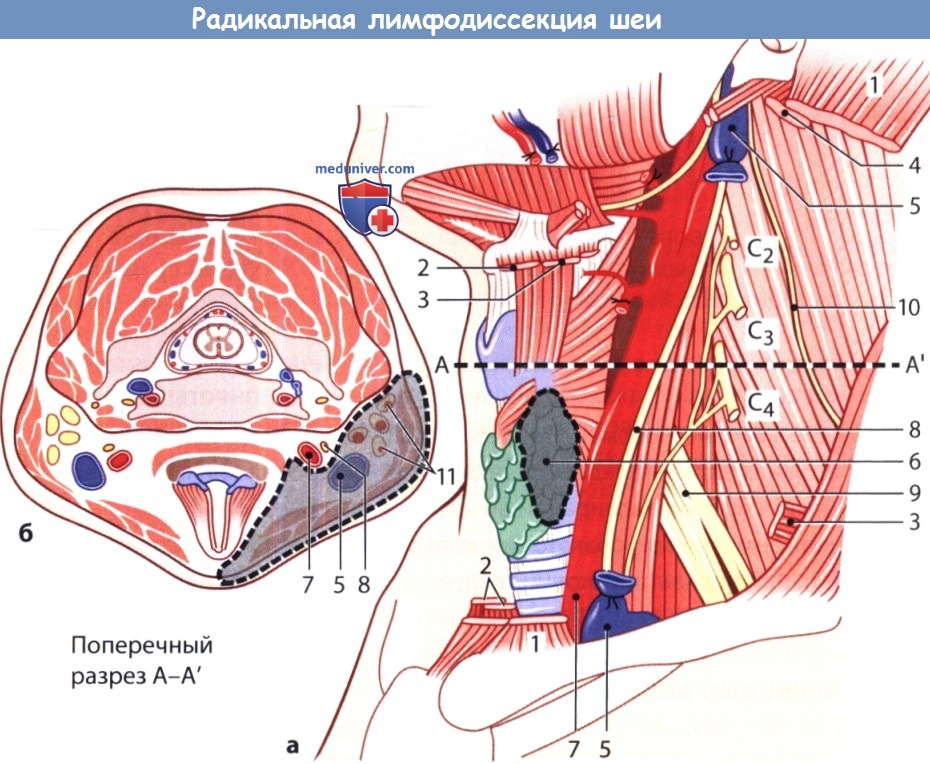
Схематическое изображение операционного поля после радикальной лимфодиссекции шеи.
а Вид после удаления ряда структур, таких как: 1 - грудино-ключично-сосцевидная мышца; 2 - подъязычные мышцы; 3 - лопаточно-подъязычная мышца (рассечена);
4 - двубрюшная и шилоподъязычная мышцы (рассечены); 5 - культя внутренней яремной вены; 6 - резекция щитовидной железы.
Оставлены: 7 - сонная артерия (иногда, в зависимости от распространенности опухолевого процесса, внутреннюю сонную артерию приходится резецировать);
8 - блуждающий нерв; 9 - плечевое сплетение; 10 - добавочный нерв (его следует сохранить, если соответствующая ему цепочка лимфатических узлов не поражена метастазами).
б Поперечный разрез шеи на уровне А-А'. Резецированные ткани между глубоким и поверхностным листками фасции закрашены серым цветом.
11 - метастазы в шейные лимфатические узлы. Корешки С2-С4.
Прогноз. В целом, подтвержденные гистологическим исследованием метастазы в регионарных лимфатических узлах ухудшают прогноз. При поражении лимфатических узлов метастазами прогноз зависит от того,
• какая группа лимфатических узлов поражена. Наличие метастазов в задней группе лимфатических узлов, в надключичных, заглоточных и затылочных лимфатических узлах связано с менее благоприятным прогнозом;
• сколько лимфатических узлов поражено метастазами: поражение более двух лимфатических узлов отягощает прогноз;
• в каком состоянии находится капсула лимфатических узлов. Выход опухоли за пределы капсулы лимфатического узла - один из наиболее важных прогностических факторов. Прорастание опухолью капсулы лимфатического узла повышает риск отдаленных метастазов в 3 раза (примерно на 20%).
Изобретение относится к области медицины, а именно к хирургии, онкологии и может быть использовано для хирургического лечения больных раком щитовидной железы (ЩЖ) с метастазами в лимфатические узлы шеи.
Рак ЩЖ является наиболее распространенной эндокринной злокачественной опухолью по данным ВОЗ (http://globocan.iarc.fr, 2014).
Особенное анатомическое расположение ЩЖ, скопление жизненно важных структур в этой области, наличие развитой лимфатической и кровеносной системы, значительное разнообразие форм опухоли и особенности ее метастазирования обуславливают значительные трудности как при обследовании, так и при лечении больных с данной патологией. Это в полной мере касается и хирургического способа лечения, который является основным у большинства пациентов.
Оперативное вмешательство на ЩЖ и лимфатическом коллекторе шеи, несмотря на кажущуюся простоту и многовековую историю существования, все еще является одним из самих сложных в хирургии.
В нашей стране большой вклад в совершенствование хирургических подходов к лечению рака ЩЖ внесли А.И. Пачес, Р.М. Пропп, Г.В. Фалилеев, Е.Г. Матякин, С.Б. Пинский, И.В. Решетов, А.Ф. Романчишен, B.О. Ольшанский, Б.М. Втюрин, В.Г. Поляков. Благодаря совершенствованию техники оперативного вмешательства за последние 30 лет произошел большой прогресс в эволюции подходов к хирургическому лечению рака ЩЖ.
История хирургии рака ЩЖ дает основание констатировать эволюцию взглядов, касающихся не только объема хирургического вмешательства, но и профилактики повреждений околощитовидных желез, гортанных (верхнего и возвратного) и добавочного нервов. Техника выполнения и рекомендуемые объемы регионарных лимфодиссекций также претерпели значительные изменения в связи с появлением строгого разделения лимфатического коллектора шеи на уровни (I-VI) (Robbins K.Т. ct al, 1991), разработкой методики футлярно-фасциального иссечения клетчатки шеи и уделению пристального внимания сохранению важных анатомо-физиологических структур (Пачес А.И., Пропп Р.М. Рак щитовидной железы. - М.: ЦВДНТ, 1995. - 134 с.; Пачес А.И. Опухоли головы и шеи. - М.: Медицина, 2013. - 480 с.).
Несмотря на существенные успехи в хирургии при злокачественных опухолях ЩЖ на сегодняшний день частота осложнений может достигать 52%. Среди них можно выделить специфические: повреждение нервов (верхнего гортанного 0,4-3,7%, возвратного гортанного - 5-9%, добавочного - 4-11%, плечевого сплетения - 0,5-1,4%), травматизация околощитовидных желез (51,9%). Кроме того, важными являются местные осложнения: кровотечение - 1,2-4%; расхождение краев раны - 1-11%, нагноение раны - 0,3-0,8%, развитие серогематом - 0-6%, лимфорея - 1-2.5% (Хрыщанович В.Я., Третьяк С.И., 2010; Gourin CG, Johnson JT, 2003; Oertli D., Udelsman R., 2007; Akin M., Kurukahvecioglu O., 2009; Giordano D., Valcavi R., 2012; Dongbin A., Jin H.S., 2013).
Частота рецидивов при раке ЩЖ, по опубликованным данным, составляет 15-30% при дифференцированных и 60-80% - при недифференцированных карциномах (Валдина Е.А. 2001, Барчук А.С. 2007; Shen W.Т., Ogawa L. 2010; Tannouria S., Goldenbergb D., 2012). Это диктует необходимость выполнения радикальных оперативных вмешательств с точным достижением оптимального объема операции. Вышесказанное также указывает на неоднозначность методики оперирования на ЩЖ и неполноценность некоторых технических приемов, необходимых для профилактики возможных осложнений.
Известен способ фациального-футлярного иссечения лимфатических узлов и клетчатки шеи у больных раком ЩЖ с метастазами в лимфатические узлы шеи (Савенок Э.В. RU 2241381, 10.12.2004). В качестве доступа применяется разрез кожи по Вагнеру. Сущность метода: операция начинается с выделения и удаления шейной клетчатки с лимфатическими узлами. Пересечение грудино-ключично-сосцевидной мышцы над ключицей и разведение ее концов в стороны на держалках позволяет облегчить выделение и удаление клетчатки и лимфатических узлов бокового треугольника шеи. Далее операция на ЩЖ производится по экстрафасциальной методике. Объем вмешательства зависит от распространенности опухолевого процесса.
Существенные недостатки данного способа следующие: автор при раке ЩЖ с метастазами в лимфатические узлы бокового треугольника шеи предлагает выполнять органосохраняющую операцию: гемитиреоидэктомию или субтотальную резекцию ЩЖ, что ставит под сомнение радикальность вмешательства. Способ не предусматривает визуализацию и сохранение околощитовидных желез, верхнего гортанного нерва и поверхностных ветвей шейного сплетения, не описана методика визуализации и сохранения возвратного гортанного нерва. В результате этого в послеоперационном периоде могут быть следующие осложнения: стойкий гипопаратиреоз, парезы и параличи гортани, нарушение чувствительности кожи шеи. Пересечение грудино-ключично-сосцевидной мышцы влечет за собой развитие в ней рубцовых процессов и, следовательно, нарушение ее функции.
Также известен способ хирургического доступа для удаления клетчатки и лимфатических узлов шеи (Клочихин А.Л. RU 2318455, 2006 г.), при котором производят линейный разрез в косом направлении от верхушки сосцевидного отростка по заднему краю кивательной мышцы в верхней ее трети с переходом на передний ее край в средней трети, и далее книзу до места прикрепления к грудине. При этом одномоментно рассекают кожу, подкожно-жировую клетчатку, подкожную мышцу и фасциальный футляр кивательной мышцы. Далее края раны отсепаровывают в медиальном и латеральном направлениях, формируя медиальный кожно-подкожно-платизмальный лоскут и латеральный кожно-подкожно-платизмальный с включением в лоскут кивательной мышцы. Затем производится удаление клетчатки с лимфоузлами бокового треугольника шеи с резекцией нижнего полюса околоушной и подчелюстной слюнной железы.
Несмотря на хорошие функциональные и косметические результаты данного способа, авторами не указана возможность выполнения тиреоидэктомии с центральной лимфодиссекцией при данном варианте доступа.
Данный способ наряду с явными достоинствами (онкологический подход, абластичность операции, полное удаление ЩЖ с клетчаткой шеи) имеет существенные недостатки: в данной методике не акцентируется внимание на очередность и способы выделения возвратного гортанного нерва и перевязки сосудов, имеющие важное значение для абластичности вмешательства и сохранения целостности указанного нерва; метод не подразумевает профилактику гипопаратиреоза, поскольку околощитовидные железы и питающие их сосудистые структуры не идентифицируются; широкий доступ, пересечение мышц и не полностью послойное закрытие раны обуславливает ограниченный косметический эффект с последующим дискомфортом и нарушением качества жизни.
Задачей изобретения является создание высокоэффективного способа операции для применения его при раке ЩЖ с метастазами в лимфатических узлах шеи с целью улучшения качества жизни пациентов за счет уменьшения количества интра- и постоперационных осложнений, снижения вероятности рецидива злокачественного процесса и улучшения функциональных и косметических результатов операции.
Данный технический результат достигается следующим образом.
Под эндотрахеальным наркозом с положением больного на спине производят нанесение красителем границ будущего разреза, причем авторами впервые использован оригинальный уменьшенный разрез длиной 10-11 см (фиг. 1), который начинается с точки, расположенной на расстоянии 4 см от сосцевидного отростка. Вертикальная часть проходит вдоль латерального края грудино-ключично-сосцевидной мышцы, на расстоянии 2-3 см от грудино-ключичного сочленения, плавно изгибается и переходит в горизонтальную часть, продолжается параллельно кожным складкам и заканчивается на точке, расположенной на расстоянии 3 см от яремной вырезки заходя за среднюю линию шеи на 1 см. Послойно на всем протяжении разреза рассекаются кожа, подкожно-жировая клетчатка, первая фасция, подкожная мышца шеи, вторая фасция, передние яремные вены. Затем кожу вместе с подкожной мышцей отсепаровывают на протяжении. Границами отсепарованного кожно-жирового-платизмального лоскута служат: снизу - ключица, яремная вырезка грудины, ножки грудино-ключично-сосцевидных мышц, сверху - нижний край нижней челюсти до сосцевидного отростка, медиально-противоположный внутренний край грудино-ключично-сосцевидной мышцы, латерально-передний край трапециевидной мышцы. Далее грудино-ключично-сосцевидная мышца, грудино-щитовидные, грудино-подъязычные мышцы, выделяются из фасциальных футляров и мобилизуются максимально на протяжении для обеспечения достаточной подвижности. Затем производят полное экстафасциальное удаление щитовидной железы с использованием прецизионной техники, современного медицинского оборудования и, в ряде случаев, увеличительных приборов.
Для уменьшения кровоточивости и профилактики распространения опухолевых клеток все манипуляции на ЩЖ начинают после перевязки и последующего пересечения тиреоидных сосудов. В стандартных случаях освобождают сначала верхний, затем нижний полюс и заднебоковые поверхности ЩЖ. При выделении верхнего полюса, для профилактики повреждения верхнего гортанного нерва все сосудистые элементы после их идентификации на глаз перевязывают, коагулируют и только потом пересекают у тиреоидной капсулы с обнажением переднебоковой поверхности гортани (фиг. 2). При этом особенное внимание уделяют полноценному удалению пирамидальной доли.
После верхнего переходят на мобилизацию нижнего полюса ЩЖ с раздельной перевязкой и пересечением основных стволов и ветвей нижних щитовидных сосудов у тиреоидной капсулы с сохранением нижних околощитовидных желез и питающих их артерий (фиг. 3).
Мобилизацию заднебоковой поверхности доли осуществляют с раздельным лигированием сосудистых коллатералей с визуализацией верхней околощитовидной железы и возвратного гортанного нерва (фиг. 4). Особенно сложным и важным моментом является выделение последнего у входа его в гортань, в области связки Берри. Именно здесь чаще есть опасность повреждения данной анатомической структуры и оставления тиреоидной ткани. ЩЖ удаляют полностью. Отдельное внимание уделяют возможным разрастаниям, загрудинному расположению и эктопии тиреоидной ткани.
На сложных этапах операции, которые чаще соответствуют выделению гортанных нервов и околощитовидных желез, при необходимости используют бинокулярные лупы.
При высоком расположении верхнего полюса ЩЖ или наличии рецидивного процесса применяют методику нейрофизиологической идентификации верхних и возвратных гортанных нервов.
Затем удаляют яремные лимфоузлы (фиг. 6.) и лимфоузлы бокового треугольника шеи с клетчаткой (фиг. 7), при этом отсепарованный кожно-жировой-платизмальный лоскут и мобилизированные на протяжении мышцы шеи позволяют адекватно выполнить ревизию и лимфодиссекцию с сохранением внутренней яремной вены, добавочного нерва, плечевого сплетения и поверхностных ветвей шейного сплетения.
При закрытии раны валик из-под шеи удаляют. Рану дренируют 3 микроирригаторами и строго послойно зашивают. Мобилизованные грудино-щитовидные и грудино-подъязычные мышцы сшивают в продольном направлении для прикрытия трахеи и ограничения последней от подкожной клетчатки. Закрытие сосудисто-нервного пучка производят путем сшивания медиального края грудино-ключично-сосцевидной мышцы с латеральным краем грудино-щитовидной и грудино-подъязычной мышц. Поверхностную мышцу и подкожную клетчатку отдельно ушивают. На кожу накладывают внутрикожный шов. Для дополнительного сопоставления краев раны применяют кожный клей.
Все приспособления для дренирования удаляют на 2-3-е сутки после операции. Кожные швы снимают на 5-е сутки. В результате через 6 месяцев после операции формируется рубец, который характеризуется хорошим косметическим эффектом (фиг. 8).
Фигура 1 иллюстрирует кожный разрез.
Фигура 2 отображает этап визуализации верхнего гортанного нерва.
Фигура 3 - идентификация и сохранение нижней околощитовидной железы.
Фигура 4 - визуализация верхней околощитовидной железы и возвратного гортанного нерва.
Фигура 5 - фотодинамическая идентификация околощитовидной железы.
Фигура 6 - этап яремной лимфодиссекции.
Фигура 7 - этап боковой лимфодиссекции.
Фигура 8 - внешний вид послеоперационного рубца спустя 6 месяцев после операции.
Все выше изложенные моменты предлагаемого универсального способа позволяют улучшить результаты хирургического лечения больных раком ЩЖ с метастазами в лимфатических узлах шеи, а именно:
За счет длины разреза 10-11 см и использования внутрикожного шва значительно улучшается косметический результат операции, что особенно важно, так как рубец располагается на видимой части шеи и основная категория пациентов - женщины.
Функциональный результат операции достигается за счет мобилизации грудино-щитовидной, грудино-подъязычной, грудино-ключично-сосцевидной и лопаточно-подъязычной мышц на протяжении. Это позволяет удалять ЩЖ и клетчатку шеи с лимфатическими узлами без пересечения мышц, в результате чего не нарушается функция последних и значительно снижается травматизация тканей.
Профилактика послеоперационного гипопаратиреоза достигается за счет учета анатомических и топографо-анатомических особенностей околощитовидных желез, а именно: околощитовидные железы обычно имеют диаметр в 4-6 мм и встречаются чаще всего парами у нижних полюсов и заднебоковых поверхностей ЩЖ. Эпителиальные тельца имеют четкую капсулу и питающие их сосудистые веточки. Цвет околощитовидных желез коричневый, но в зависимости от возраста и жировой инфильтрации могут иметь и желтоватый оттенок. Учет анатомических особенностей в большинстве случаев позволяет определить их местоположение на этапе мобилизации нижних полюсов и заднебоковых поверхностей щитовидной железы, и большей доли вероятности идентифицировать их от окружающих тканей.
С целью снижения частоты повреждения гортанных и добавочного нервов, повреждения околощитовидных желез, и достижения необходимого объема операции использовалась определенная этапность вмешательства, прецизионная техника и увеличительные приборы. Все это позволяют при сложных анатомических особенностях, интимном контакте удаляемой ткани с органами и структурами шеи, осуществлять бережную диссекцию при минимальной травматизацей тканей под четким зрительным контролем.
С целью профилактики повреждения гортанных нервов при рецидивном процессе проводится обязательная идентификация и прецизионное выделение верхнего и возвратного гортанного нервов на протяжении с помощью микрохирургического инструментария и использования нейромиографа.
Для сохранения возвратного гортанного нерва использовали методику электрофизиологической идентификации. В этом случае, на интубационную трубку устанавливали электроды, которые при интубации соприкасались с голосовыми складками. Второй электрод использовали для дифференциации тяжистых структур в ране. При контакте данного электрода с исследуемым образованием, в случае наличия возвратного гортанного нерва получали сокращение иннервируемых им голосовых мышц, и разность потенциалов регистрировали и звуковым и графическим способом.
Визуализация или выделение околощитовидных желез и сохранение верхнего и возвратного гортанного нервов позволяют в большинстве случаев предотвратить развитие временного, постоянного гипопаратиреоза, пареза и паралича гортани.
Кроме того, в данной методике проводится контроль объема оперативного вмешательства для соблюдения правильной тактики лечения больных.
Предлагаемый способ использован при лечении 70 больных (добровольцах) раком ЩЖ с метастазами в лимфатические узлы шеи: 60 женщин и 10 мужчин в возрасте от 30 до 73 лет. Сроки наблюдения за пациентами составили от 1 мес до 5 лет. В послеоперационном периоде в результате наших хирургических вмешательств были зафиксированы 2 (2,8%) осложнения. В 1 (1,4%) случае парез гортани на фоне повреждения верхнего гортанного нерва развился у больной с тиреоидной карциномой, у которой верхний полюс был интимно связан с перстне-щитовидной мышцей. В другом наблюдении у больной, в результате выделения возвратного гортанного нерва, было отмечено ограничение подвижности одной голосовой связки с голосовым дефектом. Подвижность восстановилась через 1,5-2 месяца после операции. У 10 (14,2%) пациентов в послеоперационном периоде было отмечено незначительное снижение уровня кальция. Изменения купировались до выписки. Однако у 2 (2,8%) пациентов явления гипопаратиреоза сохранялись в течение 1 месяца. Рецидивов опухоли выявлено не было. Применение способа позволило улучшить результаты хирургического лечения больных раком ЩЖ с метастазами в лимфатических узлах шеи с улучшением функциональных и косметических результатов операции, в результате чего повысилось качество жизни пациентов после вмешательства.
Больная О., 58 лет. Диагноз: рак щитовидной железы T2N1bM0, метастазы в лимфатических узлах бокового треугольника шеи слева.
Анамнез заболевания: считает себя больной в течение 1 месяца, когда впервые отметила появление опухолевидного образования в надключичной области слева. При ультразвуковом исследовании шеи в левой надключичной области выявлен размерами до 2 см лимфатический узел с признаками нарушения дифференцировки. В левой доле щитовидной железы обнаружено гипоэхогенное узловое образование размерами до 3 см с нечеткими контурами. При тонкоигольной аспирационной пункции ЩЖ и лимфатического уза получена цитологическая картина папиллярного рака. При дообследовании данных за поражение гортани, пищевода, магистральных сосудов и органов грудной клетки не выявлено. Направлена в ГКБ им. С.П. Боткина для оперативного лечения.
При гистологическом исследовании: папиллярный рак ЩЖ без признаков прорастания капсулы железы. В клетчатке центральной зоны обнаружено 8 лимфатических узлов с метастазами карциномы, в яремной клетчатке и клетчатки бокового треугольника шеи обнаружено 28 лимфатических узлах, из них 6 с метастазами папиллярной карциномы.
При контрольном осмотре через 2 месяца деформации шеи и западения тканей не выявлено, движения головы в полном объеме, рана зажила первичным натяжением с хорошим косметическим эффектом, уровень кальция крови в норме, нарушения фонации и дыхания не выявлены. При обследовании через 5 лет, признаков рецидива опухолевого процесса не выявлено.
Читайте также:

