Болезнетворные возбудители и раковые клетки
Немедленно исключи их из своего рациона!
На сегодняшний день рак — одно из самых страшных заболеваний в мире. Ежегодно число онкобольных людей становится всё больше и больше, что не может не настораживать. Возникают раковые опухоли из-за ряда причин: наследственность, гормональные факторы, биологические факторы, химические и физические канцерогены.
Помимо этих причин, вероятность возникновения онкологических заболеваний в немалой степени зависит и от того, что мы едим. Онкологи составили список продуктов, содержащих в себе химические канцерогены, при употреблении которых значительно повышается риск появления рака и злокачественных опухолей.
Для профилактики возникновения рака исключите из рациона эти продукты:
- Алкоголь
![]()
Всемирная организация здравоохранения (ВОЗ) назвала алкоголь второй после курения причиной возникновения рака. Чаще всего у людей, которые злоупотребляют спиртными напитками, появляются раковые опухоли органов пищеварительной системы: кишечника, гортани, печени, ротовой полости и горла.
Главный канцероген в алкоголе — этанол. Он в процессе переработки организмом превращается в альдегид уксусной кислоты, который повреждает клетки и делает их более склонными к злокачественным изменениям.
Соль
Человек, употребляющий чрезмерное количество соли, подвергает себя опасности накопления хлора в организме, что приводит к возникновению онкологических заболеваний.
Регулярное употребление соленых продуктов удваивает риск заболевания раком желудка, причем такая тенденция наиболее явно прослеживается у мужчин.
Колбасные изделия
Колбасы, особенно копченые, содержат пищевую добавку — нитрит натрия (E250), которая провоцирует развитие раковых заболеваний.
Нитрит натрия — это популярная пищевая добавка, которую используют в качестве пищевого красителя и консерванта в мясных продуктах. Ученые утверждают, что у людей, употребляющих колбасные изделия, в составе которых есть это вещество, чаще развивается рак кишечника.
Сладкая газировка
Научно доказано, что употребление двух стаканов сладкой газированной воды в неделю увеличивает риск развития рака поджелудочной железы в два раза. А всё потому, что такой напиток содержит многочисленные канцерогены, ароматизаторы и сахарозаменители.
Фастфуд
Плохие новости для любителей фастфуда… Согласно иследованиям ученых, люди, регулярно употребляющие продукты быстрого питания, имеют повышенные шансы на развитие не только проблем с пищеварением, также они более подвержены ожирению, сахарному диабету, раку молочной железы.
Чтобы не заболеть раком, ученые призывают отказаться от вредных привычек, питаться правильно, вести активный образ жизни и не поддаваться унынию. Если статья оказалась для вас полезной, поделитесь ею с друзьями. Будьте здоровы!
В кишечнике человека обитает штамм стрептококка Streptococcus gallolyticus, который целенаправленно вызывает рак прямой кишки. К такому выводу пришли американские биологи. О своем чудовищном открытии они рассказали на страницах медицинского журнала PLOS Pathogens.

Фото: GLOBAL LOOK press/ Jim West
О том, что данный штамм - далеко не подарок, было известно и ранее. Ученые знали, что этот микроб ассоциируется с повышенной вероятностью заполучить рак прямой или толстой кишки. Однако в результате наблюдений и экспериментов выяснилось, что развитие онкологического заболевания - это не побочный эффект жизнедеятельности микроорганизма, а его главная цель. Streptococcus gallolyticus играет ключевую роль в развитии рака.
Перед биологом И Сюй (Yi Xu) и его коллег из университета A&M в Техасе стояла задача определить, участвуют ли патогенные обитатели микрофлоры кишечника в развитии рака или же они просто предпочитают жить внутри опухолей. Для наблюдений ученые использовали микробов и культуры клеток кишечника, выращенных в пробирке и извлеченных из опухолей пациентов.
Выяснилось, что совместное выращивание кишечных клеток и колоний Streptococcus gallolyticus действительно ускоряет рост опухоли и заставляет здоровые клетки превращаться в раковые "заготовки".
Впрочем, для разрастания опухоли необходимо выполнение трех условий. Во-первых, бактерии должны непосредственно соприкасаться со стенками кишечника. Во-вторых, они могут начать свою подрывную деятельность, лишь находясь в определенной фазе роста. В-третьих, микробы вызывают рак не во всех без исключения клетках прямой кишки, а лишь в тех, которые выделяют определенное количество одного из ферментов в окружающую среду.
Когда ученые проанализировали содержимое нескольких сотен опухолей, удаленных из кишечника пациентов, они обнаружили, что практически во всех из них присутствовали колонии Streptococcus gallolyticus. Это окончательно подтвердило, что данные микробы действительно замешаны в развитии рака прямой кишки и что борьба с ними может помочь пациентам или замедлить развитие опухоли, или избежать ее появления.
Точка в исследовании, однако, еще не поставлена. "Есть еще много чего, что мы должны понять. К примеру, мы пока не знаем, необходимо ли постоянное присутствие микроба для распространения рака или же даже временное заражение кишечника Streptococcus gallolyticus приведет к подобным последствиям", - заявил И Сюй.
Прорывом в изучении онкологических заболеваний в последние годы стало открытие взаимосвязи между наличием определенных видов микробов и развитием рака в организме человека, других животных или в тканях растений. Так, бактерии Heliobacter pylori и Streptococcus gallolyticus обнаружили практически во всех опухолях прямой кишки и желудка человека. На корнях растений часто появляются опухоли благодаря их заражению микробами Agrobacterium tumefaciens и десятком других бактерий.
1. РАЗНОСЧИК ПАПИЛЛОМ
Что делать:
Хорошая новость: предраковое состояние, вызванное ВПЧ, сейчас успешно лечится. Поэтому главная задача — вовремя обнаружить такие изменения. Для этого применяются специальные медицинские тесты, в частности, женщинам рекомендуется регулярно делать так называемый ПАП-тест (исследование мазка с поверхности шейки матки). Он входит в бесплатную диспансеризацию по полису ОМС, делается раз в 3 года, но при наличии ВПЧ №16 и №18 врач-гинеколог, как правило, назначает более частый график обследования (так же бесплатно по полису ОМС).
2. ОХОТНИК ЗА ПЕЧЕНЬЮ
Еще одна группа вредителей, способных вызвать рак — вирусы гепатитов В и С. Заразиться ими можно при незащищенных половых контактах, а также, например, при пирсинге или маникюре, если косметологические салоны игнорируют правила санобработки инструментов. У больных гепатитом В при отсутствии лечения в 10 – 20% случаев развивается цирроз печени, который примерно у 10% пациентов переходит в рак. Гепатит С, если его не лечить, приводит к раку печени у 25%, то есть у каждого четвертого (по данным Европейской ассоциации по изучению печени, EASL).
Что делать:
Имейте в виду, что от гепатита В существует вакцина, которая гарантирует защиту печени от опасного вируса. В нашей стране с 1996 г. она включена в Национальный календарь профилактических прививок (НКПП), делается бесплатно всем малышам, а также вакцинироваться могут взрослые в возрасте до 55 лет, не привитые от гепатита В ранее.
3. УБИЙЦА ИММУНИТЕТА
- Наша иммунная система играет большую роль в распознавании, атаке и уничтожении новообразованных раковых клеток. Если человек заражается ВИЧ , то иммунитет, подорванный вирусом, может позволить новым раковым клеткам выжить достаточно долго, чтобы вырасти в серьезную, опасную для жизни опухоль, - поясняет онколог Дмитрий Олькин. Известно, что ВИЧ-инфекция связана с повышенным риском развития рака шейки матки, саркомы Капоши , а также рядом гематологических онкозаболеваний.
Что делать:
4. ОПАСНЫЙ ГЕРПЕС
HHV-8 передается, как и остальные виды герпеса — при половых контактах, через слюну при поцелуях, при пользовании общей посудой. Инфекция живет в организме человека всю жизнь, но у большинства людей все-таки обходится без развития рака, радует наш эксперт. Однако если иммунитет сильно ослаблен — подорван ВИЧ или после пересадки органов, то риск возникновения саркомы Капоши резко повышается.
Что делать:
Стараться соблюдать правила гигиены: не пить из одного стакана, избегать незащищенных половых контактов с партнерами, чье состояние здоровья вам не известно. При ослаблении иммунитета (при ВИЧ, после трансплантации) строго соблюдать рекомендации врача.
5. ВИРУС ЭПШТЕЙНА-БАРР
Эта инфекция повышает риск развития рака носоглотки, некоторых видов лимфом, а также рака желудка. Онкозаболевания, спровоцированные вирусом Эпштейн - Барра (ЭБВ), чаще встречаются в Африке и Юго-Восточной Азии , уточняет Дмитрий Олькин. К счастью, немногие люди с ЭБВ заболевают раком.
Что делать:
Пациентам с ЭБВ рекомендуется пролечивать инфекцию в период обострений, а также регулярно проходить диспансеризацию и вовремя лечить обострения любых хронических болезней, не запуская их.
- Если у человека в желудке живет бактерия Helicobacter pylori (H pylori), она может вызвать гастрит и язву желудка. В случае язвы может возникнуть воспаление, повреждающее внутренний слой желудка, и некоторые из таких воспалений ведут к раку, - поясняет эксперт.
Что делать:
7. ХРОНИЧЕСКИЕ ВОСПАЛЕНИЯ
Что делать:
Вовремя лечиться, не запуская воспаления, чтобы они не переходили в хроническую форму.
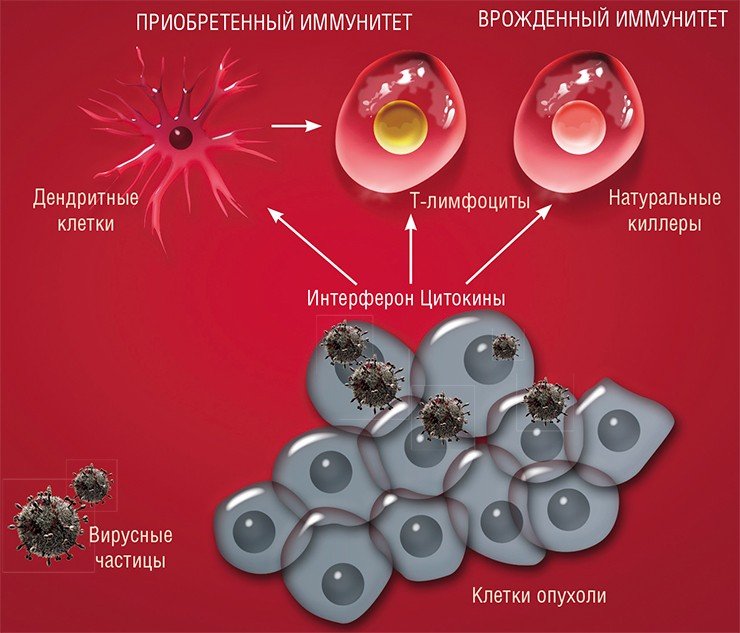
По-видимому, есть вирусы, которые паразитируют на человеке, размножаясь ограниченно в группах клеток и не причиняя видимого вреда своему хозяину. Однако при определенных условиях они могут мутировать с образованием более патогенных вариантов. В этом случае возникает острая вирусная инфекция, которая заканчивается, когда в организме сформируется специфический иммунитет к патогену.
Но несмотря на относительно слабую изученность вирусного сообщества человека, практически сразу после открытия вирусов был обнаружен удивительный факт: у онкобольных вирусная инфекция может повлиять на протекание злокачественного процесса. Были зафиксированы случаи улучшения состояния таких пациентов и даже наступление длительной ремиссии после перенесенного вирусного заболевания либо вакцинации.
На основе этой информации еще в начале XX в. родилась идея использовать вирусы в борьбе с раковыми заболеваниями человека.
Взлеты и падения
Возможность создания принципиально новой формы терапии онкологических заболеваний, основанной на присущей вирусам способности убивать клетки, в которых он размножается, была впервые показана в середине прошлого века на примере рака шейки матки (Newman, 1954).
В результате удалось выделить и типировать ряд непатогенных для людей энтеровирусов, на основе которых были созданы живые энтеровирусные вакцины для профилактики сезонных вирусных заболеваний. При этом в ряде случаев удалось наблюдать положительный клинический эффект и в отношении злокачественных заболеваний, вплоть до полного исчезновения первичной опухоли и метастазов.

В ходе дальнейших исследований вакцинотерапию получили более полутора тысяч больных на поздних стадиях опухолевого процесса, и у части из них было отмечено улучшение состояния (Ворошилова, Ваганова, 1969; Ворошилова и др., 1977; Ворошилова, 1988).
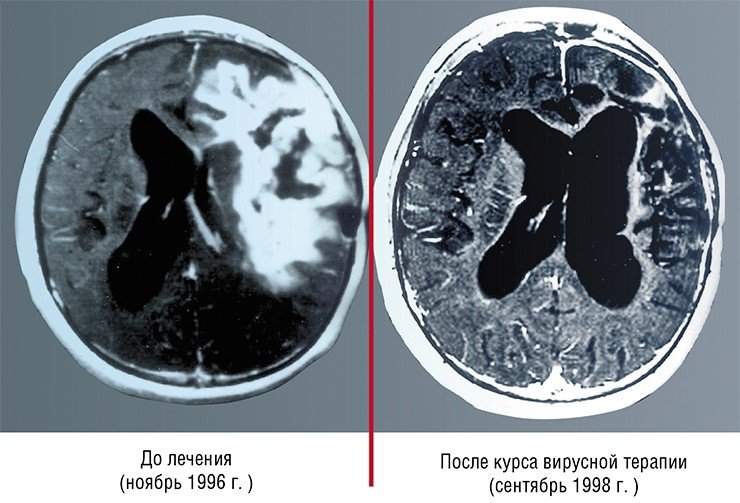
Но уже в начале 1990-х гг. онколитические вирусы вновь стали объектом пристального внимания исследователей после публикации работы, посвященной лечению глиобластомы модифицированным вирусом простого герпеса (Martuza, 1991).
За последующие десятилетия благодаря выдающимся достижениям в молекулярной биологии и генетике и стремительному развитию биотехнологических методов исследования удалось проделать огромную экспериментальную работу по описанию специфических взаимодействий онколитических вирусов с раковымм клетками и выявить перспективные для терапии вирусные штаммы и типы опухолей, которые они могут поражать.
Почему же вирусы – и не какая-нибудь специфическая группа, а все в целом – поражают в первую очередь именно опухолевую ткань? Причин этому несколько.
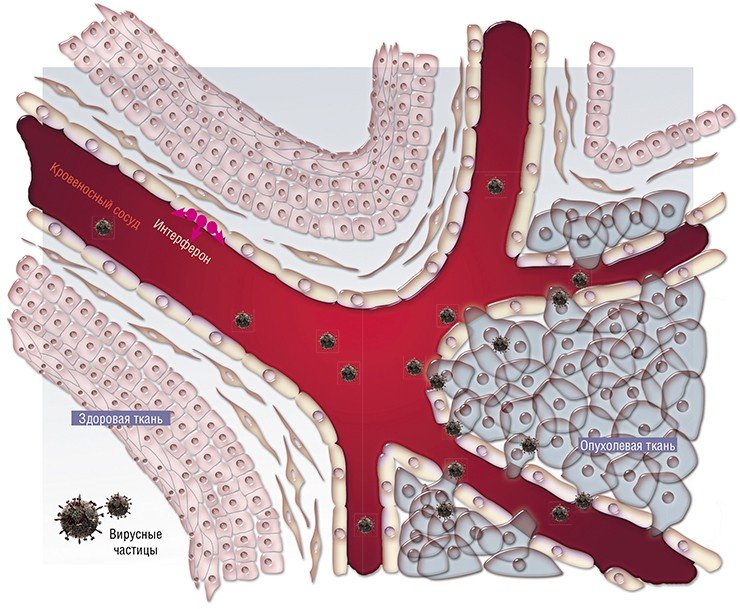
Таким образом, первая причина высокой чувствительности раковых клеток к вирусам – их физическая доступность.
Вторая причина связана со способами размножения самих инфекционных агентов. Дело в том, что вирусы в этом смысле не самодостаточны и используют для размножения ресурсы зараженной клетки. Обычно это происходит тогда, когда клетка сама находится в процессе деления и в ней присутствуют все ферменты, необходимые для репликации генетического материала и синтеза белков.
Некоторые вирусы имеют специальные механизмы, которые позволяют перевести клетку из покоящегося состояния в делящееся (к ним относятся и так называемые онкогенные вирусы, например, вирус папилломы, который вызывает рак шейки матки именно за счет стимуляции клеточного деления). Однако очень многие вирусы могут размножаться только в уже активно делящихся клетках, например, клетках слизистой (которая, как известно, в первую очередь поражается при сезонных вирусных инфекциях). И в этом смысле раковые клетки, главное занятие которых – деление, особенно беззащитны перед вирусной интервенцией.
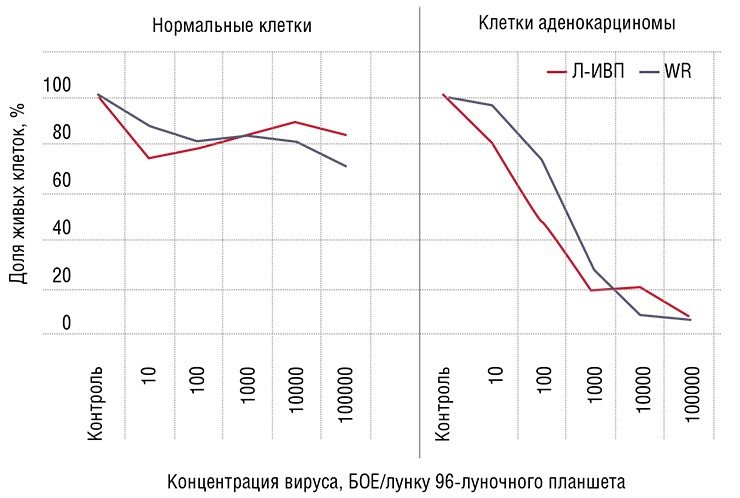
Здоровые – в безопасности
Таким образом, раковые клетки по милости самой природы служат готовой мишенью для вирусов. С использованием современных биотехнологий сегодня можно создавать вирусные препараты, которые будут специфически поражать и уничтожать только раковые клетки, не затрагивая здоровые.
Поэтому мишенью вируса должны стать хаотичные скопища активно делящихся клеток. При этом в первую очередь будут поражаться наименее дифференцированные, наиболее злокачественные клетки. Здоровые же дифференцированные клетки будут защищены от проникновения такого дефектного вируса механизмами противовирусной защиты.
Персональный подход
Для решения этой задачи, в частности, проводится селекция вирусов на их способность размножаться в различных культурах раковых клеток. На основе анализа генетической структуры таких вирусов можно определить, какие из приобретенных вирусом мутаций делают его наиболее действенным в отношении определенного типа опухолевых клеток.
Имея панель таких онколитических вирусов, можно будет, взяв биопсию опухоли от конкретного пациента, подобрать для него наиболее эффективный набор вирусных штаммов. Причем эту процедуру можно повторять по мере лечения, поскольку сама опухоль может меняться, ускользая от действия онковируса. В таком случае сможет помочь уже другой вариант вируса, а так как он будет отличаться по антигенной структуре от предыдущего, то не уничтожится под действием механизмов противовирусного иммунитета, сформировавшегося в ходе предыдущего лечения.
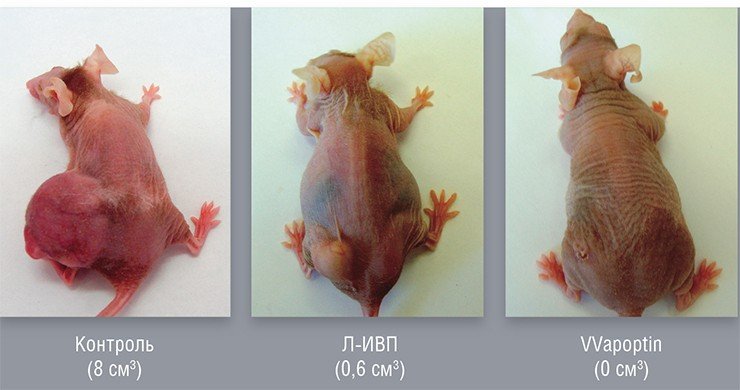
СИБИРСКИЙ КАНЦЕРОЛИЗИН
Онколитические вирусы можно дополнительно вооружить и генами, продуцирующими в раковой клетке белки, опасные лишь для этих клеток. Например, белок апоптин, выделенный из вируса птичьей анемии, по еще не совсем понятному механизму вызывает самоубийство исключительно только раковых клеток. На основе вируса осповакцины генно-инженерным способом уже создан такой штамм, способный эффективно уничтожать клетки опухоли человека, подсаженные лабораторным мышам.
Еще одна проблема терапии с помощью онколитических вирусов связана с разработкой наиболее эффективных способов их введения в организм. Ведь на пути вируса в организме встает много барьеров. К примеру, та же печень, являющаяся своего рода мощнейшим антивирусным фильтром.
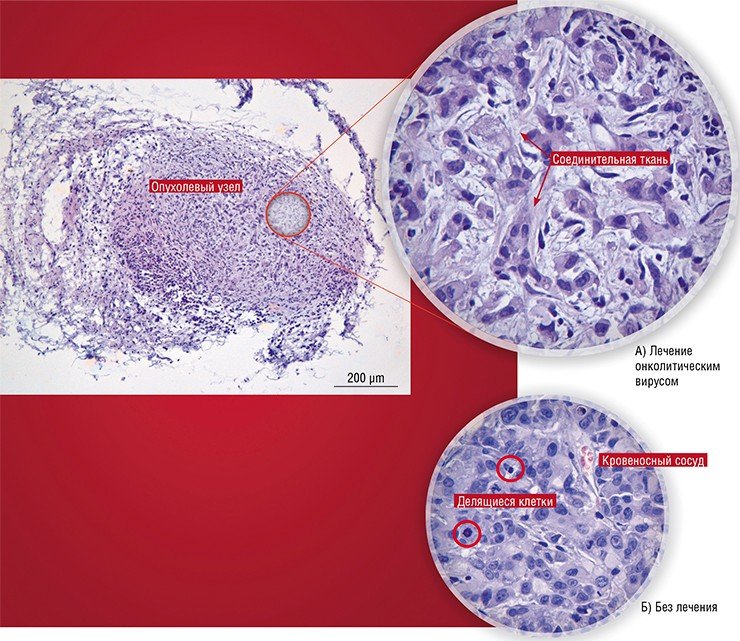
За и против
В настоящее время, несмотря на все успехи в изучении онколитических свойств вирусов, их применение в онкотерапии является, скорее, исключением, чем правилом.
Так, разработанный в США препарат сегодня применяется с согласия пациента при лечении глиобластомы в качестве дополнительной терапии. В Китае лицензирован и успешно применяется для терапии карцином один из штаммов аденовируса, несущий две генетические делеции (Yu, 2007).
В Латвии после распада СССР были продолжены работы по изучению онколитических вирусов, начатые в рамках противополиомиелитных исследований. В результате на основе одного из энтеровирусов был создан и сегодня используется на практике препарат Ригвир, направленный против меланом, который можно вводить непосредственно в кровяное русло.
Всего же сегодня в мире проходят клинические испытания свыше тридцати разнообразных онколитических вирусных препаратов. И основная проблема здесь не столько научная, сколько экономическая. Дело в том, что терапия рака (в первую очередь химиотерапия) – это большие деньги. В условиях сложившегося и процветающего рынка химиотерапевтических препаратов применение новых, пусть даже и более безопасных биотерапевтических средств потребует весьма дорогостоящей перестройки всей системы лечения. А это не может не затронуть интересы крупных фармацевтических компаний.
Стратегия таких компаний в отношении нарождающихся разработок в области онколитических вирусов неоднозначна. Так, права на один из первых онколитических препаратов ONYX-015 вместе с самой компанией-разработчиком были приобретены одной известной фармацевтической фирмой, после чего исследования по этой теме были закрыты. С другой стороны, по¬скольку полностью остановить прогресс в этой области невозможно, уже сегодня во многих фармацевтических компаниях создаются подразделения, занимающиеся изучением вирусных онколитиков. Оптимизма добавляет и тот факт, что за последние пятнадцать лет число работ по этой тематике растет как снежный ком.
Одновременно с прогрессом в создании вирусных противораковых средств в обществе, как и в случае пресловутых генетически модифицированных организмов (ГМО), возникают разнообразные фобии и слухи. Они во многом базируются на недостаточной осведомленности широкой общественности в сути дела и раздуваются благодаря действиям некоторых заинтересованных компаний.
Действительно, вопрос о безвредности тех или иных вирусов пока изучен не до конца. Поэтому приходится мириться с тем, что на пути к широкому внедрению этих очень перспективных методов лечения рака будут вставать многие преграды. В любом случае, исследователи должны действовать очень обдуманно, осторожно взвешивая все возможные последствия.
Но, как учит история науки, подобные проблемы всегда вставали на пути любого нового перспективного метода лечения и, как правило, успешно преодолевались.
Сейчас крепнет уверенность, что знания, накапливающиеся в области вирусологии, иммунологии, биологии клетки и других смежных дисциплин, позволят (и уже позволяют!) создавать такие варианты вирусов, которые будут не только эффективно и избирательно уничтожать раковые клетки, не затрагивая нормальные, но еще и стимулировать в организме естественные механизмы противоопухолевой защиты.
В будущем основой для терапии рака могут стать искусственные вирусы. Уже сейчас дальней целью разработок московских и новосибирских специалистов является создание модульной вирусной системы (в будущем – полностью синтетической) – своего рода молекулярного конструктора, из которого исследователь по желанию сможет собрать из отдельных генетических компонентов нужный вариант онколитического вируса.
Такие синтетические вирусы не должны структурно напоминать природные. Это важно потому, что схожие вирусы способны рекомбинировать друг с другом, обмениваясь участками своего генома, благодаря чему терапевтический вирус может приобрести неполезные гены и, соответственно, нежелательные, опасные свойства. Можно разработать такой синтетический вирус, который по функциям и общему плану строения будет похож на природный, но по нуклеотидной последовательности будет настолько от него отличаться, что утратит способность к рекомбинации со своими природными собратьями.
Ворошилова М. К. Полезные для организма непатогенные штаммы энтеровирусов: профилактическое и лечебное их применение. М.,1988. С. 24–29.
Качко А. В. и др. Рекомбинантная плазмидная ДНК pAd5 f, несущая фрагмент генома аденовируса 5 типа с делецией в гене Е 1 В 55 К, и штамм мутантного аденовируса Adel2, обладающий селективной противоопухолевой активностью. Патент РФ № 2194755 (467) 05.03.01.
Качко А. В. и др. Варианты аденовируса типа 5 с делениями в ранних генах: способность к селективной репликации в р53 дефектных опухолевых клетках человека // Молекулярная биология. 2003. № 37 (5). С. 868–875.
Martuza R. L.et al. Experimental therapy of human glioma by means of a genetically engineered virus mutant//Science. 1991. V. 252. P. 854–856.
Первый за Уралом
Победители первого конкурса научных мегагрантов Правительства РФ, направленных на поддержку исследований под руководством ведущих ученых в российских вузах, были названы в октябре 2010 г. Всего на конкурс подавалось 507 заявок, которые были рассмотрены международными экспертами и утверждены Советом по грантам. Победители, среди которых оказался и Новосибирский национальный исследовательский государственный университет, получили финансирование в размере 150 млн рублей
Новосибирский национальный исследовательский государственный университет (НГУ) получил в 2010 г. три мегагранта правительства РФ, один из которых под руководством д.б.н., профессора П. М. Чумакова, предназначался для создания университетской лаборатории по исследованию онколитических вирусов.

В 2010—2012 гг. за счет средств мегагранта и софинансирования в НГУ реконструированы помещения для проведения практических занятий по микробиологии и частично – по аналитической химии. На этой базе был создан исследовательский комплекс из лаборатории микробиологии и вирусологии (руководитель П. М. Чумаков) и лаборатории бионанотехнологий (руководитель – проректор по научной работе НГУ, д.б.н., профессор С. В. Нетесов).
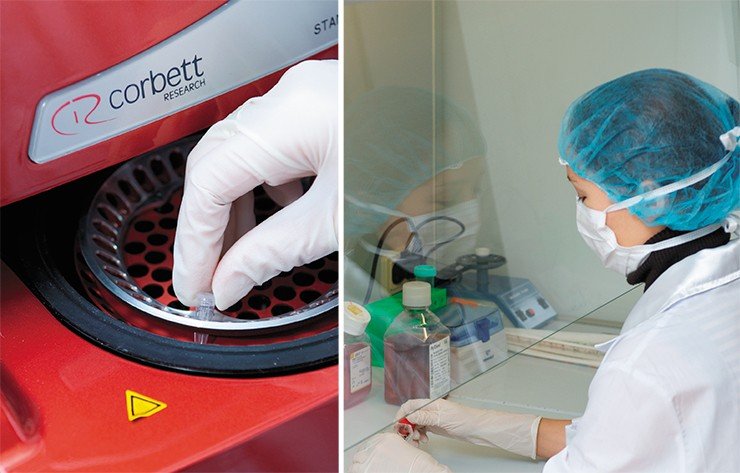
В вирусологическом боксе, оснащенном всем необходимым современным оборудованием для высокопроизводительной работы с непатогенными вирусами и их геномами, могут одновременно проводить исследования три сотрудника. Весной 2013 г. заканчивается реконструкция помещений для генно-инженерных работ, секвенирования геномов, а также биоинформационных и биотехнологических исследований.

В штат лабораторий вошли на долговременной основе несколько специалистов – докторов и кандидатов наук, а также аспиранты и студенты, ориентированные на научные исследования и разработки в самых современных областях микробиологии и молекулярной биологии. Во-первых, это изучение молекулярного разнообразия геномов вирусных возбудителей желудочно-кишечных и респираторных заболеваний человека и животных на территории азиатской части России. Во-вторых – создание онколитических рекомбинантных вирусов, а также бактерий, производящих рекомбинантные биологически активные белки человека, которые на сегодня признаются одними из самых перспективных противораковых препаратов.
Таким образом, принимая во внимание наличие в Научно-образовательном комплексе по наноматериалам и наносистемам НГУ нескольких суперсовременных электронных микроскопов, можно с утверждать, что в университете вступил в строй первый за Уралом современный лабораторный мини-комплекс по изучению микроорганизмов и разработке на их основе новых биомедицинских приложений.
Работы по этой тематике планируется проводить в сотрудничестве с передовыми биотехнологическими компаниями Новосибирской области и всего Сибирского федерального округа, а также, в случае взаимной заинтересованности, и с ведущими зарубежными предприятиями аналогичного профиля.
* Этот уровень биологической безопасности, по зарубежной классификации, используется для работы с возбудителями заболеваний человека, представляющими умеренную опасность для персонала и окружающей среды
Наиболее часто причиной заболевания человека и животных является проникновение в организм болезнетворных возбудителей, а именно: вирусов, микробов, грибков, простейших, гельминтов (паразиты, например, бычий цепень, аскарида), а также перерождение нормальной клетки в раковую.
Для лечения таких заболеваний используют лекарственные препараты, действующие на болезнетворного возбудителя или раковую клетку. В зависимости от того, на какой возбудитель действует лекарственный препарат, различают противомикробные, противопаразитарные, противовирусные, противогрибковые и препараты для лечения злокачественных новообразований. Отметим, что борьба с болезнетворными бактериями это один из наиболее успешных разделов медицинской химии. Впервые идентификация болезнетворных бактерий осуществлена Ван Левенгуком после открытия микроскопа в 1870 году. В середине XIX века были выявлены бактерии ответственные за холеру, тиф, туберкулез.
Использование бактерий в роли бактериологического оружия представляет собой страшную силу, способную не менее эффективно, чем химическое, уничтожать огромную массу людей.
В соответствии с предложенной Грамом систематикой, бактерии делятся на два типа:
- грамположительные, окрашиваемые в синий цвет смесью красителей кристаллического фиолетового с иодом (реактив Грама).
- грамотрицательные, не окрашиваемые реактивом Грама.
Грамотрицательные бактерии более устойчивы к бактерицидным препаратам, чем грамотрицательные, и для борьбы с ними необходим более сильнодействующий препарат.
Противомикробные препараты – это прежде всего сульфаниламиды. Их история начинается с 1935 года, когда впервые были проведены их испытания in vivo (внутри организма).
Сульфаниламиды обладают химиотерапевтической активностью при инфекциях, вызванных грамположительными и грамотрицательными бактериями.
Основной представитель – белый стрептоцид (парааминобензолсульфонамид).
Его водорастворимая форма п‑сульфонамидфениламинометансульфонат натрия.
Белый стрептоцид имеет место быть в организме в результате метаболизма красного стрептоцида.
Но из-за токсичности красный стрептоцид снят с производства.
Механизм действия сульфаниламидов выяснен на уровне ферментов (досконально). Антибактериальная активность стрептоцида связана с ингибированием процесса синтеза дигидрофолиевой кислоты – важного фактора роста микроорганизмов. В этих процессах патогенные для человека бактерии используют в качестве строительного блока природный метаболит – п-аминобензойную кислоту.
Пользуясь структурным сходством с п-аминобензойной кислотой, сульфаниламиды конкурентно включаются в процесс превращения пирофосфата в ложную дигидрофолиевую кислоту. Последняя не способна выполнить свою жизненную функцию и губительна для микроорганизмов. Дигидрофолиевая кислота под действием восстанавливающего фермента превращается в тетрагидрофолиевую кислоту, которая служит переносчиком углеродных фрагментов и играет важную роль в живых организмах как млекопитающих так и бактерий.
Для бактерий процесс синтеза дигидрофолиевой кислоты на основе п-аминобензойной кислоты является очень важным. Бактерии, в отличие от млекопитающих, могут получать этот продукт только в результате синтеза. А, например, люди к синтезу не способны и получают ее с пищей. Отсюда ингибирование этого синтеза приводит к гибели патогенных бактерий, не затрагивая жизненноважных функций организма млекопитающих.
Сульфаниламиды близки по структуре, электронным свойствам и размерам молекулы к п-аминобензойной кислоте. Вмешиваясь в синтез на стадии конденсации п-аминобензойной кислоты с глутаминовой кислотой и пиридиновым основанием сульфаниламиды нарушают синтез тимино- и пуриновых оснований, что ведет к быстрой гибели бактерий, лишенных возможности синтеза собственных ДНК.
Структурные аналоги метаболитов, подавляющие их биологические функции, называются антагонистами или антиметаболитами. Таким образом, антибактериальное действие сульфаниламидов обусловлены тем, что они являются антиметаболитами. Понятно, что многое решают дозы, в которых они используются, так как блокада ферментов является конкурентной и надо применять такие количества лекарственного препарата, которые исключат возможность использования микроорганизмами п-аминобензойной кислоты.
Недостаточные дозы или прерванный курс лечения приведут к выработке штаммов возбудителей резистентных (устойчивых) к сульфаниламидам.
Выявление физиологической активности синтезируемых структурных аналогов сульфаниламидов позволило дать заключение:
Эти особенности выявлены в результате молекулярного дизайна.
Ряд сульфаниламидных препаратов получен за счет модификации сульфамидной группы, при этом имеет место наиболее целенаправленное действие. Так сульфацил натрий (альбуцид) широко применяется для лечения глазных болезней.
Ряд сульфамидных препаратов получен путем введения сульфамидную группу остатков гетероциклических оснований. К таким препаратам можно отнести сульфодиметоксин – лекарство длительного действия, и сульфален – сверхдлительного действия.
Введение дополнительных гетероциклических заместителей позволяет пролонгировать действие лекарственного препарата, улучшить проникновение их в жидкости и ткани организма и тем самым увеличить эффективность их действия.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Читайте также:


