Биохимия канцерогенеза особенности метаболизма злокачественных клеток
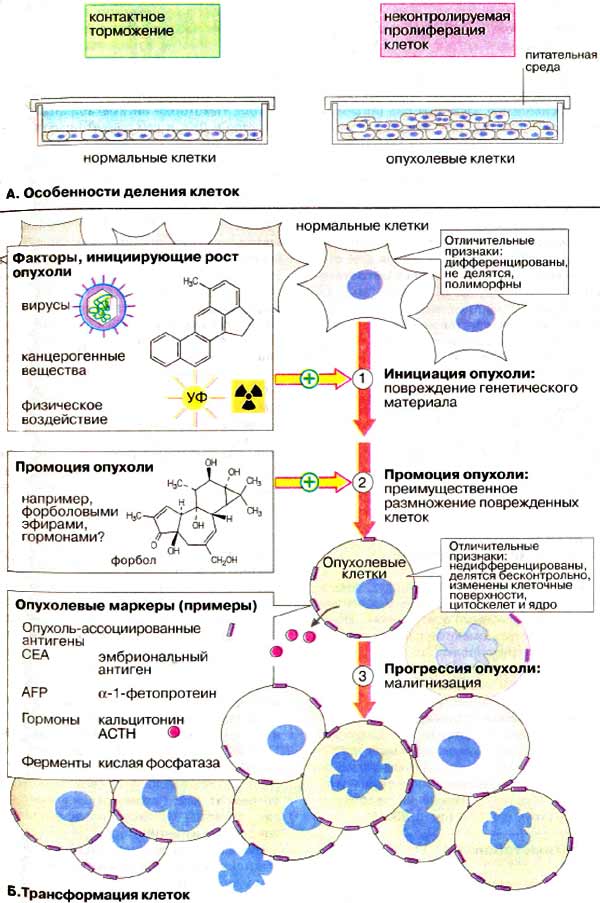
На схеме показано деление клеток в культуре. В то время как нормальные клетки в условиях in vitro делятся до установления контакта с соседними клетками (примерно 20-60 циклов), опухолевые клетки делятся неограниченно долго и не подвержены контактному торможению.
Превращение нормальной клетки в опухолевую носит название трансформация .
В медицине принято различать доброкачественные и злокачественные (малигнизирующие) виды опухолей. Доброкачественные опухоли растут относительно медленно и состоят из дифференцированных клеток. Малигнизирующие опухоли, напротив, демонстрируют способность к быстрому и инвазивному росту и к метастазированию (образованию вторичных опухолей). В соответствии с происхождением опухоли различают примерно 100 различных видов опухолей. В Европе и Северной Америке смертность от онкозаболеваний составляет более 20% от общего числа летальных исходов.
Нормальным клеткам присущи все свойства полностью дифференцированных клеток, выполняющих в организме определенные функции. Они не делятся и обычно находятся в фазе покоя (G 0 -фазе, см. рис. 381). Эти клетки полиморфны и их форма определяется структурированным цитоскелетом.
Напротив, опухолевые клетки часто недифференцированы, по ряду свойств они напоминают эмбриональные клетки и делятся неограниченно; у них изменена клеточная мембрана и они нечувствительны к контактному торможению. Цитоскелет у опухолевых клеток также изменен, часто редуцирован, из-за чего они имеют более или менее округлую форму. Опухолевые клетки могут содержать несколько ядер, не типичных по форме и размерам.
Для клинической идентификации опухолей важно располагать опухолевыми маркерами . Обычно это белки, которые проду цируются опухолевой клеткой (группа 1) или синтезируются другими клетками, взаимо действующими с опухолевыми (группа 2). К опухолевым маркерам группы 1 относятся опухоль-ассоциированные антигены, секре тируемые гормоны и ферменты. В таблице перечислено несколько маркеров этого типа.
Превращение нормальной клетки в трансформированную — процесс многостадийный.
1. Инициация. Почти каждая опухоль на чинается с повреждения ДНК в отдельной клетке. Этот генетический дефект может быть вызван канцерогенами, например канцерогенными веществами (в частности компонентами табачного дыма), физическими факторами (УФ-излучение, рентгеновские лучи, см. рис. 253) или онкогенными вирусами (см. рис. 391). По-видимому, в течение человеческой жизни немалое числи клеток организма из общего их числа 10 14 претерпевает повреждение ДНК. Однако для инициации опухоли важны лишь повреждения протоонкогенов (см. рис. 385). Эти повреждения являются наиболее важным фактором, определяющим трансформацию соматической клетки в опухолевую. К инициации опухоли может привести и повреждение антионкогена (гена-онкосупрессора, см. рис. 385).
2. Промоция опухоли это преимущественное размножение измененных клеток, поврежденных опухоль-инициирующими факторами. Такой процесс может длиться годами. В качестве модельных веществ, инициирующих развитие опухоли, используются форболовые эфиры — вещества растительного происхождения (из растений семейства молочайных), являющиеся активаторами протеинкиназ С (см. рис. 385).
3. Прогрессия опухоли — это процессы размножения малигнизированных клеток, инвазии и метастазирования, ведущие к появлению злокачественной опухоли.
Дифференцированные клетки соблюдают границы ткани и не вторгаются в сопредельные территории, подчиняясь правилу контактного торможения. При трансформации это свойство утрачивается.
Клетки опухолей, как правило, имеют округлую или звёздчатую форму и крупнее, чем нормальные. В них изменено ядерно-цитоплазма-тическое соотношение, имеет место полиплоидия (состояние, при котором ядро содержит 3 и большее число гаплоидных наборов хромосом) или анэуплоидия, когда число хромосом изменяется и становится не кратным гаплоидному набору. Они могут расти, не прикрепляясь к поверхности из-за сниженной способности к адгезии, и образовывать мультислои.
А. Особенности метаболизма
В метаболизме опухолевых клеток обнаруживается ряд характерных особенностей, которые сообщают им существенные преимущества по сравнению с нормальными клетками. Так, в раковых клетках:
- · возрастает активность рибонуклеотидредук-тазы и снижается катаболизм пиримидинов и пуринов, увеличивается синтез ДНК и РНК;
- · повышается скорость гликолиза (как аэробного, так и анаэробного) и увеличивается продукция лактата. Характерная для многих опухолей повышенная секреция лактата получила название "эффект Варбурга". Преимущественный анаэробный гликолиз является, по-видимому, не внутренне присущим опухолевым клеткам свойством, а скорее следствием быстрого роста при слабой обеспеченности сетью кровеносных сосудов. Поскольку установлено, что чем менее дифференцирована опухоль и чем выше скорость её роста, тем интенсивнее протекает в ней анаэробный гликолиз и слабее окислительное фосфорилирование;
- · в изоферментном спектре различных белков и ферментов возрастает содержание фетальных форм. Так, в углеводном обмене это фосфофруктокиназа, не ингибирующаяся АТФ и цитратом, изофермент гексокиназы, характеризующийся чрезвычайно высоким сродством к глюкозе, и очень активная лактатде-гидрогеназа.
Такие изменения обеспечивают раковую клетку чрезвычайно высоким сродством к глюкозе и способностью ассимилировать её даже при очень низких концентрациях в крови. Аналогичные сдвиги в спектре изоферментов наблюдаются и в других обменах. Это позволяет опухолевым клеткам успешно конкурировать с окружающими тканями за жизненно важные метаболиты.
Б. Появление эмбриональных белков и ферментов
Клетки синтезируют, а иногда и секретируют в кровь эмбриональные белки и антигены, такие как б-фетопротеин, карциноэмбриональный антиген и многие другие. В них появляется характерный для эмбриональных тканей высокоактивный фермент теломераза. Как уже указывалось ранее (см. раздел 4), у животных и человека на концах линейных хромосом расположены тысячи высоко консервативных повторов гексадезоксинуклеотидов -TTAGGG, называемых теломерами, которые позволяют концам хромосом прикрепляться к ядерной оболочке и предотвращают их разрушение и рекомбинации. При каждой репликации длина теломер укорачивается примерно на 120 пар оснований. Для делящихся соматических клеток укорочение теломер служит репликометром. После достижения теломерными последовательностями критического размера клетки теряют способность к делению, стареют и подвергаются апоптозу (запрограммированной гибели).
В опухолевых и эмбриональных тканях теломераза достраивает теломеры на 3'-концах ДНК хромосом и после репликации восстанавливает их исходную длину. За счёт работы этого фермента прекращается старение клеток, и они становятся бессмертными.
В. Изменения в структуре плазматических мембран и секреций
Трансформация клеток приводит к изменению состава и структуры олигосахаридных цепей гликопротеинов и гликосфинголипидов плазматической мембраны, а как следствие - к её проницаемости и заряда. В частности, снижается интенсивность синтеза и изменяется структура адгезивных молекул и интегриновых рецепторов (см. раздел 5), входящих в состав мембран опухолевых клеток.
Наблюдается секреция некоторых протеаз, коллагеназ и гликозидаз, которые разрушают коллаген, белки, гликозаминогликаны межклеточного матрикса и способствуют инвазии опухоли в соседние ткани и сосуды. Усиливается синтез факторов ангиогенеза, стимулирующих развитие сосудов, которые должны снабжать раковые клетки питательными веществами.
Г. Роль гормонов и факторов роста в развитие опухолей
Рост и развитие клетки в нормальных и опухолевых линиях начинаются с воздействия на клетку факторов роста (ФР). Взаимодействуя с рецепторами, расположенными на поверхности клеток, или с внутриклеточными рецепторами, они стимулируют в клетке каскад событий, приводящих к активации генов, ответственных за синтез белков, обеспечивающих рост и деление клеток (рис.).

Действие факторов роста на клетку. ФР связываются с рецепторами либо на поверхности мембраны, либо внутри клетки. А - ФР вызывают фосфорилированиё белков либо непосредственно при взаимодействии с рецептором, являющимся тир-ПК-азой (ИФР-1, ИФР-2, инсулин), либо за счёт включения аденилатциклазного или фосфатидилинозитольного каскадов и активации протеинкиназ. Фосфорилированные белки активируют транскрипционные факторы, вызывающие синтез новых мРНК и белков. Б - ФР входит в клетку, в комплексе с внутриклеточным рецептором поступает в ядро, активируя транскрипцию генов, стимулирующих рост клетки, Гены, которые кодируют ФР (I), белки-рецепторы (II), трансдукторы сигналов (III) и транскрипционные факторы (IV), называют протоонкогенами. При изменении структуры I, II, III, IV протоонкогены становятся онкогенами и вызывают аномальный рост: 1 - G-белок; 2 - ферменты, синтезирующие вторичные посредники: аденилатциклаза, фосфолипаза С, гуанилатциклаза
Очевидно, что если гены, кодирующие рецепторы, трансдукторы сигналов и транскрипционные факторы, изменены вследствие мутаций таким образом, что экспрессируются постоянно, то контролируемый рост заменяется неограниченной пролиферацией.
В опухолевых клетках возрастает скорость синтеза и секреции некоторых гормонов и факторов роста. Опухоли приобретают способность к автономному росту за счёт перехода на паракринный или аутокринный механизмы регуляции клеточного роста.
При аутокринном механизме регуляции опухоли синтезируют факторы роста и рецепторы к ним (рФР) или онкобелки, являющиеся аналогами ФР или рФР, которые, взаимодействуя между собой, вызывают аутостимуляцию роста и деления клеток.
Паракринная регуляция предполагает взаимодействие ФР, вырабатываемых одними клетками, с рФР, расположенными на соседних клетках. Так, например, при раке лёгкого клетки стромы вырабатывают инсулиноподобный фактор II, который взаимодействует с рецепторами раковых клеток лёгкого и стимулирует их рост и деление.








ОСОБЕННОСТИ МЕТАБОЛИЗМА ОПУХОЛЕВЫХ КЛЕТОК
Уровень смертности населения от рака занимает второе место после сердечно-сосудистых заболеваний [1]. Известно не менее 100 видов рака, но наиболее частыми органами-мишенями являются: легкие, молочная железа, толстая кишка, предстательная железа и матка. Раковые заболевания данных органов составляют более 50% от всех впервые диагностируемых случаев [3].
По способности к распространению опухоли делятся на две группы: доброкачественные (локальные) - не способные к распространению в близлежащие ткани, и злокачественные, способные пропастрать и метастазировать в другие органы.
Рак – это совокупность генных болезней, основным признаком которых является неконтролируемая клеточная пролиферация.
Общепризнанным фактом является то, что нарушения, ставшие причиной развития опухолей, происходят на уровне ДНК. Трансформация клеток в раковые вызывают структурные изменения в генах, кодирующих белки, которые отвечают за регуляцию роста, деление и гибель клеток.
Как правило, опухолевые клеткиимеют звездчатую или округлую форму, более крупные размеры. Также для раковых клеток характерна полиплоидия или анеуплоидия. В трансформированных клетках слабая способность к адгезии, поэтому клетки способны расти без прикрепления к поверхности.
Опухолевые клетки отличаются от нормальных клеток не только морфологическими особенностями, но и изменениями в метаболизме. Отличительными особенностями метаболизма опухолевых клеток является:
• повышение активности рибонуклеотидредуктазы и снижение катаболизма пиримидинов, а также увеличение синтеза ДНК и РНК;
• увеличение скорости гликолиза и значительное повышение секреции лактата (эффект Варбурга);
• изменение соотношения изоферментного спектра фосфофруктокиназы, не ингибирующейся АТР и цитратом, изофермента III гексокиназы, характеризующегося очень высоким сродством к глюкозе, и лактатдегидрогеназа, обладающая очень высокой активностью. В результате чего опухолевая клетка приобретает повышенное высокое сродство к глюкозе и может ассимилировать ее при крайне низких концентрациях в крови. Подобные сдвиги спектра изоферментов наблюдаются и в других видах обмена. Данные процессы обеспечивают раковым клеткам преимущество в борьбе за жизненно важные метаболиты с окружающими клетками;
• появление новых эмбриональных белков и антигенов, таких, как α-фетопротеин, карциноэмбриональный антиген и т.д.;
• изменение состава и структуры олигосахаридных цепей: гликопротеинов и гликосфинголипидов цитоплазматической мембраны, в результате чего изменяется ее заряд и проницаемость;
• секреция некоторых металлопротеаз, коллагеназ, обеспечивающих проникновение опухоли в близлежащие ткани и сосуды, факторы ангиогенеза, вызывающие развитие кровеносных сосудов, которые должны обеспечивать опухолевые клетки питательными веществами.
• увеличение скорости синтеза и секреции гормонов, а также некоторых факторов роста (например, секреция тканью рака легкого адренокортикотропного гормона, инсулина и глюкагона). Для опухолей становится возможным автономный рост;
• появление высокоактивного фермента теломераза, а также альтернативных путей удлинения теломер. У человека на концах линейных хромосом расположены десятки тысяч повторов гексадезоксинуклеотидов (теломеры), которые обеспечивают прикрепление хромосом к кариолемме, и предупреждают их деградацию и рекомбинации [2].
Исходя из вышесказанного можно сделать вывод о том, что особенности метаболизма, способность к автономному росту, а также существование эффективного механизма удлинения обеспечивают опухолевым клеткам преимущество в росте и размножении.
По мере своего развития в организме человека и прогрессирования, опухоль оказывает постоянное воздействие на обмен веществ и вызывает изменение гомеостаза, что может стать причиной гибели организма.
На ранних стадиях роста опухоли недостаточное обеспечение тканей кислородом. Анемизация становится причиной увеличения расхода глюкозы и активации фосфоролиза гликогена в печени, а также стимуляции глюконеогенеза, мобилизации ТАГ и синтез кетоновых тел. Повышенное содержание липидов в крови повышает вязкость крови и способствует развитию большего дефицита кислорода. Помимо дефицита кислорода в организме больного развивается и недостаток витаминов С и Е, которые являются антиоксидантами и снижают явления перекисного окисления липидов. Прогрессирование опухоли сопровождается нарастанием количества продуктов ПОЛ, что вызывает повреждение структуры мембран [2].
Помимо гипоксии и самоподкисления опухоли нарушается и функционирование эндокринной системы. Возникает резистентность к инсулину и реактивной гиперинсулинемии, гиперпродукции адренокортикотропного гормона, пролактина, тиреотропина и глюкокортикоидов.
Глюкокортикоиды, стимулирующие глюконеогенез из тканевых белков, оказывают негативное влияние на клетки иммунной системы, вызывая их разрушение по механизму апоптоза, что вызывает состояние стойкой иммуносупрессии. В период максимального роста опухоли в тимоцитах и Т-лимфоцитах селезенки ингибируется синтез ДНК на уровне синтеза предшественников – дезоксирибонуклеозидтрифосфатов. В центре неоплазмы часто возникают участки некроза, продукты которого всасываются в кровь и разносятся по организму, вызывая повышение температуры тела и другие проявления общей интоксикации.
Таким образом, изучение процессов канцерогенеза и изменений метаболизма, вызванных этими процессами является ключевым моментом не только для понимания происхождения опухолей, но и для разработки новых и эффективных методов лечения онкологических заболеваний.
Список литературы
Коган, А.Х. Патофизиология опухолей: (Введ. в общую теорию канцерогенеза): Учеб. пособие/ А. Х. Коган//Моск. мед. акад. им. И. М. Сеченова. - М.: ММА, 1991. - 55 с.
Худолей В.В. Канцерогены: характеристики, закономерности, механизмы действия/ В.В. Худолей// Исследования по генетике. – 1999. - №12. – С.67-85.
ВВЕДЕНИЕ В ПРОБЛЕМЫ БИОХИМИИ ОПУХОЛЕВОГО РОСТА.
Опухоли представляют собой группу генных болезней, характеризующихся неконтролируемой клеточной пролиферацией. По способности к распространению в организме их делят на:
- доброкачественные (не обладающие способностью прорастать в соседние ткани);
- злокачественные, способные к разрастанию (инвазии) в определенных тканях и перемещению в другие части тела, давая начало вторичным опухолям (метастазам).
Опухоли классифицируют также в зависимости от тканей и типов клеток, из которых они возникли:
Карциномы – опухоли из клеток эктодермы и эндодермы;
Саркомы – из клеток мезодермы;
Гемобластозы (лейкозы и лимфомы) – из камбиальной клетки кроветворной и лимфатической ткани.
Описано более 100 различных видов рака, хотя 6 из них дают более 60% от всех диагностируемых случаев заболевания. Это рак легкого (на первом месте сейчас находится), рак желудка, молочной железы, толстой и прямой кишки, простаты, матки и яичников. Опухолевые заболевания – вторая по значимости причина смертности в мире после сердечно-сосудистой патологии. Раку подвержены все возрастные категории людей, однако частота многих видов опухолей повышается с возрастом, поэтому, чем старше человек, тем больше вероятность для него умереть от рака. Онкологические заболевания – тяжелейший недуг, борьба с которым – задача современного общества.
Причины, вызывающие развитие опухолей, можно разделить на три обширные группы: а) радиационная энергия, Б) химические соединения и В) вирусы.
А) Мутагенное и канцерогенное действие оказывают ультрафиолетовые лучи, рентгеновские лучи и γ-излучение. Во всех случаях наблюдается повреждение ДНК. Ультрафиолет вызывает образование пиримидиновых (тиминовых) димеров. Результатом облучения могут быть разрывы одной или двух цепей ДНК и другие повреждения. Помимо прямого влияния на ДНК, излучения вызывают образование в тканях активных форм свободных радикалов, которые взаимодействуют с ДНК и другими макромолекулами, повреждая генетический аппарат и матричный синтез в клетке.
Б) Канцерогенным действием обладает огромное количество различных по химическому строению веществ. Контакт с такими соединениями может быть связан с профессиональной деятельностью человека (бензол, асбест), особенностями питания (достоверно выявлено, что риск рака толстой кишки, молочной железы, простаты, повышен у людей с высоким потреблением животных жиров и мяса), образом жизни (курение табака - является одним из самых изученных канцерогенных факторов для человека, оно приводит, прежде всего, к развитию рака губы, языка и других отделов ротовой полости, глотки, пищевода, гортани, трахеи, бронхов, мочевого пузыря и др. Курение сигарет является причиной 35% всех злокачественных заболеваний. Риск возникновения рака любых локализаций у курильщиков повышен в 5-6 раз, у выкуривающих более одной пачки в день риск возрастает до 10-15 раз).
Мы можем увидеть громадное многообразие канцерогенов в окружающей нас среде! Естественно возникает вопрос, можно ли исключить полностью вероятность опухолевой трансформации клетки, устранив из окружающей среды все мыслимые канцерогены. На этот вопрос, по-видимому, следует ответить отрицательно по двум причинам: некоторые химические канцерогены могут образовываться внутри организма в ходе различных метаболических реакций; а также в силу внутренне присущей геному изменчивости оказывается возможным (хотя и с малой вероятностью) повреждения генов.
В) Данные о роли вирусов развитии опухолей были получены еще в начале ХХ столетия. В качестве носителя генетической информации у онкогенных вирусов может выступать как ДНК, так и РНК.
РНК-содержащие вирусы, попадая в клетки человека, синтезируют ДНК с помощью обратной транскриптазы и частично или полностью включают ее в геном клетки в виде провируса (латентного вируса).
ДНК-содержащие вирусы частично, а иногда и полностью встраиваются в клеточный геном, экспрессируют вирусные гены, в результате чего образующиеся в ядре белки нарушают регуляцию клеточного цикла. К ДНК-содержащим онковирусам относят вирус герпеса, аденовирус, вирус ветряной оспы, вирус гепатита В и др. Как правило, эти вирусы вызывают инфекционные болезни и лишь в одном из нескольких сот тысяч случаев - злокачественную трансформацию.
Возникает вопрос, почему и откуда у вирусов появились гены, вызывающие рост опухолей. Сначала предполагалось, что они изначально принадлежат вирусному геному, однако в 90-х годах было установлено, что онкогенные свойства получены ими из генома тех клеток, в которых они обитают. За время существования в составе вирусного генома соответствующие гены млекопитающих и человека, могут подвергаться мутациям. И если такие "сломанные" гены ввести в клетку в составе вируса, то они способны приводить к опухолевой трансформации.
Онкогены – это участки ДНК (гены), функционирование которых приводит к опухолевой трансформации клеток. Чтобы отличить нормальные хозяйские гены от вирусных онкогенов, было введено понятие протоонкогенов. Протоонкогены участвуют в ключевых процессах жизнедеятельности клетки: регуляции клеточного цикла, роста клетки, процессах транскрипции и трансляции др.
Классификация и номенклатура онкобелков
Онкогены обозначают трехзначным кодом из строчных латинских букв, который указывает объект из которого данный онкоген был выделен впервые. Например, название онкогена "с-ras", указывает на ген, впервые обнаруженный в саркоме крысы (от англ. Rat sarcomes),первая буква "с" означает, что онкоген содержится в опухолевых клетках (cellular oncogene). Аналоги, содержащиеся в нормальных клетках, протоонкогены –соответственно носят название c-ras-протоонкоген. Вирусный онкоген называют v-onc от viral oncogene.
Онкобелки классифицируются по локализации на следующие группы:
3. Цитоплазматические белки.
Стабильная локализация только ядерных онкобелков, а мембранные и цитоплазматические способны меняться: мембранные перемещаются в цитоплазму и наоборот.
Существует процесс превращения нормального протоонкогена в онкоген, который называется активацией. Выделяют следующие механизмы активации:
1. Нарушения в первичной структуре онкогена в результате точечных мутаций, которые являются следствием замены одного азотистого основания другим, что приводит к продукции белка, измененного структурно.
2. Амплификация протоонкогена, то есть появление множества копий гена в ДНК.
3. Рекомбинации ДНК
Однако, в настоящее время стало известно, что введение в нормальные клетки лишь одного какого-то онкогена недостаточно для их трансформации. Для приобретения клеткой опухолевого фенотипа необходимо введение еще одного онкогена, принадлежащего иной, комплементарной по своим функциям, группе. Т.о, трансформация клетки возникает в результате первичного акта инициации, который заключается в том или ином повреждении ДНК, и вторичной промоции, способствующей проявлению трансформированного фенотипа. Далее, на следующей стадии- прогрессии, когда уже сформировавшаяся опухоль приобретает все новые черты злокачественности, в дело включаются все новые группы онкогенов, сочетание которых определяет конкретные биологические свойства данной опухоли.
В нормальных клетках присутствуют и антионкогены (гены – супрессоры), белковые продукты которых сдерживают репликативный потенциал клеток и развитие опухолей. Установлено, что в ходе злокачественной трансформации функции этих генов часто утрачиваются. В настоящее время известно более 10 таких генов – супрессоров, наиболее важная роль принадлежит белку р53.
Характерные признаки опухолевой клетки
1) Самодостаточность в пролиферативных сигналах. Опухолевые клетки способны размножаться в среде, где содержание ростовых факторов в десятки и сотни раз меньше, чем необходимо для стимуляции размножения нормальных клеток, что может объясняться секрецией необходимых факторов роста самими трансформированными клетками, либо резким увеличением количества рецепторов для необходимых факторов роста.
2) Пониженная чувствительность к рост-ингибирующим сигналам. Как известно, в организме существует множество антипролиферативных сигналов, поддерживающих определенное число клеток в каждой из тканей. Нормальные клетки, например фибробласты, размножаются до тех пор, пока не возникнет плотный монослой и не установятся межклеточные контакты. В отличие от этого, трансформированные клетки не останавливают свою пролиферацию, а продолжают делиться, наползать друг на друга и образовывать очаги многослойного роста.
3) Отсутствие репликативного старения, или приобретение бессмертия (иммортализация). Как известно, существует механизм, ограничивающий число делений большинства типов зрелых клеток человека. В опухолевых клетках наблюдается нарушение работы такого "счетно-ограничительного" механизма контроля репликации.
4) Ослабление индукции апоптоза. Апоптоз представляет собой активный механизм программируемой клеточной смерти, поддерживающий в организме определенное число клеток и, кроме того, защищающий его от накопления аномальных клеточных вариантов.
5) Способность стимулировать неоангиогенез, т.е. формировать новые кровеносные и лимфатические сосуды из эндотелиальных клеток мелких сосудов. Это необходимое условие для дальнейшего роста опухолевого узелка, достигшего в диаметре 2-4 мм. В ином случае клетки в центре опухоли, не получая кислород и питательные вещества, будут погибать.
6) Изменения морфологии и движения клеток. Вкратце, они выражаются в нарушении формирования фокальных контактов и ухудшении прикрепления клеток к внеклеточному матриксу, дезорганизации системы актиновых микрофиламентов. Это приводит к изменениям подвижности. Необходимо подчеркнуть, что именно эти нарушения, вместе с некоторыми другими свойствами, в частности способностью секретировать протеолитические энзимы, коллагеназы, гликозидазы предопределяют приобретение неопластическими клетками двух свойств, лежащих в основе злокачественного роста: 7) способность к инвазии, т.е. проникновению в окружающие здоровые ткани, и сопряженную с ней 8) Способность к метастазированию - образованию вторичных очагов опухолевого роста.
9) Нарушения клеточной дифференцировки, т.е. образования специализированных типов клеток, синтезирующих специфические белки.
10) Генетическая нестабильность, которая базируется на уменьшении точности воспроизведения генетического аппарата, нарушениях механизмов репарации ДНК и изменениях регуляции клеточного цикла в поврежденных клетках.
Особенности метаболизма при опухолевом росте.
В метаболизме опухолевых клеток обнаруживается ряд особенностей. Первым таким свойством является стойкое изменение ее энергетики – повышается скорость как аэробного так и анаэробного гликолиза, увеличивается количество молочной кислоты. Преимущественный анаэробный гликолиз является не внутренне присущим опухолевым клеткам, свойством, а скорее следствием особых условий роста опухоли – быстрого размножения при слабой васкуляризации и недостаточной оксигенации. Установлено, что чем менее дифференцирована опухоль и чем выше скорость ее роста, тем интенсивнее протекает в ней гликолиз и тем слабее окислительное фосфорилирование.
Вторым важным биохимическим свойством является сдвиг в изоэнзимном спектре ряда ферментов энергетического обмена. Так в углеводном обмене это фосфофруктокиназа, не ингибирующаяся АТФ и цитратом, очень активная лактатдегидрогеназа, изофермент гексокиназа, характеризующийся чрезвычайно высоким сродством к глюкозе и способной использовать ее для своих нужд даже при очень низкой концентрации в организме. Кроме того, увеличивается содержание фетальных форм белков и ферментов.
Благодаря своему интенсивному росту, требующему пластических и энергетических ресурсов, опухоль может выступать как "ловушка" различных питательных веществ. Опухоль обуславливает мощный подсос глюкозы, утилизируемой для ее собственных нужд и теряемой вследствие этого организмом и возникновения гипогликемии, что компенсаторно повышает секрецию некоторых гормонов, например, глюкокортикоидов, которые в свою очередь стимулируют глюконеогенез, мобилизацию липидов, кетогенез. Повышение уровня липидов в крови ухудшает вязкостные свойства крови, что сопровождается дефицитом кислорода. С другой стороны, глюкокортикоиды индуцируют распад белков лимфоидной ткани и ослабляет иммунитет. Положение осложняется тем, что создавая дефицит определенных соединений, опухоль способна продуцировать биологически активные вещества, не свойственные нормальному организму и еще в большей степени дезорганизующие обмен.
Биохимическое исследование онкологического больного позволяет во многих случаях судить о степени распространения опухоли, о функциональном состоянии жизненно важных органов и систем, о сопутствующих заболеваниях и т.д. Для оценки общего биохимического статуса пациента определяют в сыворотке крови несколько наиболее важных показателей:
Для белок-синтетической функции печени – общий белок, альбумин, билирубин, активность АЛаТ;
Для почек и мочевыделительной системы – мочевина;
Для инсулярного аппарата поджелудочной железы - глюкоза.
О возможном повреждение костей скелета первичной опухолью или метастазами судят по повышению в сыворотке крови активности щелочной фосфатазы.
Обнаруживаемые при общем скрининге наиболее существенные сдвиги могут быть интерпретированы следующем образом:
Увеличение содержания мочевины при нормальной концентрации креатинина свидетельствуют об интенсивном распаде опухоли, а при повышенной его концентрации – о нарушении функции почек;
Увеличение содержания глюкозы указывает на нарушение функции инсулярного аппарата, а снижение – на значительную утилизацию глюкозы опухолевыми клетками;
увеличение содержания общего белка (при снижении концентрации альбумина) – характерный признак миеломной болезни; снижение содержания общего белка и альбумина обнаруживается у онкологических больных при поражении печени метастазами и в ряде других случаев как отражение общего действия опухоли на организм в результат снижения синтеза белка и усиленного его распада;
повышение активности щелочной фосфатазы свидетельствует о нарушении функции печени, в частности, в результате появления в ней метастазов или может быть следствием гиперпродукции клетками остеогенной саркомы.
Биохимические маркеры опухоли.
Термином "опухолевые маркеры" обозначают соединения, обнаруживаемые в биологических жидкостях онкологических больных и синтезируемые либо раковыми клетками, либо клетками нормальных тканей в ответ на инвазию опухоли.
Маркеры, продуцируемые опухолью:
Альфа-фетопротеин – эмбриональный белок, сходен с альбумином и выполняет его функции на эмбриональной стадии развития. Повышение содержания его может служить указанием на гепатоцеллюлярный рак.
Раково-эмбриональный антиген – гликопротеид, обнаруживаемый на мембранах опухолевых клеток. Повышение содержания отмечается у больных раком толстой кишки, поджелудочной железы, молочной железы и легкого. Содержание антигена коррелирует с числом клеток опухоли, нередко указывает на плохой прогноз заболевания.
Тканевой полипептидный антиген (ТПА) в высокой концентрации содержится в тканях эмбриона. Обнаруживается практически во всех опухолевых тканях. Значительное повышение содержания его отмечено при раке мочевого пузяря, предстательной железы и почек.
Хорионический гонадотропин – в норме синтезируется и секретируется интерстициальными клетками хориона. При опухолях трофобласта содержание маркера в сыворотке крови коррелирует с массой опухолевых клеток и имеет прогностическое значение.
Маркеры, ассоциированные с опухолью.
Маркеры этой группы продуцируются клетками самой опухоли и тканями организма, непосредственно ею не затронутыми. К ним относятся белки острой фазы воспаления, ферритин, некоторые ферменты, иммунные комплексы.
Белки острой фазы – соединения, вырабатываемыми клетками печени в ответ на разнообразные патологические процессы (воспаление, повреждение, злокачественные новообразования). Их повышенная продукция при опухолевом росте может быть вызвана либо секретируемыми опухолью ростовыми факторами, либо вторичным воспалением. К числу белков острой фазы воспаления относятся церулоплазмин, гаптоглобин, α2-глобулины, С-реактивный белок и др.
Лактатдегидрогеназа (ЛДГ) – один из важнейших ферментов углеводного обмена. При различных онкологических заболеваниях отмечено повышение активности ЛДГ в сыворотке крови, причем при некоторых формах преобладает М-субъединица, тогда как при других – Н-суъединица.
Креатикиназа – фермент, поддерживающий оптимальные концентрации АТФ и АДФ в клетке. Повышение концентрации креатинкиназы в сыворотке крови отмечается у больных с опухолями желудочно-кишечного тракта.
Читайте также:

