Биохимический рецидив рака предстательной железы что это такое
Рак предстательной железы (РПЖ) диагностируют у 32 – 40% мужчин старше 50 лет. В половине случаев это локализованный рак, то есть опухоль не выходит за пределы простаты. Стандартом лечения в такой ситуации считается радикальная простатэктомия – одномоментное удаление новообразования. Не уступает по радикальности и лучевая терапия, которую часто рассматривают как альтернативу операции. Тем не менее, лечение не всегда эффективно. Иногда болезнь возвращается спустя несколько месяцев или лет после радикального лечения. Такое состояние называется рецидивом рака предстательной железы, который может быть локальным или местным, системным и биохимическим.
Вероятность рецидива после радикальной простатэктомии составляет от 10 до 28% в первые 5 лет после вмешательства. Это зависит от строения опухоли, соматического состояния пациента, размера новообразования. Например, если радикальную простатэктомию выполняли на стадии T3а (рак распространяется на клетчатку вокруг простаты), вероятность возрастает до 45%.

Развитие рецидива в течение 5 лет после лучевой терапии составляет 12 – 38%. При этом будут иметь значение не только особенности новообразования, но и доза облучения – чем она меньше, тем выше риски. Вид воздействия (брахитерапия или дистанционное) большой роли не играет.
Если же говорить о сроках в целом, 45% случаев регистрируются в течение 2 лет после радикального лечения, 77% – в пределах 5 лет, 96% – на протяжении 9 лет.
Биохимический рецидив
Протекает бессимптомно и определяется исключительно по результатам анализа на уровень простатспецифического антигена (ПСА или PSA). Это особый белок, который есть только в тканях предстательной железы. Соответственно, после ее удаления, уровень простатспецифического антигена должен резко снизиться до значений, не определяемых стандартными методами исследований. Если же, спустя некоторое время, уровень ПСА начинает вновь возрастать, это может означать лишь то, что в организме остались клетки опухоли, которые начали размножаться. Биохимический рецидив после радикальной простатэктомии диагностируют, когда уровень ПСА систематически увеличивается через три измерения подряд на 0,2 нг/мл и более, интервал между исследованиями больше или равен 2 неделям.
Подобная ситуация возможна и после радиотерапии. Конечно, при облучении часть тканей железы остается жизнеспособной и уровень ПСА не опускается до неопределяемых значений. Поэтому за исходную точку берут самый низкий уровень антигена.
Критерием биохимического рецидива считается повышение показателя PSA более чем на 2 нг/мл по сравнению с минимальным значением, отмечавшимся у больного.
Биохимический рецидив рака предстательной железы лечат облучением ложа простаты, иногда вместе с захватом области регионарных лимфоузлов.
Локальный рецидив
Локальный рецидив рака простаты после радикальной простатэктомии регистрируется в 15 – 35% случаев. Местным — считается появление очага опухоли в области расположения удаленной предстательной железы при отсутствии поражения лимфоузлов и отдаленных метастазов. Этот очаг должен быть визуализирован, то есть виден на УЗИ, компьютерной томограмме, при МРТ-обследовании или ПЭТ — КТ. Его злокачественность должна подтверждаться гистологически – то есть после взятия биопсии и исследования под микроскопом.
Клинических симптомов на ранней стадии обычно не бывает. Чаще всего во время очередного профилактического обследования у пациента обнаруживают вновь повысившийся уровень ПСА, после чего проводят углубленную диагностику и выявляют местный рост опухоли. Если пациент, вопреки рекомендациям, не обследуется профилактически после радикального лечения и рецидив на ранних стадиях не выявлен, на поздних этапах развития возвращаются некоторые симптомы запущенных стадий рака простаты: боли в промежности и над лобком, задержка мочи, запоры.

Лечение локального рецидива РПЖ зависит от того, какой метод был использован ранее.
Если первично возникший рак лечили с помощью лучевой терапии, при рецидиве выполняют радикальную простатэктомию (РПЭ). При этом вероятность послеоперационных осложнений выше, чем если бы хирургическое вмешательство было сделано при первичном раке: после облучения возрастает опасность повреждения прямой кишки, увеличивается кровопотеря во время вмешательства, высок риск возникновения недержания мочи, или, наоборот, контрактуры (патологического сокращения) шейки мочевого пузыря. 5-летняя безрецидивная выживаемость после операции 55 – 69%.
Если же первично была выполнена РПЭ, при лечении рецидива рака используют лучевую терапию. 5-летняя безрецидивная выживаемость при этом зависит от исходного уровня ПСА. Если он меньше 0,2 нг/мл, показатель 5-летней безрецидивной выживаемости достигает 77%, при 0,2 нг/мл опускается до 34%, а если уровень ПСА доходит до 1 нг/мл, прогноз расценивается как неблагоприятный.
Из экспериментальных методов, достоверной статистики эффективности которых пока нет, применяется криоабляция (замораживание) и воздействие сфокусированным ультразвуком высокой интенсивности (HIFU-терапия). Несмотря на то, что предварительные результаты исследований эффективности методик довольно обнадеживающие, в официальные гайдлайны эти манипуляции пока не включены.
Системный рецидив
Случается и так, что на момент радикального лечения остались недиагностированные микрометастазы, которые продолжили свое развитие после вмешательства. В этом случае трудно отличить системный рецидив (возобновление роста новообразования) от системной прогрессии опухоли (продолжения развития не удаленных очагов).
Отчасти, их можно различить по следующим критериям:
- повышение концентрации ПСА менее чем через год после операции;
- уровень ПСА удваивается за 4 – 6 месяцев;
- 8 – 10 баллов по шкале Глисона.
Системный рецидив клинически проявляется такими же симптомами, как и метастатический рак. Поскольку злокачественные новообразования предстательной железы метастазируют в кости, легкие, печень, возникают признаки поражения этих органов:
- боли в костях;
- патологические переломы;
- повышенный уровень кальция и щелочной фосфатазы крови;
- боли в позвоночнике;
- парезы, параличи (при сдавлении спинного мозга);
- боли в подреберье;
- увеличение печени;
- анемия.
Эти проявления сопровождаются общим недомоганием, повышением температуры до 37-38, потерей аппетита, резким снижением массы тела.
При системном рецидиве, равно как и при прогрессии рака предстательной железы применяют гормонотерапию, чаще всего – кастрацию.
Метастазы в кости подвергаются радиотерапии – облучение помогает уменьшить интенсивность болевого синдрома.
Оперативное удаление опухоли, облучение и химиотерапия не являются 100% гарантией исцеления рака предстательной железы. Благополучный исход определяют ранее выявление онкологии и выраженность злокачественного процесса. Через 5 лет после лечения больше чем у 1/3 пациентов обнаруживается рецидив рака простаты, через 10 лет РПЖ повторно диагностируют у > 50% мужчин. Под рецидивом понимают пальпаторно определяемую опухоль, метастазы и повышение показателей ПСА.
- Этиология и патогенез
- Симптомы и проявления
- Диагностика
- Как проводится лечение
- Прогноз
Этиология и патогенез
Возвращение болезни после операции происходит в результате неполного удаления раковых клеток. Последующие радио- и химиотерапевтические мероприятия по разным причинам оказываются неэффективными. Формируется новая опухоль либо обнаруживаются метастазы. Рецидив рака простаты чаще развивается у пациентов, начавших борьбу с онкологией поздно, на 3–4-й стадиях болезни. В этой ситуации онкологический процесс возобновляет метастатический узел.
Различают два вида рецидива:
- Местный (локальный) – поражает только предстательную железу. Обычно наступает через 2 года после операции. Характеризуется повышением уровня ПСА в 2 раза.
- Системный – в онкологический процесс вовлекаются другие органы. Биохимический рецидив развивается быстро – ПСА за год после РПЭ увеличивается более чем в 2 раза.
Новая волна злокачественного процесса возникает в результате некорректного либо запоздалого лечения. Возобновить рак может дессеминация организма мутировавшими клетками. Основные причины рецидива.
- неполное удаление опухоли в ходе операции;
- неэффективность лучевой и химиотерапии;
- позднее начало терапии (при 3–4 степени).
Полное излечение от рака простаты возможно при первых двух стадиях при условии своевременного лечения. Риск возвращения онкологии повышает прорастание опухоли в близлежащие органы.
Симптомы и проявления
Начало заболевания проходит незаметно. Первые симптомы местного рецидива возникают по мере роста раковой опухоли и сдавливания ею мочеиспускательного канала. Возникают проблемы с мочеиспусканием, потенцией и эякуляцией. Характерные симптомы:
- ощущение наполненности мочевого пузыря;
- частые позывы, вялая струя урины;
- беспрерывные боли в паху;
- нарушение потенции, ее отсутствие;
- боли при семяизвержении;
- наличие крови в эякуляте;
- эпизодические боли внизу живота.

Задайте вопрос врачу-урологу!

Запущенные стадии характеризуются разрастанием опухоли за границы капсулы железы, поражением окружающих тканей, прогрессивным метастазированием в соседние и отдаленные органы. Далее процесс распространяется на поясничный сегмент позвоночника, кости таза и конечностей. Эта стадия проявляется:
- сильными болями в позвоночнике, тазу;
- появлением неврологических расстройств;
- повышением частоты патологических переломов;
- хронической усталостью и слабостью;
- утратой аппетита, сильным похуданием.

Для инфильтрации опухоли в прямую кишку характерны проблемы с дефекацией (запоры, опорожнения с кровью). Достаточно быстро в злокачественный процесс вовлекаются легкие, печень, почки и головной мозг. Развивается последняя стадия рака, обычно с печальным финалом. Клиника системного рецидива РПЖ зависит от топографии метастазирования:
- в легких – боль в грудине, кашель, кровохаркание;
- печени – боль, увеличение печени, желтизна, отеки;
- почках – боли в пояснице, гематурия, дизурия;
- в мозге – сильные головные боли, тошнота.
Для поздних стадий рецидива рака простаты после РПЭ характерны общее истощение, кахексия с признаками интоксикации (повышение температуры тела, лихорадочное состояние).
Диагностика
После оперативного удаления опухоли и специфического лечения пациенты наблюдаются у уролога-онколога. Контролируется уровень ПСА – маркера карциномы простаты. Предположением на возвращение рака простаты будет повышение результатов выше 0,2 нг/мл. Это является поводом к обследованию. Диагностические мероприятия:
- Ректальный осмотр. Выявляет местный рецидив рака на этапе, когда опухоль разрослась и пальпируется через стенку прямой кишки.
- Опрос и осмотр пациента, выявление жалоб. Выясняется состояние больного: наличие и выраженность болей, потеря в весе.
- Биохимическое тестирование. Анализы крови (общий развернутый, на сахар, ПСА) и мочи.
- Аппаратные методы (ТРУЗИ, МРТ, КТ) – дают возможность определить рецидив на раннем этапе. Томография позволяет обнаружить метастазы.
Проводятся ПЭТ (двухфотонно-эмиссионная томография), сканирование с фтордезоксиглюкозой. Перед исследованием вводится радиофармпрепарат, маркирующий атипичные клетки.
Как проводится лечение
Тактика и длительность лечебных мероприятий рецидива рака простаты после лучевой терапии и операции отличаются и зависят от первичной методики. При недостаточной эффективности облучения назначается химиотерапевтический курс либо альтернативный метод. При местной форме эффективна дистанционная радиотерапия. Системный рак простаты лечат специфическими гормональными препаратами. Новыми эффективными методами лечения рецидива РПЖ являются следующие.
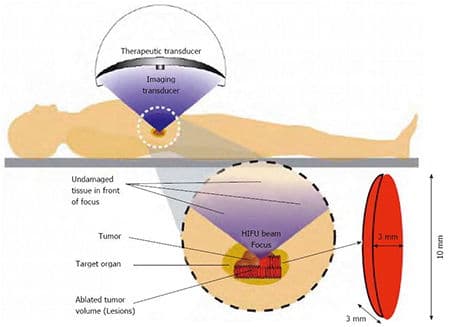
Спасительная (сальважная) HIFU терапия – при местном расположении опухоли у пациентов, перенесших полную простатэктомию. Используется высокоинтенсивный фокусированный ультразвук (High Intensity Focused Ultrasound).
Фотодинамическая терапия (ФДТ) — в/венное, локальное введение фотосенсибилизаторов, безопасных веществ, действующих на пораженный орган световым лучом заданной волны. Включает этапы:
- введение фотосенсибилизирующего препарата (минуты);
- накопление его в тканях-мишенях (дни);
- облучение опухоли лазером через световод (минуты);
- высвобождение токсинов, избирательно уничтожающих атипичные клетки.
Брахитерапия (контактное облучение) — источник излучения находится внутри ткани органа. При возобновлении рака простаты после облучения возможны локальная HIFU- и брахитерапия.
Пациент с диагнозом РПЖ после радикальной простатэктомии периодически обследуется у онколога. Проводится динамичное наблюдение показателей простатического антигена. При рецидиве рака терапевтическая тактика зависит от типа опухоли и характера ее прорастания. Учитываются возраст, иммунный статус, сопуствующие патологии. При биохимическом сигналом возвращения будет повышение уровня ПСА в крови. В этом случае назначается гормонотерапия с целью снижения уровня тестостерона.

Системный рецидив предполагает метастазирование раковых клеток в соседние органы и далее. Поздние стадии имеют выраженную онкологическую клинику. Метод борьбы со злокачественным процессом зависит от клинической ситуации. Мероприятия: химиотерапия, облучение, операция, гормональная терапия, фокусированная УЗ-абляция. Лекарства, назначаемые врачом при раке простаты:
- Золадекс (Гозарлин)— аналог гонадотропин-рилизинг гормона, назначается при гормон-резистентной форме патологии. Снижает уровень ПСА.
- Андрокур (ципротерона ацетат) — антиандроген, кастрационный препарат, осуществляет полную гормональную блокаду. Показания — метастазирующий и неоперабельный рак.
- Флутамид — нестероидный антиандроген. Препятствует усвоению клетками мужских гормонов. Снижает уровень тестостерона и, как следствие, ПСА.
Суть терапии биохимического рецидива РПЖ — нормализация показателей ПСА. Клинические рекомендации при малоэффективности гормональной терапии склоняются к проведению орхиэктомии (удалению тестикул).
Прогноз
Выживаемость пациентов с раком простаты довольно высокая. В среднем 80—90% своевременно оперированных остаются живы через 5 лет. Рецидивы также достаточно часты, 15—30% больным не удается одолеть онкологию. Смертность в течение 10 лет составляет 15—20 %. На статистику выживаемости влияет исходный уровень ПСА: чем меньше его показатели после радикальной простатоэктомии, тем лучше прогноз.
Выраженность распространения злокачественного процесса дает возможность оценить исход заболевания. Важным прогностическим фактором после РПЭ является положительный хирургический край. Рост новообразования по краю резекции и его выход за пределы капсулы значительно сокращают выздоровление.
В течение 5 лет у оперированных пациентов с негативным хирургическим краем вероятность рецидива — всего 20%, с позитивным — 40—60%. При прорастании опухоли в семенные пузырьки после удаления простаты местный рецидив рака возникает в 70% случаев. Хорошая 10-летняя выживаемость отмечается после брахитерапии (86%).
Если у вас остались вопросы, задайте их в комментариях (это абсолютно анонимно и бесплатно). По возможности, я или другие посетители сайта помогут вам.

Раннее обнаружение рака предстательной железы часто приводит к излечиванию болезни. Мужчине после основной терапии необходимо с установленной урологом периодичностью сдавать кровь для определения уровня простатического специфического антигена – вещества, уровень которого выходит за пределы нормы при патологическом процессе простаты (воспалении, доброкачественной гиперплазии, карциноме). После проведенной простатэктомии ПСА прогрессивно повышается в случае возобновления заболевания.
По статистике, если обнаружен рецидив злокачественного процесса в продолжение 5 лет от момента произведенной радикальной простатэктомии, от него гибнет до 4% пациентов. На протяжении 10 лет неопластический процесс возобновляется до 53% случаев, по этому поводу пациенты начинают получать вторую линию терапии.
Биохимический рецидив получил такое название, потому что он регистрируется по изменению биохимического показателя – уровня простатического специфического антигена. Других признаков возвращения заболевания на начальном этапе нет. В соответствии с принятыми стандартами концентрация ПСА сыворотки крови не должна превышать 0,2 нг/мл. Если два последовательно взятых анализа предстательной железы демонстрируют значения, отличные от нормальных, врач ставит диагноз биохимический рецидив рака.

Виды рецидивов

Рецидив рака предстательной железы может быть местным или генерализованным (системным).
Чтобы дифференцировать одно состояние от другого, онколог производит оценку следующих данных:
- время, прошедшее с момента осуществления оперативного вмешательства;
- характеристика опухолевого процесса по TNM-классификации;
- определение уровня дифференцировки атипичных клеток по шкале Глисона;
- время, прошедшее с момента операции, потребовавшееся на удвоение концентрации ПСА.
Местный рецидив рака формируется, как правило, не менее чем спустя 3 года после простатэктомии. Онкопроцесс не выше T3a стадии, обнаруживаются умеренно или высоко дифференцированные опухолевые клетки. Концентрация ПСА удваивается не менее чем за 11 месяцев после хирургической манипуляции. Генерализованный (системный) рецидив образуется значительно раньше, концентрация ПСА нарастает быстрее. Атипичные клетки характеризуются как низкодифференцированные (7 баллов и выше по шкале Глисона), а стадия соответствует T3b.
Диагностические мероприятия

Для подтверждения рецидива рака используется несколько методик, однако некоторые из них малоинформативны на ранних стадиях развития рецидивирующего заболевания. К таким исследованиям относят пальпацию, а также остеосцинтиграфию и томографию (компьютерную и магнитно-резонансную).
Хорошо зарекомендовали себя такие исследования как ПЭТ и эндоректальная МРТ. Сцинтиграфия с применением антител к простатическому мембранному антигену позволяет обнаружить до 80% новых злокачественных очагов.
Если уровень ПСА не превышает 0,5 нг/мл, биопсия позволяет верифицировать рецидив рака в 28% эпизодов. Взятие биологического материала из зоны уретровезикального анастомоза не считается эффективным, наиболее информативной характеристикой является изменение уровня ПСА.
Лечение

Обнаружив у пациента рецидив рака предстательной железы, врач может предложить одну из следующих лечебных методик:
- Динамическое наблюдение.
- Спасительные манипуляции:
- дистанционная лучевая терапия;
- простатэктомия;
- брахитерапия;
- HIFU-терапия;
- криоабляция.
- Гормональная терапия.
Наблюдательная тактика используется, как правило, если опухоль не отличается агрессивностью: индекс по шкале Глисона не превышает 7, ПСА начал повышаться спустя длительный промежуток времени от радикальной простатэктомии. Метастатические отсевы формируются в подобных случаях в среднем через 8 лет. Еще через 5 лет наступает гибель мужчины.
К настоящему времени не осуществлялось серьезных исследований, подтверждающих эффективность гормонального лечения. Считается, что чем в более короткие сроки была начата терапия с использованием гормонов, тем ниже риск образования отдаленных метастазов. Гормонотерапию назначают при местнораспространенном процессе. Используются антиандрогены, бикалутамид.

В редких случаях онкоуролог может посчитать эффективной хирургическую кастрацию. Важное условие – отсутствие отдаленных метастазов. Переносимость лечения одним лекарственным средством (монотерапия) обычно лучше, чем использование комбинации препаратов. Курс антиандрогенов может быть сопряжен с такими нежелательными эффектами как гинекомастия (увеличение у мужчин молочных желез), болезненность груди. Другие побочные эффекты: приливы, эректильная дисфункция, снижение полового влечения.
Спасительные методики могут проводиться как изолированно друг от друга, так и последовательно. Например, результат лечения улучшается после применения дистанционной лучевой терапии вслед за HIFU-терапией. После лучевой терапии врач может посчитать необходимым осуществление простатэктомии.
В отличие от первичной операции, вмешательство, осуществляемое по поводу рецидива рака предстательной железы, нередко приводит к осложнениям:
- около четверти пациентов сталкиваются с сужением уретровезикального анастомоза (стриктурой);
- у двух мужчин из ста процесс операции сопряжен с травмой прямой кишки;
- больше половины мужчин, которым выполнили спасительную простатэктомию, жалуются на недержание мочи;
- у 10% пациентов формируется острая задержка мочи, требующая неотложной медицинской помощи;
- 2% пациентов сталкиваются с присоединением вторичного инфекционного процесса.
Хорошо зарекомендовала себя высокодозная брахитерапия.

Такое лечение показано в следующих случаях:
- двукратное возрастание концентрации ПСА происходит не менее чем за полгода;
- необструктивный характер мочеиспускания;
- по шкале Глисона злокачественная опухоль предстательной железы оценена не больше чем на 6 баллов;
- максимально высокий зафиксированный уровень антигена не превышает 10 нг/мл;
- пациенту ориентировочно предстоит жить больше 5 лет.
Методика лечения при рецидиве рака предстательной железы может повлечь за собой такие последствия:
- повреждение структуры прямой кишки с кровотечением из нее или без такового;
- обнаружение примеси крови в анализе мочи;
- острая задержка мочи.
Онкоуролог может счесть целесообразным применение криоабляции при наличии таких показаний:
- предстательная железа имеет объем, не превышающий 30 мл;
- сумма баллов по шкале Глисона не более 7;
- предельно допустимая стадия карциномы T2c.
Практически невыполнима криоабляция, если объем предстательной железы свыше 40 мл или злокачественный процесс распространился на семенные пузырьки. Врачи стараются не прибегать к криоабляции, если в анамнезе указана перенесенная ранее трансуретральная резекция простаты (вмешательство способно привести к некротизированнию мочеиспускательного канала).

Манипуляция может спровоцировать такие осложнения:
- образование свищей;
- недержание мочи;
- болезненные ощущения промежностной области.
Указание на ранее произведенную трансуретральную резекцию предстательной железы не является препятствием для осуществления HIFU-терапии.
Если рецидив лечится с применением данной методики, могут возникнуть последствия:
- склерозирование шейки мочевого пузыря;
- формирование свищей;
- недержание мочи;
- образование стриктуры мочеиспускательного канала.

К методам радикального лечения рака простаты относятся хирургическое удаление простаты (простатэктомия), дистанционное облучение и брахитерапия (вживление в простату радиационных зерен). Их целью является полное удаление опухоли. Если после лечения нет признаков рака, то врачи констатируют ремиссию. О полном излечении от рака не говорят, поскольку всегда остается риск развития рецидива. Раковые клетки могут быть незаметны во время исследований, но через некоторое время они активизируются, и начинается рост ПСА. Биохимический рецидив рака простаты – это увеличение уровня антигена, обнаруженное еще до появления клинических симптомов. В таких случаях назначают уточняющие исследования и начинают лечение. Биохимический рецидив после радикальной простатэктомии на начальной стадии рака почти не возникает, поскольку опухоль легко выделить из окружающей ткани.
Отличия биохимического рецидива от других типов
При отсутствии адекватной терапии биохимический рецидив в ряде случаев (далеко не всегда) перестает быть изолированным и перерастает в клиническую форму: местную (локальную) или системную. В первом случае опухоль начинает расти на месте удаленной железы, она просматривается на УЗИ, метастазов нет. Клинические симптомы обычно отсутствуют, поскольку рецидив обнаруживают на ранней стадии в ходе профилактических обследований.
Системный рецидив – это вторичный рост раковых клеток, оставшихся в не удаленных очагах, развитие метастазов. При локальном рецидиве скорость прироста ПСА составляет менее 0,75 нг/мл, при системном – более 0,7.
Биохимический рецидив после радикальной простатэктомии (РПЭ)
Хирургическое удаление простаты считается наиболее эффективным способом лечения рака, однако и после РПЭ у 15-40% пациентов в течение 5 лет возникает бессимптомный биохимический рецидив. В ряде случаев он является доброкачественным: ПСА медленно, но стабильно повышается до 0,3 нг/мл из-за остатков здоровых тканей простаты, которые продолжают продуцировать антиген. Подобное характерно для уретросберегающей простатэктомии, когда врачи оставляют сохранной шейку мочевого пузыря. Этот метод позволяет минимизировать риск осложнений после операции, но повышает вероятность рецидива.
Прогноз вероятности рецидивов после радикальной простатэктомии врачи делают в соответствии с моделями (их более 20), разработанными на основе дооперационных обследований пациентов и послеоперационных исследований удаленных опухолей. Это помогает выделить больных, нуждающихся в постоперационном (адъювантном) лечении.
Факторы (предикторы), которые влияют на возникновение рецидива:
- Уровень ПСА до операции;
- Сумма баллов по шкале Глисона;
- Локализация опухоли;
- Состояние лимфоузлов.
У пациентов с предоперационным уровнем ПСА выше 10 нг/мл риск развития рецидива составляет 44%, от 4 до 10 нг/мл – 17%.

Локальный рецидив, визуализированный при помощи ПЭТ-КТ у пациента с повышенным уровнем ПСА после РПЭ
- Плохой дают при наличии одного или нескольких условий: вовлечены семенные пузырьки или лимфоузлы, обширное распространение опухоли за пределы капсулы (экстракапсулярная пенетрация).
- Умеренный: опухоль находится в капсуле или незначительно выходит за нее, при этом сумма по Глисону не более 7 либо обширное распространение опухоли за пределы капсулы с суммой по Глисону 6.
- Благоприятный: опухоль в рамках капсулы, сумма по Глисону меньше 7.
Если опухоль ограничена капсулой, то вероятность безрецидивной выживаемости в течение 5 лет составляет 95%, в течение 10 лет – 90%.
Перспективным прогностическим маркером в настоящее время является фермент АПФ. Его уровень повышается задолго до биохимического рецидива (на 5 месяцев раньше).
Радикальная простатэктомия подразумевает полное удаление железы, но сделать это непросто, поскольку сквозь нее проходит часть уретры, простата вплотную прилегает к шейке мочевого пузыря. Врачи стараются полностью удалить опухоль, что не всегда получается.
После удаления рака простаты хирургическим путем обычно развивается местный рецидив. Клетки могут остаться в ложе опухоли, шейке мочевого пузыря, уретре, прямой кишке. Причина рецидива может быть в неточности работы хирурга или неправильном диагнозе. Предварительные результаты визуальной диагностики опухоли не всегда точны из-за некачественных снимков, их неправильной трактовки.
Сам пациент не ощущает никаких проявлений рецидива. Его выявляют исключительно по уровню ПСА. После удаления простаты он падает до неопределяемых значений примерно через 21 день при условии, что вся патологическая ткань удалена, а дооперационный уровень не превышал 15 нг/мл.
Биохимический рецидив регистрируют в случае повышения уровня антигена до 0,2 нг/мл по результатам двух анализов, проведенных с интервалом в 2-3 недели.
Для выявления причины рецидива используют следующие методы:
- ТРУЗИ простаты.
- МРТ органов малого таза.
- КТ забрюшинного пространства и таза для выявления пораженных лимфоузлов.
- ПЭТ-КТ, остеосцинтиграфия для обнаружения метастазов в костях и других органах организма. Показания: высокий уровень ПСА и удвоение значения ПСА менее чем за полгода.
- Биопсия подозрительных участков (после РПЭ исследуют зону уретровезикального анастомоза – места сшивания уретры после удаления простаты). Отрицательный результат не гарантирует отсутствие раковых клеток.

Критерии отличия местного рецидива от системного (генерализованного) после радикальной простатэктомии
Наиболее точным методом дифференциальной диагностики рецидива является иммуносцинтиграфия с применением антител к ПСМА (простатспецифический мембранный антиген), однако его распространенность в клинической практике ограничена (далеко не везде делают).
Для определения тактики лечения рецидива важно понять, откуда он исходит. Если его характер локальный, то рекомендована спасительная лучевая терапия на постоперационную область (прямо на ложе удаленной опухоли). ПСА начинает стабильно снижаться спустя 3 месяца после дистанционного облучения у 60-80% пациентов, однако в течение 5 лет результат держится только у 10-45% (по разным исследованиям). Эффективность лечения повышается при добавлении гормональной терапии. Брахитерапию после радикальной простатэктомии не делают, поскольку простаты больше нет.
При системном рецидиве для купирования роста метастазов и оставшихся в ложе очагов применяют гормональную терапию (обычно это финастерид + антиандрогены). По поводу времени начала лечения: если проводить гормональную терапию только на основании повышения ПСА (до клинических проявлений), то появление метастазов отсрочится при условии непревышения 7 баллов по Глисону и периода удвоения ПСА не более 10 месяцев. Перспективным методом является интермиттирующая блокада (прерывистая гормональная терапия) – гормоны вводят только при превышении определенного уровня ПСА.
В ряде случаев для лечения химического рецидива при раке простаты применяют HIFU-терапию – воздействие на опухоль сфокусированными пучками УЗ-волн. Данный метод помогает отсрочить назначение гормональной терапии.
Причина биохимического рецидива может остаться неустановленной, то есть никаких клинических проявлений в ходе наблюдения не возникает. Визуальные исследования также ничего не показывают. Если сумма по Глисону меньше 7, ПСА повысился поздно (через 2 года), а его удвоение происходило дольше 10 месяцев, то ограничиваются динамическим наблюдением.
Рецидив рака простаты после лучевой терапии
После лучевой терапии риск развития рецидива гораздо выше, поскольку облучение само по себе провоцирует патологические изменения клеток, а обнаружить его сложнее из-за того, что снижение ПСА идет медленно. Пороговый уровень, при достижении которого следует начинать лечение, до сих пор четко не обозначен. К тому же примерно у 30% пациентов фиксируют временный скачок антигена, не связанный с реальным рецидивом. В связи с этим были выработаны критерии ASTRO – Американское общество радиационной онкологии:
- Фиксация рецидива еще не является сигналом к началу лечения.
- О прогрессировании свидетельствует повышение ПСА во время трех последовательных анализов. За точку отсчета принимается так называемый надир – минимальное снижение ПСА для конкретного больного.
- Нет универсального уровня ПСА, который бы после лучевой терапии считался показателем рецидива. Опасным принято считать повышение антигена на 2 нг/мл по сравнению с минимумом.
- Нет одинакового для всех надира.

Результаты дистанционной лучевой терапии у больных с биохимическим рецидивом в зависимости от уровня ПСА
Минимальный период наблюдения за больным после проведения лучевой терапии составляет 2 года, затем наступает ремиссия и только после (то есть через 4-5 лет после облучения) можно судить о рецидиве. Если проводить оценку раньше, то она может быть неоправданно благоприятной. Рецидив может развиться и через 5, и через 8 лет.
После лучевой терапии в течение первых 2 лет уровень ПСА измеряют каждые 3-4 месяца. Должна быть тенденция к его снижению. В течение длительного времени никаких клинических проявлений может не быть. Единственным признаком зачастую является повышение уровня ПСА в долгосрочной перспективе. Основной критерий – время его удвоения.
В ходе исследований было выявлено, что если в течение 100 дней уровень ПСА падает ниже 4 нг/мл, то вероятность выживания пациента в течение 8 лет составляет 62%, в противном случае − 20%.
Основной задачей диагностики рецидива после лучевой терапии, как и после радикальной простатэктомии, является отличие системного злокачественного процесса от локализованного. Методы исследования те же, то и после РПЭ. Биопсия не является обязательным и высокорезультативным способом диагностики в данном случае.
Основные методы лечения рецидива после лучевой терапии:
- Простатэктомия. Не самый популярный метод из-за частых осложнений. Требуется тщательный отбор пациентов. Метод оправдан при типе опухоли Т1-Т2, Глисоне менее 7, уровне ПСА менее 10 нг/мл.
- Низкодозная и высокодозная брахитерапия. В отношении лечения рецидива отличается высокой токсичностью и ограниченной эффективностью. Показания к высокодозной брахитерапии: отсутствие затруднений мочеиспускания, удвоение ПСА более полугода, Глисон менее 6, ПСА менее 10 нг/мл.

Проведение высокодозной брахитерапии
- Криоабляция (локальное замораживание опухоли при помощи криозондов под контролем УЗИ). Из-за лучевого повреждения тканей осложнений возникает гораздо больше, чем при первичном применении данного метода. При уровне ПСА больше 10 нг/мл и суммой баллов по Глисону более 9 криоабляция не рекомендуется.
- Гормональная терапия применяется при метастазировании и наличии противопоказаний к предыдущим методам лечения. При постлучевом рецидиве проводится в 92% случаев.
Лучевая терапия повреждает ткани, поэтому радикальные методы применимы далеко не всегда.
Лечение рецидива после брахитерапии проводят при помощи следующих методов:
- Гормональная терапия.
- Криоабляция.
- HIFU-терапия.
Выбор методов зависит от состояния пациента.
Рецидив рака простаты после гормонотерапии
Гормональная терапия рано или поздно становится неэффективной, поскольку раковые клетки адаптируются к отсутствию андрогенной стимуляции, рак переходит в гормонорезистентную форму. В таких случаях наблюдается биохимический рецидив. Врачи меняют препараты, тактику их введения, но эффективность лечения все равно падает.
Следующим этапом после гормонотерапии является химиотерапия – введение в организм препаратов, останавливающих рост раковых клеток (цитостатиков). Данный метод подходит не всем пациентам. Если гормонотерапия проводилась для лечения первичного рака, то возможны радикальные методы борьбы с опухолью.
Заключение
Врачи будут подбирать различные методы лечения рецидива рака простаты до тех пор, пока пациент будет в состоянии восстанавливаться, затем последует симптоматическое лечение – прием сильных обезболивающих, помогающих облегчить жизнь. Последний этап может не наступить, если опухоль или ее рецидив обнаружены вовремя, поэтому врачи настоятельно советуют мужчинам, прошедшим курс лечения, не игнорировать назначенные профилактические обследования.
Читайте также:

