Беспалов в г химиопрофилактика рака
Достижения и перспективы химиопрофилактики рака
С середины 80-х годов 20 века в лаборатории предклинических испытаний, наряду с работами прикладного характера, определилось самостоятельное научное направление по разработке проблемы химиопрофилактики опухолей (В.Г. Беспалов, В.А. Александров), основываясь на современных принципах, которые практически не изменились до сих пор. Разработка средств для химиопрофилактики рака является сложным и длительным процессом, который должен проходить следующие этапы: доклиническое изучение антиканцерогенной активности на моделях опухолей различных органов и оценка возможных токсических свойств, предварительное клиническое изучение эффективности и безопасности у относительно небольшого числа пациентов из групп повышенного риска злокачественных опухолей, итоговое клиническое изучение на больших контингентах пациентов с оценкой онкологической заболеваемости и смертности. Перспективными для химиопрофилактики рака являются вещества, обладающие выраженным антиканцерогенным действием на широком спектре экспериментальных моделей опухолей, не имеющие токсических свойств, показавшие эффективность и безопасность в клинических исследованиях.
Цель химиопрофилактики – поиск эффективных средств (природных и синтетических), способных тормозить или препятствовать возникновению и развитию опухолей и внедрение наиболее активных препаратов в клиническую практику.
Средства для профилактики рака должны отвечать следующим основным требованиям:
- доказанная в клинических испытаниях эффективность;
- возможность применения в течение длительного времени – многолетнего или даже постоянного в течение всей жизни;
- отсутствие токсических эффектов и побочных действий или минимальная токсичность, чтобы риск возможных осложнений при использовании онкопрофилактического препарата был допустимым в сравнении со снижением риска возникновения рака;
- желательны дополнительные благоприятные свойства, достигаемые в более короткие сроки;
- лекарственные формы должны быть преимущественно для перорального применения, в некоторых случаях – местными для нанесения на кожу и слизистые оболочки.
Усилия в разработке этой проблемы были сосредоточены на поиске препаратов, способных ингибировать канцерогенез при их использовании, в основном, в период постинициации, т.е. в фазу промоции и прогрессии опухолей. Именно такой подход является наиболее перспективным для химиопрофилактики рака, поскольку показания к применению антипромоторных препаратов необычайно широки: среди популяции практически здоровых лиц, живущих в экологически неблагоприятных условиях; в группах с высоким риском развития рака; среди больных с преопухолевыми заболеваниями; у онкологических больных в период ремиссии после проведенного радикального лечения.
С первых шагов разработки проблемы химиопрофилактики рака решалась важная и трудоемкая задача по отработке моделей опухолей (как злокачественных, так и доброкачественных), вызываемых с достаточно высокой частотой в течение относительно непродолжительного времени (не более 1–1,5 лет), особенно тех локализаций, которые относятся к наиболее распространенным. В итоге в лаборатории были освоены, а также разработаны новые оригинальные экспериментальные модели всех основных опухолей, встречающихся у человека (табл. 1). Кроме того, в лаборатории была разработана модель опухолей молочной железы, эндокринной и репродуктивной систем и других органов, индуцированных гамма-облучением, у крыс; многоорганные модели канцерогенеза, вызываемого химическими канцерогенами.
Таблица 1. Экспериментальные модели предрака и рака, применяемые в лаборатории, для изучения антиканцерогенных средств
Локализация
Метод индукции
Гистологический тип
МНМ интраммамарно, МНМ или ДМБА в/в у крыс
Инициация МНМ в/в + промоция тестостероном в/б у крыс
Простатическая интраэпителиальная неоплазия, аденокарциномы
МХ интратрахеально у крыс, уретан в/б у мышей
АОМ п/к у крыс и мышей, МНМ интраректально у крыс
Очаги аберрантных крипт, аденокарциномы
МБНА или ЭЭНС п/о
Плоскоклеточные карциномы, папилломы
ДЭНА в/б у крыс и мышей
Пренеопластические очаги, гепатоцеллюлярные карциномы
ДМБА + ТПА или БП накожно
Плоскоклеточные карциномы, папилломы
Глиомы головного и спинного мозга, невриномы периферических нервов
АОМ – азоксиметан, БП – бензо(а)пирен, ДЭНА – N-диэтилнитрозоамин, ДМБА – 7,12-диметилбенз(а)антрацен, МБНА - N-метил-N-бензилнитрозамин, МНМ – N-метил-N-нитрозомочевина, МННГ – N-метил-N-нитро-N’-нитрозогуанидин, МХ – 3-метилхолантрен, ТПА – 12-О-тетрадеканоилфорбол 13-ацетат, ЭНМ – N-этил-N-нитрозомочевина, ЭЭНС – этиловый эфир N-нитрозосаркозина; в/б – внутрибрюшинно, в/в – внутривенно, п/к – подкожно, п/о – перорально
Основные результаты научно-исследовательской работы
К настоящему времени на различных моделях опухолей изучено более 80 веществ, и из них более 50 проявило антиканцерогенную активность, основные из которых представлены в табл. 2. В результате проведенной работы впервые выявлен ряд новых антиканцерогенных веществ, у известных ингибиторов установлена способность тормозить развитие опухолей ранее неизвестных локализаций.
Таблица 2. Ингибиторы канцерогенеза, изученные в лаборатории
Класс соединений
Препараты и вещества
Ретинол, альфа-токоферол, аскорбиновая кислота, тиамин, рибофлавин, витаминно-минеральные комплексы
Бета-каротин обычный и липосомальный
Селенит натрия, молибдат натрия, цинка сульфат
Нестероидные противовоспалительные средства
Диазепам, дифенин, карбонат лития
Тималин, тимоген, эпиталамин, кортексин
Органические кислоты и их соли
Фумаровая кислота, глюкарат кальция, глюкуронат калия
Биотехнологические растительные препараты
Экстракты лекарственных растений
Betula pendula, Eleutherococcus senticosus, Filipendula ulmaria, Glycyrrhiza glabra, Plantago major, Rhaponticum cartamoides, Urtica dioica
Пищевые вещества и природные комплексы
Концентрат ламинарии, масло зародышей пшеницы, пренолы из хвои, провитаминный концентрат из хвои, оксигумат торфяной, отруби пшеницы, рыбий жир, хвойный комплекс, экстракт фукусный
На основании полученных результатов по всем испытанным веществам на разных моделях были сделаны важные общие выводы:
- Длительное применение онкопрофилактических средств в постиниционный период не позволяет добиться полного 100%-ного торможения канцерогенеза, хотя снижение частоты и/или множественности может достигать 60%, но чаще около 30% (при статистической достоверности).
- Способность к ингибированию канцерогенеза даже известных онкопрофилактических средств (ретинол, ?-токоферол, 13-цис-ретиноевая кислота, ?-дифторметилорнитин и др.) не всегда подтверждалась, поэтому для гарантированного выявления активности у новых веществ необходимо проводить тестирование на нескольких моделях (не менее трех).
- Проявление онкопрофилактических свойств не является уникальным для какой-то определенной группы препаратов; отчетливая активность может быть выявлена у довольно широкого ряда синтетических и природных веществ с различным механизмом действия.
- В целом, комплексные природные вещества не уступают синтетическим соединениям по антиканцерогенной эффективности. В то же время, преимуществом природных веществ является их потенциально более низкая токсичность.
- У ряда веществ антиканцерогенная активность сочетается с другими позитивными фармакологическими эффектами: антиатеросклеротическим, адаптогенным, иммуномодулирующим, противовоспалительным, антиоксидантным и др.
- У комбинаций антиканцерогенных агентов выраженность и спектр антиканцерогенного действия может быть выше, а токсические эффекты менее выражены по сравнению с отдельными компонентами.
В результате экспериментов были отобраны и предложены для дальнейшего клинического изучения наиболее эффективные и безопасные антиканцерогенные вещества. Разработан алгоритм клинических исследований химиопрофилактических препаратов у пациентов из групп повышенного риска рака молочной железы, желудка, легких, толстой кишки с использованием клинических, эндоскопических, гормональных, биохимических, иммунологических, эхографических, рентгенологических, гистологических, цитологических, цитоморфометрических исследований и оценкой влияния на промежуточные биомаркеры повышенного онкологического риска. В проведенных клинических испытаниях выявлены химиопрофилактические средства, оказывающие выраженное лечебное действие на патологические сдвиги у пациентов из групп повышенного онкологического риска. Кламин (БАД на основе концентрата ламинарии) ослаблял симптомы диспепсии и эндоскопические признаки гастрита, увеличивал уровень пепсиногена-пепсина в желудочном соке, вызывал регрессию кишечной метаплазии и дисплазии у больных атрофическим гастритом; улучшал клинико-рентгенологическую картину, вызывал регрессию дисплазии и метаплазии эпителия бронхов у больных хроническим бронхитом курильщика; вызывал регрессию предраковых очагов у больных красным плоским лишаем ротовой полости; нормализовал стул, подавлял повышенную пролиферацию эпителия слизистой оболочки и вызывал частичную регрессия полипов у пациентов с аденоматозными полипами толстой кишки. Лесмин (БАД на основе хвойного комплекса) ослаблял симптомы диспепсии и эндоскопические признаки гастрита, подавлял инфекцию Helicobacter pylori, увеличивал уровень пепсиногена-пепсина в желудочном соке, вызывал регрессию лимфоплазмоцитарной инфильтрации и кишечной метаплазии слизистой оболочки желудка у больных атрофическим гастритом. Результаты доклинического и клинического изучения пищевых веществ и разработанных в лаборатории на их основе БАД опубликованы в нескольких монографиях (в частности: Беспалов В.Г. Питание и профилактика онкологических заболеваний. – Великий Новгород, Полиграфическая компания "Позитив", 2015. – 242 с.).
На основе концентрата ламинарии в качестве фармацевтической субстанции был создан и внедрен в клиническую практику лекарственный препарат мамоклам, который применяется для лечения фиброзно-кистозной болезни молочных желез. В проведенных клинических испытаниях установлено, что мамоклам значительно уменьшает проявления масталгии, предменструального напряжения молочных желез и альгоменореи, ослабляет пальпаторные признаки фиброзно-кистозной болезни, нормализует менструальный цикл, баланс тиреоидных и половых гормонов; по данным маммографии и эхографии вызывает регрессию фиброаденоматозных уплотнений и кист в ткани молочных желез, приводит к уменьшению диаметра расширенных млечных протоков, снижает маммографическую плотность. Результаты клинического изучения мамоклама обобщены в монографии: Беспалов В.Г. Мастопатия и лекарственный препарат мамоклам. Методическое пособие для врачей. – СПб.: Издательство "Игра света", 2008. – 68 с.
В последние годы нами были пересмотрены результаты изучения ранее синтезированных противоопухолевых препаратов, чтобы выявить наиболее перспективные для внедрения в клиническую практику после более углубленного и широкого экспериментального исследования. Наибольший интерес привлекли два препарата: диоксадэт и хлонизол.
Диоксадэт относится к группе алкилирующих соединений – этилениминов. В лаборатории были разработаны новая схема синтеза фармацевтической субстанции и новая лекарственная лиофилизированная форма препарата, которые обеспечивают большую безопасность в производстве; разработан новый проект ФСП на лекарственную форму; проведены доклинические исследования по оценке противоопухолевой активности диоксадэта на стандартных моделях трансплантированных опухолей в сравнении с цитостатиками, применяемыми в клинической практике.
В доклинических исследованиях была установлена выраженная противоопухолевая активность диоксадэта на широком спектре перевиваемых опухолей у лабораторных животных. Данные сравнительного изучения диоксадэта свидетельствуют о его более высокой противоопухолевой активности, чем у наиболее близкого к нему по структуре тиофосфамида. В эксперименте на крысах с перевиваемой асцитной опухолью яичника противоопухолевое действие диоксадэта при внутрибрюшинном введении сравнимо с действием цисплатина, являющегося стандартом в клинической интраперитонеальной химиотерапии рака яичника. С учетом того, что диоксадэт, в отличие от препаратов платины, обладает значительно более низкой токсичностью, не вызывает осложнений в виде спаечного процесса, перспективным является применение диоксадэта для интраперитонеальной химиотерапии рака яичника. В экспериментах с асцитной опухолью Эрлиха у мышей выявлен выраженный синергизм противоопухолевого действия диоксадэта в комбинации с гемцитабином при отсутствии повышения токсичности.
Клинические испытания диоксадэта по II фазе были проведены в 15 онкологических учреждениях у 229 больных распространенными формами злокачественных новообразований различных локализаций. Несмотря на то, что все больные были с далеко зашедшими формами злокачественных новообразований, практически при всех локализациях был доказан объективный противоопухолевый эффект диоксадэта. Особенно сильным противоопухолевый эффект диоксадэта оказался в лечении распространенных форм рака яичников и молочной железы, в том числе у больных с асцитом и ранее леченных другими алкилирующими агентами. Были проведены клинические испытания диоксадэта в качестве противоопухолевого средства для химиоэмболизации при операбельных и распространенных формах рака почки. Химиоэмболизация с диоксадэтом повышала 2- и 3-летнюю выживаемость больных неоперабельным раком почки. Были проведены клинические испытания диоксадэта в качестве противоопухолевого средства для химиоэмболизации печеночной артерии у больных с первичным раком печени и метастазами в печень колоректального рака. Была доказана эффективность химиоэмболизации с диоксадэтом в виде получения объективного противоопухолевого ответа и увеличения выживаемости больных.
Диосадэт обладает выраженным так называемым контактным противопухолевым действием. В настоящее время в лаборатории развивается направление использования диоксадэта в различных режимах интраперитонеальной химиотерапии канцероматоза брюшной полости. Доклинические исследования показали, что диоксадэт при интраперитонеальной химиотерапии превосходит по эффективности и безопасности другие применяемые с этой целью цитостатики: циспалатин, паклитаксел, митомицин С, мелфалан.
Создана экспериментальная установка для химиоперфузионного лечения канцероматоза брюшной полости на моделях у крупных и мелких лабораторных животных.
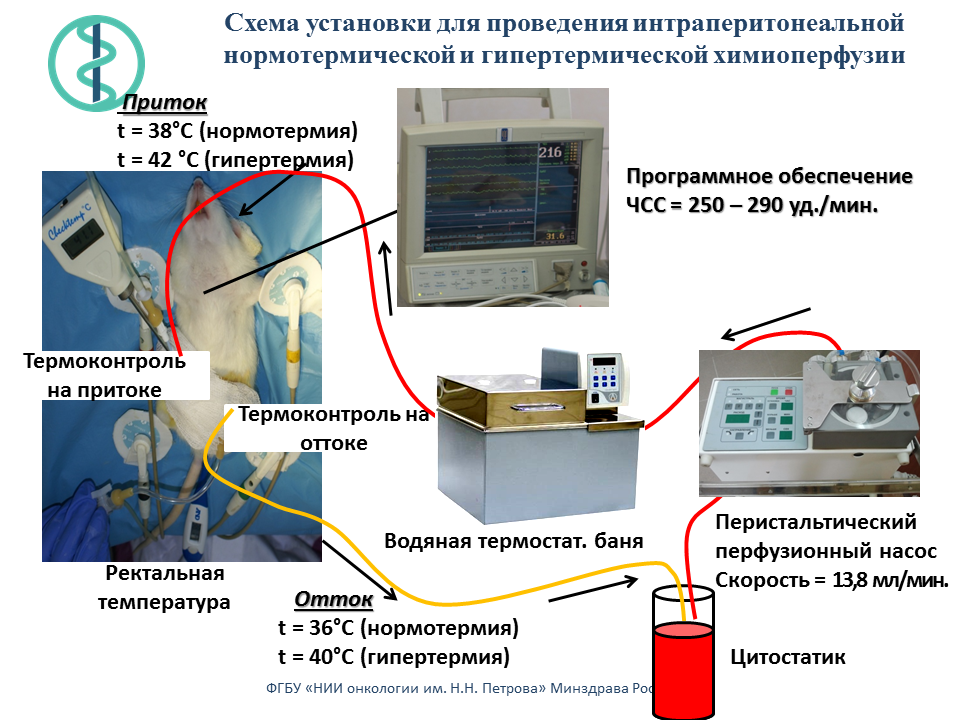
Результаты доклинического и клинического изучения химиоперфузионного лечения злокачественных опухолей обобщены в монографии: Беляева О. А., Беспалов В. Г., Сенчик К. Ю., Киреева Г. С., СтуковА. Н., Гафтон Г. И., Карачун А. М., Гусейнов К. Д. Беляев А. М. Химиоперфузионное лечение канцероматоза брюшной полости. – СПб., 2016. – 146 с.
Проведено сравнительное статистическое исследование результатов восьми независимых экспериментов по изучению эффективности интраперитонеальной химиотерапии. Изучены режимы инъекционной внутрибрюшинной (в/б) химиотерапии (ИВХ), нормо– и гипертермической химиоперфузии (НИПХ и ГИПХ) препаратом диоксадэт на модели перевиваемого асцитного рака яичника (РЯ) у 288 крыс самок Вистар. Перевивка РЯ осуществляли в/б в количестве 1?107 опухолевых клеток, интраперитонеальную химиотерапию проводили однократно через 48 часов после трансплантации опухоли. Диоксадэт вводили в максимально переносимых дозах в/б: при ИВХ с помощью шприца в дозе 1,5 мг/кг массы тела; при НИПХ и ГИПХ раствор с цитостатиком прокачивали через брюшную полость специальным насосом соответственно в дозе 30 мг/кг при температуре 36,5–37,5°С и 15 мг/кг при температуре 40,5–41,5°С. В контрольных группах крысам в/б аналогичными путями вводили физиологический раствор. Противоопухолевые эффекты лечения оценивали по увеличению средней продолжительности жизни крыс. Для статистического анализа использован принцип гармонизации статистических доказательств и предсказаний. В контрольной группе с инъекционным в/б введением физиологического раствора средняя продолжительность жизни составила 15 дней, 95% доверительный интервал (ДИ) от 12 до 19. По сравнению с данным контролем воздействие ИВХ, НИПХ и ГИПХ увеличивало среднюю продолжительность жизни соответственно на 85, 97 и 202% (p
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
1. Александров В.А., Беспалов В.Г. Принципы и перспективы химиопрофилактики рака//Вопросы онкологии. 1991. Т. 37, № 4. С. 387-393
2. Барнаулов О.Д. Женьшень и другие адаптогены. СПб.: ЭЛБИ, 2001. 138 с
3. Беспалов В.Г., Александров В.А., Петров А.С., Троян Д.Н. Влияние α-дифторметилорнитина на развитие индуцированных N-метил-N-бензилнитрозамином опухолей пищевода, нервной системы и почек у крыс//Экспериментальная онкология. 1992. Т. 14, № 2. С. 26-30
4. Беспалов В.Г., Александров В.А., Яременко К.В. и др. Тормозящий эффект фитоадаптогенных препаратов биоженьшеня, элеутерококка колючего и левзеи сафлоровидной на развитие опухолей нервной системы, индуцированных N-нитрозоэтилмочевиной у крыс//Вопросы онкологии. 1992. Т. 38, № 9. С. 1073-1080
5. Зорькина А.В., Скопин П.И. Влияние комбинации дистанционного гамма-облучения и антиоксидантного препарата на показатели эндогенной интоксикации в условиях экспериментального опухолевого роста//Сибирский онкологический журнал. 2009. № 3 (33). С. 56-59
6. Яременко К.В. Оптимальное состояние организма и адаптогены. СПб.: ЭЛБИ-СПб., 2008. 130 с
7. Bailey H.H., Kim K., Verma A.K. et al. A randomized, double-blind, placebo-controlled phase 3 skin cancer prevention study of alphadifluoromethylornithine in subjects with previous history of skin cancer//Cancer Prev. Res. (Phila). 2010. Vol. 3. Р. 35-47
8. Bonovas S., Tsantes A., Drosos T. et al. Cancer chemoprevention: a summary of the current evidence//Anticancer Res. 2008. Vol. 28. P. 1857-1866
9. Einspahr J.G., Nelson M.A., Saboda K. et al. Modulation of biologic endpoints by topical difluoromethylornithine (DFMO) in subjects at high-risk for nonmelanoma skin cancer//Clin. Cancer Res. 2002. Vol. 8. P. 149-155
10. IARC Monographs on Evaluation of the Carcinogenic Risks to Human. Ionizing Radiation. Part 1: X-and Gamma (γ)-Radiation, and Neutrons. 2000. Vol. 75. 491 p
11. Kelloff G.J. Perspectives on cancer chemoprevention research and drug development//Adv. Cancer Res. 2000. Vol. 78. P. 199-334
12. Meyskens F.L., Gerner E.W. Development of difluoromethylornithine (DFMO) as a chemoprevention agent//Clin. Cancer Res. 1999. Vol. 5. P. 945-951
13. Meyskens F.L., McLaren C.E., Pelot D. et al. Difluoromethylornithine plus sulindac for the prevention of sporadic colorectal adenomas: a randomized placebo-controlled, double-blind trial//Cancer Prev. Res. (Phila). 2008. Vol. 1. P. 9-11
14. Ozasa K., Shimizu Y., Sakata R. Risk of cancer and non-cancer diseases in the atomic bomb survivors//Radiat. Prot. Dosimetry. 2011. Vol. 146. P. 272-275
15. Simoneau A.R., Gerner E.W., Nagle R. et al. The effect of difluoromethylornithine on decreasing prostate size and polyamines in men: results of a year-long phase IIb randomized placebo-controlled chemoprevention trial//Cancer Epidemiol. Biomarkers Prev. 2008. Vol. 17. Р. 292-929
16. Yun T.K., Zheng S., Choi S.Y. et al. Non-organ-specific preventive effect of long-term administration of Korean red ginseng extract on incidence of human cancers//J. Med. Food. 2010. Vol. 13. Р. 489-494
Беспалов В.Г., Александров В.А., Семенов А.Л., Кованько Е.Г., Иванов С.Д. ХИМИОПРОФИЛАКТИКА ОТДАЛЕННЫХ ОНКОЛОГИЧЕСКИХ ПОСЛЕДСТВИЙ НА МОДЕЛИ РАДИАЦИОННОГО КАНЦЕРОГЕНЕЗА. Сибирский онкологический журнал. 2013;(5):27-33.
Bespalov V.G., Alexandrov A.V., Semenov A.L., Kovanko E.G., Ivanov S.D. Chemopreventionof long-term oncological consequences on the model of radiation carcinogenesis in female rats. Siberian journal of oncology. 2013;(5):27-33. (In Russ.)

Контент доступен под лицензией Creative Commons Attribution 4.0 License.

Российский университет дружбы народов
Общероссийская профессиональная медицинская ассоциация
специалистов традиционной народной медицины
Российская академия естественных наук
Институт фитотерапии
СОВРЕМЕННЫЕ ПРОБЛЕМЫ ФИТОТЕРАПИИ И ТРАВНИЧЕСТВА
МАТЕРИАЛЫ
5-ГО МЕЖДУНАРОДНОГО СЪЕЗДА ФИТОТЕРАПЕВТОВ И ТРАВНИКОВ,
посвященного 100-летию патриарха отечественной фитотерапии
Карпа Абрамовича Трескунова
(г. Черноголовка, 28 – 29 января 2019 г.)
ОНКОПРОФИЛАКТИЧЕСКИЕ СВОЙСТВА ЭКСТРАКТА ЦВЕТКОВ ЛАБАЗНИКА ВЯЗОЛИСТНОГО
Высочина Г.И., Центральный сибирский ботанический сад СО РАН, Новосибирск, Россия
Костикова В.А., Центральный сибирский ботанический сад СО РАН, Новосибирск, Россия
Аннотация: Преставлено исследование антиканцерогенной активности отвара цветков F. ulmaria на 4 моделях индуцированных опухолей.
Ключевые слова: фитотерапия, лекарствненые растения, лабазник, индуцированные опухоли, антиканцерогенная активность
В настоящее время актуальным направлением борьбы со злокачественными опухолями признается химиопрофилактика, которую Всемирная организация здравоохранения определяет как использование фармакологических или натуральных агентов с целью предотвращения возникновения рака. Средства для химиопрофилактики рака должны отвечать следующим основным требованиям: 1) доказанная эффективность – способность предупреждать возникновение злокачественных опухолей; 2) возможность применения в течение длительного времени; 3) отсутствие токсических эффектов или минимальная токсичность; 4) желательные дополнительные благоприятные свойства; 5) лекарственные формы – только пероральные или для местного применения. Фитопрепараты потенциально наиболее полно отвечают вышеназванным требованиям. Мы впервые изучили в качестве средства для химиопрофилактики рака цветки лабазника вязолистного (Filipendula ulmaria (L.) Maxim), так как F. ulmaria содержит в достаточно больших количествах антиканцерогенные вещества. В медицине экстракты F. ulmaria в настоящее время применяютв качестве противовоспалительного, иммуностимулирующего, антиоксидантного, гепатопротекторного, ноотропного, адаптогенного и антигипоксического средства.
Цель исследования – оценка антиканцерогенной активности отвара цветков F. ulmariaна моделях индуцированных опухолей.
Результаты. В таблице 1 приведены результаты химического анализа экстрактов цветков F. ulmaria. Выявлено, что экстракты содержат в фармакологически значимых дозах различные флавоноиды исалициловую кислоту. Флавоноиды обладают антиоксидантным, антипролиферативным и иммуностимулирующим действием, индуцируют апоптоз и дифференцировку клеток, тормозят ангиогенез; салициловая кислота ингибирует активность циклооксигеназы, что может объяснять механизмы антиканцерогенного действия отвара цветков F. ulmaria.
Таблица1. Химический состав спиртового экстракта и отвара цветков F. ulmaria
| Компонент | Содержание, в пересчете мг/гвоздушно-сухого сырья | |
| Спиртовой экстракт F. ulmaria | Отвар F. ulmaria | |
| Флавоноиды суммарно | 120,6 | 93,5 |
| Гиперозид | 1,04 | 3,39 |
| Изокверцитрин | 0,99 | 3,08 |
| Эллаговая кислота | 0,13 | 2,97 |
| Спиреозид | 7,84 | 17,7 |
| Авикулярин | 1,4 | 4,39 |
| Астрагалин | Следовые количества | 0,73 |
| Кверцетин | 0,61 | 0,23 |
| Лютеолин | 0,04 | — |
| Кемпферол | 0,06 | — |
| Салициловая кислота | 0,21 | 0,54 |
В таблице 2 приведены результаты изучения влияния отвара цветков F. ulmariaна канцерогенез в различных органах. На всех 4 моделях канцерогенеза выявлена онкопрофилактическая активность отвара цветков F. ulmaria. По сравнению с контрольными группами отвар цветков F. ulmariaстатистически достоверно снижал частоту и множественность как злокачественных, так и доброкачественных опухолей, особенно антиканцерогенная активность проявилась в отношении рака молочной железы, толстой кишки и головного мозга.
Таблица 2. Торможение канцерогенеза с помощью отвара цветков F. ulmaria
| Модель канцерогенеза | Индуцированные опухоли | Эффективность |
| Гамма-облучение всего тела самок крыс | Фиброаденомы и аденокарциномы молочной железы; аденомы гипофиза, полипы эндометрия, лейомиомы и лейомиосаркомы матки, гранулезоклеточные опухоли яичников, ганглионевромы надпочечников; мезенхимальные опухоли почек,аденомы и саркомы легких, аденомы толстой кишки, подкожные и забрюшинные саркомы, глиомы головного мозга, лейкозы | Снижение общей частоты и множественности опухолей молочной железы на 47 и 52%; уменьшение общей частоты и множественности опухолей на 39 и 30%, в том числе злокачественных опухолей – на 49 и 46% |
| Интрамаммарное введение N-метил-N-нитрозомочевины крысам самкам | Аденокарциномы, фибросаркомы и фиброаденомы молочной железы; мезенхимальные опухоли почек, аденокарциномы толстой кишки, саркомы эндометрия, лимфолейкозы, злокачественные фиброзные гистиоцитомы брыжейки кишечника | Снижение частоты и множественности всех опухолей молочной железы на 36 и 52%, в том числе злокачественных опухолей – на 41 и 56%; уменьшение общей частоты и множественности злокачественных опухолей на 32 и 59% |
| Интраректальные инстилляции N-метил-N-нитрозомочевины крысам самкам | Аденокарциномы и аденомы толстой кишки; аденокарциномы и фиброаденомы молочной железы, мезенхимальные опухоли почек, глиомы головного мозга, лимфолейкозы,злокачественные фиброзные гистиоцитомы брыжейки кишечника | Снижение частоты и множественности опухолей толстой кишки на 46 и 62%; уменьшение общей частоты и множественности опухолей на 35 и 65% |
| Трансплацентарное введение N-этил-N-нитрозомочевины крысам | Олигодендроглиомы, астроцитомы, смешанные глиомы, глиобластомы, эпендимомы головного и спинного мозга и спинного мозга, злокачественные невриномы периферических нервов; фиброаденомы и аденокарциномы молочной железы, аденомы гипофиза гранулезоклеточные опухоли яичников | Снижение частоты и множественности опухолей головного мозга на 55 и 57%; уменьшение общей частоты и множественности опухолей на 26 и 50% |
Выводы. Отвар цветков F. ulmaria при длительном применении предупреждает развитие индуцированных злокачественных опухолей различного гистогенеза: прежде всего аденокарцином молочной железы и толстой кишки, глиом головного мозга. Отвар цветков F. Ulmaria перспективен для применения в качестве эффективного и безопасного средства для химиопрофилактики рака.
Доктор медицинских наук, лаборатория химиопрофилактики рака Научно-исследовательского Института Онкологии.
(Из выступления по телевидению 10.06.98 года)
На сегодняшний день весь мир обеспокоен быстрым ростом онкологических заболеваний. Каждый год в России регистрируют свыше 400 000 случаев заболеваний раком, только в Санкт-Петербурге количество больных превышает 17 000.
В настоящее время около 20% мужского и 18% женского населения рискует приобрести онкологическое заболевание в течение жизни. Многочисленными исследованиями доказано, что 30% случаев злокачественных новообразований возникает из-за неправильного питания. Для эффективного метода борьбы с раковыми опухолями необходимо сбалансированное питание за счет употребления продуктов, которые богаты содержанием натуральных противораковых веществ.
Пророщенные зеленые ростки пшеницы являются общепризнанным и самым известным из ряда продуктов, содержащих разнообразные компоненты, препятствующие развитию раковых клеток. Пигменты хлорофилла, предупреждающие воздействие канцерогена и мутагена на человеческую клетку, считаются признанными во всем мире.
В связи с этим, каждому курильщику необходимо ввести в рацион ростки пшеницы, которые способны защищать от вредоносного влияния отравляющих веществ табака. Ученым известно также о большом количестве различных канцерогенов, которые содержатся и в продуктах питания. Следовательно, для защиты организма требуется регулярное употребление пророщенной пшеницы в небольших объемах 3-4 раза в день вместе с обычным питанием.
Еще одним важным составляющим звеном зеленых ростков являются каротиноиды, большое количество которых служит антиоксидантом, повышает иммунитет человека и трансформируется в витамин А. Доказано, что недостаточное употребление каротина (до 5 мг в сутки) способствует увеличению риска образования раковых клеток. Следовательно, употребление зеленых ростков пшеницы, которые содержат большое количество каротина, защищает и предотвращает развитие онкологии.
Беспалов В.Г., занимаясь профилактическими и лечебными методами в институте онкологии, проводил исследования на животных, с целью определения эффективности действия проростков пшеницы. Дорогостоящие и длительные опыты показали эффективность данных методик, направленных на развитие борьбы с онкологией. Это направление было и остается приоритетным во всех странах мира. В современной онкологии существуют практически все модели онкологических заболеваний. В лаборатории Химиопрофилактики рака отрабатывались эксперименты на лабораторных мышах и крысах, достоверно моделирующих образование рака молочных желез, рака желудка, рака пищевода, рака толстой кишки, рака шейки матки и прочих локализаций у человека. Благодаря экспериментальным моделям подсчитали, насколько эффективно применение пророщенных семян пшеницы в борьбе с онкологией. Как выяснилось, самым целесообразным является применение сока ростков для людей, попадающих в группы повышенного риска онкозаболеваний. К примеру, лица, страдающие новообразованиями молочных желез, имеющих полипы толстой кишки, больные атрофическим гастритом. Применяя ростки пшеницы, больные, попадающие в эти категории, могут приостановить процесс развития рака.
Онкология является длинным, многоэтапным процессом. Считают, что злокачественный процесс может растягиваться до нескольких десятилетий. Многие злокачественные опухоли начинают появляться в возрасте 20-40 лет, в некоторых случаях даже в детстве. Следовательно, ежедневно принимая зеленые ростки еще с детского возраста, Вы получаете профилактику и надежную защиту от рака.
На протяжении многих лет эпидемиологических исследований ученые достоверно определили факторы риска возникновения онкологических заболеваний. Раку молочной железы присуще 50 факторов риска. Каждая женщина, у которой обнаружен рак груди, имела более пяти факторов риска сразу. Профилактика и лечение рака соком из зеленных ростков возможно за счет высокого содержания витамина Е, хлорофилла, фермента супероксиддисмутазы и антиоксидантов.
Давайте бороться с онкологией заблаговременно и каждый день для профилактики употреблять замороженный сок ростков пшеницы! В случае окнозаболевания целесообразно проконсультироваться с вашим лечащим врачом.
Читайте также:

