Белок теплового шока что это от рака
Вначале считалось, что они выполняют исключительно защитную роль, предупреждая возникновение необратимых нарушений. Однако со временем выяснилось, что эти соединения могут принимать активное участие в регенерации поврежденных структур клетки, а также в работе иммунной системы.
Белки теплового шока активно участвуют в клеточном метаболизме
Подтверждение этой теории, а также доскональное изучение структуры белка теплового шока и его действия в опухолевых тканях на молекулярном уровне, стало возможным только после того, как это уникальное вещество попало на международную космическую станцию. Отправили его в космос российские специалисты НИИ Особо Чистых Биопрепаратов ФМБА, синтезировавшие БТШ с помощью эксклюзивных технологий генной инженерии.
Директор НИИ ОЧБ Андрей Симбирцев и его сотрудники рассказывают о своих разработках участникам конференции
Исследовать структуру синтезированного БТШ позволило выращивание кристаллов белка в лаборатории МКС
Полученные данные легли в основу создания уникального препарата, действие которого опробовали сначала в пробирках на клеточных культурах, а потом – на лабораторных животных. Лекарством на основе синтезированного БТШ были пролечены мыши с саркомой и меланомой, включая животных с четвертой (терминальной) стадией заболеваний.
Результаты оказались более чем впечатляющими:
- абсолютное большинство мышей полностью выздоровело;
- не было зарегистрировано ни одного побочного эффекта.
Как российские ученые получают белок теплового шока
HSP продуцируется клетками бактерий, в которые внедрен выделенный из клеток человека и клонированный ген. Этот ген отвечает за синтез белка теплового шока. В настоящее время его изготовление по данной технологии ведется на производственных участках НИИ ОЧБ.

Разработка и производство особо чистых биопрепаратов проводятся в условиях полной стерильности
Разработчики утверждают, что разработанный ими метод универсален так же, как универсален сам белок, продуцируемый всеми тканями нашего организма. Поэтому если при дальнейших испытаниях лечебное действие лекарства подтвердится, а побочные не будут выявлены, его можно будет применять для терапии абсолютно всех форм рака.
Другие достоинства российской разработки:
Деньги на заключительный этап доклинических исследований нового средства (порядка 100 млн. рублей) уже найдены. Остается найти спонсора, который разделит с государством финансирование клинических испытаний. Пока приоритеты отдаются российскому бизнесу. Если же российских спонсоров найти не удастся, будут рассматриваться варианты партнерства с японскими предпринимателями или бизнес-структурами из других стран. На завершение процесса испытаний может понадобиться еще 3-4 года. При их положительном исходе онкологи смогут получить высокоэффективный инструмент в борьбе с раком.
Что может сдерживать инвесторов и снижать уровень оптимизма при прогнозах
Вложения в любые клинические испытания несут достаточно большие риски для бизнеса. Ведь даже при современном развитии науки нельзя со стопроцентной вероятностью предположить, как поведет себя новое лекарство, насколько эффективным и безопасным оно окажется не в пробирке и в организме лабораторной мыши, а на практике. Тем не менее, поиски инвестиций – всего лишь вопрос времени.
Насколько действенным будет новый метод, также покажет время. Например, нельзя исключить, что при ослабленном естественном иммунитете его возможностей для борьбы с опухолью может просто не хватить.
И, разумеется, только по истечении нескольких лет можно будет понять:
Российские ученые объявили о создании лекарства, излечивающего рак даже в последних стадиях

В пятницу 3 марта в СМИ появились сообщения о новом универсальном средстве от рака. Его представил доктор медицинских наук Андрей Симбирцев, рассказавший об изобретении лекарства, его свойствах и перспективах производства.
Институт особо чистых препаратов Федерального медико-биологического агентства (ФМБА) уже достаточно давно проводит исследования с использованием космической техники.

Андрей Симбирцев, доктор медицины, член-корреспондент РАН, зам. директора Института особо чистых препаратов
– Мы упаковали сверхчистый белок в капиллярные трубочки и отправили их на МКС, – рассказывает Симбирцев. – Дело в том, что для рентгеноструктурного анализа действия белка необходимо сформировать из него сверхчистый кристалл. Однако в условиях земного притяжения получить его невозможно.
Ученые получили требуемую степень чистоты препарата, и после того как подтвердится его безвредность, должна начаться проверка на клиническом уровне.
Лечебное действие основано на введении в организм определённого белка. Это вещество синтезируется всеми клетками в условиях стресса (например, теплового шока) и выполняет защитную функцию, в том числе вырабатывает опухолевые антигены, усиливая иммунную реакцию организма. Однако в нашем организме этого белка бывает недостаточно, чтобы победить заболевание. Поэтому ученые разработали технологию его синтеза, и на основе белка создали лекарственный препарат. Утверждается, что он действует на любые клетки, поэтому применим для лечения всех видов рака.
Институт имеет грант на первый этап исследований от Министерства образования и науки. Продолжатся ли разработки на клиническом этапе, зависит от финансирования.
– Клинические исследования стоят очень дорого, около 100 млн рублей. Обычно находится частный инвестор, который вкладывает средства, а государство возвращает 50% в случае успешного завершения, – говорит профессор Симбирцев. Пока что частный инвестор не найден, есть надежда найти его в России или в Японии, а также разработчик рассчитывает на поддержку Минздрава или Минпромторга.
По мнению профессора, если вопрос финансирования будет решен, потребуется еще 3-4 года для завершения исследований перед тем как препарат попадет к пациентам. О предполагаемой стоимости лекарства пока судить рано.

Лариса Фечина, онколог, доверенное лицо президента РФ
Алексей Муравьев, преподаватель НИУ ВШЭ:
Автор “белка теплового шока” рассказал, что подобные разработки ведутся учеными в США и Японии, но пока что результаты их исследований не были опубликованы.
Однако полет газетной утки (упоминавшей к тому же о своих приключениях в космосе) было уже не остановить.
Он рассказал корреспондентам Indicator.Ru, о каком белке речь идет на самом деле. Оказалось, изучением препарата на доклинической стадии занимался его друг и коллега из Института цитологии РАН, доктор биологических наук Борис Маргулис, которому и принадлежит идея использовать чистый белок HSP70 в терапии некоторых конкретных разновидностей рака.
Борис Маргулис со своей супругой и соавтором Ириной Гужовой, заведующей лабораторией защитных механизмов клетки Института цитологии РАН в Санкт-Петербурге, изначально были разработчиками этого препарата, хотя в данный момент отошли от исследования и изучают другие свойства HSP70. 13 марта они побывали с докладом в Москве, в Институте молекулярной биологии имени В.А. Энгельгардта РАН, и выступили с заявлением, опровергающим недостоверную информацию в СМИ.
Четыре человека и двуличный белок
Тому мнению, что белок теплового шока массой 70 килодальтон существует и вне клетки, мы обязаны четырем людям. Открыл БТШ вне клеток Майкл Тайтелл (он нашел их в гигантских аксонах кальмара), а через три года этот эффект подтвердил Ларри Хайтауэр на фибробластах крысы. Потом в дело вступила Габи Мультхофф. Она показала, что БТШ в опухолевых клетках способен выходить на поверхность, и клетка как бы сигнализирует клеткам, так называемым натуральным киллерам: "Съешь меня". Потом подключился Прамуд Сривастава — человек, который поставил все на коммерческие рельсы. Он создал вакцины на основе БТШ, которыми сейчас лечат от рака (преимущественно от рака почки).
«Сейчас мы знаем много физических и химических стимулов, способных выгнать HSP70 из клетки, но самый лучший из этих "выгонятелей" или "выталкивателей" — это экзогенный (произведенный вне клетки) HSP70, — сообщила Ирина Гужова. — На основе всех этих данных последних 5 лет мы создали парадигму, которая заключается в том, что когда HSP70 (экзогенный) входит в опухолевую клетку, происходит некая цепь событий, которая приводит к тому, что эндогенный (произведенный внутри клетки) белок выходит на поверхность. Но это его не постоянное состояние, с поверхности он уходит в экзосомах (маленьких клеточных пузырьках, выделяемых наружу) и тоже влияет на иммунную систему.
Впечатляющие результаты в ожидании проверки
Ирина Гужова рассказала и о дальнейших испытаниях препарата: «Мы испытывали этот механизм на мышиной меланоме B16, которая растет подкожно, и использовали в виде геля, наносимого на поверхность кожи. Результат получился впечатляющий: выживаемость мышей была гораздо выше, чем у контрольной группы, которую лечили гелем без действующего вещества или не лечили вообще. Разница была примерно в десять дней. Для мышей и данного типа опухоли это очень хорошая отсрочка. Подобные результаты были показаны и на крысиной глиоме C6 (это опухоль, которая растет непосредственно в мозге).
Эти данные побудили ученых провести ограниченное исследование в рамках клиники имени Поленова (НИИ Нейрохирургии в Санкт-Петербурге). «В это время в нашем коллективе был нейрохирург Максим Шевцов, который одновременно с аспирантурой Бориса Александровича (Маргулиса, — прим. Indicator.Ru) проходил ординатуру в этом НИИ. Он убедил своего руководителя, профессора Хачатуряна, испытать этот препарат. По тогдашнему законодательству достаточно было решения ученого совета и информированного согласия пациентов, и нам было выделено 25 больных. У них у всех были различные опухоли мозга, и они все получали то, что им полагалось по страховке, но плюс после хирургического удаления опухоли Максим вводил в операционное ложе раствор HSP70.
Просто космос
Кроме того, исследователи сравнивали эффект введения компонентов клеточной стенки бактерий с эффектом от HSP70, и эти сравнения явно были в пользу последнего.
В результате ситуация все больше становится похожа на небезызвестную басню, когда Роскосмос и госструктуры, раздающие гранты, рвутся в облака, ожидая немедленных результатов от фундаментальной науки, рак пятится назад, журналисты разливают структурированную воду… А российская наука в очередной раз оказывается в незавидном положении, вынужденная оправдываться за преступления, которых не совершала.
Белок теплового шока – лекарство против рака, открывающее большие перспективы в лечении этого смертельного заболевания. Они позволяют одновременно блокировать тормозные рецепторы PD-1 и Tim-3, Т-лимфоцитов. Благодаря этому снимается блокировка иммунной системы, активируется естественная противораковая защита организма.
Что такое белки теплового шока (БТШ70)
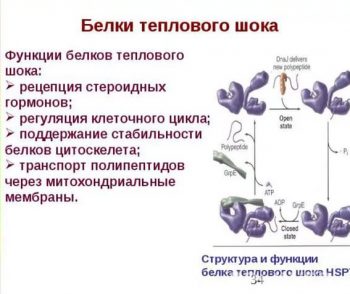
Это белки, которые вырабатываются при воздействии на клетки высоких температур и других экстремальных факторов. Их синтез активируется при различных интоксикациях, стрессе, воздействии ультрафиолета на кожу. Эти соединения выполняют защитную функцию.
В периоды отсутствия воздействия стрессовых факторов БТШ70 также присутствуют в организме. Они защищают белковые молекулы, из которых построены ткани, позволяют вновь образовавшимся белкам приобрести правильную структуру. Также БТШ70 участвуют в иммунном ответе и связывании антигенов и остатков разрушенных белковых молекул. Именно последнее свойство заинтересовало онкологов.
Механизм действия белков теплового шока при раке
БТШ70 и их коньюгаты с полиэтиленгликолем и фрагментом Ig G1 оказывают блокирующее действие на рецепторы PD-1 и Tim-3, расположенные на поверхности Т-лимфоцитов. Благодаря этому активируется иммунный противоопухолевый ответ организма. Исследования проф. С.Б. Оникиенко и его соавторов показали, что количество PD-1 позитивных клеток снижается в 1,6-2,7 раза, а количество Tim-3 позитивных – в 10,5 раз.

Комбинированная терапия Ниволумабом и БТШ70: результаты клинических исследований
Учитывая механизм действия белков токсического шока, российские ученые решили попробовать использовать их в рамах комбинированной терапии рака вместе с препаратом Ниволумаб.
Результаты клинического исследования показали такие данные: при изолированном применении Ниволумаба регресса опухоли удалось добиться у 16% пациентов, при использовании комбинированной терапии – в 52% случаев.

Следует отметить, что комбинация с БТШ70 позволила снизить дозу Ниволумаба, благодаря чему значительно уменьшилось количество аутоиммунных реакций, которые при изолированном применении препарата мешали дальнейшему лечению у половины пациентов. Белок теплового шока против рака – это важное открытие в сфере онкологии, которое позволяет сделать иммунотерапию более безопасной и эффективной.
Для прогнозирования эффективности лечения БТШ70 используют инкубационные биопробы. Они позволяют in vitro оценить, как влияет терапия на количество комплексов раковых клеток, неассоциированных с лимфоцитами.

Результаты и перспективы
На сегодняшний день доказана эффективность лекарств от рака на основе белков теплового шока у пациентов с меланомой, астроцитомой, опухолями почек, желудка, легких, предстательной железы. Также проводились эксперименты на животных, в ходе которых получен положительный результат.

Учеными разработаны пролонгированные формы БТШ70, позволяющие значительно повысить эффективность лечения. С этой целью используются конъюгаты с Fc-фрагментом Ig G и ПЭГ. Именно эти формы стали основой препаратов, которые используются в комплексе с иммунотерапией.
Комбинированная схема лечения имеет следующие преимущества по сравнению с изолированным использованием Ниволумаба:
- высокая степень активации противоопухолевой защиты организма;
- более высокая эффективность;
- минимальное количество побочных эффектов;
- снижение частоты развития аутоиммунных реакций;
- щадящее действие на организм;
- возможность результативного лечения 4 стадии рака у большего числа пациентов.
БТШ70 также используются и в других схемах терапии онкозаболеваний. Их успешно применяют в сочетании с онколитическими вирусами, радиотерапией. Благодаря масштабным научным исследованиям сегодня можно подобрать эффективный метод лечения для ранее безнадежных пациентов.
Перспективным направлением в лечении рака является персонализированная терапия. Комбинация препаратов подбирается в зависимости от иммунного статуса пациента, который определяется не только в начале, но и в процессе лечения. При гиперэкспрессии PD-1 рецепторов актуальна схема: Ниволумаб+БТШ70.
Использование белков теплового шока – это возможность воспользоваться всеми преимуществами иммунотерапии, при этом значительно сократив процент нежелательных последствий, которые вызывают серьезные изменения в организме и препятствуют дальнейшему лечению. Благодаря новым методикам лечения рака многие люди получили шанс избавиться от смертельного заболевания или прожить намного дольше, чем это было возможно ранее.
Справка:
Шапероны — класс белков, основной функцией которых является восстановление третичной или четвертичной структуры белков, также они участвуют в образовании и диссоциации белковых комплексов.
Белки теплового шока есть во всех клетках. Однако в разных клетках (особенно опухолевых, которые сильно отличаются при разных видах рака как друг от друга, так и от нормальных клеток организма) эти белки ведут себя по-разному. К примеру, в одних видах рака экспрессия белка HSP-70 может быть как повышенной (при злокачественной меланоме), так и пониженной (при раке почки).
Чтобы понять, о каком белке идет речь и действительно ли он используется в терапии рака и может помочь при всех его видах, мы поговорили с доктором биологических наук Александром Сапожниковым. Этот ученый — руководитель лаборатории клеточных взаимодействий Института биоорганической химии имени М.М. Шемякина и Ю.А. Овчинникова РАН, которая занимается одним из самых перспективных для разработок в этом направлении белков теплового шока уже много лет. Он так прокомментировал эту статью:
«Я не скажу, что это бред, но это абсолютно некорректная информация. Автором идеи применения белков теплового шока с молекулярной массой 70 килодальтон (так называемые БТШ-70, по-английски HSP70) является мой друг и коллега Борис Маргулис. Он работает в Институте цитологии в Санкт-Петербурге.
Однако белок, который получают из тканей онкологических больных, находится в прочной связи с опухоль-ассоциированными пептидами — теми признаками опухоли, которые распознает иммунная система. Поэтому, когда этот комплекс вводят больным, у большого количества больных вырабатывается иммунный ответ, и получается позитивный эффект для больного.
Что касается Бориса Маргулиса, он (в частности, на базе моей лаборатории) показал (и опубликовал результаты своей работы), что если чистый белок, без всякой опухолевой нагрузки, добавить к опухолевым клеткам, то этот экзогенный белок заставляет опухолевые клетки выставлять на свою поверхность те самые опухолево-ассоциированные пептиды, которые в нормальном состоянии находятся внутри этих клеток, в цитоплазме. Тогда иммунная система их распознает, и организм будет своими силами отторгать эти клетки, бороться с опухолью.
Это было показано в культуре in vitro, то есть не в организме, а в пробирке. К тому же Борис Маргулис претендовал только на детские лейкемии, поскольку он связан с клиницистами в Питере. То, что Симбирцев в своем интервью сказал, — это уже расширение вот такого метода применения голого, чистого белка.
Сам Маргулис не потянул бы доклинические исследования, он получил (лет пять назад) грант совместно с Институтом особо чистых препаратов. В этом институте, видимо, и работает этот Симбирцев, его фамилию я слышал много раз, но коль скоро это Федеральное медико-биологическое агентство, к которому относится Институт иммунологии на Каширке, в котором я много лет работал, то, скорее всего, это Институт особо чистых препаратов, с которым он получил грант на доклинические исследования. В советские годы это было Третье управление Минздрава. Именно с этим институтом был получен грант на доклинику от Минобра на 30 миллионов на три года, который закончился два года назад.
Все бумажные дела Институт особо чистых препаратов сделал, они отчитались по своему гранту, что касается следующей стадии, продвижения препарата, там тоже нужны деньги. Это первая стадия клинических исследований. Тут Борис Маргулис, насколько я понимаю, уже отошел от разработок, отдав это на откуп Институту особо чистых препаратов.
Они делают этот белок, сделали биотехнологию, у меня он даже в холодильнике есть, Борис давал его для испытаний. Они в больших количествах его делают, хранят в лиофилизированной форме (в сухом виде), в стерильных ампулах. Собственно, этот препарат и надо, может быть с какими-то добавками, применять в клинических испытаниях. Но для этого нужны деньги.
Увидев случайно новость с интервью Симбирцева, я прочитал, послал Маргулису, спросил, читал ли он. Борис мне ответил, что Андрей (с которым он хорошо знаком) сделал какую-то глупость, даже не сослался на авторов. Автором этой идеи (применять чистый белок как противоопухолевый препарат в онкологии), повторюсь, является Борис Маргулис. Но, насколько я от него слышал в последнее время, он от этой проблематики отошел.
![]()
На днях камрадесса ko_mon опубликовала материал
Эта информация вызвала интерес не только на АШ но и во всем рунете. Многочисленные комментарии причастных и не очень лиц, экспертов и ученых прошли по центральным каналам и в прессе. Представленный материал - это попытка разобраться, действительно ли близок прорыв в лечении опухолей с помощью семейства белков теплового шока и что нужно сделать, чтобы этот прорыв реализовать.
Основные претензии к Андрей Семеновичу Симбирцеву со стороны профессионального сообщества связаны с тем, что он сильно забегает вперед.
Нельзя так вольно экстраполировать данные, полученные в первичных животных исследованиях, и делать далеко идущие предположения о выводе нового препарата на рынок аж уже через 3-4 года. Тем более, что эти данные не опубликованы и их релевантность никто не оценивал.
Белки теплового шока есть во всех клетках. Однако в разных клетках (особенно опухолевых, которые сильно отличаются при разных видах рака как друг от друга, так и от нормальных клеток организма) эти белки ведут себя по-разному. К примеру, в одних видах рака экспрессия белка HSP-70 может быть как повышенной (при злокачественной меланоме), так и пониженной (при раке почки).
Дадим слово научному эксперту в данном вопросе, который участвовал в исследованиях БТШ и в курсе многих ньюансов.
Чтобы понять, о каком белке идет речь и действительно ли он используется в терапии рака и может помочь при всех его видах, мы поговорили с доктором биологических наук Александром Сапожниковым. Этот ученый — руководитель лаборатории клеточных взаимодействий Института биоорганической химии имени М.М. Шемякина и Ю.А. Овчинникова РАН, которая занимается одним из самых перспективных для разработок в этом направлении белков теплового шока уже много лет. Он так прокомментировал эту статью:
«Я не скажу, что это бред, но это абсолютно некорректная информация. Автором идеи применения белков теплового шока с молекулярной массой 70 килодальтон (так называемые БТШ-70, по-английски HSP70) является мой друг и коллега Борис Маргулис. Он работает в Институте цитологии в Санкт-Петербурге.
Однако белок, который получают из тканей онкологических больных, находится в прочной связи с опухоль-ассоциированными пептидами — теми признаками опухоли, которые распознает иммунная система. Поэтому, когда этот комплекс вводят больным, у большого количества больных вырабатывается иммунный ответ, и получается позитивный эффект для больного.
Что касается Бориса Маргулиса, он (в частности, на базе моей лаборатории) показал (и опубликовал результаты своей работы), что если чистый белок, без всякой опухолевой нагрузки, добавить к опухолевым клеткам, то этот экзогенный белок заставляет опухолевые клетки выставлять на свою поверхность те самые опухолево-ассоциированные пептиды, которые в нормальном состоянии находятся внутри этих клеток, в цитоплазме. Тогда иммунная система их распознает, и организм будет своими силами отторгать эти клетки, бороться с опухолью.
Это было показано в культуре in vitro, то есть не в организме, а в пробирке. К тому же Борис Маргулис претендовал только на детские лейкемии, поскольку он связан с клиницистами в Питере. То, что Симбирцев в своем интервью сказал, — это уже расширение вот такого метода применения голого, чистого белка.
Сам Маргулис не потянул бы доклинические исследования, он получил (лет пять назад) грант совместно с Институтом особо чистых препаратов. В этом институте, видимо, и работает этот Симбирцев, его фамилию я слышал много раз, но коль скоро это Федеральное медико-биологическое агентство, к которому относится Институт иммунологии на Каширке, в котором я много лет работал, то, скорее всего, это Институт особо чистых препаратов, с которым он получил грант на доклинические исследования. В советские годы это было Третье управление Минздрава. Именно с этим институтом был получен грант на доклинику от Минобра на 30 миллионов на три года, который закончился два года назад.
Все бумажные дела Институт особо чистых препаратов сделал, они отчитались по своему гранту, что касается следующей стадии, продвижения препарата, там тоже нужны деньги. Это первая стадия клинических исследований. Тут Борис Маргулис, насколько я понимаю, уже отошел от разработок, отдав это на откуп Институту особо чистых препаратов.
Они делают этот белок, сделали биотехнологию, у меня он даже в холодильнике есть, Борис давал его для испытаний. Они в больших количествах его делают, хранят в лиофилизированной форме (в сухом виде), в стерильных ампулах. Собственно, этот препарат и надо, может быть с какими-то добавками, применять в клинических испытаниях. Но для этого нужны деньги.
Увидев случайно новость с интервью Симбирцева, я прочитал, послал Маргулису, спросил, читал ли он. Борис мне ответил, что Андрей (с которым он хорошо знаком) сделал какую-то глупость, даже не сослался на авторов. Автором этой идеи (применять чистый белок как противоопухолевый препарат в онкологии), повторюсь, является Борис Маргулис. Но, насколько я от него слышал в последнее время, он от этой проблематики отошел.
Но оставим в стороне вопросы научного приоритета, и обратимся к мотивам появления статьи в Известиях.
Таким образом, мотив становится понятен. На руках у разработчика имеется многообещающий кандидат в лекарственный препарат в хорошими перспективами. Но нет средств на продолжение исследований. Половину необходимых средств можно получить в рамках какой-нибудь ФЦП, но еще половину необходимо привлечь из внебюджетных источников финансирования, то есть найти частного инвестора, готового серьезно рискнуть 50 млн.рублей (это очень скромная оценка и если все делать только в России - то есть без перспективы выхода на самые вкусные зарубежные рынки) с перспективой возврата не ранее 2022 года (срок вывода препарат на рынок в самых благоприятных условиях)
Надо отметить, что А.С. Симбирцев немного лукавит, либо его неправильно цитируют журналисты.
Разработка по гранту Минобрнауки в рамках ФЦПИР завершилась в 2014 году. То есть перспективная разработка уже 2 года лежит на полке.
Здесь паспорт проекта и основные результаты.
Необходимо отметить, что судя по перечню отчетных документов, работы выполнена добротно, в соответствии с существующими требованиями. Хотя модельных экспериментов по изучению функциональной активности БШТ на моделях двух видов рака все же маловато. Ну и конечно посмотреть отчеты "изнутри" не помешало бы.
1. Разработка песпективная
2. Денег на её продолжение нет
3. Денег надо много больше, чем запрашивают
4. Результаты предыдущих работ требуют тщательной экспертизы, возможны некоторые придется повторить/переделать
5. Найти частного инвестора в России на таких условиях возврата инвестиций практически нереально.
Белок теплового шока – лекарство против рака, открывающее большие перспективы в лечении этого смертельного заболевания. Они позволяют одновременно блокировать тормозные рецепторы PD-1 и Tim-3, Т-лимфоцитов. Благодаря этому снимается блокировка иммунной системы, активируется естественная противораковая защита организма.
Что такое белки теплового шока (БТШ70)
Это белки, которые вырабатываются при воздействии на клетки высоких температур и других экстремальных факторов. Их синтез активируется при различных интоксикациях, стрессе, воздействии ультрафиолета на кожу. Эти соединения выполняют защитную функцию.
В периоды отсутствия воздействия стрессовых факторов БТШ70 также присутствуют в организме. Они защищают белковые молекулы, из которых построены ткани, позволяют вновь образовавшимся белкам приобрести правильную структуру. Также БТШ70 участвуют в иммунном ответе и связывании антигенов и остатков разрушенных белковых молекул. Именно последнее свойство заинтересовало онкологов.
Механизм действия белков теплового шока при раке
БТШ70 и их коньюгаты с полиэтиленгликолем и фрагментом Ig G1 оказывают блокирующее действие на рецепторы PD-1 и Tim-3, расположенные на поверхности Т-лимфоцитов. Благодаря этому активируется иммунный противоопухолевый ответ организма. Исследования проф. С.Б. Оникиенко и его соавторов показали, что количество PD-1 позитивных клеток снижается в 1,6-2,7 раза, а количество Tim-3 позитивных – в 10,5 раз.

Комбинированная терапия Ниволумабом и БТШ70: результаты клинических исследований
Учитывая механизм действия белков токсического шока, российские ученые решили попробовать использовать их в рамах комбинированной терапии рака вместе с препаратом Ниволумаб.
Результаты клинического исследования показали такие данные: при изолированном применении Ниволумаба регресса опухоли удалось добиться у 16% пациентов, при использовании комбинированной терапии – в 52% случаев.

Следует отметить, что комбинация с БТШ70 позволила снизить дозу Ниволумаба, благодаря чему значительно уменьшилось количество аутоиммунных реакций, которые при изолированном применении препарата мешали дальнейшему лечению у половины пациентов. Белок теплового шока против рака – это важное открытие в сфере онкологии, которое позволяет сделать иммунотерапию более безопасной и эффективной.
Для прогнозирования эффективности лечения БТШ70 используют инкубационные биопробы. Они позволяют in vitro оценить, как влияет терапия на количество комплексов раковых клеток, неассоциированных с лимфоцитами.

Результаты и перспективы
На сегодняшний день доказана эффективность лекарств от рака на основе белков теплового шока у пациентов с меланомой, астроцитомой, опухолями почек, желудка, легких, предстательной железы. Также проводились эксперименты на животных, в ходе которых получен положительный результат.

Учеными разработаны пролонгированные формы БТШ70, позволяющие значительно повысить эффективность лечения. С этой целью используются конъюгаты с Fc-фрагментом Ig G и ПЭГ. Именно эти формы стали основой препаратов, которые используются в комплексе с иммунотерапией.
Комбинированная схема лечения имеет следующие преимущества по сравнению с изолированным использованием Ниволумаба:
- высокая степень активации противоопухолевой защиты организма;
- более высокая эффективность;
- минимальное количество побочных эффектов;
- снижение частоты развития аутоиммунных реакций;
- щадящее действие на организм;
- возможность результативного лечения 4 стадии рака у большего числа пациентов.
БТШ70 также используются и в других схемах терапии онкозаболеваний. Их успешно применяют в сочетании с онколитическими вирусами, радиотерапией. Благодаря масштабным научным исследованиям сегодня можно подобрать эффективный метод лечения для ранее безнадежных пациентов.
Перспективным направлением в лечении рака является персонализированная терапия. Комбинация препаратов подбирается в зависимости от иммунного статуса пациента, который определяется не только в начале, но и в процессе лечения. При гиперэкспрессии PD-1 рецепторов актуальна схема: Ниволумаб+БТШ70.
Использование белков теплового шока – это возможность воспользоваться всеми преимуществами иммунотерапии, при этом значительно сократив процент нежелательных последствий, которые вызывают серьезные изменения в организме и препятствуют дальнейшему лечению. Благодаря новым методикам лечения рака многие люди получили шанс избавиться от смертельного заболевания или прожить намного дольше, чем это было возможно ранее.
Читайте также:

