Авелумаб при раке почки

Тимофеев Илья Валерьевич
Бюро по изучению рака почки,
Российское общество клинической онкологии,
Москва
Почечно-клеточный рак (ПКР) наравне с меланомой традиционно считается моделью для изучения новых подходов иммунотерапии. Еще в 2000-х годах предполагалось, что комбинация двух иммунных препаратов – в то время цитокинов – позволит увеличить общую эффективность лечения [1]. В исследованиях предпринимались неоднократные попытки сочетать интерферон и интерлейкин-2 в различных режимах, однако результаты зачастую оказывались настолько противоречивыми, что монотерапия цитокинами так и осталась стандартом того времени [2]. Вторым направлением было изучение комбинаций цитокинов, колониестимулирующих факторов с вакцинами, что тоже не привело к значимому результату.
Спустя десятилетие иммунотерапия сделала новый виток: появились ингибиторы контрольных точек, блокирующие рецепторы-супрессоры или их лиганды на лимфоцитах и опухолевых клетках. Вместе с тем, появились надежды на комбинации нескольких ингибиторов контрольных точек.
Рак почки стимулирует и подавляет иммунную систему
Известно, что ПКР является иммуногенной опухолью. С одной стороны, опухолеассоциированные антигены, находящиеся на клетках рака почки, активируют специфический иммунитет [3]. С другой стороны, система регуляторных механизмов приводит к иммуносупрессии и дезактивации развивающегося противоопухолевого ответа [4]. Ранее было показано, что присутствие иммунных контрольных точек обуславливает агрессивный фенотип ПКР. В частности, экспрессия рецепторов PD-1 и CTLA-4 на клетках, как первичной опухоли почки, так и метастазов, приводит к худшим показателям общей выживаемости больных метастатическим ПКР 6. Также были описаны два агрессивных фенотипа, связанных с лимфоцитами: CD8+PD-1+Tim-3+Lag-3+ и CD25+CD127-Foxp3+/Helios+GITR+ [8]. Примечательно, что чем больше контрольных точек задействовано, тем агрессивнее течение болезни. Еще в 2009 году Blackburn с соавторами показали, что в отсутствие иммуносупрессорных молекул лимфоцит продуцирует большие количества интерферона-гамма и фактора некроза опухоли, являющиеся показателями активности иммунной клетки [9]. При включении двух контрольных точек активность лимфоцита снижается в 2 раза по сравнению с одной и в 3 раза по сравнению с лимфоцитом без инициированных контрольных точек (рисунок 1). Различия в продукции интерферона лимфоцитом между двумя и тремя активными контрольными точками уже достоверно не определяются. Следовательно, можно предположить, что блокада двух контрольных точек является принципиально значимой для активации иммунной системы.
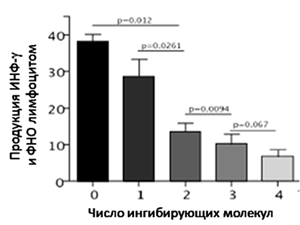
Рисунок 1. Снижение активности лимфоцита при активации ингибирующих молекул (количество от 0 до 4).
Blackburn et al. Nature Immunology 2009 (адаптировано).
Успех иммунотерапии был предопределен в 2015 году
Пять лет назад были опубликованы первые результаты рандомизированного исследования 3 фазы CheckMate 025, в котором изучался ниволумаб [10]. Ниволумаб является моноклональным антителом, действующим на рецептор PD-1. Связывая этот рецептор, ниволумаб приводит к активации лимфоцитов, которые находят опухолевые клетки и поражают их.
В исследовании CheckMate 025 принял участие 821 пациент с метастатическим ПКР и прогрессированием заболевания на первой или второй линии терапии антиангиогенными препаратами. Пациенты были рандомизированы в 2 группы, одна из которых получала ниволумаб (3 мг/кг, внутривенно, каждые 2 недели), а вторая – эверолимус (10 мг внутрь ежедневно).
Основным критерием эффективности была общая выживаемость. Помимо этого проводили оценку объективного ответа, выживаемости без прогрессирования и безопасности применения препарата.
На GU ASCO в 2020 году авторы продемонстрировали окончательные результаты исследования CheckMate 025. Впервые у пациентов с метастатическим ПКР, получавших ингибитор контрольных точек, была проанализирована долгожданная 5-летняя общая выживаемость, которая составила 26%, а ее медиана – 25,8 месяца [11]. Такие показатели, в 2-3 раза превышающие как российские, так и американские результаты, несомненно, впечатляют. Так, в российском исследовании RENSUR5 5-летняя общая выживаемость составила 8,2% (медиана 11 месяцев) [12], а в американской базе SEER – 12% (рисунок 2) [13]. Следует отметить, как в RENSUR5, так и в SEER анализировались пациенты с впервые выявленным распространенным ПКР, в то время как в CheckMate 025 включались пациенты с прогрессированием болезни на стандартной терапии, и даже в этой ситуации результат был лучше.
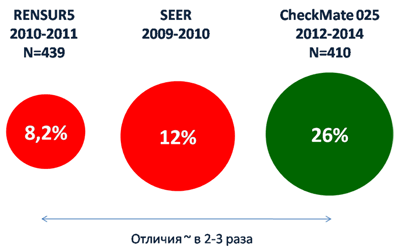
Рисунок 2. Непрямое сравнение показателей 5-летней выживаемости в российском исследовании RENSUR5,
американской базе данных SEER и исследовании CheckMate 025 (указаны годы включения пациентов).
Частота объективных ответов также была удовлетворительной – 23%. В случае развития ответа на лечение медиана продолжительности ответа составила 18,2 месяца. Медиана выживаемости без прогрессирования была 4,2 месяца.
Нежелательные явления 3-4 степени были зарегистрированы у 19% больных, получавших ниволумаб [10]. За 5 лет частота этих нежелательных явлений увеличилась лишь до 21%, что теоретически свидетельствует об отсутствии долгосрочной токсичности. Из всех нежелательных явлений 3-4 степени у больных из группы ниволумаба чаще всего была усталость (2%). Среди других нежелательных явлений у больных, получавших ниволумаб, были отмечены кашель, тошнота, сыпь, одышка, диарея, запор, снижение аппетита, боли в спине и суставах. С течением времени кардинальных изменений различных видов токсичности также не наблюдалось.
Следовательно, ниволумаб в монотерапии оказался в 5 раз более эффективной терапевтической опцией при токсичности меньшей, чем у таргетных препаратов. Первые результаты этого исследования послужили основанием для разработки комбинации для использования в первой линии терапии.
Настоящее. Двойная иммунотерапия в первой линии
Логичным было после успеха иммунотерапии у пациентов с прогрессированием болезни на традиционных таргетных препаратах изучить эффективность нового метода в первой линии терапии. Более того, целесообразным представлялось использование комбинации ингибиторов, блокирующих две контрольные точки – PD-1 и CTLA-4. Поскольку первая линия терапии вносит максимальный вклад в общую выживаемость пациентов с метастатическим ПКР, и зная, что есть достоверное влияние на продолжительность жизни во второй линии, можно было предположить, что ниволумаб в комбинации с ипилимумабом существенно улучшат общий результат лечения впервые выявленного метастатического рака почки. Наконец, предположим, что если у пациента появились метастазы, то опухолевые клетки ускользнули от иммунного надзора и, следовательно, нужно оказать незамедлительное воздействие на иммунную систему в первой же линии терапии.
В регистрационном рандомизированном исследовании 3 фазы CheckMate 214 [14] не получавшие ранее терапию по поводу светлоклеточного метастатического ПКР пациенты были рандомизированы в группу ниволумаба в комбинации с ипилимумабом (N=550) или в группу сунитиниба, выбранного в качестве препарата сравнения (N=546). Исследование было спланировано так, чтобы оценить эффективность терапии в группе промежуточного и плохого прогноза согласно критериям IMDC. Ниволумаб использовался в дозе 3 мг/кг в комбинации с ипилимумабом в дозе 1 мг/кг каждые 3 недели в количестве 4 доз, далее продолжалась терапия ниволумабом в дозе 3 мг/кг каждые 2 недели. Сунитиниб пациенты получали в стандартном режиме 4/2 в дозе 50 мг. Первичными конечными точками в исследовании были общая выживаемость, выживаемость без прогрессирования и частота объективных ответов в группе пациентов с промежуточным и плохим прогнозом.
Статья предоставлена компанией BMS. Публикуется в редакции авторов.
Про фессиональное
решение
про блем
меланомы
- Об Ассоциации
- Документы
- Банковские реквизиты
- Правление
- Координационный Совет
- Члены ассоциации
- Мероприятия
- Календарь событий
- План мероприятий 2020
- Специалистам
- Клинические рекомендации
- Новости
- Информация для специалистов
- Видеоматериалы конференций
- Публикации
- Пациентам
- Информация для пациентов
- Новости для пациентов
- Партнеры
- Контакты
- Войти


- Специалистам
- Информация для специалистов
- Положительное заключение по вопросу о целесообразности регистрации авелумаба для лечения метастатической карциномы Меркеля
Г. Дармштадт, Германия, и г. Нью-Йорк, США, 21 июля 2017 года – компаниями Merck и Pfizer Inc. (индекс на Нью-Йоркской фондовой бирже: PFE ) сегодня объявлено о том, что Комитет по лекарственным средствам, предназначенным для применения у человека (CHMP) при Европейском Агентстве по Лекарственным Средствам порекомендовал зарегистрировать авелумаб* (БАВЕНЦИО) в качестве монотерапии для лечения взрослых пациентов с метастатической карциномой Меркеля (редким и агрессивным кожным злокачественным новообразованием). Европейской комиссией ( EC ) будут рассмотрены рекомендации CHMP ; решение ожидается в третьем квартале 2017 года.
Положительное мнение CHMP основано на результатах исследования JAVELIN Merkel 200, которое представляет собой международное многоцентровое открытое исследование II фазы в единственной группе, разделенное на 2 части:
· Часть A включала 88 пациентов с метастатической карциномой Меркеля, у которых произошло прогрессирование заболевания после по крайней мере одной линии химиотерапии, при этом у 59% пациентов сообщалось об одной предшествующей линии противоопухолевой терапии по поводу метастатической карциномы Меркеля (мКМ), и у 41% пациентов – о двух или более предшествующих линиях терапии. Поданные сведения охватывали минимум 18 месяцев наблюдения .
· Часть B на дату закрытия данных включала 39 пациентов с гистологически подтвержденной мКМ, которые ранее не получали системной терапии по поводу метастатического заболевания, при этом у 29 из них было завершены по крайней мере 12 недель наблюдения. Набор в Часть B этого исследования в настоящее время продолжается, в него планируется включить 112 ранее не получавших терапию пациентов.
Европейская комиссия ( EC ) ранее присвоила авелумабу (человеческому антителу к PD - L 1) статус орфанного препарата ( Orphan Drug Designation , ODD ) для лечения КМ. Для присвоения статуса орфанного препарата в EC лекарственное средство должно быть предназначено для терапии, профилактики или диагностики заболевания, представляющего собой угрозу для жизни либо вызывающего инвалидизацию, распространенность которого в Европейском союзе не превышает 5 случаев на 10000 человек.
Авелумаб был одобрен Управление по контролю над качеством пищевых продуктов и лекарственных средств ( FDA ) в рамках процедуры ускоренной регистрации для лечения взрослых пациентов и подростков в возрасте от 12 лет и старше с метастатической карциномой Меркеля (мКМ); в мае 2017 года он был зарегистрирован для лечения пациентов с местнораспространенным или метастатическим раком мочевого пузыря, у которых произошло прогрессирование заболевания по время или после завершения химиотерапии на основе препаратов платины, либо с прогрессированием заболевания в течение 12 месяцев после завершения неоадъювантной или адъювантной терапии на основе препаратов платины [1]. Данное показание утверждено в рамках процедуры ускоренной регистрации на основании данных/критериев по частоте ответов со стороны опухоли и длительности ответов. Дальнейшая регистрация по данному показанию может быть обусловлена подтверждением и описанием клинической эффективности в дополнительных исследованиях.
Программа клинических разработок авелумаба, известная под названием JAVELIN , состоит из по крайней мере 30 клинических исследований, в которой были изучены более 6000 пациентов с более чем 15 различными типами опухолей. Помимо метастатической КМ, изученные злокачественные новообразования включают рак молочной железы, рак желудка / зоны пищеводно-желудочного перехода, рак головы и шеи, ходжкинскую лимфому, меланому, мезотелиому, немелкоклеточный рак легкого, рак яичника, почечноклеточный рак и рак мочевого пузыря.
* Авелумаб не зарегистрирован ни по одному показанию ни на одном из рынков вне США. БАВЕНЦИО®- проприетарное наименование для исследуемого препарата авелумаб, поданное в Европейское агентство по лекарственным средствам.
О метастатической карциноме Меркеля (мКМ)
Метастатическая КМ – редкое агрессивное заболевание, при котором образуются злокачественные клетки в верхнем слое кожи, вблизи нервных окончаний [2,3]. КМ, известная также как нейроэндокринный рак кожи или трабекулярный рак кожи, часто развивается в областях кожи, в наибольшей степени подверженных воздействию солнечного света, включая голову и шею, а также верхние конечности [2,4]. Факторы риска развития КМ включают инсоляцию и инфицирование полиомавирусом клеток Меркеля. Риск повышен у мужчин европеоидной расы старше 50 лет [2,4]. КМ – это высокоиммуногенная злокачественная опухоль, вследствие чего более риск ее развития выше у пациентов с иммунодефицитами (например, у реципиентов трансплантатов солидных органов, пациентов с ВИЧ/СПИД, а также у людей с другими злокачественными новообразованиями, например, с хроническим лимфолейкозом) [2, 4]. Вместо КМ часто ставится ошибочный диагноз других видов рака кожи, а на коже, хронически повреждаемой под воздействием солнца, он растёт с экспоненциальной скоростью 6. Существующие виды лечения КМ в Европе включают оперативное вмешательство, лучевую терапию и химиотерапию [3]. Лечение метастатической (или IV стадии) КМ в основном паллиативное [3].
Об исследовании JAVELIN Merkel 200
Эффективность и безопасность авелумаба установлены в открытом международном многоцентровом исследовании II фазы JAVELIN Merkel 200, проводимом в единственной группе пациентов с разделением на 2 части:
· Часть A проводилась у 88 пациентов с гистологически подтвержденной мКМ, у которых произошло прогрессирование заболевания во время или после химиотерапии по поводу отдаленных метастазов. Ожидаемая продолжительность жизни в этой популяции пациентов должна была составлять более 3 месяцев. В целом, в Части A у 59% пациентов сообщалось об одной предшествующей линии противоопухолевой терапии по поводу мКМ, и у 41% – о двух или более линиях предшествующей терапии. Поданные сведения охватывали минимум 18 месяцев наблюдения. Основными параметрами эффективности в части А являлись наилучшие общие ответы и их длительность, согласно критериям RECIST (Критериям оценки ответа со стороны солидных опухолей - Response Evaluation Criteria in Solid Tumors ) в версии 1.1; оценка проводилась независимым центральным комитетом ( independent central review committee , IRC ), не обладающим информацией о характере лечения индивидуальных пациентов; вторичные конечные точки эффективности включали длительность ответа и выживаемость без прогрессирования (ВБП).
· Часть B на дату закрытия данных включала 39 пациентов с гистологически подтвержденным мКМ, которые ранее не получали системной терапии по поводу метастатического заболевания, при этом у 29 из них было завершены по крайней мере 12 недель наблюдения. Набор в Часть B этого исследования в настоящее время продолжается, в него планируется включить 112 ранее не получавших терапию пациентов. Основной конечной точкой эффективности является устойчивый ответ, определяемый как объективный ответ (полный или частичный ответ) длительностью по крайней мере 6 месяцев; вторичные конечные точки включают наилучший общий ответ, длительность ответа, выживаемость без прогрессирования и общую выживаемость (ОВ).
Из исследования исключались пациенты с метастазами в ЦНС (в анамнезе или в настоящее время), с аутоиммунными заболеваниями, с наличием в анамнезе других злокачественных новообразований за последние 5 лет, после трансплантации органов, а также с медицинскими состояниями, по поводу которых требовалась системная иммуносупрессивная терапия, с активной ВИЧ-инфекцией, вирусными гепатитами B или C. Пациенты получали препарат авелумаб в дозе 10 мг/кг в виде внутривенных инфузий на протяжении 60 минут каждые 2 недели вплоть до прогрессирования заболевания или неприемлемой токсичности.
Об авелумабе
Показания
Авелумаб был одобрен Администрацией США по пищевым продуктам и лекарственным средствам ( FDA ) в рамках процедуры ускоренной регистрации для лечения ( i ) взрослых и педиатрических пациентов в возрасте от 12 лет и старше с метастатической карциномой Меркеля (мКМ); ( ii ) пациентов с местнораспространенным или метастатическим раком мочевого пузыря, у которых произошло прогрессирование заболевания по время или после завершения химиотерапии на основе препаратов платины, либо с прогрессированием заболевания в течение 12 месяцев после завершения неоадъювантной или адъювантной терапии на основе препаратов платины. Данные показания были одобрены в рамках процедуры ускоренной регистрации на основании данных по частоте ответов со стороны опухоли и длительности ответов. Дальнейшая регистрация по этим показаниям может быть обусловлена подтверждением и описанием клинической эффективности в дальнейших исследованиях.
Важная информация о безопасности
Предупреждения и предостережения при применении препарата БАВЕНЦИО включают иммуноопосредованные нежелательные реакции (в частности, пневмонит, гепатит, колит, эндокринопатии, нефрит и нарушение функции почек, а также прочие нежелательные реакции), инфузионные реакции, а также токсичность в отношении эмбриона и плода.
Наиболее распространённые нежелательные реакции (встречавшиеся у не менее чем 20% пациентов) у больных, получавших авелумаб по поводу метастатической КМ, а также по поводу распространенного или метастатического рака уротелия, включали слабость, скелетно-мышечные боли, диарею, тошноту, инфузионные реакции, периферические отеки, снижение аппетита / гипофагию, инфекции мочевыводящих путей и сыпь.
О компании Pfizer Inc.: совместная работа для построения более здорового мира®
Литературные источники
1. BAVENCIO Prescribing Information. Rockland, MA: EMD Serono Inc.; 2017.
2. Schadendorf D et al. Merkel cell carcinoma: epidemiology, prognosis, therapy and unmet medical needs. European Journal of Cancer 2017;71;53–69
3. American Cancer Society. What is Merkel cell carcinoma?
4. Nghiem P. Systematic literature review of efficacy, safety and tolerability outcomes of chemotherapy regimens in patients with metastatic Merkel cell carcinoma. Future Oncology 2017;13(14):1263–1279.
6. NCCN Merkel Cell Carcinoma Guidelines version I. 2017.
www . nccn . org / professionals / physician _ gls / PDF / mcc . pdf . Доступ проверялся в июне 2017 года.
Фармакологическое действие
Авелумаб — представляет собой антитело к белку PD-L1.
PD-L1 может быть экспрессирован на опухолевых клетках и опухолепроникающих иммунных клетках и может способствовать ингибированию противоопухолевого иммунного ответа в микроокружении опухоли. Связывание PD-L1 с рецепторами PD-1 и B7.1, обнаруженное на Т-клетках и антигенпредставляющих клетках, подавляет активность цитотоксических Т-клеток, пролиферацию Т-клеток и продуцирование цитокинов. Авелумаб связывает PD-L1 и блокирует взаимодействие между PD-L1 и его рецепторами PD-1 и B7.1. Это взаимодействие блокирует ингибирующие эффекты PD-L1 на иммунный ответ, приводящее к восстановлению иммунных реакций, включая противоопухолевые иммунные ответы. Было также показано, что авелумаб индуцирует антителозависимую клеточно-опосредованную цитотоксичность in vitro. В сингенных опухолевых моделях мыши блокирование активности PD-L1 приводило к уменьшению роста опухоли.
Фармакокинетика
Фармакокинетика авелумаба изучалась у 1629 пациентов, получавших дозы от 1 до 20 мг/кг каждые 2 недели. Данные показали, что экспозиция авелумаба увеличивалась пропорционально дозе в диапазоне доз 10–20 мг/кг каждые 2 недели. Стабильные концентрации авелумаба достигались через приблизительно 4–6 недель (2–3 цикла) дозирования, а системное накопление было приблизительно в 1,25 раза.
Геометрический средний объём распределения в стационарном состоянии после введения дозы 10 мг/кг, составлял 4,72 л.
Основным механизмом элиминации авелумаба является протеолитическая деградация. На основе популяционного фармакокинетического анализа у пациентов с солидными опухолями общий системный клиренс составил 0,59 л/сут, а период полувыведения составил 6,1 дня у пациентов, получавших 10 мг/кг.
Показания
Метастатическая карцинома из клеток Меркеля у взрослых и детей старше.
Распространённый или метастатический рак мочевого пузыря у пациентов которые:
- проявляют прогрессирование заболевания во время или после проведения платиносодержащей химиотерапии;
- прогрессирование заболевания в течение 12 месяцев после проведения неоадъювантного или адъювантного лечения платиносодержащей химиотерапией.
Противопоказания
- Повышенная чувствительность к авелумабу;
- беременность;
- лактация.
Беременность и грудное вскармливание
Способ применения и дозы
Рекомендуемая доза авелумаба составляет 10 мг/кг в виде внутривенной инфузии в течение 60 минут каждые 2 недели до прогрессирования заболевания или развития неприемлемой токсичности.
Побочные действия
Побочные реакции у ≥10 % пациентов, получающих авелумаб в исследовании JAVELIN Merkel 200 Trial (метастатическая карцинома из клеток Меркеля): утомляемость, инфузионные реакции, периферические отеки, скелетно-мышечная боль, артралгия, понос, тошнота, запор, боль в животе, рвота, сыпь и зуд кожи, снижение аппетита, снижение веса, кашель, одышка, головокружение, головная боль, повышенное артериальное давление.
Побочные реакции в ≥10 % пациентов с распространённым или метастатическим раком мочевого пузыря в исследовании JAVELIN Solid Tumor: тошнота, боль в животе, понос, запор, рвота, утомляемость, инфузионные реакции, периферические отеки, лихорадка, инфекции мочевыводящих путей, снижение веса, скелетно-мышечная боль, одышка, кашель, сыпь и зуд кожи, повышенное артериальное давление/гипертонический криз.
Взаимодействие
Клинически значимых взаимодействий с другими лекарственными средствами не описано.
Особые указания
Авелумаб может вызывать иммуно-опосредованные побочные реакции в том числе с летальным исходом. Среди них иммуно-опосредованный пневмонит, иммуно-опосредованный колит, иммуно-опосредованный гепатит, иммуно-опосредованные эндокринопатии и поражения почек.
Авелумаб может вызывать серьёзные и опасные для жизни реакции, связанные с инфузией. Премедикация с антигистаминными препаратами и парацетамолом необходима перед первыми 4 инфузиями. Необходим мониторинг пациентов с признаками инфузионных реакций, включая пирексию, озноб, покраснение, гипотонию, одышку, боли в спине, боли в животе и крапивницу.
Хранить в холодильнике при температуре от 2 °C до 8 °C, в оригинальной упаковке для защиты от света. Не замораживать и не встряхивать.

14 мая 2019 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило применение Авелумаба (Bavencio®, EMD Serono, Inc.) в комбинации с Акситинибом как метод первого выбора в лечении пациентов с прогрессирующей почечно-клеточной карциномой (раком почки — RCC).
Что представляют собой препараты из новой схемы
Авелумаб — цельное моноклональное антитело изотипа IgG1, которое связывается с запрограммированным лигандом смерти 1 (PD-L1) и блокирует его связывание с рецепторами программируемой гибели клеток 1 (PD-1).
Образование комплекса рецептор PD-1 /лиганд PD-L1 приводит к ингибированию T-клеток класса (CD8 +) и к подавлению иммунной реакции.
Иммунотерапия направлена на прекращение этого подавления путем блокирования создания пар лигандов/рецепторов. В случае авелумаба образование пар PD-1/PDL1 блокируется, и иммунный ответ Т-клеток повышается.
Таким образом, Авелумаб относится к группе ингибиторов контрольных точек — препаратов, восстанавливающих противоопухолевый иммунитет.
Акситиниб — тоже довольно новый препарат, основной механизм действия которого связан с рецептором 1-3 сосудистого эндотелиального фактора роста, воздействуя на который, препарат подавляет ангиогенез (образование новых кровеносных сосудов опухолями).

Было также высказано предположение, что это не единственный механизм лекарственного воздействия у Акситиниба.
Он может действовать, вызывая аутофагию, как ингибиторы тирозинкиназы, такие как сорафениб .
Также он может связываться со слитым белком BCR-ABL, специфически ингибируя устойчивую к лекарственным средствам мутантную изоформу T315I.
Как проходило исследование
Пациенты были разделены на две группы. Первая получала внутривенные инфузии Авелумаба по 10 мг/кг каждые 2 недели в сочетании с пероральным приемом акситиниба по 5 мг два раза в день.
Пациенты второй группы были пролечены Сунитинибом (устоявшийся препарат первого выбора) в дозах по 50 мг один раз в день перорально в течение 4 недель с последующим перерывом на 2 недели до радиографического прогрессирования или неприемлемой токсичности.
Основными конечными точками эффективности были выживаемость без прогрессирования заболевания (PFS), оцененная с помощью слепого независимого центрального обзора с использованием RECIST v1.1, и общая выживаемость (OS) у пациентов с PD-L1-позитивными опухолями.
Результаты исследования
Статистически значимое улучшение PFS было продемонстрировано у пациентов с PD-L1-позитивными опухолями. Статистически значимое улучшение PFS в общей популяции также было продемонстрировано при промежуточном анализе.
Медиана PFS в общей популяции составила 13,8 мес для пациентов, получавших авелумаб плюс акситиниб, и 8,4 мес для пациентов, получавших сунитиниб. При средней общей выживаемости в группе авелумаба течение 19 месяцев против 9,6 месяцев в группе синитиниба.

Наиболее частыми побочными реакциями авелумаба в комбинации с акситинибом у ≥ 20% пациентов с ПКР были:
- диарея;
- повышенная утомляемость;
- гипертония;
- мышечно-скелетные боли;
- тошнота;
- воспаление слизистых оболочек;
- ладонно-подошвенная эритродизестезия;
- дисфония;
- снижение аппетита;
- гипотиреоз;
- сыпь;
- кашель;
- и головная боль.
Гепатотоксичность 3 или 4 степени наблюдалась у 9% пациентов и приводила к постоянной отмене Авелумаба или Акситиниба у 7%. Основные побочные явления со стороны сердца имели место у 7% пациентов, получавших комбинацию.
Рекомендуемая доза Авелумаба для пациентов с прогрессирующим ПКР определена в 800 мг в виде внутривенных инфузий каждые 2 недели в комбинации с 5 мг Акситиниба перорально два раза в день.
Перспективы использования
Новая схема предоставляет возможность по более длительному контролю прогрессирующего рака почек. Что в свою очередь способно обеспечить пациенту даже с устойчивой формой этого онкологического заболевания дополнительные 8-9 месяцев жизни. При этом для пациентов с более чувствительными к новой схеме лечения опухолями можно добиться остановки прогрессирования заболевания более чем на год!
Содержание
- 1 Латинское название
- 2 Фармакологическая группа
- 3 Характеристика вещества
- 4 Фармакология
- 5 Применение
- 6 Авелумаб: Противопоказания
- 7 Применение при беременности и кормлении грудью
- 8 Авелумаб: Побочные действия
- 9 Взаимодействие
- 10 Авелумаб: Способ применения и дозы
- 11 Меры предосторожности
- 12 Условия хранения
- 13 Торговые наименования
- 14 МКБ-10
Авелумаб представляет собой антитело к белку PD-L1. Авелумаб является гуманизированным моноклональным антителом IgG1лямбда, которое имеет молекулярную массу приблизительно 147 кДа.
Механизм действия
PD-L1 может быть экспрессирован на опухолевых клетках и опухолепроникающих иммунных клетках и может способствовать ингибированию противоопухолевого иммунного ответа в микроокружении опухоли. Связывание PD-L1 с рецепторами PD-1 и B7.1, обнаруженное на Т-клетках и антигенпредставляющих клетках, подавляет активность цитотоксических Т-клеток, пролиферацию Т-клеток и продуцирование цитокинов. Авелумаб связывает PD-L1 и блокирует взаимодействие между PD-L1 и его рецепторами PD-1 и B7.1. Это взаимодействие блокирует ингибирующие эффекты PD-L1 на иммунный ответ, приводящее к восстановлению иммунных реакций, включая противоопухолевые иммунные ответы. Было также показано, что авелумаб индуцирует антителозависимую клеточно-опосредованную цитотоксичность in vitro. В сингенных опухолевых моделях мыши блокирование активности PD-L1 приводило к уменьшению роста опухоли.
Фармакокинетика
Фармакокинетика авелумаба изучалась у 1629 пациентов, получавших дозы от 1 до 20 мг/кг каждые 2 недели. Данные показали, что экспозиция авелумаба увеличивалась пропорционально дозе в диапазоне доз 10-20 мг/кг каждые 2 недели. Стабильные концентрации авелумаба достигались через приблизительно 4-6 недель (2-3 цикла) дозирования, а системное накопление было приблизительно в 1,25 раза.
Распределение
Геометрический средний объем распределения в стационарном состоянии после введения дозы 10 мг/кг, составлял 4,72 л.
Основным механизмом элиминации авелумаба является протеолитическая деградация. На основе популяционного фармакокинетического анализа у пациентов с солидными опухолями общий системный клиренс составил 0,59 л/сут, а период полувыведения составил 6,1 дня у пациентов, получавших 10 мг/кг.
- Авелумаб показан для лечения метастатической карциномы из клеток Меркеля у взрослых и детей старше.
- Авелумаб показан для лечения распространенного или метастатического рака мочевого пузыря у пациентов, которые проявляют прогрессирование заболевания во время или после проведения платиносодержащей химиотерапии.
Авелумаб противопоказан при беременности и лактации.
Побочные реакции у ≥ 10% пациентов, получающих авелумаб в исследовании JAVELIN Merkel 200 Trial (метастатическая карцинома из клеток Меркеля): утомляемость, инфузионные реакции, периферические отеки, скелетно-мышечная боль, артралгия, понос, тошнота, запор, боль в животе, рвота, сыпь и зуд кожи, снижение аппетита, снижение веса, кашель, одышка, головокружение, головная боль, повышенное АД.
Побочные реакции у ≥ 10% пациентов с распространенным или метастатическим раком мочевого пузыря в исследовании JAVELIN Solid Tumor: тошнота, боль в животе, понос, запор, рвота, утомляемость, инфузионные реакции, периферические отеки, лихорадка, инфекции мочевыводящих путей, снижение веса, скелетно-мышечная боль, одышка, кашель, сыпь и зуд кожи, повышенное АД/гипертонический криз.
Рекомендуемая доза авелумаба составляет 10 мг/кг в виде внутривенной инфузии в течение 60 минут каждые 2 недели до прогрессирования заболевания или развития неприемлемой токсичности.
Иммуно-опосредованный побочные реакции
Авелумаб может вызывать иммуно-опосредованные побочные реакции в том числе с летальным исходом. Среди них иммуно-опосредованный пневмонит, иммуно-опосредованный колит, иммуно-опосредованный гепатит, иммуно-опосредованные эндокринопатии и поражения почек.
Инфузионные реакции
Авелумаб может вызывать серьезные и опасные для жизни реакции, связанные с инфузией. Премедикация с антигистаминными препаратами и парацетамолом необходима перед первыми 4 инфузиями. Необходим мониторинг пациентов с признаками инфузионных реакций, включая пирексию, озноб, покраснение, гипотонию, одышку, боли в спине, боли в животе и крапивницу.
Хранить в холодильнике при температуре от 2 °C до 8 °C, в оригинальной упаковке для защиты от света. Не замораживать и не встряхивать.
Бавенсио: флакон 200 мг/10 мл; Merck KGaA
Читайте также:

