Аутоиммунный лимфопролиферативный синдром клинические рекомендации

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
- Код по МКБ-10
- Патогенез
- Симптомы
- Формы
- Диагностика
- Что нужно обследовать?
- Какие анализы необходимы?
- Дифференциальная диагностика
- Лечение
- Прогноз

Аутоиммунный лимфопролиферативный синдром (АЛПС) - заболевание, в основе развития которого лежат врожденные дефекты Fas-опосредоаанного апоптоза. Оно было описано в 1995 г., но еще с 60-х годов заболевание со схожим фенотипом было известно под названием синдром CanaLe-Smith.
Заболевание характеризуется хронической незлокачественной лимфопролиферацией и гипергаммаглобулинемией, которые могут сочетаться с различными аутоиммунными нарушениями.

[1], [2], [3], [4], [5]
Код по МКБ-10
Патогенез
Апоптоз, или физиологическая гибель клетки, является одним из неотъемлемых механизмов поддержания гомеостаза организма. Апоптоз развивается вследствие активации различных сигнальных механизмов. Особую роль в регуляции системы гемопоэза и иммунной системы играет апоптоз, опосредованный активацией Fas-рецепторов (CD95) при их взаимодействии с соответствующим лигандом (Fas-лиганд, FasL). Fas представлен на различных гемопоэтических клетках, высокая экспрессия Fas рецептора характерна для активированных лимфоцитов. Fasl-экспрессируется, главным образом, CD8+T-лимфоцитами.
Активация Fas рецептора влечет за собой ряд последовательных внутриклеточных процессов, итогом которых является дезорганизация ядра клетки, денатурация ДНК, изменения мембраны клетки, приводящие к ее распаду на ряд фрагментов без выброса во внеклеточную среду лизосомальных ферментов и без индукции воспаления. В передаче апоптотического сигнала к ядру участвует ряд ферментов, называемых каспазами, в том числе каспаза 8 и каспаза 10.
Fas-опосредованный апоптоз играет важную роль в элиминации клеток с соматическими мутациями, аутореамтивных лимфоцитов, а также лимфоцитов, выполнивших свою роль в процессе нормального иммунного ответа. Нарушение апоптоза Т-лимфоцитов приводит к экспансии активированных Т-клеток, а также так называемых двойных негативных Т-лимфоцитов, которые экспрессируют Т-клеточный рецептор с a/b цепями (TCRa/b), но не имеют ни CD4, ни CD8 молекул. Дефект программируемой гибели В-клеток в совокупности с повышением уровня интерлейкина 10 (IL-10) приводят к гипергаммаглобулинемии и повышению выживаемости аутореактивных В-лимфоцитов. Клиническими последствиями являются избыточное накопление лимфоцитов в крови и лимфоидных органах, увеличение риска аутоиммунных реакций и опухолевого роста.
К настоящему времени выявлено несколько молекулярных дефектов, приводящих к нарушению апоптоза и развитию АЛЛС. Это мутации в генах Fas, FasL, каспазы 8 и каспаэы 10.

[6], [7], [8], [9], [10], [11], [12], [13]
Симптомы аутоиммунного лимфопролиферативного синдрома
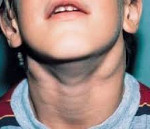
АЛПС отличается большой вариабельностью спектра клинических проявлений и тяжести течения, и возраст клинической манифестации также может колебаться в зависимости от выраженности симптоматики. Известны случаи дебюта аутоиммунных проявлений во взрослом возрасте, когда и был диагностирован АЛПС. Проявления лимфопролиферативного синдрома присутствуют с рождения в виде увеличения всех групп лимфоузлов (периферических, внутригрудных, внутрибрюшных), увеличения размеров селезенки, а часто и печени. Размеры лимфоидных органов могут изменяться в течение жизни, иногда отмечено их нарастание при интеркуррентных инфекциях. Лимфоузлы имеют обычную консистенцию, иногда плотноваты; безболезненны. Известны случаи резко выраженных проявлений гиперпластического синдрома, имитирующих лимфому, с увеличением периферических лимфоузлов, приводящим к деформации шеи, гиперплазией внутригрудных лимфоузлов вплоть до развития синдрома сдавления и дыхательной недостаточности. Описаны лимфоидные инфильтраты в легких. Однако во многих случаях проявления гиперпластического синдрома не столь драматичны, и они остаются незамеченными врачами и родителями. Степень выраженности спленомегалии также весьма вариабельна.
Тяжесть течения заболевания определяется главным образом аутоиммунными проявлениями, которые могут развиться в любом возрасте. Чаще всего встречаются различные иммунные гемопатии - нейтропения, тромбоцитопения, гемолитическая анемия, которые могут сочетаться в виде двух- и трехростковых цитопений. Может иметь место единичный эпизод иммунной цитопении, но зачастую они носят хронический или рецидивирующий характер.
Из других, более редких аутоиммунных проявлений, могут наблюдаться аутоиммунный гепатит, артрит, сиаладенит, воспалительные заболевания кишечника, узловатая эритема, панникулит, увеит, синдром Guiltain-Barre. Кроме того, могут наблюдаться различные кожные сыпи, преимущественно уртикарные, субфебрилитет или лихорадка без связи с инфекционным процессом.
У больных аутоиммунным лимфопролиферативным синдромом увеличена частота развития злокачественных опухолей по сравнению с популяцией. Описаны случаи гемобластозов, лимфом и солидных опухолей (карцинома печени, желудка).

[14]
Формы
В 1999 г. предложена рабочая классификация аутоиммунного лимфопролиферативного синдрома, основанная на типе дефекта апоптоза:
- ALP5 0 - полный дефицит CD95, являющийся следствием гомозиготной нуль-мутации (homozygous nuLl mutation) в гене Fas/CD95;
- ALPS I - дефект передачи сигнала через Fas-рецептор.
- При этом ALPS la является следствием дефекта Fas-рецептора (гетерозиготная мутация в гене Fas);
- ALPS lb является следствием дефекта Fas-лиганда (FasL), связанного с мутацией в соответствующем гене - FASLG/CD178;
- ALPS Ic является следствием только что выявленной гомозиготной мутации в гене FA5LG/CD178;
- ALPS II - дефект внутриклеточной передачи сигнала (мутация в гене каспазы 10 - ALPS IIа, в гене каспазы 8 - ALPS IIb);
- ALPS III - молекулярный дефект не установлен.
АЛПС 0 типа - полный дефицит CD95 - описан всего лишь у нескольких пациентов, Поскольку гетерозиготные члены семей не имеют фенотипа АЛПС, была предложена гипотеза о аутосомно-рецессивном типе наследования. Однако, неопубликованные данные о наблюдении за семьей, в которой был выявлен пациент с АЛПС 0, не полностью согласуются с данным утверждением. Ученые выяснили, что многие, если не все, мутации являются доминантными, и что если они оказываются гомозиготными, это приводит к более выраженному фенотипу заболевания.
При АЛПС I типа тип наследования - аутосомно-доминантный, с неполной пенетрантностью и вариабельной экспрессивностью. В частности, при АЛПС1а описаны случаи гомозиготности или сочетанной гетерозиготности, при которой определяются различные мутации гена Fas в обеих аллелях. Эти случаи характеризовались тяжелым течением с пренатальной или неонатальной манифестацией (водянка плода, гепатоспленомегалия, анемия, тромбоцитопения). Кроме того, выявлена корреляция выраженности клинической симптоматики с типом мутации в гене Fas; для мутации во внутриклеточном домене характерно более тяжелое течение. Всего в мире описано более 70 пациентов с ALPS la. Мутация FasL была впервые описана у пациента с клиническими проявлениями системной красной волчанки и хронической лимфопролиферацией. Она была категоризирована как ALPS lb, хотя фенотип не полностью отвечал критериям классического аутоиммунного лимфопролиферативного синдрома (двойные негативные Т-клетки и спленомегалия отсутствовали). Первая гомозиготная мутация А247Е в гене FasL (внеклеточный домен) была описана недавно, в 2006 году, Del-Rey M et al. у пациента с нелетальным АЛПС, что говорит о важной роли терминального домена FasL C0OH во взаимодействии Fas/FasL. Авторы предлагают в действующую классификацию аутоиммунного лимфопролиферативного синдрома внести подгруппу ALPS Ic.
АЛПС II типа наследуется по аутосомно-рецессивному типу, и у многих пациентов с этим типом заболевания отмечалась типичная клиническая и иммунологическая АЛПС, включая нарушенный Fas-опосредованный апоптоз, в реализации которого задействованы как каспаза 8 (вовлечена на ранних этапах межклеточной передачи сигнала на уровне взаимодействий TCR и BCR), так и каспаза 10 (вовлечена в апоптотический каскад на уровне всех известных рецепторов, которые индуцируют апоптоз лимфоцитов).
Более чем у 30 пациентов была выявлена клиническая картина АЛПС средней степени выраженности, включавшая в себя гипергаммаглобулинемию и повышенный уровень двойных негативных Т-клеток в крови, причем активированные лимфоциты пациентов с АЛПС III типа (именно так был назван этот синдром) показывали нормальную активацию Fas-опосредованного пути in vitro, и никаких молекулярных дефектов найдено не было. Возможно, причиной заболевания служат нарушений других апоптотических путей, опосредованных, например, Trail-R, DR3 или DR6. Интересным кажется наблюдение R. Qementi о выявлении мутации N252S в гене перфорина (PRF1) у больного с АЛПС III типа, у которого наблюдалось существенное снижение НК-активности. При этом автор отмечает, что значительная разница между частотой обнаружения N252S у пациентов с АЛПС (2 из 25) и частотой ее выявления в группе контроля (1 из 330) заставляет предполагать ее связь с развитием АЛПС в итальянской популяции. С другой стороны, F. Rieux-Laucat отмечает, что данный вариант мутации PRF1 выявлялся им у 18% здоровых и у 10% больных АЛПС (неопубликованные данные). И, кроме того, наряду с полиморфизмом N252S, им найдена мутация гена Fas у пациента с АЛПС и его здорового отца, что, по мнению F.Rieux-Laucat, говорит о непатогенности гетерозиготной мутации N252S в гене перфорина, описанной несколько ранее R. Qementi у пациента с АЛПС (мутация Fas) и крупноклеточной В-лимфомой. Таким образом, вопрос о причинах возникновения АЛПС III типа на сегодняшний день остается открытым.

[15], [16], [17], [18]
Лимфопролиферативный синдром
Аутоиммунный лимфопролиферативный синдром
ALPS – группа заболеваний в основе патогенеза которых лежит нарушение FAS опосредованного апоптоза. Белок FAS относится к группе TNF рецепторов и является одним из главных участников регуляции запрограммированной клеточной гибели. Манифестация заболевания чаще всего наблюдается в первые годы жизни. Основными клиническими и лабораторными проявлениями являются:
- Хроническая лимфоаденопатия без признаков малигнизации
- Спленомегалия
- Экспансия CD4-CD8- Т клеток (DNT) более 1%
- Поликлональная гипергаммаглобулинемия
- Т- и В- клеточный лимфоцитоз
- У 80% пациентов наблюдается наличие аутоантител (антикардиолипина или Coombs антител)
- У 50% пациентов обнаружены аутоиммунные заболевания (аутоиммунная гемолитическая анемия, идиопатическая тромбоцитопеническая пурпура, аутоиммунная нейтропения и др.)
ALPS — наследственное аутосомно доминантное заболевание, но у 2% пациентов заболевание обусловлено соматическими мутациями гена FAS в CD4-CD8- Т клетках (DNT).
Генетически ALPS подразделяют на шесть типов:
Соматические
мутации в гене FAS
По литературным источникам у 65% пациентов заболевание обусловлено мутациями в генах FAS и CASP10. CASP10 — внутриклеточный белок (цистин-аспарагин кислотная протеаза), активация которого необходима для осуществления апоптоза. У 50% ALPS пациентов IA и Im типов мутации обнаруживаются в экзоне 9 гена FAS, кодирующем домен, ответственный за взаимодействие с молекулой FADD.
Постановка клинического диагноза ALPS требует проведения ряда иммунологических исследований и консультации высококвалифицированного врача-иммунолога. Подтверждением диагноза является обнаружение мутации в гене, ответственном за развитие заболевания. ALPS требует назначения специального лечения и регулярного наблюдения в специализированном медицинском центре.
В Центре Молекулярной генетики разработана методика поиска мутаций в гене FAS у больных с ALPS IA типа, которая позволяет провести прямую диагностику данного заболевания, дает возможность установить гетерозиготное носительство мутации у родителей больного и провести пренатальную ДНК-диагностику на раннем сроке беременности (9-11 недель).
При проведении пренатальной (дородовой) ДНК-диагностики в отношении конкретного заболевания, имеет смысл на уже имеющемся плодном материале провести диагностику частых анеуплоидий (синдромы Дауна, Эдвардса, Шерешевского-Тернера и др), пункт 54.1. Актуальность данного исследования обусловлена высокой суммарной частотой анеуплоидий — около 1 на 300 новорожденных, и отсутствием необходимости повторного забора плодного материала.
Х-сцепленный лимфопролиферативный синдром. Симптомы. Диагностика. Лечение
Патогенез Х-сцепленного лимфопролиферативного синдрома
EBV отностится к семейству человеческих герпес-вирусов, он персистирует в клетках хозяина в течение всей жизни. Внедрение EBV в организм приводит к развитию различных состояний, от бессимптомного носительства до развития тяжелых EBV инфекций, лимфопролиферативных и онкологических заболеваний.
Вирусная частица состоит из оболочки — суперкапсида, несущей капсидные гены (вирусный капсидный антиген — VCA и ранний антиген — ЕА) и поверхностные гликопротеины, способствующие внедрению вируса в клетку; тега-мента, включающего белки, необходимые для репликации вируса; ядра, содержащего вирусную ДНК, заключенного в оболочку — нуклеокапсид. Одна часть них белков ответственна за внедрение в клетки-мишени и репликацию вируса. Действие других вирусных протеинов направлено на снижение уэнаваемости EBV иммунной системой хозяина в течение латентной персистенции. Вирусный геном представляет собой двуцепочечную ДНК, состоящую примерно из 172 тысяч пар нуклеотидов, кодирующих около 100 протеинов.
Инфицированного EBV среди населения в среднем составляет 90%. В 70% случаев инфицирование происходит до 3 лет. К 50 годам инфицированность ЕBV достигает 100%. Большинство людей переносит инфекцию субклинически или в виде легкого катарального синдрома в детском и подростковом возрасте. Клинически выраженная первичная инфекция протекает главным образом в ниде инфекционного мононуклеоза в возрасте 5-15 лет. После перенесенной первичной EBV-инфекции остается персистенция вируса в В-клетках памяти на протяжении всей жизни.
Внедрение E8V в клетки иммунной системы ведет к реализации цепочки сложных взаимодействий вирусных белков с клеточными протеинами, результатом которых является поликлональная активация трансформированных вирусом лимфоцитов.
В норме иммунный ответ на продуктивную (острая или реактивация латентной) инфекцию EBV осуществляется посредством элиминирования инфицированных вирусом В-кпеток цитотаксическими Т-лимфоцитами (преимущественно CD8+) и NK-клетками и действием нейтрализующих антител, которые тормозят распространение вируса между клетками-мишенями.
Активация Т- и NK-клеток инициируется взаимодействием лигандов зараженного В-лимфоцита с поверхностными молекулами, относящиеся к суперсемейству иммуноглобулинов, гомологичными CD2: Сигнальной молекулой, активирующей лимфоциты (signaling Lymphocytic activation molecule — SLAM (CD150), 2B4 (CD244), Ly-9 (CD229), CD84. В результате соединения SLAM с SLAM-ассоциированным протеином (SAP) в цитоплазме Т-клетки происходит передача сигнала активации лимфоцита. SAP необходим и для передачи активационного сигнала с 2В4 на NK-клетках.
При заражении EBV индивидуумов с дефектами гена SAP реализуется фенотип Х-сцепленного лимфопролиферативного синдрома. Для таких больных характерно нарушение активации и снижение цитотоксичности CD8+ и NK-клеток, уменьшение синтеза провоспалительных и регуляторных цитокинов.
Симптомы Х-сцепленного лимфопролиферативного синдрома
В результате нарушения иммунного ответа, ведущего к неконтролируемой пролиферации трансформированных EBV В-лимфоцитов и заражению вирусом новых клеток-мишеней, происходит дебют клинико-иммунологических проявлений XLP. Описано четыре наиболее часто распространенных фенотипа XLP: тяжелый и, чаще фатальный, инфекционный мононуклеоз, злокачественные лимфопролиферативные состояния (лимфомы, лейкозы — преимущественно, В-клеточные), анемия или панцитопения, в том числе и вследствие вирус-индуцированного гемофагоцитарного синдрома, дисгаммаглобулинемия. Описано также развитие системного некротизирующего лимфоидного васкулита с хориоретинитом. Причины развития того или иного фенотипа XLP недостаточно изучены. Наиболее вероятно, что сочетание генетических факторов с внешними предопределяет различные клинические проявления.
Среди внешних факторов наибольшее значение для развития определенных клинических проявлений имеет контакт больного XLP с EBV. Инфицирование вирусом является триггерным механизмом формирования наиболее тяжелых, быстропрогрессирующих и фатальных заболеваний, таких как фульминантный инфекционный мононуклеоз, гемофагоцитарный синдром. В 10% случаев фенотип XLP появляется до инфицирования EBV. Как правило, в этом случае, развиваются дисгаммаглобулинемия и лимфомы.
Наиболее тяжелым проявлением XLP является фульминантный инфекционный мононуклеоэ, который у 58% пациентов ведет к летальному исходу. У больных отмечаются эпизоды лихорадки с лейкоцитозом и появлением атипичных мононуклеаров, лимфоаденопатия и гепатоспленомегалия в результате лимфоцитарной инфильтрации. Может наблюдаться макуло-папулезная сыпь, катаральные явления, тяжело текущий тонзиллит. Тяжесть течения определяется прогрессивного повреждения гепатоцитов с формированием обширных некрозов. Повреждение клеток и сосудов печени происходит под воздействием ци-токинов, вырабатываемых мигрирующими из циркуляции цитотоксическими Т-лимфоцитами. Острая быстропрогрессирующая печеночная недостаточность является наиболее частой причиной смерти XLP-пациентов, развивших инфекционный мононуклеоз.
Цитопении как острые состояния у больных XLP развиваются более редко. Это может быть изолированная красноклеточная анемия, апластическая или аутоиммунная анемия. Наиболее тяжелые цитопении наблюдаются вследствие развития вирус-ассоциированного гемофагоцитарного лимфогистиоцитоза (ГЛГ), который является результатом В-клеточной экспансии костного мозга, Т-клеточной цитотоксичности и цитокинемии. Клиника вирус-ассоциированного ГЛГ может развиваться как на фоне тяжелого инфекционного мононуклеоза, так и самостоятельно. Основные его проявления — это прогрессирующая цитопения с поражением одного или нескольких ростков кроветворения, явления лимфогистиоцитарной гиперплазии и фагоцитоза клеток крови в костном мозге, реже — в других органах. При отсутствии лечения лимфогистиоцитарная активация ведет к летальному исходу в результате осложнений (тяжелые инфекции, кровотечения,сердечно-легочная недостаточность) почти в 100% случаев.
Дисгаммаглобулинемии, как уже сказано выше, могут развиваться как у EBV-позитивных, так и у EBV-негативных пациентов с XLP, Наиболее часто наблюдаются различные виды гипогаммаглобулинемий: снижение уровней всех иммуноглобулинов, селективный дефицит IgA, дефицит IgA и IgG при нормальном или повышенном уровне IgM. Реже отмечаются гипергаммаглобулинемии. Иммунодефицит у пациентов с XLP носит комбинированный характер, что ведет к развитию не только тяжелых бактериальных, на и грибковых, вирусных и оппортунистических инфекций.
Неконтролируемая поли- и олигоклональная лимфопролиферация у 30% пациентов с XLP ведет к развитию лимфом. Чаще, это B-клеточные неходжкинсккие или ходжкинские лимфомы, в том числе иммунобластные саркомы, реже встречаются Т- и NK-клеточные лимфомы, назофарингеальные и гастроинтестинальные карциномы, гладкомышечные опухоли. Локализация их в большинстве случаев экстранодальная, около 80% из них развиваются в илеоцекальном углу.
Диагностика XLP часто бывает труд ной в связи с полиморфностью клинической картины и редкостью данной болезни. Однако, порой, от ранней и правильной диагностики зависит прогноз заболевания.
Окончательным подтверждением диагноза XLP является обнаружение мутации гена SH2D1A с помощью проведения молекулярно-генетического анализа. Однако поломки в гене SAP выявляются только у 60-70% пациентов с типичной клиникой XLP и наличием положительного семейного анамнеза. Отсутствие мутации при проведении генетического анализа не должно исключать диагноз XLP. При исследовании экспрессии SAP у больных с XLP-фенотипом без выявленной мутации и у пациентов с генетически подтвержденным диагнозом она была низкой или отсутствовала вообще в обоих случаях. Таким образом, для диагностики заболевания у пациентов с типичным и атипичным XLP-фенотипами рекомендуется использовать сочетание генетического анализа SH2D1A и оценки уровня экспрессии SAP.
Диагностику XLP затрудняет атипичное течение заболевания, которое может скрываться под маской других первичных иммунодефицитов, первичного ГЛГ, гемобластозов и других злокачественных новообразований. Чаще всего, при снижении уровней одной или нескольких фракций иммуноглобулинов, сопряженном с инфекционными осложнениями, аутоиммунными заболеваниями (иммунные цитопении, гемофагоцитарный синдром, аутоиммунно-воспалительные заболевания желудочно-кишечного тракта), злокачественными процессами, и при исключении других иммунодефицитов с дефектами антителопродукции, диагностируется общая вариабельная иммунная недостаточность (ОВИН). При генетическом исследовании у нескольких больных с ОВИН и наличием семейного анамнеза диагностирован XLP. Таким образом, анализ гена 5H2D1A следует проводить всем пациентам мужского пола с картиной ОВИН, особенно, если водной семье встречается более одного случая ОВИН у лиц мужского пола.
Лечение Х-сцепленного лимфопролиферативного синдрома
Единых подходов к терапии больных с XLP не выработано. Различные профилактические режимы могут быть использованы в случае выявления дефекта на доклинических этапах течения XLP. Прежде всего, предположить заболевание можно у мальчиков с характерным семейным анамнезом и серо- или PCR-негативных в отношении EBV. В качестве профилактического средства возможно применение ацикловира. Было показано, что его раннее назначение ингибирует репликацию вируса в ротоглотке. С профилактической целью некоторые авторы рекомендуют применять терапию ВВИГ. Однако, ни ацикловир, ни внутривенный иммуноглобулин не предотвращают инфицирования EBV.
При развившейся клинической картине одного из фенотипов XLP необходима специфическая терапия. При гипогаммаглобулинемиях рекомендуется применять внутривенный иммуноглобулин ежемесячно в поддерживающей дозе, а также антибактериальную терапию.
Для лечения фульминантного инфекционного мононуклеоза использовали сочетание высоких доз ацикловира — 500 мг/м2 и метилпреднизолона (до 5-6 мг/кг/сут.), высокодозовую терапию ВВИГ с высоким титром анти-EBV антител и сочетание высокодозовой терапии ВВИГ с интерфероном-альфа, однако при использовании обеих схем терапии удалось получить только кратковременный положительный эффект.
При развитии гемофагоцитарного синдрома рекомендуется лечение по протоколу HLH-94 — сочетание высоких доз дексаметазона с этопозидом (VP-16) в течение 15 месяцев, или по протоколу иммуносупрессии, предложенному N. Jabado. Оба протокола позволяют контролировать лимфоцитарно-макрофагальную активацию в рамках XLP и, в дальнейшем, провести ТГСК.
Для лечения злокачественных заболеваний, возникающих на фоне XLP, применяются соответствующие стандартные протоколы антинеопластической терапии.
Учитывая плохой прогноз течения заболевания, радикальным методом лечения XLP является ТГСК до момента инфицирования EBV, однако опыт проведения трансплантаций весьма ограничен.
Синдром Санфилиппо (мукополисахаридоз III типа) Этот диагноз довольно трудно поставить вовремя: он долго (иногда до…
Болезнь минимальных изменений у взрослыхФизикальное обследованиеФизикальное обследование включает оценку тяжести состояния пациента, выраженности и распространенности…
Фармация и фармакологияНаучный журнал на тему: Фундаментальная медицина, Экономика и бизнес, Науки о здоровье, Клиническая медицина,…
Аналоги препарата ропинирол* (ropinirolum)реклама Какую дозу этого лекарства Вы принимаете?1-5мг 6-10мг 11-50мг 51-100мг 101-200мг 201-500мг…
Фенотипическая изменчивость в семье с синдромом Таунса – Брокса | журнал генетики человека - Журнал…
Аутоиммунный лимфопролиферативный синдром – группа генетически обусловленных заболеваний, которые возникают по причине наследственных или соматических мутаций в генах, отвечающих за различные этапы FAS-обусловленного апоптоза. Симптоматика может быть вариабельной и наиболее часто включает в себя лимфаденопатию, спленомегалию и разнообразные аутоиммунные поражения системы крови, печени, щитовидной железы. Диагностика аутоиммунного лимфопролиферативного синдрома производится на основании результатов общего и биохимического анализов крови, биопсии лимфатических узлов, генетических исследований. Специфического лечения заболевания в настоящий момент нет, применяют комбинации иммунносупрессивной и цитотоксической терапии.
- Причины аутоиммунного лимфопролиферативного синдрома
- Классификация аутоиммунного лимфопролиферативного синдрома
- Симптомы аутоиммунного лимфопролиферативного синдрома
- Диагностика аутоиммунного лимфопролиферативного синдрома
- Лечение и прогноз аутоиммунного лимфопролиферативного синдрома
- Цены на лечение
Общие сведения
Аутоиммунный лимфопролиферативный синдром (АЛС, ALPS, синдром Канале-Смит) – группа иммунодефицитных состояний, характеризующихся аутоиммунными цитопениями, лимфаденопатией, спленомегалией. Первые данные о заболевании стали поступать в 1968-м году, после чего вскоре началось бурное изучение патологии. Изначально АЛС был отнесен к первичным иммунодефицитам, однако со временем были обнаружены формы синдрома, обусловленные соматическими мутациями в детском и подростковом организме. Данные о встречаемости у разных исследователей довольно сильно различаются, на сегодняшний момент описано более 500 случаев различных форм аутоиммунного лимфопролиферативного синдрома. Наследственные формы заболевания передаются по аутосомно-доминантному типу, при этом в развитии врожденных форм также довольно велика роль спонтанных мутаций. Среди больных с одинаковой частотой встречаются как мальчики, так и девочки.

Причины аутоиммунного лимфопролиферативного синдрома
Выяснено, что причиной любого типа АЛС является нарушение FAS-опосредованного апоптоза лимфоцитов. При образовании Т-лимфоцитов те линии, которые способны атаковать собственные ткани, уничтожаются за счет активизации рецепторов CD-95 (Fas-рецепторов) на поверхности их мембраны. Активация CD-95, относящегося к группе рецепторов фактора некроза опухолей, запускает многостадийную реакцию с участием каспаз, которая оканчивается апоптозом клетки. При аутоиммунном лимфопролиферативном синдроме генетические мутации приводят к блоку этого процесса на определенном этапе, из-за чего устранения потенциально опасных клонов Т-лимфоцитов не происходит, и они начинают накапливаться в лимфатических узлах. Кроме того, создаются условия для аутоиммунного поражения органов и тканей.
Наиболее часто встречаются наследственные и спонтанные мутации в гене TNFRSF6, который кодирует собственно Fas-рецептор. При этом нарушение структуры белка (особенно домена, отвечающего за взаимодействие с FADD-молекулой) приводит к тому, что он становится неспособным выполнять свои рецепторные функции и активизировать апоптоз. Возможны и соматические мутации в гене FAS, которые в полной мере проявляют себя в позднем детском или подростковом периоде, и поэтому их относят к отдельной группе АЛС. Второй по распространенности вариант аутоиммунного лимфопролиферативного синдрома обусловлен мутацией в гене CASP10, кодирующем цистин-аспарагин кислотную протеазу (каспаза-10). Этот белок играет ключевую роль в передаче сигнала об апоптозе с клеточной мембраны в ядро клетки. К этому же варианту относят и мутации гена CASP8.
Классификация аутоиммунного лимфопролиферативного синдрома
При помощи методов современной генетики удалось выявить шесть основных форм АЛС:
ALPS 1A – вызвана мутацией гена TNFRSF6, расположенного на 10-й хромосоме, чаще всего имеет врожденный характер, наследуется по аутосомно-доминантному типу. По статистике, более 40% АЛС относятся именно к этой разновидности.
ALPS 1В – обусловлена мутацией гена FASLG, также довольно часто приводит к врожденному аутоиммунному лимфопролиферативному синдрому. К этому типу относят около 10% от всех клинических случаев АЛС.
ALPS 1m – ее причиной являются соматические мутации в гене FAS, возникающие в детском или подростковом возрасте и поэтому приводящие к поздним формам АЛС. При этом повреждение гена должно произойти в полипотентной клетке-предшественнице, которая способна дать начало многим линиям лимфоцитов. При этой форме наиболее часто возникает внезапная самопроизвольная ремиссия заболевания.
ALPS 2 – вызвана мутацией в генах CASP10 и, по некоторым данным, CASP8, которые кодируют белки-каспазы, передающие сигнал об апоптозе от рецептора к ядру клетки. Эта форма аутоиммунного лифопролиферативного синдрома составляет примерно 25% от всех случаев заболевания, может быть как врожденной, так и проявиться в более старшем возрасте.
ALPS 3 – мутация какого гена и характер ее наследования при этой форме неизвестны. Особенностью такого варианта АЛС является нарушение не только FAS-, но и IL2-опосредованного апоптоза, а также более тяжелый характер течения.
ALPS 4 – обусловлена мутацией гена NRAS, также кодирующего белки-передатчики внутриклеточного сигнала. Данный тип аутоиммунного лимфопролиферативного синдрома характеризуется более доброкачественным течением и умеренной выраженностью симптомов.
Симптомы аутоиммунного лимфопролиферативного синдрома
Симптомы АЛС довольно вариабельны из-за большого количества мутаций, которые могут приводить к такому состоянию. Начало заболевания можно заметить уже на 15-й день после рождения (при врожденных формах), в детском или подростковом возрасте в случае соматических мутаций в генах FAS, CASP10 или NRAS. Обычно первым проявлением заболевания является лимфаденопатия – подмышечные, паховые или шейные лимфатические узлы увеличиваются в размерах, но при этом безболезненны и не спаяны с окружающими тканями. Регистрируется спленомегалия, в некоторых случаях она сопровождается увеличением печени (гепатоспленомегалия).
Аутоиммунные проявления АЛС регистрируются обычно через некоторое время после лимфаденопатии и увеличения селезенки. В основном это поражения кровяных ростков – тромбоцитопения, гемолитическая анемия, приводящая к желтухе, изредка нейтропения. Помимо крови, аутоиммунному поражению могут подвергаться органы ЖКТ (возникают гастрит, панкреатит, колит, аутоиммунный гепатит). На коже могут проявляться признаки васкулита, делая клинику аутоиммунного лимфопролиферативного синдрома схожей с таковой при системной красной волчанке. Кроме того, могут возникать аутоиммунные формы тиреоидита, гломерулонефрита, поражаться суставы, ткани глаза (иридоциклит, увеит). Нередки поражения центральной нервной системы – эпилептические припадки, миелиты, мозжечковая атаксия.
Выраженность симптомов и их количество может значительно варьироваться у каждого конкретного больного. Кроме того, при аутоиммунном лимфопролиферативном синдроме в десятки раз возрастает риск развития злокачественных опухолей, так как опухолевые клоны лимфоцитов также устраняются посредством апоптоза. Примерно в 20% случаев АЛС приводит к неходжкинским лимфомам (лимфома Беркитта, фолликулярная лимфома), описаны и другие онкологические заболевания. Из-за этого проявления АЛС могут быть ошибочно определены как следствие опухолевой инфильтрации лимфоидной ткани. Среди других осложнений аутоиммунного лимфопролиферативного синдрома наиболее часто встречается травматический разрыв селезенки, сепсис и другие инфекционные поражения.
Диагностика аутоиммунного лимфопролиферативного синдрома
Диагностика АЛС производится на основании осмотра, а также лабораторных, иммунологических и генетических исследований. При осмотре выявляют увеличение более чем трех групп лимфатических узлов, спленомегалию, увеличение печени. Анализ крови может показывать уменьшение количества некоторых клеток (анемию, тромбоцитопению), у части больных определяется высокая (до 30%) эозинофилия. Проба Кумбса положительная, в биохимическом анализе крови определяется выраженная гипергаммаглобулинемия. Одним из высокочувствительных методов иммунологической диагностики аутоиммунного лимфопролиферативного синдрома является проточная иммуноцитофлюориметрия, проводимая с целью выявления количества лимфоцитов с атипичным набором рецепторов (CD3+CD4-CD8-). При АЛС количество таких клеток превышает 1% от всех лимфоцитов. В биоптате лимфатических узлов определяется фолликулярная гиперплазия, результатом гистологического исследования селезенки служит лимфоидная гиперплазия.
Лечение и прогноз аутоиммунного лимфопролиферативного синдрома
Этиотропное лечение аутоиммунного лимфопролиферативного синдрома не разработано, патогенетическая терапия сводится к применению иммуносупрессивных и цитотоксических средств. В качестве средств, подавляющих аутоиммунную активность, наиболее часто используют кортикостероиды (преднизолон, дексаметазон). К специфическим препаратам, ограничивающим скорость пролиферации лимфоцитов, относят микофенолата мофетил, сиролимус. Также при аутоиммунном лимфопролиферативном синдроме активно применяются традиционные цитотоксические средства – метотрексат, циклоспорин А и другие. При значительном увеличении селезенки или отсутствии эффекта от консервативного лечения прибегают к спленэктомии. Пересадка костного мозга и использование стволовых клеток в долгосрочной перспективе давали только временный эффект. При значительно выраженных гематологических нарушениях применяют гемотрансфузии, введение эритроцитарной или тромбоцитарной массы. Больному следует избегать физических нагрузок, использовать высоковитаминную диету.
Прогноз заболевания, ввиду высокой вариабельности и выраженности симптомов, неопределенный или неблагоприятный. У большей части больных проявления заболевания постепенно нарастают, со временем приводя к летальной анемии, тромбоцитопении, билиарному циррозу печени. Также важную роль в прогнозе играют нарушения иммунитета, так как нередко причиной смерти выступают сепсис и другие инфекционные поражения. В прогнозе аутоиммунного лимфопролиферативного синдрома следует учитывать и повышенный риск онкологических заболеваний, примерно пятая часть больных умирает от различных типов лимфом. В некоторых случаях возникает спонтанная и длительная ремиссия патологии.
Читайте также:

