Апоптоз раковых клеток что это такое
Лечение: рак простаты, рак груди, рак матки, рак ЖКТ, рак легких, рак кожи, базалиома, меланома, рак шеи гортани ротоглотки, носа, головы, мозга, рак крови, лимфолейкоз, лейкоз… Реактив универсальный практически для большинства видов опухолей, а также предраковых состояний как лейкоплакия, гиперплазия…
Что такое АПОПТОЗ
Это спуск механизма самоотмирания больных и мутированных клеток. Так задумано природой, чтобы все клетки у которых произошел сбой программы существования и то, что мешает существованию здоровых клеток, должно элиминироваться, исключаться. Для этого в каждой клетке встроен такой механизм естественного, физиологичного, запрограммированного отмирания патологических или ненужных организму клеток. Причем, апоптоз абсолютно безвредный путь элиминации ненужных клеток, в отличие от некроза, то есть патологического пути отмирания. Единственно этому правилу не подчиняются онкологические клетки. Они вышли из-под контроля, стали автономными и живут по своим примитивным программам прото-клеток.
Причины онкологического перерождения клеток – слом механизмов регулировки особенностей энергетики клетки.
Почему организм не может бороться с онкоклетками?
По антигенным характеристикам такие онкоклетки полностью аналогичны здоровым, поэтому для иммунитета они совершенно не видимы, а вернее их иммунитет расценивает как свои нормальные. Ведь это те же самые клетки, что и здоровые, только у них сломан механизм сохранения энергетики клетки. Вернее, сломаны гомеостазные программы и механизмы ответственные за вывод клеток из гликолизного типа энергетики обратно в аэробную. В организме часто бывает, что при какой-то запредельной нагрузке на ткань её клетки вынуждены переходить на гликолиз. Например, мышцы у спортсменов-марафонцев часто переходят на режим гликолиза, это нормально. Марафоновая нагрузка закончилась и тут же включаются автоматически механизмы по возвращению к требуемым нормо-константам гомеостаза, которые выводят клетки из этого запредельного режима работы. Точно также нагрузкой для ткани может быть затянувшийся воспалительный процесс при травме кости с последующим продолжением её длительного раздражения. Также хроническое, то есть устойчивое воспаление может происходить из-за длительных солнечных ожогов. Такой же результат с исходом в хроническое провоспаление могут дать и гормональные перегрузки ткани и многое другое. Во всех этих случаях в итоге ткани могут зайти в гликолиз. Это симптом каких-то перегрузок для какой-то части клеток. То есть во всех случаях ткань должна быть предварительно заведена в гликолиз. В случае если одновременно к этому присоединяется слом операторной системы, ответственной за вывод клеток из гликолиза и процесс затягивается, то клетки навсегда застревают в этом гликолизе. Это и является по сути механизмом провоспаления, предрака, а затем перерождения в рак. Во всех случаях этот процесс сопровождается предварительным хроническим провоспалением.
В случаях повреждения специфической системы регулировки на мембранах клеток, процесс идет в сторону дегенеративных перерождений тканей и утрате ею своих специфических особенностей и функций. Если процесс идет по направлению повреждения неспецифических операторных систем регулировки, ответственных за тип энергетики клетки, то происходит онкологическое перерождение клеток. Как на онкологические, так и на дегенеративные клетки иммунитет не обращает внимания, они свои. Это объясняет почему, научное направление иммунотерапии онкологии неперспективно.
Итак, возлагать надежды на иммунитет, иммунотерапию при онкологии не следует, он просто здесь не дееспособен, зря искать препараты для противоопухолевого иммунитета. Но есть еще и другой эшелон обороны, должны подключиться механизмы самозащиты клеток изнутри: апоптоз.
Каждая клетка способна анализировать себя и свой обмен с нормой и при необходимости его корректировать. Если клетка не соответствует требуемым правилам и не может себя откорректировать – она должна самоликвидироваться. Для этого включены в клетки специальные программы на самоликвидацию. Это основное правило и требование здорового организма как системы. Программы апоптоза расположены в кольцевом геноме митохондрий. Это сделано специально. Митохондрии обеспечивают аэробизм. Здоровая клетка не может и не должна находиться долго вне аэробизма. Ведь аэробизм – это важнейшее условие существования высших или метаклеток. Вне аэробизма они должны потерять свою специализацию. Этого клетка не может допустить. На пути этому она ставит заградительный механизм в виде апоптоза. Поэтому программа на самоликвидацию заложена в митохондриях. Особенность онкоклеток в том, что они программы апоптоза не могут запустить, ведь для этого должны быть готовы воспринять такой сигнал, быть чувствительными к нему, то есть быть в рабочем состоянии митохондрии. В общем разорвана цепочка автоматической электрорегулировки и самонастройки клетки.
В наборе рабочих программ онкоклеток в качестве прото-клеток нет программ на апоптоз. Онкоклетки свободны от всех программ как апоптоза, так и высших программ. Все эти программы у онкоклеток имеются, они никуда не исчезли, но они зависли. Это тот случай, когда высшая клетка не может сама себе помочь и включить апоптоз на устранение таких аберрантных клеток.
Причины почему организм не может бороться с онкоклетками.
По антигенным характеристикам такие онкоклетки практически аналогичны здоровым, поэтому для иммунитета они практически не видимы. Но должен подключиться еще второй механизм обороны – самозащиты: апоптоз. Каждая клетка способна анализировать себя и свой обмен с нормой. Если клетка не соответствует требуемым правилам – она должна самоликвидироваться. Программы апоптоза расположены в кольцевом геноме митохондрий, а они у онкоклеток не работают и поэтому не запускается апоптоз. Онкоклетки свободны от всех программ как апоптоза, так и высших программ. Все эти программы у онкоклеток имеются, они никуда не исчезли, но они зависли. Это тот случай, когда высшая клетка не может сама себе помочь и включить апоптоз на устранение таких аберративных клеток.
Механизмы апоптоза.
В клетке встроены механизмы анализа ситуации. Это так называемая система ГЛОНАСК (глобальная навигационная система клетки): самоориентации и саморегулировки как по электромагнитным параметрам, так и по химическим. Если клетка зашла слишком далеко в глубокий гликолиз, то должны запуститься механизмы на вывод ее из этого состояния. В случае если одновременно сломана операторная система, и сопряженные с ней системы интегральных и информационных белков, обеспечивающих такой вывод, то такая система не может замкнуть свой контур из разорванных звеньев в единой цепи и удержания гомеостата и не может даже запустить механизмы апоптоза. Открыта дорога для процветания онкоклеток.
Симптоматика апоптоза и некроза
В первом случае происходит сморщивание и усыхание клеток. Не отмечается провоспалительный процесс. Во втором случае некроза отмечается мощный провоспалительный процесс, набухание клеток и отекание ткани с последующей интоксикацией как локального типа, так и всего организма, когда страдают многие органы и ткани. Поэтому-то все современные методы медицины, которые приводят к некрозу опухоли, не приемлемы.
Апоптанты и апоптогены
В первом случае апоптантами являются вещества готовые произвести спуск механизма апоптоза. Во втором случае это вещества способные запустить механизмы апоптоза. Апоптантами, например, являются вещества участвующие в процессе метаморфоза, то есть превращения головастика в лягушку или гусеницы в бабочку. Это механизм четкой регулировки, задуманный природой и не наносящий ущерб или побочки особи. Апоптогенами не всегда являются вещества естественные для организма, они могут быть и искусственного происхождения и при своём воздействии проявлять даже определенную побочку на организм в целом. Например, есть ретиноиды которые способны вызывать апоптоз в онкоклетках, но при этом имеют и выраженные негативные последствия на печень или сухость кожи.
Каротиноиды (ретиноиды) участвуют в механизмах апоптоза.
Из биологии известно, что ряд ретиноидов (подобных витамину А) в качестве многочисленных представителей каротиноидов отвечают, как за механизмы дифференциации клеток, регулировки темпов роста клетки, так и за проявление избирательного апоптоза в онкоклетках. Доказано противоопухолевое действие каротиноида Ликопин при лечении рака простаты. Давно обсуждаются возможности широкого применения каротиноидов при гормонозависимых опухолях груди и т.п. Но практическая сторона этого дела не могла долго использоваться из-за не выраженности процесса, противоречивости полученных научных данных и необъяснимости процесса. Существуют цис- и транс-формы каротиноидов, которые оказывают противоположное действие.
Тем не менее в России тоже проведены минимальные исследования и уже проведены первичные испытания на мышах с привитыми опухолями, которые показывают максимально возможную эффективность и высшую перспективность из всего, что известно на сегодняшний день в лечении онкологии.
Наружные опухоли при этом как базалиома или меланома, начинают засыхать, сморщиваться, отшелушиваться или постепенно исчезать без гноя. Внутренние опухоли лизируют, но без жуткой интоксикации, которая сопровождает некрозы опухолей, и без провоспалительного процесса. Именно провоспалительный процесс разжигает пожар саморазгорающегося онкопроцесса: промоуцию, то есть бурный рост онколеток, и их метастазирование.
Ретиноиды Российского производства.
Практика показывает, что чтобы новый препарат был внедрен в медицине нужны многие годы. Заинтересовать Минздрав России профинансировать такие исследования и довести их до выпуска препарата тоже не представляется возможным. Очевидно нужен бум общественного мнения и широкие наработки инициатив волонтеров. Но больным сегодняшнего дня не дождаться таких препаратов.
Тем не менее, учитывая первичные положительные опыты на животных и достаточно глубокие исследования по ретиноидам за рубежом, в т. ч. и на людях, предлагаю воспользоваться таким ретиноидным веществом.
Опыт лечебного применения ретиноида CD437 на примере раковых клетках простаты.
Статьи по результатам экспериментального применения его при различном типе опухолей имеются в интернете. Инкубация клеточных линий рака простаты в культуре ткани показало заметное ингибирование пролиферации и появление в популяции клеток апоптирующих клеток. Вывод: CD437 представляет собой уникальный ретиноид, который индуцирует арест митозов (остановку делений) в s-фазе и апоптоз в андроген-зависимых и независимых человеческих раковых клеток простаты. Это указывает на высокую потенциальную роль CD437 в лечении человека от рака простаты. Такие же исследования проведены и на многочисленных других группах опухолей, в том числе рак груди, рак легких, рак кишечника…
Конечно, пациенты должны понимать, что на данном этапе им предлагают не лекарство, а определенную химическую субстанцию, которая обладает известными физиологическими свойствами, способными вызвать апоптоз в больных клетках. Решение по применению такого вещества необходимо принимать самим. Важно то, что предлагаемое вещество безвредно для организма, но способно делать то, что не способно делать ни одно лекарство.
Мне известна формула этого ретиноидного вещества. Поэтому принято решение заказать это вещество через одну из Российских лабораторий. Соответствие требуемой химической формуле гарантировано и подтверждено аналитически. Цена к сожалению, пока на сегодняшний день достаточно высокая. Одна ампула отпускается по 800 руб. По этой же цене могу отпустить и всем клиентам без всякой накидки. На курс надо минимум 20 ампул – 16 тыс. рублей и почтовые 500 р. Эффект проявляется через 1-2 или более месяцев. Принимают по 1 ампуле наружно или в виде свечей через анальное отверстие (ректально). Это необходимо, чтобы оно попало в кровь минуя ЖКТ. В лабораториях его применяют в виде уколов в опухоль или вокруг, или внутривенно капельницами.
Применение ретиноида CD437 на кожной опухоли базалиома и меланома
1 апреля поменяли тактику лечения на применение наружно в виде компресса ретиноида СД. Какого же было удивление, когда опухоль впервые за много лет перестала болеть и сочиться. Довольно быстро ушло нагноение опухоли и за две недели опухоль начала не только подсыхать, но и уменьшаться в своих размерах, сморщиваться. Явно здесь запустился механизм апоптоза, опухоль начала давать обратный ход развития, а роль апоптанта сыграл ретиноид.
К сожалению, пока на сегодняшний день достаточно высокая. Одна ампула отпускается по 800 руб. По этой же цене могу отпустить и всем клиентам без всякой накидки. На курс надо минимум 20 ампул – 16 тыс. рублей и почтовые 500 р.
Эффект начинает проявлятся через 1-2 или более месяцев.
Каждая ампула является аликвотой, то есть по сути, разовой дозой препарата. Это аналогично тому как таблетка содержит разовую требуемую дозу действующего вещества.
Действуют ли ретиноиды и другие индукторы апоптоза на здоровые ткани?
Оказывается, нет. Они в принципе не могут этого делать, так как работают адресно (таргетно) только на те группы клеток, на которые они нацелены, то есть на клетки, которые готовы их воспринять, услышать. Следовательно, побочка, в том числе боли, интоксикации и воспаления исключены. Опасения, что будут рассасываться и некоторые здоровые ткани тоже напрасны. Дело в том, что рассасывание здоровых тканей, например, хвосты у головастиков, когда они осуществляют метаморфозный переход в лягушек, возможен только в случае гормональной подготовки этого этапа.
При наружных опухолях как рак кожи, включая и рак меланома, базалиома, язвящий открытый рак груди применяют в виде компресса. В этом случае непосредственно над областью болезни на кожу намазывают 1 ампулу препарата, а сверху накрывают пленкой или вощенной бумагой и затем всё закрепляют бинтом или пластырем. Применяют обычно по 1 ампуле на 1 болячку через 1 день. Если площадь опухоли обширная или они разбросаны в разных местах по телу, то применяют 2 ампулы. Через месяц-два необходимо написать отчет о динамике в результате применения препарата. Возможно надо будет усиливать его путем приема внутрь, но не через рот, а путем применения в виде свечей через анальное отверстие (ректально). Это необходимо, чтобы оно попало в кровь минуя ЖКТ. В лабораториях его применяют в виде уколов в опухоль или вокруг, или внутривенно капельницами.

ЧЁРНЫЙ ОРЕХ "ЮГЛОН" В настоящее время достаточно большое количество информации по поводу лечения и применения настоек, экстрактов из черного ореха - я бы хотел обобщить многолетние труды и .

ФИТОТЕРАПИЙНЫЙ НАБОР ДЛЯ КОМПЛЕКСНОГО СИСТЕМНОГО ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ (ОНКОЛОГИИ) по методу ГарбузоваОнконабор 1ОСНОВНОЙ ФИТОТЕРАПИЙНЫЙ набор для лечения рака (онкологии):ЮГЛОН Черный Орех 350 .

Противоопухолевая диета Моэрмана.В принципе лечение добро — и зокачественных заболеваний диетой, как показывает практика целительства, сходны. Одним из первых, кто подошел нау.
Все клетки многоклеточных существ несут в себе потенциальную способность к апоптозу, так же как японские самураи всю жизнь носят с собой меч. И если по каким-то причинам тонкий механизм апоптоза разлаживается, последствия для организма могут оказаться самыми катастрофическими. Например, раковые клетки, блокируя систему апоптоза, приобретают бессмертие. Поэтому изучение механизмов клеточной самоликвидации является важнейшим направлением современных биомедицинских исследований: раскрытие тайн апоптоза поможет в разработке новых лекарств для борьбы с самыми тяжелыми и трудноизлечимыми болезнями современности
Каждый день и каждый час в нашем организме погибают миллионы клеток. Отшелушиваются ороговевшие клетки покровного эпителия, быстро изнашиваются и гибнут клетки слизистой ткани, выстилающей пищеварительный тракт, лейкоциты – белые клетки крови, находят свою смерть в борьбе с патогенами… Но как наше тело избавляется от специализированных клеток, когда в результате накопившихся внутренних повреждений они становятся неспособными выполнять свои функции? Одним из самых парадоксальных и удивительных механизмов, контролирующих жизнеспособность многоклеточного организма, является апоптоз – клеточная самоликвидация.
Регулярная, генетически запрограммированная гибель отдельных клеток необходима для нормального функционирования организма в целом. Все клетки многоклеточных существ обладают аппаратом апоптоза, так же как японские самураи всю жизнь носят с собой меч. Однако у этого естественного процесса есть и обратная сторона: если по каким-то причинам тонкий механизм апоптоза разлаживается, последствия для организма могут оказаться самыми катастрофическими.
Нарушения в запуске апоптоза ведут к возникновению ряда серьезных заболеваний, в том числе аутоиммунных и онкологических. Например, раковые клетки, блокируя систему апоптоза, приобретают бессмертие. Поэтому изучение механизмов клеточной самоликвидации является важнейшим направлением современных биомедицинских исследований: раскрытие тайн апоптоза поможет в разработке новых лекарств для борьбы с самыми тяжелыми и трудноизлечимыми болезнями современности.
Ферменты-киллеры
В то же время каспазы активируют ряд белков, которые участвуют в выполнении программы самоликвидации. Например, белка, который разрезает ДНК на большие фрагменты, – этот процесс, после которого целостность ДНК необратимо уничтожается, является характерной чертой апоптоза.
Сигнал на запуск
Но каким же образом клетка узнает, что ей пора самоликвидироваться? Кто и как дает указания киллерам-каспазам?
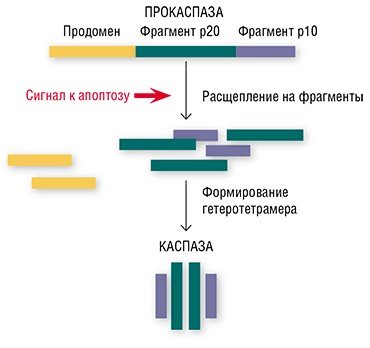
Имеется два основных пути, по которым передаются апоптопические сигналы в виде клеточных регуляторов, таких как гормоны, антигены, моноклональные антитела и другие молекулы. Это митохондриальный (или внутренний) путь, а также через особые трансмембранные белки – так называемые рецепторы смерти (DR, от англ. death receptor). В обоих случаях для запуска апоптоза должны образоваться особые инициаторные апоптотические комплексы. Затем происходит активация так называемых инициаторных каспаз, которые, в свою очередь, активируют эффекторные (разрушающие клеточные структуры) каспазы, о которых упоминалось выше (Nicholson, 1999).
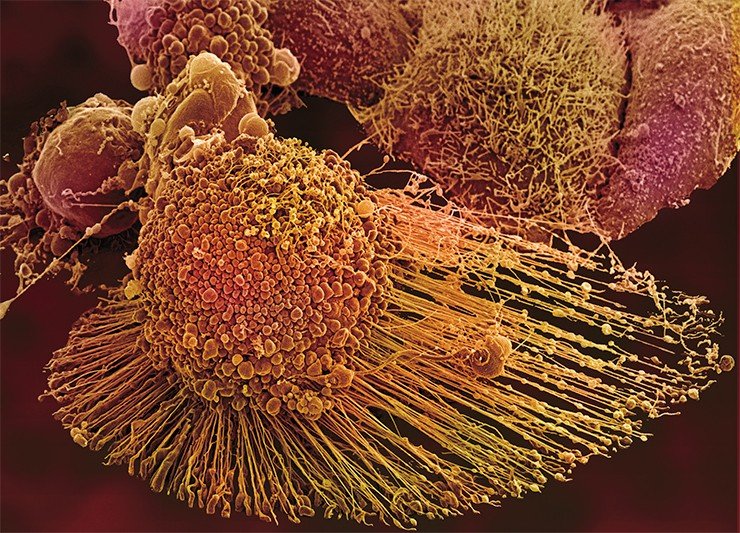
Речь идет об очень интересном явлении – самоактивации прокаспазы. Такое может произойти лишь в том случае, когда две молекулы этого белка, ориентированные определенным образом относительно друг друга, образуют димер. Именно такие уникальные пространственные условия, необходимые для димеризации и каталитической активации фермента, и предоставляет прокаспазе-9 апоптосома. Образовавшаяся в результате активная каспаза-9 расщепляет эффекторные каспазы (каспазу-3 и каспазу-7), а дальше все происходит по стандартной схеме апоптоза (Green et al., 2004).
В случае рецептор-зависимого сигнального пути инициация апоптоза начинается с другого белкового комплекса, который образуется непосредственно на самом рецепторе смерти (Krammer et al., 2007; Lavrik et al., 2005).
Жить или не жить?
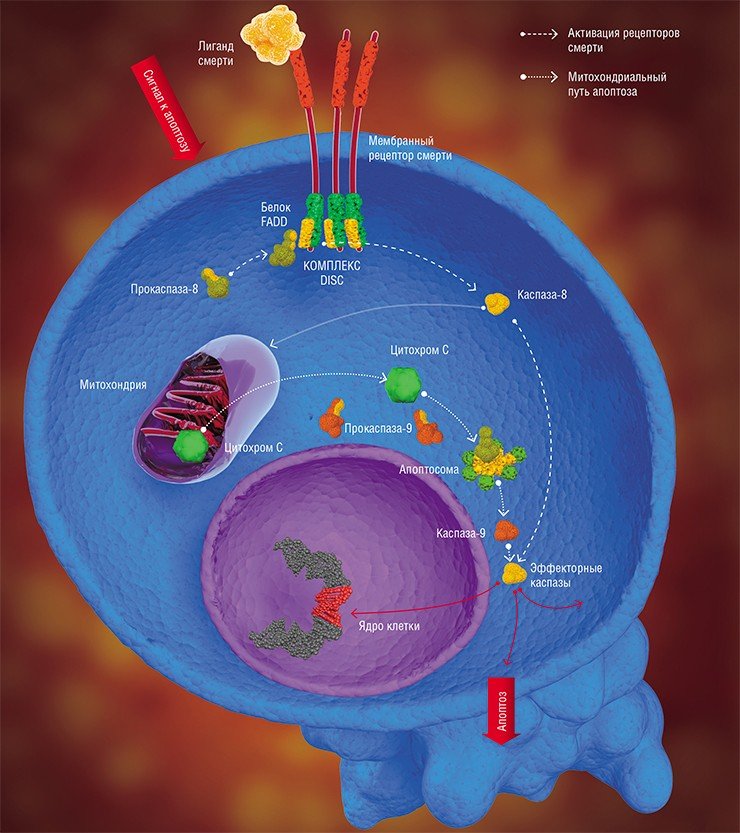
Итак, в отличие от голливудского детектива, в истории про апоптоз нет главного действующего лица: своевременное уничтожение поврежденных клеток и в итоге – жизнеспособность организма зависит от слаженной цепочки событий, в которой участвует множество различных белковых молекул.
И здесь очень важны количественные показатели, такие как концентрация. Сегодня изучением того, как влияет на инициацию и дальнейший ход апоптоза уровень содержания в клетке различных молекул, занимается одна из передовых областей современной науки – системная биология (Bentele et al., 2004). Основной ее постулат заключается в том, что протекание сложных процессов внутри клетки можно понять, лишь учитывая максимально большое число клеточных параметров. Для этого на основе экспериментальных данных создается компьютерная модель, которая учитывает действие множества факторов. Полученные таким образом предсказания о ходе основных клеточных процессов могут использоваться в борьбе с препятствиями человечества на пути к долгой и здоровой жизни.
Lavrik I. N., Golks A., Krammer P. H. Caspases: Pharmacological manipulation of cell death // J. Clin. Invest. 2005. V. 115, N 10. P. 2665—2672.
Krammer P. H., Arnold R., Lavrik I. N. Life and death in peripheral T cells // Nat. Rev. Immunol. 2007. V. 7. P. 532—542.
Green D. R. and Kroemer G. The pathophysiology of mitochondrial cell death // Science. 2004. V. 305. P. 626—629.
Из этого К. Гален сделал выводы: 1) листопад – это преднамеренное самоубийство; 2) листья убивают сами себя, так как при наличии их зимой, снег сломает ветки. Это явление он обозначил термином апоптоз.
Оказалось, что способность к самоубийству присуща любой клетке, как у растений, так и у животных.
Для поддержания жизни многоклеточного организма требуется, как замена клеток новыми путем деления, так и присутствие смерти уже ненужных клеток – апоптоз их.
Отмирание клеток в многоклеточном организме первыми обнаружили биологи. Так, у эмбриона человека между пальцами рук и ног имеются перепонки, есть жабры и хвост. Но они к рождению человека исчезают через апоптоз их клеток.
После открытия апоптоза в течение десятилетий ученые были заняты описанием морфологии апоптоза клеток и стадиями или этапами этого процесса. Позднее была изучена морфология другого типа смерти клетки – некроза.
Дж. Керр (J.R. Kerr, 1972) и соавторы отметили, что апоптоз имеет не меньшее значение, чем митоз. Любая живая клетка снабжена программой апоптоза, регулируемой рядом генов.
До 1960-х гг. XX века причина апоптоза оставалась невыясненной. Предполагалось, что такая ликвидация клетки происходит посредством фагоцитоза или каким-то другим, еще неизвестным способом.
В 1963 г. двое британцев – С. Бреннер (S. Brenner) и Дж. Салстон (J. Sulston) и американец Р. Горвиц (R. Horvitz) занялись изучением развития много- клеточного организма от одной клетки до взрослого организма.
Для этого С. Бреннер впервые предложил удачный объект – червь нематоду (C. elegans). Длина его тела меньше 1 мм, а тело прозрачно, что делает удобным изучение размножения клеток просто под микроскопом. При изуче- нии развития этого простого многоклеточного организма Дж. Салстон открыл апоптоз.
Он заметил, что в процессе развития тканей и органов червя клетки не только делились, но и умирали. Удивляло то, что смерть их не была вызвана какими-либо внешними повреждениями. Ему стало ясно, что смерть клеток – четко отрегулированный процесс при развитии червя.
Дж. Салстон мог точно отметить те клетки, которым суждено погибнуть, – это и есть регулируемый процесс смерти клетки – апоптоз. Ученый обнаружил, что апоптоз регулируется генами – выявил мутацию одного из генов – nuc-
1, продукт его оказался необходимым для деградации ДНК погибающей клетки.
Апоптоз и некроз клетки – разные типы смерти клеток



Апоптоз клеток сопровождает человека на протяжении всей его жизни, начиная с оплодотворенной яйцеклетки. Из нее берут начало все типы клеток, их более 200 типов, а организм взрослого человека состоит из 5•1013-14 клеток. Взаимодействия между разными типами клеток объединяет функции организма в единое целое. Клетка каждого типа является частью той или иной ткани и организма в целом. В организме человека каждый день рождается за счет деления более тысячи миллиардов клеток и столько же отмирает через апоптоз, и мы не ощущаем этого.
Причины апоптоза клеток
В физиологических условиях для:
- сохранения генетически заданной численности клеток в каждой ткани, стабилизации границ ткани;
- ликвидации клеток, к которым не поступает сигнал к делению от соседних клеток, например, при отсутствии молекулы фактора роста;
- уничтожения нормальных клеток после 50±10 делений – лимит Хейфлика; из-за предельного укорочения теломер на концах ДНК геном такой клетки включает апоптоз;
В патологических условиях для:
- уничтожения клетки с повреждениями ДНК – эпимутации в генах свойств клетки, чтобы она не превратилась в раковую клетку;
- уничтожения клетки с повреждениями ДНК – раковая клетка, чтобы не дала потомства с такими дефектами ДНК, т.е. рак;
- ликвидации клетки с нерегулируемой стимуляцией пролиферации за счет повышенной экспрессии гена c-myc и/или транскрипционного фактора E2F;
- ликвидации клетки с нарушениями клеточного цикла;
- отмирания клетки, инфицированной вирусом, в том числе опухолеродным вирусом; в первом случае для предупреждения распространения инфекции на соседние клетки, а во втором – для предупреждения образования из нее раковой клетки.
Клетка, подвергающаяся апоптозу, в литературе обозначается определенным термином:
Как включается программа апоптоза в клетке?
Апоптоз вызывают как внутриклеточные сигналы, так и внешние. Внешние сигналы действуют через молекулу-рецептор, пронизывающую насквозь мембрану клетки-мишени. В молекуле-рецепторе три части – наружная, т.е. вне клетки, внутренняя – в толще цитоплазматической мембраны и внутренняя, выступающая в цитоплазму клетки. Сигнальная молекула находится либо во внеклеточной жидкости, либо на поверхности других клеток или в межклеточном матриксе.
В апоптозе выделяют три стадии, но пока они еще мало охарактеризованы: 1 стадия – инициации, т.е. воспринятие сигнала. 2 стадия – передача сигнала и 3 стадия – эффекторная стадия (Рис. 1).

Общая схема стадий апоптоза
(рис. и цит. по: М.А. Пальцев и соавт., 1998).
1. Стадия инициации. Сигнал к клетке-мишени о смерти изнутри клетки поступает от повреждений ДНК, от дефицита или отсутствия фактора роста. Сигнал к клетке-мишени извне вылавливает молекула-рецептор.
ферменты, участвующие в апоптозе.
Судьба клетки-мишени при поступлении сигнала к апоптозу – войдет ли она в апоптоз или сохранит жизнь себе, зависит от количества белка.
Так, если преобладает белок Bax над белком Bcl-2, клетка-мишень вступит в апоптоз. Если образуется комплекс из двух молекул Bax, т.е. Bax/Bax, то и в этом случае начнется апоптоз. При наличии достаточного количества молекул белка Bcl-2 происходит образование комплекса Bax/Bcl-2, в этом комплексе Bax теряет свою апоптотическую активность.
Митоптоз в реализации апоптоза
Bcl-2 – главный ингибитор апоптоза и локализуется на наружной мембране митохондрий (Рис. 2). Белок Bax до получения сигнала к апоптозу нахо дится в цитоплазме, а после сигнала мигрирует в мембраны митохондрий.

Митоптоз в реализации апоптоза
Этот белок связывается с внутренней мембраной митохондрии и открывает в ней поры, вызывая набухание матрикса митохондрии и разрыв ее внеш- ней мембраны. В результате из межмембранного пространства митохондрий выходит в цитозоль ряд белков: цитохром с, фактор, индуцирующий апоптоз или белок самоубийства – второй фактор, активирующий апоптоз, и прокаспаза
9. Именно эти белки осуществляют эффекторную стадию апоптоза – деградацию ДНК, изменения мембран и фрагментацию клетки в апоптозные тельца.
Белок AIF в своей структуре имеет адресную метку в ядро клетки- мишени. Он сразу из цитоплазмы проникает в ядро клетки, активирует нуклеазы, которые расщепляют ДНК, это приводит клетку-мишень к апоптозу.
Цитохром с вызывает апоптоз иначе. В цитоплазме этот белок связывается с белком Apaf-1 и молекулами прокаспазы 9 – это фермент протеаза; путем расщепления образуется каспаза 9. Она расщепляет прокаспазу 3 и образуется каспаза 3 – активный фермент, разрушает в клетке-мишени белки, ДНК, и клетка гибнет.
Оба пути апоптоза – через белок Apaf-1 и цитохром c схематично выглядят так: сигнал самоубийства митоптоз апоптоз (В.П. Скулачев, 2001).
В инициации программы апоптоза важная роль принадлежит гену-супрессору wt53.
Белок этого гена – p53 локализован в ядре клетки и является регулятором транскрипции других генов – ген белка p21 и других, которые могут задерживать клетку в G-фазе клеточного цикла.
В норме ген wt53 в клетке молчит. При повреждениях ДНК происходит активация этого гена – много белка его. Он блокирует клеточный цикл в фазах G1 и G2 до репликации ДНК и митоза, делая возможной репарацию ДНК, и этим предотвращает появление клеток с эпимутациями и мутациями. Если репарация не произошла, то индуцируется апоптоз для защиты организма от присутствия дефектных по геному, т.е. предраковых клеток, способных превращаться в раковые клетки.
В половине случаев раковых клеток разного типа ген-супрессор wt53 имеет мутации. Это ведет к превращению предраковой клетки в раковую клетку и возникновению из нее рака. То есть раковая клетка в отличие от любой другой клетки не подвергается апоптозу, если в ней дефекты в ее генах- супрессорах.
Генетические изменения в раковых клетках, ведущие к подавлению обоих путей индукции апоптоза
В них закономерно обнаруживаются:
- потеря экспрессии на поверхности раковой клетки рецептора смерти Fas; при наличии бы рецептора Fas взаимодействие его с FAS-L или с моноклональными антителами приводило бы раковую клетку к феноптозу;
- блокирование активации эффекторных каспаз. Например, при потере экспрессии белка Apaf-1 в результате метилирования его гена и др.
Пути использования индукции апоптоза в раковой клетке
Главная задача сегодня – как можно быстрее найти способы воздействия на молекулярные причины апоптоза, чтобы вызвать апоптоз раковых клеток. Над этим сейчас работают ученые во многих странах мира, в том числе и ученые нашей страны.
- подавление в раковой клетке генов с эпимутациями, создающими ее свойства, и замена генов-супрессоров с мутациями нормальными генами.
Очень многие патологические процессы в организме заканчиваются апоптозом.
Ключевым фактором в изучении апоптоза клетки оказался правильный выбор объекта для экспериментов ученых. На одноклеточных организмах – бактерии и др. апоптоз изучать невозможно. Млекопитающие очень сложны для исследования, так как состоят из большого числа клеток. Идеальное решение предложил в начале 60-х гг. С. Бреннер: выбор пал на нематоду.
В процессе апоптоза клетки разрушаются ее структуры, например, митохондрии, но при этом мембрана клетки остается целой.
Так клетка разрушает сама себя изнутри без каких-либо негативных последствий для организма. Клетка заканчивает свою жизнь самоубийством, когда получает сигнал на уничтожение. А отдают его специфические ферменты и белки, которые вырабатываются в клетке в нужном количестве и в нужный момент.
Эта программа строго контролируется многими генами, которые были открыты учеными. Одни охраняют полноценные клетки, другие дают сигнал на уничтожение исчерпавших свой срок или подвергшихся эпимутациям и мутациям. И лишь одни клетки не подвергаются апоптозу, очень часто – раковые. Причина: изменения в генах, регулирующих апоптоз в клетке.
Акад. В.П. Скулачев (2001) задает вопросы и отвечает на них сам так:
1. В.Н. Пак и его группа (2000) разработали препарат, индуцирующий апоптоз в раковых клетках, и применили его для лечения пациентов, страдающих от рака. Они заставили раковые клетки покончить жизнь самоубийством. Ясно, что для запуска апоптоза надо вскрыть мембраны митохондрий в раковых клетках.
2. Активация прокаспазы 3 в раковых клетках химическим соединением и включение апоптоза.
Выше была подчеркнута роль прокаспазы 3, которая превращается в активный фермент – каспазу 3. Она разрушает в клетке-мишени белки, ДНК, и клетка гибнет.
Ученые оценили эффект РАС-1 на клетках рака прямой кишки, взятые у 23 пациентов. Содержание прокаспазы 3 в них было в восемь раз выше нормы, что усиливало действие препарата.
В других экспериментах на мышах, которым прививали клетки рака почек и легких человека, показана эффективность препарата РАС-1 и нарастание ее с ростом количества прокаспазы 3 в раковых клетках (цит. по: Д. Биелло,2006).
Читайте также:

