Антиангиогенез лишает рак крови
По сосудам поступает питание для всех органов и тканей организма. Ангиогенез опухоли – это способность рака обеспечивать собственное кровоснабжение за счет формирования новой сосудистой сети: без питательных веществ и кислорода раковые клетки погибнут, поэтому создание опухолью новых артерий – необходимое и обязательное условие роста злокачественного новообразования.
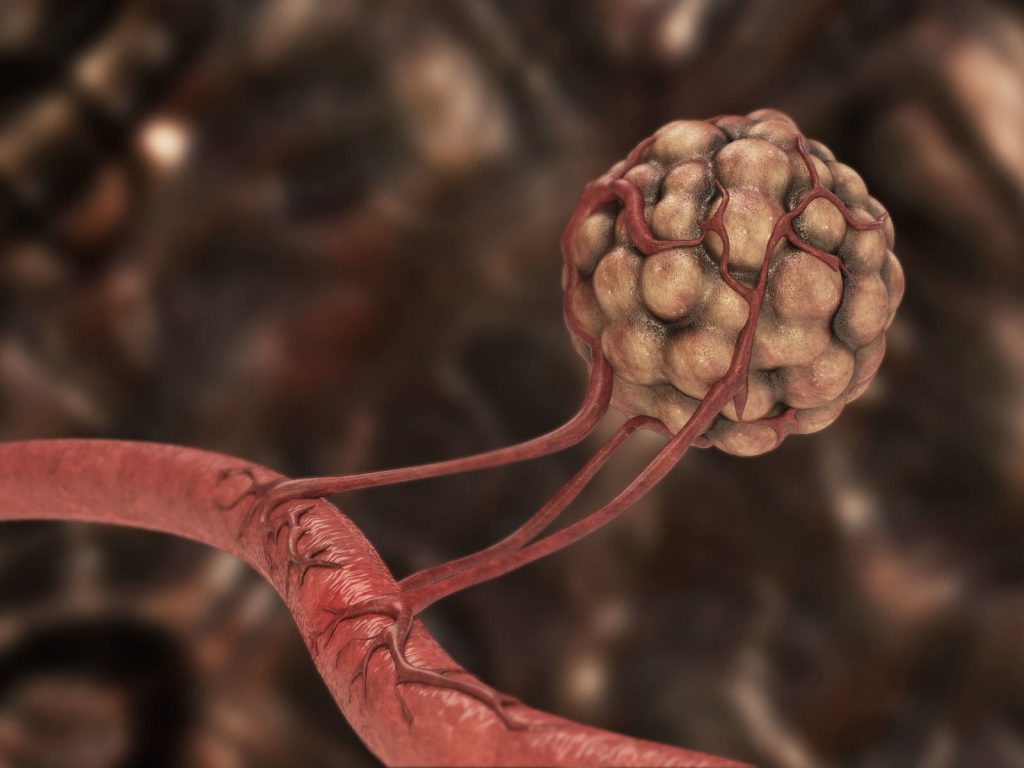
Кровоснабжение ракового очага
Ангиогенез опухоли – что это такое
У здорового взрослого человека новые сосуды не образуются – в сформировавшемся организме в этом нет никакой необходимости. В норме появление и рост новых артерий и вен происходит в следующих ситуациях:
- В период эмбриогенеза, при беременности у плода и в первые месяцы жизни ребенка;
- При регенерации тканей на фоне травмы или после операции.
Ангиогенез опухоли – это патологический вариант возникновения новой сосудистой сети, возможный за счет стимулирующего действия злокачественного новообразования на имеющиеся мелкие капилляры и артерии. На первом этапе формирования ракового очага злокачественные клетки получают питание и кислород из окружающих тканей, но этот бессосудистый механизм опухолевого роста возможен только до величины узла в 1-2 мм. Затем, если нет собственных сосудов, в опухоли происходят следующие события:
- некроз всей или локального участка новообразования;
- апоптоз раковых клеток;
- переход в дремлющее состояние.
Механизм формирования сосудов в опухоли
Любой кровеносный сосуд состоит из клеток эндотелия. Это самые стабильные и долгоживущие клетки в живом организме, которые не обновляются длительное время (в кишечнике в каждый момент времени происходит обновление 14% клеток кишечной стенки, а в сосудах – 0.01%). Состояние покоя определяет стабильность системы: без определенного стимулирующего влияния никаких новых капилляров и артерий не будет. Ангиогенез опухоли – это прямое и выраженное воздействие раковой опухоли на эндотелий сосудов, которые находятся рядом с новообразованием. Включение механизма формирования капилляров в опухоли происходит при создании определенных условий и при обязательной величине новообразования в 1-2 мм. Основные этапы ангиогенеза:
- Активация эндотелия стимуляторами злокачественного новообразования;
- Пролиферация эндотелиальных клеток;
- Миграция эндотелия (перемещение) в опухоль;
- Появление и рост кровеносного сосуда.
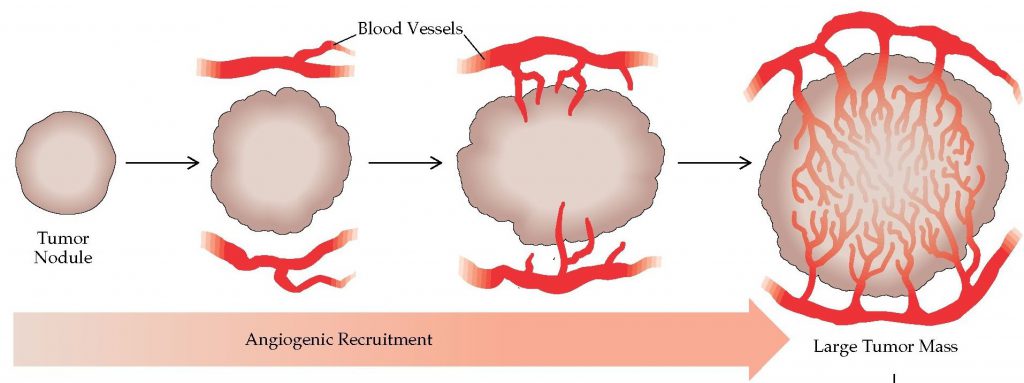
Механизм ангиогенеза опухолевого очага
Прогностическое значение ангиогенеза для рака
Необходимо понимать – ангиогенез опухоли является важнейшим фактором опухолевого роста: если в очаге рака стали формироваться новые капилляры, то можно ожидать в ближайшее время появление первых признаков заболевания с быстрым увеличением размеров злокачественного новообразования. И что самое худшее – появление новых артерий открывает ворота для метастазирования: раковые клетки из первичного очага могут устремиться в путешествие по организму, захватывая новые территории, расселяясь по органам и тканям, что резко снижает вероятность благоприятного прогноза для выздоровления.

Антиангиогенная терапия является относительно новым методом лечения злокачественных новообразований. Дело в том, что быстрый рост размеров злокачественного новообразования должен обеспечиваться регулярной доставкой обильного количества питательных веществ и кислорода. Есть данные, свидетельствующие о том, что на каждый миллиметр опухолевой ткани требуется построение новой капиллярной сети. Если этого не произойдет, бесконтрольный рост новообразования будет невозможен.
Образование капиллярной сети реализуется посредством ангиогенеза, который регулируется множеством факторов, стимулирующих и блокирующих его. Если влиять на эти факторы, можно контролировать этот процесс, тем самым влияя на развитие новообразования. Более подробно остановимся на этом.
Ангиогенез — это процесс образования новых кровеносных сосудов путем выпячивания стенки уже существующего сосуда. Во взрослом организме этот процесс обеспечивает восстановление поврежденных тканей — заживление ран, ушибов, восстановление после инсультов, инфарктов и других патологических процессов.
Активация ангиогенеза происходит и при патологических процессах, например, при развитии злокачественных опухолей. Чтобы они могли интенсивно размножаться, им необходимо большое количество кислорода и питательных веществ, которые они получают из крови. Соответственно, по мере роста размера опухоли, ее ткань прорастает новыми кровеносными сосудами. А если это по каким-либо причинам невозможно, рост новообразования также невозможен.
Чтобы обеспечить процесс ангиогенеза, опухолевые клетки вырабатывают специальные молекулы — факторы роста (ФР), которые будут стимулировать прорастание новых капилляров. Самая важная из них — это фактор роста эндотелия сосудов VEGF. А вообще, открыто более 20 молекул, которые стимулируют образование новых капилляров.
Как это происходит
Весь процесс образования капилляра можно представить следующим образом:
- Разрушение стенки кровеносного сосуда под действием металлопротеаз, синтезируемых опухолью.
- Выход эндотелиальных клеток из сосудов и их миграция по направлению к опухоли.
- Пролиферация (размножение) эндотелиальных клеток по мере продвижения в строме.
- Образование новых капиллярных трубок.
- Образование анастамозов между трубками и формирование новой капиллярной сети.
- Угнетение процесса ангиогенеза под действием антиангиогенных факторов.
Факторы, стимулирующие ангиогенез
Пока нет единой классификации факторов, которые стимулируют ангиогенез. Мы их разделим на биомеханические и физические.
Из биомеханических факторов наибольшее значение имеет ток крови. Постоянный ламинарный (ровный) поток крови способствует стабилизации кровеносных сосудов. И наоборот, турбулентности, циклические деформации и другие сбои приводят к активации эндотелия.
- Главным стимулятором роста кровеносных сосудов является семейство факторов роста кровеносных сосудов VEGF. Они представлены несколькими видами:
- VEGF А — отвечает за миграцию и деление эндотелиальных клеток,
- VEGF B — обеспечивает эмбриональный ангиогенез. У взрослых людей его максимальная концентрация обнаруживается в сетчатке, ткани головного и спинного мозга и миокарде. Оказывает мощное нейропротекторное действие, поэтому на него возлагают большие надежды в лечении болезни Альцгеймера и инсультов. На проницаемость кровеносных сосудов и их пролиферацию он не влияет.
- VEGF С — в максимальной концентрации обнаруживается в клетках лимфатических сосудов, обеспечивает их рост. В онкологическом процессе играет роль маркера метастазирования.
- VEGF D — отвечает за развитие лимфатических сосудов в легких.
- PLGF — плацентарный фактор роста.
- FGF2 фактор роста фибробластов — при взаимодействии с рецепторами FGFR стимулирует деление эндотелиальных клеток и их миграцию.
- IGF-1 инсулиноподобный фактор роста — стимулирует рост сосудов за счет активации синтеза IL-8.
- Ангиопоэтины — способствуют выживанию мигрировавших эндотелиоцитов, формированию между ними связей, их взаимодействию с перицитами. Таким образом, стабилизируются вновь образованные сосуды.
- Тромбоцитарный фактор роста также отвечает за стабилизацию сосудов.
Факторы, угнетающие ангиогенез
- Тромбоспондины TSP. Эти факторы были открыты и описаны одними из первых. Они имеют два механизма действия — один реализуется за счет прямого действия на эндотелиоциты, а второй за счет подавления проангиогенных факторов. При прямом действии оказывается подавляющий эффект на деление клеток и их миграцию, помимо этого активируется апоптоз. Вторым механизмом действия является угнетение VEGF за счет связывания его и препятствования его выходу в межклеточное пространство. Помимо этого, тромбоспондины угнетают активность и биодоступность фактора роста фибробластов и других стимуляторов роста кровеносных сосудов.
- Ангиостатины. Они подавляют опухолевый ангиогенез, пролиферацию и миграцию эндотелиоцитов, активируют их апоптоз (гибель), блокируют внутриклеточный синтез VEGF.
- Эндостатины — подавляют размножение эндотелиоцитов и тубулогенез.
- Вазогибин — подавляет экспрессию рецепторов VEGF.
- Некоторые цитокины, например, IL4 (интерлейкин-4).
Антиангиогенные препараты
Эффект антиангиогенных препаратов основан на блокировании действия факторов роста кровеносных сосудов. Тем самым процесс образования новых капилляров замедляется, опухоль не получает достаточного количества питательных веществ и соответственно не может наращивать свою массу. С этой целью используется большое количество препаратов.
- Бевацизумаб — гуманизированные моноклональные антитела, которые избирательно связываются с биологически активной формой VEGF и блокируют его действие. Антиангиогенную терапию бевацизумабом применяют для лечения метастатических форм колоректального рака (вместе с химиотерапией), рака груди, немелкоклеточного рака легких, почечно-клеточного рака и глиобластомы.
- Афлиберцепт. Он действует как ловушка для VEGF. При соединении, он образует более прочные связи, и мешает VEGF соединяться с внеклеточным рецептором. Благодаря этому, блокируется передача внутриклеточных сигналов, запускающих процессы образования новых сосудов. Доказал свою эффективность при метастатическом колоректальном раке.
- Рамуцирумаб — блокирует рецепторы второго типа эндотелиального фактора роста и, соответственно, мешает его связыванию с VEGF. В результате становится невозможным синтез митогенактивируемых протеинкиназ, нейтрализуется размножение клеток эндотелия. Антиангиогенную терапию рамуцирумабом применяют при аденокарциномах желудка (совместно с паклитакселом или в монорежиме), немелкоклеточном раке легких и метастатическом колоректальном раке.
- Акситиниб — блокирует тирозин-киназные рецепторы эндотелиального фактора роста VEGFR, PDGFR, KIT. Применяется в рамках терапии второй линии при лечении больных распространенным раком почки.
- Вандетаниб. Подавляет активность рецептора VEGF, тем самым угнетая размножение, пролиферацию эндотелиоцитов, подавляет образование новых кровеносных сосудов, проницаемость опухолевых сосудов и уменьшает плотность сосудистой сетки. Применяется при распространенных формах медуллярного рака щитовидной железы.
- Ниндетаниб. Блокирует ангиокиназу, рецепторы VEGF 1-3 типа, рецепторы к тромбоцитарному фактору роста и фактору роста фибробластов. Применяется при рецидивирующих формах немелкоклеточного рака легкого.
- Пазопаниб. Блокирует рецепторы VEGF 1-3 типа, рецепторы к тромбоцитарному фактору роста и фактору роста фибробластов, рецепторы к фактору роста стволовых клеток. Антиангиогенная терапия пазопанибом используется при раке почки и лечении сарком мягких тканей.
- Регорафениб. Оказывает комплексное противоопухолевое действие, влияя не только на факторы роста кровеносных сосудов, но и на процессы канцерогенеза, метастазирования и на опухолевое микроокружение. Применяется при колоректальном раке, ГИСО и раке печени.
- Сорафениб — блокирует тирозин-киназные рецепторы эндотелиального фактора роста VEGFR 2,3, PDGFR, FGFR. В настоящее время применяется для лечения диссеминированного рака почки, который уже не чувствителен к стандартной терапии. Увеличивает время до прогрессирования заболевания и общую выживаемость пациентов. Также может применяться для лечения немелкоклеточного рака легких, меланомы, рака печени и предстательной железы, рака яичников и др.
- Сунитиниб. Блокирует рецепторы тромбоцитарного фактора роста, факторов роста эндотелия и стволовых клеток и колониестимулирующего фактора. Антиангиогенная терапия сунитинибом используется при ГИСО (гастроинтестинальлных стромальных опухолях).
Метрономная терапия
Метрономная химиотерапия представляет собой длительное и регулярное применение цитостатиков в низких дозировках. Препараты могут назначаться еженедельно, несколько раз в неделю и даже ежедневно. Такое лечение оказывает комплексное воздействие на опухоль:
- Оказывает антиангиогенное действие, блокируя рост опухолевых сосудов.
- В некоторой степени уничтожает или останавливает размножение злокачественных клеток.
- Стимулирует противоопухолевый иммунитет.
Антиангиогенное действие метрономной химиотерапии основано на следующих эффектах:
- Подавляют циркуляцию эндотелиальных стволовых клеток.
- Подавляет деление эндотелиальных клеток.
- Увеличивает уровень тромбоспондина — антиангиогенного фактора.
В метрономных режимах назначается винкрестин, капецитабин, циклофосфамид, метотрексат, фторурацил и многие другие препараты.
Интересно понаблюдать за перипетиями вхождения новых идей, нередко это очень трудный и тернистый путь. Давайте посмотрим, что случилось с одной революционной теорией, которая ко всеобщему облегчению уже миновала третий этап и теперь ее справедливость ни у кого не вызывает сомнений.
Речь идет об ангиогенезе (развитии кровеносных сосудов, ассоциирующихся со злокачественными новообразованиями). О самом этом понятии - ангиогенез - онкологическое сообщество до недавнего времени ничего не ведало и ведать не хотело, считая это бредом идиота-хирурга, взявшегося учить “неприкосновенную” касту онкологов. Доктор Джуда Фолкман, военный врач-хирург флота США, в середине шестидесятых годов, проводя многочисленные онкологические операции, заметил одну странную особенность. Буквально все злокачественные опухоли были насквозь пронизаны и опутаны мелкими кровеносными сосудами (капиллярами). Причем в отличие от нормальных капилляров, достаточно прочных и гибких, эти раковые сосуды и капилляры были необычно хрупкие, словно сделанные на скорую руку.
Ангиогенез и рак
Здесь нужно заметить, что кровеносная система со всеми ее сосудами и капиллярами, дается нам раз и навсегда и формируется еще в утробе матери. Между прочим, ее общая длина составляет ни много ни мало 60 000 миль, т.е. больше 100000 км.
Как правило, клетки стенок кровеносных сосудов не делятся и не создают новых капилляров, за исключением чрезвычайных обстоятельств - ранение например, когда требуется провести ремонт поврежденных тканей или органов, или после менструации. Это как раз те случаи, когда необходима скорость даже в ущерб качеству. Такие сосуды крайне непрочны, при малейшем повреждении могут рваться и кровоточить, и как только необходимость в них отпадает организм от них избавляется. Для этого существует специальный механизм саморегуляции и строгого контроля.
Капилляры несут питательные вещества и кислород ко всем клеткам тела и уносят отходы их жизнедеятельности, без них ни одна клетка существовать не может. Это равно относится и к раковым клеткам. Для выживания растущая опухоль отчаянно нуждается в собственной кровеносной системе, но поскольку опухоль растет очень быстро, то и сосуды должны расти не менее быстро, т.е. опять же скорость в ущерб качеству. Да по-другому и быть не может, поскольку используется один и тот же механизм роста сосудов, как для раковой опухоли, так и для аварийного ремонта поврежденных систем организма.
Доктор Фолкман назвал это явление (обретение опухолью способности создавать собственную кровеносную систему) angiogenesis - ангиогенез, от греческого angio- сосуд и genesis- рождение. Он вполне резонно рассудил, что раковые зародыши размером с острие иглы каким-то образом умудряются использовать имеющийся у организма механизм быстрого реагирования для создания временной кровеносной системы, и если не дать им этим механизмом воспользоваться, то они так и останутся в этом спящем состоянии и никогда не смогут развиться в то, что называют злокачественной опухолью.
Что потом началось - не опишешь словами. Никакой реакции на статью не было. Зато было другое: за ним прочно укоренилось прозвище - шарлатан, с его лекций демонстративно уходили, коллеги по работе просто от него шарахались, даже студенты стали его покидать.
В карьерной американской медицине такое пятно в преподавательской биографии никому не нужно. Непреклонность доктора Фолкмана стоила ему потери поста главы хирургического отделения.
"Бороться и искать, найти, и не сдаваться" - это про него, он вполне бы мог претендовать на роль третьего капитана в известном романе В. Каверина. Не обращая внимания на злопыхателей, доктор продолжал исследования и сформулировал свою теорию развития рака.
Вот ее основные положения:
1. Микроопухоли не могут развиться в опасные для жизни злокачественные новообразования без создания собственной кровеносной системы, питающей их.
2. Для того чтобы это сделать, микроопухоли выделяют химические субстанции, называемые ангиогенины, побуждающие кровеносные сосуды достигать их и генерировать систему новых сосудов.
3. Раковые клетки, отпочковавшиеся от основной опухоли - то есть метастазы, опасны только тогда, когда им удается создать свою собственную кровеносную систему.
4. Основная опухоль посылает метастазы. Но как всякая колониальная империя, она держит руку на пульсе и не дает своим колониям-метастазам слишком большой независимости, производя специальную химическую субстанцию - ангиостатин, блокирующую рост новых сосудов.
Да, но где доказательства, господа? Где этот мифический ангиостатин, блокирующий рост сосудов? Смешно было думать, что исследовательские лаборатории бросятся искать вещество, являющееся плодом воображения свихнувшегося хирурга, тем более, что задача представлялась совершенно непосильной - найти этот самый ангиостатин среди тысяч разных белков, которые производит растущая опухоль. Как в сказке - “Пойди туда, не знаю куда и принеси то, не знаю что”. Дурных нема. Это умные так думают и ошибаются - как в нашем случае. Но безумные идеи на то и безумные, что привлекают одержимых людей.
Таким оказался молодой исследователь-хирург Майкл О'Рейлли, чья воля и упорство была под стать боссу. В течение двух лет он искал ангиостатин в моче мышей, резистентных к метастазам. Наконец он нашел протеин, блокирующий рост сосудов куриных эмбрионов, где сосуды растут очень быстро.
Момент истины настал. Нужно было показать эффективность ангиостатина на живых организмах. Двадцати мышам ввели тип рака, чьи метастазы при удалении основной опухоли быстро прорастают в легкие. Сразу после введения раковых клеток половине мышей ввели ангиостатин. Через несколько дней в присутствии многочисленных свидетелей провели вскрытие всех участников эксперимента. Легкие контрольной группы были черными, пронизанными метастазами. У другой половины получивших инъекцию мифического ангиостатина легкие остались девственно розовыми, без каких-либо признаков рака. Случилось это в 1994 году, двадцать лет спустя.
Ангиогенез сразу занял сердца и умы всего онкологического и фармацевтического сообщества. А где же хулители, с их званиями и дипломами?Думаете, лишили-отобрали? Да ничего подобного! Они теперь в первых рядах нового прогрессивного направления в онкологии. Вещают. Ну да бог с ними.
Гораздо более интересно знать, что же с тех пор изменилось в плане эффективности лечения раковых больных. Где фармацевтические гиганты с их огромными ресурсами? Что они сделали за прошедшие 15 лет? Работали и работают, уже выдали восемь препаратов, блокирующих рост сосудов. Эти препараты выгодно отличаются от традиционных препаратов для химиотерапии, прежде всего своей избирательностью, они не затрагивают здоровые сосуды и гораздо менее токсичны для организма.
Так что же, можно теперь вздохнуть с облегчением? Нашлась, наконец, серебряная пуля, победили это чудовище? Очень хотелось бы дать утвердительный ответ. Но все мы знаем, что это не так.
В одних случаях новые препараты были весьма эффективны, в других - результаты разочаровывали. Все это было очень далеко от того сто-процентного результата, продемонстрированного на мышах. И дело не только в том, что одно дело - мыши, а совсем другое - люди. В том мышином эксперименте ангиостатин мышам вводили практически одновременно с раковыми клетками, т.е. эти клетки еще не успели сформировать собственно опухоль со своей кровеносной системой. Препарат блокировал развитие опухоли в самом зародыше, прекрасно показав справедливость теории доктора Фолкмана. Если же время упущено и основная опухоль, или ее метастазы успели сформировать свою собственную кровеносную систему, тогда одним ангиостатином не обойдешься, ведь он и задуман был как некий наместник, представитель центра, держащий под контролем заморские территории. Ну а если этим территориям удалось стать самодостаточными, кому он тогда нужен.
Что же из всего этого следует? Совершенно верно, необходимо постоянно блокировать этих монстров в колыбели. Ну вот, скажете Вы, приехали. Прикажете теперь в профилактических целях эти препараты, как витамины, глотать на постоянной основе. Ни в коем случае, даже мысли такой не держу. Эта золотая по стоимости профилактика ничего кроме вреда принести не может.
Вырисовывается какой-то замкнутый круг. Больным, а еще больше здоровым людям, (никого не хочу пугать, но как можно было заметить, отсутствие клинических показателей вовсе не означает отсутствие раковых клеток) жизненно необходимо иметь вещества типа ангиостатина на постоянной основе, но химические препараты на эту роль определенно не годятся. По счастью, ангиогенез привлек внимание не только капитанов фармацевтической индустрии, но и ученых из альтернативного сообщества.
Они и показали, что те же самые активные вещества фармацевтических препаратов, блокирующие рост сосудов, можно найти в природных соединениях и их повседневное употребление никакими побочными эффектами (медицинского и финансового характера) никому не грозит. Но вопрос этот не столь однозначен - есть вещества, блокирующие рост сосудов, а есть и провоцирующие их рост. Оказывается, организму нужны и те и другие - главное баланс. Опять настало время для мозгового штурма, надеюсь последнего в нашем расследовании. Придется потерпеть, без малопонятных терминов никак не обойтись. Рассмотрим более подробно механизм ангиогенеза не любопытства ради, а с чисто утилитарной целью - выявить его слабые места, ведь ничто в природе не совершенно.
Практически все живые организмы обладают способностью восстанавливать свои поврежденные ткани, для этого существует специальный хорошо отлаженный механизм. Речь идет о воспалительном процессе. Как только случается повреждение любого рода - будь то порез, ожог, удар, инфекция и пр., он немедленно начинает работать. Каким образом? Тромбоциты крови, как сторожевые псы, фиксируют нарушителя и окружают его со всех сторон. Они подают сигнал бедствия, выделяя определенную химическую субстанцию PDGF - фактор роста, полученный из тромбоцитов.
Получив этот сигнал, в дело вступают своего рода “силы быстрого реагирования” - лейкоциты иммунной системы. Они в свою очередь начинают выделять химические вещества (сложные названия которых я опускаю ради простоты изложения), координирующие весь процесс восстановления. Для удобства назовем их воспалительные субстанции (ВС). Работа закипела. В первую очередь эти химические вещества расширяют окружающую рану, кровеносные сосуды, облегчая к ним доступ прибывающих туда в качестве своего рода подкрепления других клеток иммунной системы. Затем они как бы запаивают рану, вбрасывая в кровь огромное количество тромбоцитов, что приводит к свертыванию крови вокруг раны. Половина работы сделана.
Теперь остается разобраться с непрошеными гостями, покусившимися на целостность организма. Для этого прилегающие к ране ткани разрыхляются, давая возможность иммунным клеткам войти и уничтожить чужеродные тела. Но остались поврежденные ткани, и здесь, внимание, включается механизм восстановления повреждений.
Остановимся на этом подробнее. Те же самые химические вещества, название которых мы опустили, побуждают поврежденные ткани к росту. Ткани должны восстановить свои утерянные позиции путем ускоренного деления клеток, а для этого их, естественно, необходимо обеспечить кислородом и питательными веществами. Окружающие рану кровеносные сосуды получают команду быстро расти и организовать необходимое кровоснабжение. Все это продолжается ровно столько, сколько нужно для полного восстановления раны. Как только это происходит, рост тканей и сосудов прекращается, и созданная временная кровеносная система безболезненно удаляется из организма. Силы быстрого реагирования - клетки иммунной системы - переходят в режим ожидания.
Каждый из нас многократно испытывал на себе работу воспалительного процесса, будь это простая заноза или глубокая рана - внешние проявления могут быть разные, но стоящий за этим механизм один и тот же. Замечательное произведение природы, служащее нам верой и правдой.
Но вот оказывается, что некая группа товарищей “положила на него глаз” и научилась его использовать в своих, далеко не благих целях. Товарищи, мне кажется, в представлении не нуждаются. Знакомые все лица - раковые клетки, желающие стать отдельной самостоятельной структурой в нашем организме. Когда речь идет о стадиях, через которые должна пройти переродившаяся клетка в то, что мы называем раком, было отмечено, что при достижении третьей стадии, стадии-развития, в числе прочего злокачественная структура приобретает способность формировать обслуживающую ее кровеносную систему.
Они, эти товарищи, ничего нового не придумали, да и зачем, ведь воспалительный процесс работает очень эффективно. Они его только слегка модифицировали, сделали непрерывным. Так же как и при легитимном процессе, раковые клетки в огромных количествах производят те же самые химические субстанции (назовем их для особо любознательных товарищей – цитокин и хемокин), инициирующие воспалительный процесс, благодаря которому достигаются те же цели, что и при самовосстановлении поврежденных тканей.
Но если в первом случае производство воспалительных субстанций прекращается с завершением ремонтных работ и клетки получают команду к прекращению воспроизводства, то во втором - эти воспалительные субстанции производятся в нарастающих количествах. Они (ВС) совершенно также как и в первом случае провоцируют клетки, раковые клетки, к быстрому росту, разрыхляют окружающие ткани, облегчающие этот рост и наконец стимулируют быстрый рост кровеносных сосудов.
А где же клетки иммунной системы, почему они не выполняют своих обязанностей? Вот здесь как раз и возникает этот злобный, порочный круг. Как только опухоль выделяет в огромных количествах ВС, клетки иммунной системы немедленно туда направляются. Однако не бросаются уничтожать опухоль, а благодаря плотному туману из воспалительных субстанций впадают в растерянность, перестают понимать что от них требуется и сами в свою очередь начинают выделять эти ВС в больших количествах.
Парадокс состоит в том, что сформировавшаяся злокачественная опухоль использует защитный механизм организма - иммунную систему - для стимуляции своего роста. Печально, но факт. И это до такой степени факт, что уже существуют методики, связывающие продолжительность жизни больных с разными видами рака с интенсивностью воспалительного процесса, провоцируемого опухолью. Удалось даже выделить единичную провоспалительную субстанцию, в очень большой степени отвечающую за рост как самой опухоли, так и кровеносных сосудов и метастазирование раковых клеток, под названием транскрипцио́нный фактор NF-κB, своего рода “черный рыцарь” раковой опухоли. В этом нет никакого преувеличения, уже появились работы, показывающие, что можно предотвратить развитие практически любого вида рака путем подавления транскрипцио́нного фактора NF-κB.
И это не обязательно должны быть химические препараты. Нужны молекулы природных соединений, которые являются ингибиторами транскрипцио́нного фактора NF-κB . Веществ этих на удивление много. Подробно об этом несколько позже, пока назовем только два - это одна из форм кахетина, полифенол, присутствующий в зеленом чае, и резвератрол, его можно найти в виноградных косточках и в красном вине.опубликовано econet.ru.
Понравилась статья? Напишите свое мнение в комментариях.
Подпишитесь на наш ФБ:
Ангиогенез — это образование новых кровеносных сосудов. Этот процесс включает миграцию, рост и дифференцировку эндотелиальных клеток, которые выстилают внутреннюю стенку кровеносных сосудов. Важно отметить, что ангиогенез необходим для прогрессирования опухоли, поскольку опухоли не могут расти до диаметра более 1–2 мм до того, как их потребности в кислороде и питательных веществах, а также удаление продуктов жизнедеятельности, больше не могут быть удовлетворены только путем диффузии (1688381). Недостаток кислорода и питательных веществ в микроокружении опухоли заставляет опухолевые клетки экспрессировать стимулирующие ангиогенез медиаторы, такие как фактор роста эндотелия сосудов (VEGF).
![]()
Два основных процесса формирования кровеносных сосудов вовлечены в развитие сосудистой системы: васкулогенез и ангиогенез. Васкулогенез преобладает у эмбрионов и относится к формированию кровеносных сосудов de novo путем дифференцировки in situ мезодермальных ангиобластов и эндотелиальных предшественников. Ангиогенез — это образование новых капилляров из уже существующих сосудов и циркулирующих эндотелиальных предшественников (Polverini, 2002 ; Chung et al ., 2010 ; Ribatti and Djonov, 2012 ). Ангиогенез — это строго контролируемый динамический процесс, который может происходить физиологически в тех тканях, которые подвергаются активному ремоделированию в ответ на стресс и гипоксию (Carmeliet, 2003; Фолькман, 2007 ). Тем не менее, он может быть ненормально активирован при многих патологических состояниях, таких как рак, диабетическая ретинопатия, а также при многочисленных ишемических, воспалительных, инфекционных и иммунных расстройствах (Carmeliet, 2003 ; Ali and El-Remessy, 2009 ; Willis et al ., 2011 ). Хотя концепция предложения ингибиторов ангиогенеза в качестве противоопухолевых препаратов получила значительный скептицизм, когда впервые была представлена доктором Фолкманом в начале 1970-х годов (Folkman, 1971 ), активные исследования в этой области и последующие клинические испытания в конечном итоге привели к Управлению по контролю за продуктами и лекарствами США (FDA). одобрение бевацизумаба при колоректальном раке в 2004 году (Cohen et al ., 2007). С тех пор было выявлено несколько ангиогенных ингибиторов.
Процесс ангиогенеза контролируется химическими сигналами в организме. Некоторые из этих сигналов, такие как фактор роста эндотелия сосудов (VEGF), связываются с рецепторами на поверхности нормальных эндотелиальных клеток. Когда VEGF и другие эндотелиальные факторы роста связываются с их рецепторами на эндотелиальных клетках, инициируются сигналы внутри этих клеток, которые способствуют росту и выживанию новых кровеносных сосудов. Другие химические сигналы, называемые ингибиторами ангиогенеза, препятствуют образованию кровеносных сосудов.
Обычно стимулирующие и ингибирующие ангиогенез эффекты этих химических сигналов сбалансированы так, что кровеносные сосуды образуются только тогда и там, где они необходимы, например, во время роста и заживления. Но по причинам, которые не совсем ясны, иногда эти сигналы могут стать несбалансированными, вызывая увеличение роста кровеносных сосудов, что может привести к ненормальным условиям или заболеваниям. Например, ангиогенез является причиной возрастной мокрой макулярной дегенерации.
Почему ангиогенез важен при раке?
Образование сосудов как в состоянии здоровья, так и при заболевании происходит посредством васкулогенеза — т.е. рекрутирования эндотелиальных клеток-предшественников из костного мозга с образованием новых сосудов, ангиогенеза — то есть прорастания и роста новых сосудов из существующей сосудистой системы или инвагинации — то есть деления или расщепления кровеносных сосудов в два или более новых сосудов [22197620]. Наиболее распространенным путем роста новообразований при злокачественных новообразованиях является ангиогенез.(22190240)
В 1971 году Джуда Фолкман впервые выдвинул гипотезу о том, что рост опухоли зависит от ангиогенеза [4938153]. Согласно этой гипотезе, эндотелиальные клетки могут переключаться из состояния покоя в фазу быстрого роста посредством диффузионного химического сигнала, исходящего от опухолевых клеток. Переключение зависит от увеличения продукции одного или нескольких положительных регуляторов ангиогенеза, таких как фактор роста эндотелия сосудов (VEGF), фактор роста фибробластов-2 (FGF-2), интерлейкин-8 (IL-8), фактор роста плаценты (PlGF), трансформирующий фактор роста — бета (TGFbeta), фактор роста, полученный из тромбоцитов (PDGF), ангиопоэтины (Angs) и другие.
Ангиогенез играет критическую роль в росте рака, потому что солидным опухолям требуется кровоснабжение, если их размер превышает несколько миллиметров. Опухоли могут фактически вызвать формирование этого кровоснабжения, испуская химические сигналы, которые стимулируют ангиогенез. Опухоли могут также стимулировать соседние нормальные клетки, чтобы продуцировать сигнальные молекулы ангиогенеза.
Поскольку опухоли не могут расти выше определенного размера или распространяться без кровоснабжения, ученые разработали препараты, называемые ингибиторами ангиогенеза, которые блокируют ангиогенез опухоли. Цель этих лекарств, также называемых антиангиогенными агентами, состоит в том, чтобы предотвратить или замедлить рост рака, лишив его необходимого кровоснабжения.
Ингибирование опухолевого ангиогенеза является современным и популярным подходом к борьбе с опухолевой прогрессией [18463380 , 16355214]. Терапевтические вмешательства, направленные на снижение роста опухоли путем ингибирования ангиогенеза, быстро находят свое применение в клинической практике [16355214]. Источником этого подхода является то, что ингибиторы ангиогенеза нацеливают клетки, которые поддерживают рост опухоли, то есть эндотелиальные клетки, вместо непосредственного нацеливания на опухолевые клетки. Эндотелиальные клетки генетически более стабильны, чем опухолевые клетки, и, следовательно, менее склонны к развитию лекарственной устойчивости. Кроме того, эндотелиальные клетки напрямую доступны из кровотока, что позволяет наноносителям с высокой полезной нагрузкой ангиостатических препаратов эффективно достигать своего целевого сайта. Есть несколько классов ангиостатических препаратов, например, фактор роста блокаторов [7683111], ингибиторов фактора роста сигнализации, внеклеточные матричные модуляторы [11948139], а также эндотелиальные пролиферации и миграция клеток ингибиторов [ 9008168 , 15050911, 11171099]. В 2004 году Управление по контролю за продуктами и лекарствами (FDA) одобрило первый ангиостатический препарат (Авастин) для применения человеком [ 15563312].
Иингибиторы ангиогенеза
Ингибиторы ангиогенеза являются уникальными борющимися с раком агентами, потому что они блокируют рост кровеносных сосудов, которые поддерживают рост опухоли, а не блокируют рост самих опухолевых клеток.
Ингибиторы ангиогенеза по-разному влияют на различные стадии роста кровеносных сосудов. Некоторые из них являются моноклональными антителами, которые специфически распознают и связываются с VEGF. Когда VEGF присоединен к этим лекарствам, он не может активировать рецептор VEGF. Другие ингибиторы ангиогенеза связываются с VEGF и / или его рецептором, а также с другими рецепторами на поверхности эндотелиальных клеток или с другими белками в нижестоящих сигнальных путях, блокируя их активность. Некоторые ингибиторы ангиогенеза являются иммуномодулирующими препаратами — агентами, которые стимулируют или подавляют иммунную систему — которые также обладают антиангиогенными свойствами.
При некоторых видах рака ингибиторы ангиогенеза оказываются наиболее эффективными в сочетании с дополнительной терапией. Поскольку ингибиторы ангиогенеза работают, замедляя или останавливая рост опухоли, не убивая раковые клетки, их дают в течение длительного периода.
Управление по контролю за продуктами и лекарствами США (FDA) одобрило ряд ингибиторов ангиогенеза для лечения рака. Большинство из них являются таргетной терапией, которая была разработана специально для нацеливания на VEGF, его рецептор или другие специфические молекулы, участвующие в ангиогенезе. Утвержденные препараты ингибиторы ангиогенеза включают в себя:
- Акситиниб (Инлита);
- Бевацизумаб (Авастин);
- Кабозантиниб (Cometriq);
- Эверолимус (Афинитор);
- Леналидомид (Revlimid);
- Ленватиниб мезилат (Ленвима);
- Пазопаниб (Вотриент);
- Рамучирумаб (Cyramza);
- Регорафениб (Стиварга);
- Сорафениб (Нексавар);
- Сунитиниб (Sutent);
- Талидомид (Синовир, Таломид);
- Вандетаниб (Caprelsa);
- Зив-афлиберцепт (Zaltrap).
![]()
Побочные эффекты лечения ингибиторами ангиогенеза, нацеленными на VEGF, могут включать кровоизлияние, образование сгустков в артериях (с результирующим инсультом или инфарктом), гипертонию, нарушение заживления ран, синдром обратимой задней лейкоэнцефалопатии (расстройство головного мозга) и белок в моче. Желудочно-кишечная перфорация и свищи также являются редкими побочными эффектами некоторых ингибиторов ангиогенеза.
Антиангиогенезные агенты, которые нацелены на рецептор VEGF, имеют дополнительные побочные эффекты, включая усталость, диарею, биохимический гипотиреоз, синдром кисть-стоп, сердечную недостаточность и изменения волос.
Ангиогенез необходим для роста опухоли и метастатического потенциала и по этой причине считается важной мишенью для лечения опухоли.(20390447)
Применение ингибиторов ангиогенеза является частью неоадъювантной химиотерапии, используется с целью попытаться уменьшить рак, так чтобы хирургическая процедура не должна быть такой обширной. Читайть подробнее про химиотерапию.
В течение последних десятилетий фитохимические препараты получили значительное признание за их потенциальное терапевтическое применение при раке.Обширные исследования выявили огромный потенциал и захватывающие фармакологические свойства растительных лекарственных соединений и продемонстрировали синергетический эффект в сочетании с другими агентами для ингибирования ангиогенеза опухоли.Некоторые фитохимические вещества, используемые в терапии рака, демонстрируют относительно низкие побочные эффекты, а некоторые даже ограничивают побочные эффекты химиотерапевтических или антиангиогенных препаратов. (25600295)
Сульфорафан оказывает антиангиогенезное действие против гепатоцеллюлярной карциномы путем ингибирования передачи сигналов STAT3 / HIF-1α / VEGF (28978924)
Rлеток рака толстой кишки человека HCT116, где SFN значительно снижал уровень экспрессии VEGF и HIF-1α в дополнение к миграционному потенциалу клеток HCT116 (26498863).
Эти новые антиангиогенные активности сульфорафана могут способствовать его химиопрофилактическому и терапевтическому потенциалу. мы показали, что сульфорафан вмешивается во все существенные стадии неоваскуляризации от проангиогенной передачи сигналов и целостности базальной мембраны до пролиферации, миграции и формирования трубок эндотелиальных клеток. Эти новые антиангиогенные активности сульфорафана могут способствовать его химиопрофилактическому и терапевтическому потенциалу.(16546971)
Фенетилизотиоцианат ингибирует индуцированное гипоксией накопление экспрессии HIF-1α и VEGF в клетках глиомы человека.(23870899)
Уменьшение ангиогенеза фенетилизотиоцианатом зафиксировано вэтом исследовании (22266918) на клетках рака предстательной железы LNCaP.
Ингибирование ангиогенеза является одним из недавно опубликованных механизмов профилактики рака молочной железы с помощью PEITC.(23138465)
Zerumbone ингибирует ангиогенез опухоли через NF-κB при раке желудка .(24220661)
Имбирь подавляет рост клеток и модулирует ангиогенные факторы в раковых клетках
яичников.(18096028)
Эпигаллокатехин-3-галлат ингибирует ангиогенез опухоли: участие передачи сигналов эндоглина / Smad1 в клетках эндотелия (31586903)
Эпигаллокатехин-3-галлат-индуцированная васкулогенезная нормализация сосудов у голых мышей, несущих ксенотрансплантат A549: терапевтическая эффективность в сочетании с химиотерапией.(30988640)
Куркумин продемонстрировал антиангиогенный эффект in vivo на ксенотрансплантатных моделях различных опухолей, включая глиобластому, гепатоцеллюлярный рак, рак предстательной железы и яичников.(18226269) (20087857) (18395899) (17545551)
Куркумин подавляет инвазию кишечных микрососудистых эндотелиальных клеток и ангиогенез, вызванный активированными тромбоцитами.(31316605)
10 мкМ куркумина значительно ингибировал VEGF-индуцированную миграцию HUVEC в большей степени (52%), чем та же концентрация синтетического антиангиогенного агента — селективного ролипрама ингибитора PDE4 (41%) [203], Кроме того, доза-ответ ЕС50 обычно ниже для антиангиогенных эффектов по сравнению с цитотоксическими эффектами на раковые клетки как для синтетических, так и для натуральных продуктов.(25230992)
Куркумин обладает прямой антиангиогенной активностью in vitro и in vivo. Активность куркумина в ингибировании канцерогенеза в различных органах, таких как кожа и толстая кишка, может быть частично опосредована ингибированием ангиогенеза.(10780880)
Как и нормальная клетка, опухоль также требует питательных веществ, а также кислорода и выделяет избыточное количество углекислого газа для поддержания неконтролируемого роста. Генерируемый опухолью процесс ангиогенеза, выполнить все эти основные потребности. Ангиогенные факторы, такие как VEGF и ангиопоэтин, индуцируют и управляют общим процессом неоангиогенеза. Куркумин ограничивает избыточную экспрессию VEGF и ангиопоэтина и предотвращает процесс ангиогенеза путем прекращения снабжения раковых клеток пищей и кислородом [ 17569211 ]. Куркумин также ингибирует экспрессию рецептора VEGF (VEGFR1 и VEGFR2), тем самым блокируя VEGF / VEGFR-опосредованный сигнальный путь для ограничения ангиогенеза [ 18479807 ].
Куркумин оказался мощным ангионингибирующим соединением, о чем свидетельствует ингибирование ангиогенеза в двух системах анализа ангиогенеза in vivo, а именно. перитонеальный ангиогенез и анализ хориоаллантоисной мембраны.(12359244)
Влияние резвератрола на экспрессию генов VEGF и HIF 1 в клетках гранулезы на пути ангиогенеза синдрома поликистозных яичников(31327131) (15297429).
Ресвератрол индуцирует апоптоз и ингибирует ангиогенез у ксенотрансплантатов рака молочной железы человека in vivo (16356836)
Потребление ликопина с пищей было связано со снижением риска летального рака простаты и с меньшей степенью ангиогенеза в опухоли. Поскольку ангиогенез является сильным фактором прогрессирования, конечная точка летального рака простаты может быть более релевантной, чем конечная точка индолентного рака предстательной железы для ликопина в эпоху скрининга простат-специфических антигенов.(24463248)
Кроме того, каротиноиды обладают противораковой активностью на животных моделях рака молочной железы. Каротиноидная группа включает альфа-каротин, бета-каротин, ликопин, лютеин, астаксантин, криптоксантин и зеаксантин [9772131 , 16309738] . Антиоксидантное действие является одним из предполагаемых механизмов антиангиогенного действия каротиноидов.
Взятые вместе, эти данные подтверждают дальнейшее исследование пиперина в качестве ингибитора ангиогенеза для применения при лечении рака.(22902327)
Капсаицин исключительно нацелен на ангиогенез посредством подавления VEGF в немелкоклеточных клетках карциномы легкого [ 24926985 ]
Ингибиторы ангиогенеза используются в качестве монотерапии или в сочетании с другими противоопухолевыми препаратами. Монотерапия с использованием антиангиогенных агентов в основном предназначена для профилактики рака у восприимчивых людей или для задержки прогрессирования заболевания у пациентов с раком, которые ранее проходили лечение схемами первой линии / второй линии. В комбинированной терапии антиангиогенные лекарственные средства могут быть добавлены к схемам лечения для повышения их эффективности или для снижения развивающейся лекарственной устойчивости.
Пациенты с раком, которых лечили схемами первой или второй линии, могут продолжать поддерживающую терапию с использованием одного антиангиогенного препарата для продления выживаемости без прогрессирования (Giuliani et al ., 2010 ; Ledermann et al ., 2011 ; Фаби и др ., 2012 ). Кроме того, антиангиогенная монотерапия может быть полезной у пациентов с высоким риском развития рака через вмешательство в ангиогенное переключение (O’Reilly et al ., 1997 ; Bergers and Benjamin, 2003). Стратегия такого рода поддерживается сравнительной безопасностью антиангиогенных препаратов, позволяющих принимать препараты в течение длительных периодов времени (Ma and Waxman, 2008 ).
Комбинированная терапия
Перекрестное взаимодействие между ангиогенными и онкогенными сигнальными путями обеспечивает сильное обоснование для сочетания ингибиторов ангиогенеза с химиотерапевтическими и целевыми противораковыми агентами. Последующий общий терапевтический ответ зависит от правильного составления схем комбинированного лечения (Ma и Waxman, 2008). Схема комбинации ингибиторов ангиогенеза может быть неоадъювантной (до химиотерапевтического препарата), одновременной или адъювантной (после химиотерапевтического препарата) в зависимости от типа опухоли, антиангиогенного препарата и самого химиотерапевтического агента (Li et al., 2002; Ma и Waxman 2009). Во многих доклинических и клинических исследованиях доказано, что использование такого комбинаторного обоснования более эффективно, чем индивидуальное лечение. Например, было показано, что бортезомиб, ингибитор протеасом, усиливает ингибирующее действие IFN-α на опухоли UM-UC-3 мочевого пузыря человека вследствие подавления VEGF с конечным снижением плотности микрососудов (Papageorgiou et al. , 2006). В другом исследовании комбинированное лечение с использованием ваталаниба, VEGF TKI и дациностата, ингибитора гистондеацетилазы, было более эффективным, чем отдельные агенты, в ингибировании VEGF-индуцированного ангиогенеза in vitro и in vivo с синергетическим ингибирующим эффектом роста на мышиной модели подкожного введения. простаты и ортотопические опухоли молочной железы (Qian et al., 2004). Значительное терапевтическое улучшение также было достигнуто, когда циклофосфамид был включен в комбинированную терапию с акситинибом, другим VEGF TKI, в ксенотрансплантатах PC-3 рака простаты (Ma and Waxman, 2009). Клинически, добавление бевацизумаба к комбинированной химиотерапии на основе фторурацила приводит к повышению выживаемости у пациентов с метастазированием.
Читайте также:

