Анемия при опухолях головного мозга
Анемия нередко осложняет течение различных новообразований. До 40 % больных со злокачественными лимфомами и более половины больных с множественной миеломой уже к моменту постановки диагноза имеют выраженную анемизацию. У 1/4 больных с миеломой содержание гемоглобина не превышает 80 г/л, а количество больных с анемией среди больных с лимфомами по окончании лечения увеличивается до 70 %. Считается, что эта проблема менее значима при солидных опухолях.
Тем не менее анализ данных донорских регистров США свидетельствует, что до 50— 60 % больных с опухолями гинекологической сферы, мочеполовых органов и легкого получали заместительные гемотрансфузии в период проведения химиотерапии.
Более половины из 7000 больных с анемией, включенных в контролируемые популяционные исследования по применению эритропоэтина у больных с неоплазиями, имели солидные опухоли.
В 2001 г. проведено проспективное изучение частоты анемии у больных с опухолевыми заболеваниями в Европе (ECAS). Содержание гемоглобина было сниженным у 31 % первичных больных, не получавших лечения, и у 42 % больных, которым проводили химио- или радиотерапию.
Если у больных не было анемии на момент постановки диагноза, то в большинстве случаев (62 %) она развивалась в процессе лечения. Анемия возникала у 63 % больных, получавших химиотерапию (у 75 % после режимов, содержащих препараты платины, и у 54 % после прочих), у 42 % больных после сочетанного применения химио- и радиотерапии и у 20 % больных только после лучевого воздействия. Лишь 40 % больных с анемией, выявленной исходно или на протяжении лечения, получали заместительные гемотрансфузии или эритропоэтин.
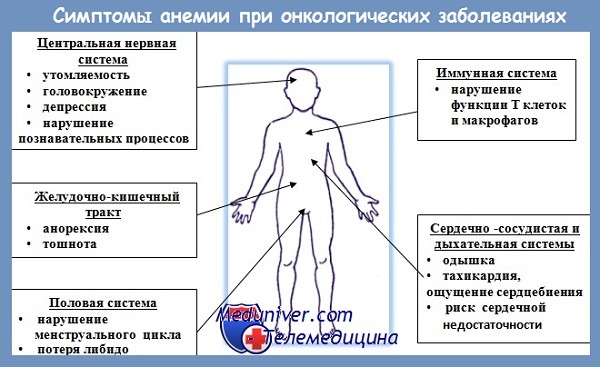
При опухолевых заболеваниях патогенез анемии многообразен. Основные причины — кровотечение, дефицит витаминов и железа, аутоиммунный гемолиз, метастазирование в костный мозг, токсичность цитостатиков и др. Анемия нередко развивается у больных, не имеющих для этого видимых причин.
При исследовании качества жизни больных с опухолевыми заболеваниями слабость выделена как одна из наиболее распространенных жалоб. В частности, слабость осложняет проведение химиотерапии у 76 % больных, тошнота — у 54 % и боль у 24 % больных. В генезе слабости могут играть роль такие факторы, как нарушение нейромышечной проводимости, повышение уровня метаболизма белков, снижение питания и аффективные расстройства (депрессия). В то же время при многовариантном статистическом анализе одним из самых значимых независимых прогностических факторов слабости была анемия. Современные данные свидетельствуют о появлении слабости, снижающей показатели качества жизни, при содержании гемоглобина менее 120 г/л. В контролируемых исследованиях по лечению анемии максимальное снижение слабости и прирост показателей качества жизни наблюдались при повышении содержания гемоглобина до 120 г/л.
Слабость, снижение физической и социальной активности часто недооцениваются врачами, которые не склонны считать эти проблемы важными по сравнению с болью, рвотой или инфекцией. В современных работах по выявлению значимости основных жалоб больных с опухолевыми заболеваниями слабость и социальная дезадаптация занимают лидирующее место. В одном из исследований на вопрос, что следует лечить в первую очередь: слабость или боль, большинство больных выбрали слабость. На тот же самый вопрос 95 % врачей ответили противоположным образом.
Анемия и как следствие тканевая гипоксия могут сказаться на эффективности лекарственного и лучевого противоопухолевого лечения. Противоопухолевый эффект радиации связан с образованием свободных радикалов, которые взаимодействуют с основаниями ДНК в присутствии молекулярного кислорода, что останавливает клеточную пролиферацию и вызывает гибель клеток. Недостаток кислорода замедляет этот процесс. В клетке, находящейся в состоянии гипоксии, свободные радикалы не фиксируются к ДНК и мембранам и, таким образом, смерть клетки может не наступить. Впервые снижение эффекта облучения при гипоксии описал врач из Вены Готвальд Шварц в 1909 г.. Он обратил внимание на то, что при наложении на кожу радиоактивной пластины лучевая реакция непосредственно под ней значительно снижена.
Исследователь объяснил свое наблюдение тем, что сдавление сосудов под тяжестью радиоаппликатора вызывает анемизацию подлежащей области и снижает эффект облучения. В последующем эта гипотеза была подтверждена в эксперименте с облучением культур бактерий, находящихся в гипоксическом состоянии, и в клинических наблюдениях. Так, в исследовании D. М. Brizel непосредственная эффективность радиотерапии и долговременная выживаемость больных с опухолями головы и шеи были в 2 раза ниже при напряжении кислорода в опухоли менее 10 мм рт. ст.. Было отмечено, что гипоксическое состояние опухоли коррелировало с содержанием гемоглобина в крови. В других исследованиях показано, что ткани опухоли находятся в более гипоксическом состоянии, чем окружающие нормальные ткани.
Обычно гипоксия опухоли возникает в тот момент, когда ее рост превышает способность локальной микрососудистой сети доставлять достаточное количество кислорода к опухолевым клеткам.
Оксигенация опухоли в основном определяется объемом кровотока, степенью развитости микроциркуляции и содержанием гемоглобина; таким образом, снижение количества гемоглобина крови может ухудшить оксигенацию опухоли.
Изучали влияние собственно анемии на чувствительность опухоли к радиотерапии. В одном из ретроспективных исследований прослежена долговременная выживаемость 889 больных с чешуйчато-клеточным раком головы и шеи, получавших радиотерапию. Пятилетняя выживаемость мужчин с содержанием гемоглобина более 130 г/л и женщин более 120 г/л составила 58,2 %, что контрастировало с уровнем этого показателя (28,4 %) для больных, у которых содержание гемоглобина оказалось ниже.
На модели фибросаркомы у мышей на опухолевые клетки, находящиеся в состоянии гипо- и нормоксии, воздействовали различными цитотоксичными препаратами. Оказалось, что клетки, находящиеся в состоянии гипоксии, были в 2—6 раз более резистентными к таким цитостатикам, как циклофосфамид, кармустин (BCNU), карбоплатин и мелфалан, чем опухолевые клетки, находящиеся в состоянии нормальной оксигенации. Клиническая значимость этих наблюдений неясна, однако данные, полученные в последние годы у больных раком шейки матки, подтверждают концепцию о способности гипоксии индуцировать селекцию клеток, резистентных к апоптозу, и то, что данный механизм определяет злокачественную прогрессию опухоли.

Анемия представляет собой патологическое состояние, для которого характерно снижение эритроцитов и/или концентрации гемоглобина в единице объема крови. Анемия не является самостоятельным заболеванием, это симптом, который характерен для самых разнообразных заболеваний, в том числе и для злокачественных опухолей.
Согласно статистике, данное состояние выявляется у каждого третьего онкологического пациента, а при прохождении химиотерапии — более чем в 90% случаев. Опасность анемии в онкологии заключается в том, что вместе с уменьшением уровня гемоглобина и эритроцитов, уменьшается и кислородная емкость крови. Этот фактор неблагоприятно сказывается на течении ракового процесса, снижает эффективность лечения и ухудшает дальнейший прогноз.
- Основные причины развития анемии у онкологических пациентов
- Как выявить анемию
- Как классифицируется анемия
- Методы лечения анемии
- Лечение анемии народными способами
Основные причины развития анемии у онкологических пациентов
Снижение уровня эритроцитов и гемоглобина может развиваться вследствие снижения их образования, ускоренного разрушения или в результате потери. Каждой из этих причин способствуют собственные факторы, которые рассмотрим подробнее:
- Недостаточная выработка форменных элементов крови и гемоглобина может развиваться при поражении костного мозга, недостатке железа в организме или некоторых витаминов (фолиевая кислота, витамин В12). Данные состояния могут быть напрямую связаны с напрямую с онкологическим заболеванием. Например, потеря железа может развиваться в результате постоянной рвоты, отсутствия аппетита и нарушения его всасывания в кишечнике, который поражен опухолевым процессом. Некоторые виды препаратов, которые назначают при злокачественных опухолях, подавляют рост не только раковых клеток, но и клеток крови, которые активно делятся. Также анемия может развиваться при непосредственном поражении костного мозга опухолевым процессом.
- Ускоренное разрушение эритроцитов отмечается при воздействии различных лекарственных препаратов и при аномальной активности иммунной системы. Разрушение эритроцитов непосредственно в сосудах называется внутрисосудистым гемолизом. Этот процесс протекает в норме после завершения жизненного цикла эритроцитов, который составляет 120 дней. Однако при воздействии различных факторов (прием антибиотиков, цитостатиков, присоединение вторичной инфекции и др.), этот срок значительно уменьшается, что и приводит к развитию анемии.
- Кровопотеря у онкологических пациентов может быть как острой, так и хронической. Первый вариант встречается при проведении хирургического лечения рака, а также при развитии внутренних кровотечений, которые являются частым осложнением основного заболевания. Развитие анемии при хронической кровопотере отмечается в тех случаях, когда имеется скрытый источник незначительного кровотечения. Например, при колоректальном раке кровь может выделяться с калом незаметно для пациента.
Установление точной причины анемии играет решающее значение при выборе метода лечения. Кроме того, врач учитывает степень тяжести, тип анемии, общее состояние пациента и другие параметры. Получить эту информацию можно на диагностическом этапе.
Как выявить анемию
Обследование традиционно начинается с опроса пациента и сбора анамнеза. Врач должен помнить, что не всегда анемия развивается вследствие основного заболевания. Возможны наследственные или любые другие причины, которые не связаны с опухолевым процессом. Также необходимо установить вид предшествующего противоопухолевого лечения, продолжительность и количество курсов, наименование препаратов, которые применялись. На следующем этапе врач проводит общий осмотр. Анемия может проявляться бледностью кожных покровов, слабостью, потерей аппетита, головокружением и другими симптомами. Очень часто эти проявления отмечаются при различных видах рака, который протекает без анемии, поэтому поставить диагноз исходя только из жалоб пациента невозможно.
Объективную информацию можно получить только при помощи лабораторных исследований. Анемия диагностируется по следующим анализам:
- Количество ретикулоцитов.
- Уровень железа сыворотки крови.
- Уровень белка трансферрина и ферритина.
- Уровень витамина В12 и фолиевой кислоты.
Отдельное внимание уделяется общему анализу крови. В нем определяется уровень гемоглобина, количество эритроцитов и гематокрит (отношение форменных элементов к жидкой составляющей крови). Также определяют средний объем эритроцита, среднее содержание гемоглобина в эритроците и среднее содержание гемоглобина во всей эритроцитарной массе.
При необходимости в программу комплексного обследования при анемии могут включаться и другие лабораторные анализы или специальные методы.
Как классифицируется анемия
В зависимости от значения цветового показателя, степени тяжести и механизма развития, анемия разделяется на несколько категорий. Цветовой показатель крови отражает степень насыщения эритроцитов гемоглобином. Его значение в норме колеблется от 0,85 до 1,05 единиц. Снижение показателя отмечается при гипохромной анемии, а повышение — при гиперхромной. Если цветовой показатель в норме, но уровень гемоглобина все равно низкий, то говорят о нормохромной анемии.
По степени тяжести, анемия разделяется на три группы, в зависимости от концентрации гемоглобина:
- При легкой степени анемии уровень гемоглобина не опускается ниже отметки в 90 г/л.
- При средней степени анемии показатель колеблется в пределах 90-70 г/л.
- Тяжелая анемия характеризуется падением гемоглобина ниже 70 г/л.
Классификация анемии по механизму развития наиболее обширна. Среди распространенных форм отмечаются:
- Железодефицитная анемия. Развивается в результате нарушения всасывания, усиленной потери или недостаточного поступления железа в организм.
- Гемолитическая анемия. Характеризуется разрушением эритроцитов в сосудистом русле или за его пределами. Наиболее частые причины — недостаточность специфических ферментов, аутоиммунные заболевания, воздействие лекарственных препаратов.
- Постгеморрагическая анемия. Данное состояние характерно для острой или хронической кровопотери
- Апластическая анемия. Характеризуется снижением уровня клеток-предшественников эритроцитов в костном мозге. Обычно отмечается снижение и других форменных элементов — тромбоцитов и лейкоцитов.
- В12-дефицитная анемия. При недостатке витамина В12 нарушается процесс образования эритроцитов, снижается их продолжительность жизни. Дефицит витамина может быть связан как с нарушением его всасывания в кишечнике, так и с недостаточным поступлением в организм.
В большинстве случаев определить точный вид анемии можно после нескольких лабораторных тестов, но иногда приходится применять более сложные методы диагностики, например, генетическое исследование. Понимание механизма развития анемии и получение максимально полной информации об изменениях в показателях крови являются важным компонентом эффективной терапии данного симптома.
Методы лечения анемии
Устранить анемию у онкологических пациентов можно тремя способами: переливание эритроцитарной массы, введение эритропоэтина, назначение препаратов, содержащих железо. В отдельных случаях может применяться комбинация этих методов.
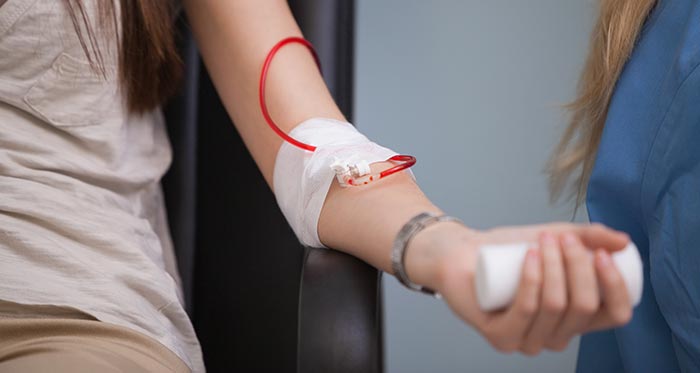
Переливание эритроцитарной массы является самым действенным методом, при помощи которого можно быстро восполнить дефицит эритроцитов, восстановить уровень гемоглобина и гематокрита. Однако без устранения причины анемии, этот способ даст лишь временный эффект. Поэтому переливание эритроцитарной массы не является альтернативой другим методикам и применяется только при наличии показаний. Одним из них является снижение уровня гемоглобина ниже 90 г/л. Переливание проводят при развитии у пациента характерных признаков анемии, среди которых отмечаются:
- Головокружение.
- Потеря сознания.
- Тахикардия.
- Быстрая утомляемость.
- Боль в груди.
- Одышка.
Данный метод лечения анемии также может применяться у пациентов, которые прошли курс химиотерапии или лучевой терапии и у которых отмечается быстрое снижение уровня гемоглобина или эритроцитов.
Стимуляторы эритропоэза при анемии увеличивают концентрацию гемоглобина и эритроцитов за счет усиления их образования в костном мозге. При сочетании с гемотрансфузиями, данный метод показывает очень хорошие результаты, но при этом имеет и ряд недостатков, которые касаются осложнений. В частности, применение стимуляторов эритропоэза для лечения анемии повышает риск развития тромботических осложнений, который и так является высоким у онкологических пациентов. По данным, полученным в ходе нескольких научных исследований, этот риск увеличивается в 1.4-1.7 раз.
В последнее время обсуждается вопрос о влиянии стимуляторов эритропоэза на выживаемость онкологических пациентов. В частности, специалисты установили, что применение препаратов данной группы при лечении анемии у пациентов с распространенным опухолевым процессом головы и шеи, шейки матки, молочной железы и других диагнозах снижает продолжительность жизни на 10-17%. В связи с этим специалисты предлагают придерживаться следующих правил:
- Если уровень гемоглобина составляет менее 100 г/л и пациент при этом проходит лечение химиопрепаратами, то стимуляторы эритропоэза могут назначаться с целью коррекции анемии и профилактики дальнейшего снижения показателей.
- Если уровень гемоглобина падает до 100 г/л и ниже, но химиотерапия при этом не проводится, то применять стимуляторы эритропоэза не рекомендуется ввиду повышенного риска развития осложнений и снижения продолжительности жизни.
- Во всех остальных случаях применять стимуляторы эритропоэза для лечения анемии у онкологических пациентов следует с осторожностью.
Также на протяжении всего времени лечения важно контролировать динамику лабораторных показателей и при увеличении уровня гемоглобина постепенно снижать дозировку стимуляторов эритропоэза.
Препараты железа применяются с целью лечения железодефицитных анемий, которые выявляются у 30-60% онкологический больных. При этом снижение уровня железа может быть связано как с самим опухолевым процессом или проводимым лечением, так и с другими факторами. Например, при назначении стимуляторов эритропоэза, существующего запаса железа в организме становится недостаточно для того, чтобы покрыть потребность, которая возникает в результате активного синтеза гемоглобина в костном мозге.

Для лечения анемии могут применяться как внутривенные, так и пероральные препараты. Второй вариант более удобен для пациента, так как таблетки проще принимать, но при этом данная форма действует медленнее и чаще приводит к осложнениям со стороны ЖКТ. Внутривенное введение позволяет добиться быстрого эффекта, что актуально при проведении химиотерапии.
Таким образом, для лечения анемии современная онкология может предложить различные методы, которые воздействуют на механизмы развития данного симптома. Точный план терапии подбирается индивидуально для каждого пациента, с учетом лабораторных показателей крови, особенностей лечения основного заболевания и других параметров.
Лечение анемии народными способами
Некоторые пациенты по разным причинам отказываются от приема описанных выше препаратов и обращаются к народной медицине. Безусловно, некоторые растения или продукты могут оказывать стимулирующее действие на систему кроветворения. Однако, учитывая основной диагноз и тяжесть анемии, этого действия крайне недостаточно для восстановления уровня гемоглобина и кислородной функции крови. В результате снижается эффективность противоопухолевого лечения, ухудшается прогноз и существенно повышается риск неблагоприятного исхода. Устранить выраженную анемию в домашних условиях при помощи народных методов невозможно. Этим должны заниматься врачи соответствующего профиля, в распоряжении которых имеются современные лекарственные препараты.
Анемия головного мозга и его оболочек (Anemia cerebri et meningum) – заболевание характеризующееся понижением притока крови к головному мозгу, в результате чего в организме развивается расстройство функций головного мозга и кислородное голодание мозговой ткани.
Болеют животные всех видов, но наиболее часто лошади.
Этиология. Анемия головного мозга и его оболочек чаще всего у животных протекает как вторичная болезнь, при больших кровопотерях, резко выраженной сердечно — сосудистой недостаточности (при полной атриовентрикулярной блокаде сердца, остром расширении сердца, артериальной гипотонии), сдавливании сбруей области сонных артерий или при внезапном оттоке большого количества крови к внутренним органам, например после быстрого выпускания транссудата при водянке или бродящих газов троакаром при тимпании рубца и вздутие слепой кишки у лошадей, при падении внутрибрюшного давления при скоро протекающих родах. Анемия головного мозга у животных может возникать при понижении тонуса сосудов и снижении кровяного давления при травматическом шоке, при атеросклерозе и артериосклерозе мозговых сосудов, острых инфекционных болезнях и интоксикациях.
Хроническая анемия головного мозга и оболочек у животных наблюдается при затруднение тока крови в черепномозговой полости вследствие повышения внутричерепного давления (симптоматическая анемия при гидроцефалии, опухолях головного мозга), при миокардиодистрофии, кардиофиброзе, декомпенсированных пороках сердца, при гипопластической анемии, инфекционной анемии, лейкемии, нарушениях обмена веществ, авитаминозах.
Патогенез. В результате уменьшения притока крови к головному мозгу происходит нарушение питания нервной ткани. Клетки головного мозга нуждаются в непрерывном поступлении глюкозы и кислорода. При недостаточном поступлении глюкозы и кислорода, в результате снижения запасов макроэргических соединений, происходит накопление в нервных клетках недоокисленных продуктов обмена: молочная кислота, углекислота, неорганический фосфат, гликоген и др., ослабление в головном мозге процессов возбуждения и торможения, что ведет к извращению нервно-рефлекторной деятельности, ослаблению у животных мышечного тонуса, расстройству секреции и моторики желудка и кишечника, нарушениям легочного и тканевого газообмена.
Для хронической анемии головного мозга характерно медленное нарастание нарушений функции коры и подкорковых центров: пониженная реакция на окружающее, вялость, апатия, сопорозное или ступорозное состояние, понижение мышечного тонуса, расстройство координации движений, фибриллярные сокращения мышц. У крупного рогатого скота наблюдается атония преджелудков и ослабление перистальтики кишечника.
При острой и хронической анемии головного мозга практически всегда отмечаются симптомы сердечно – сосудистой недостаточности: бледность с синюшным оттенком видимых слизистых оболочек, пульс малого наполнения, аритмии, глухость сердечных тонов, снижение максимального артериального давления и повышение минимального, повышение венозного давления.
Продолжительность течения болезни зависит от причин вызвавших ее. В легких случаях больное животное быстро выздоравливает, но возникшее угнетение и вялость, атония преджелудков и снижение продуктивности могут оставаться еще продолжительное время.
Прогноз осторожный. Исход болезни у животного зависит от своевременности оказания лечебной помощи и характера этиологических факторов. Прогрессирующая слабость, исчезновение у животного реакции зрачка на свет, появление судорог, неправильного слабого дыхания и ухудшение качества пульса для ветспециалиста должен служить сигналом неблагоприятного прогноза.
Патологоанатомические изменения. Сосуды мозговых оболочек слабо наполнены кровью, сосудистые сплетения плохо различимы, сами оболочки бледные. Головной мозг бледный, граница между серым и белым веществом коры головного мозга сглажена.
Диагноз ставится на основании анамнеза и характерных клинических симптомов расстройства функции центральной нервной системы. При офтальмоскопии устанавливают бледность зрительного сосочка и анемию глазного дна. При хроническом течении учитывают результаты гематологических исследований (олигоцитемия, гипохромемия, обнаружение кровепаразитов).
Дифференциальный диагноз. Дифференцируем от острой постгеморрагической анемии, миоглобинурии, гипомагнемии, коматозного состояния при различных заболеваниях.
Прогноз в острых случаях болезни, при условии своевременного оказания лечебной помощи благоприятный. При хронической анемии прогноз от сомнительного до неблагоприятного.
Лечение начинают с предоставления животному покоя, голове придают как можно более низкое положение. Дальнейшее лечение проводят в зависимости от причин, вызвавших анемию мозга. При кровотечении принимают меры к немедленной его остановке, внутривенно вводят 10% раствор кальция хлорида, а для восполнения объема крови внутривенно вводят физиологический раствор или производя переливание гомогенной крови. При анемиях, вызванных перераспределением крови, проводят энергичное растирание кожи жгутами, втирают в кожу боковых поверхностей грудной клетки или живота скипидар или горчичный спирт, делают ингаляцию нашатырного спирта, втирают нашатырный спирт около ушей, следят за работой сердца и дыхания. При ослаблении работы сердца животному вводят кофеин, камфару, кордиамин, коргликон, назначают ингаляцию кислорода. Коргликон делают животным внутривенно в виде 0,06%-ного раствора в следующих дозах: лошадям 4-5мл; коровам 3-8мл; собакам 0,5 -1мл; коргликон вводится на 40% растворе глюкозы. Кордиамин вводят подкожно — лошадям и кр.р.ск. 10-20мл; свиньям 1-4мл; собакам 0,5-2мл. В более тяжелых случаях для устранения апоплексии головного мозга применяют эуфиллин и другие сосудосуживающие лекарственные средства. При хроническом течении заболевания с целью улучшения работы сердца и процессов метаболизма в головном мозге назначают курс сердечных глюкозидов, витаминов группы В, церебролизин, аминолон, пирацетом. В том случае, когда причиной анемии головного мозга является опухоль, у высокоценных животных проводят хирургическую операцию. Больных животных необходимо содержать в хорошо вентилируемых помещениях (для частичной компенсации кислородом недостаточного кровообращения) и обеспечивают полноценным по протеину и витаминному составу рационом. Выздоровевших животных втягивают в работу постепенно.
Профилактика. Профилактика анемии мозга заключается в ранней диагностике и лечении заболеваний, которые приводят к сосудистой недостаточности (постгеморрагическая анемия, пороки сердца, сахарный диабет, кардиомиопатия). Владельцы животных должны соблюдать правила подгонки сбруи у рабочих животных (хомута, ярма и др.), ошейника у собак, не допускать чрезмерной эксплуатации животных. Проводить своевременное лечение при кровопотерях. Соблюдать правила при проколе рубца (тимпания), медленно выпускать газы и жидкости при пункциях перитонеальной полости.
Анемия при опухолях (онкологических заболеваниях) — причины, механизмы развития
Анемия нередко осложняет течение различных новообразований. До 40 % больных со злокачественными лимфомами и более половины больных с множественной миеломой уже к моменту постановки диагноза имеют выраженную анемизацию. У 1/4 больных с миеломой содержание гемоглобина не превышает 80 г/л, а количество больных с анемией среди больных с лимфомами по окончании лечения увеличивается до 70 %. Считается, что эта проблема менее значима при солидных опухолях.
Тем не менее анализ данных донорских регистров США свидетельствует, что до 50— 60 % больных с опухолями гинекологической сферы, мочеполовых органов и легкого получали заместительные гемотрансфузии в период проведения химиотерапии.
Более половины из 7000 больных с анемией, включенных в контролируемые популяционные исследования по применению эритропоэтина у больных с неоплазиями, имели солидные опухоли.
В 2001 г. проведено проспективное изучение частоты анемии у больных с опухолевыми заболеваниями в Европе (ECAS). Содержание гемоглобина было сниженным у 31 % первичных больных, не получавших лечения, и у 42 % больных, которым проводили химио- или радиотерапию.
Если у больных не было анемии на момент постановки диагноза, то в большинстве случаев (62 %) она развивалась в процессе лечения. Анемия возникала у 63 % больных, получавших химиотерапию (у 75 % после режимов, содержащих препараты платины, и у 54 % после прочих), у 42 % больных после сочетанного применения химио- и радиотерапии и у 20 % больных только после лучевого воздействия. Лишь 40 % больных с анемией, выявленной исходно или на протяжении лечения, получали заместительные гемотрансфузии или эритропоэтин.

При опухолевых заболеваниях патогенез анемии многообразен. Основные причины — кровотечение, дефицит витаминов и железа, аутоиммунный гемолиз, метастазирование в костный мозг, токсичность цитостатиков и др. Анемия нередко развивается у больных, не имеющих для этого видимых причин.
При исследовании качества жизни больных с опухолевыми заболеваниями слабость выделена как одна из наиболее распространенных жалоб. В частности, слабость осложняет проведение химиотерапии у 76 % больных, тошнота — у 54 % и боль у 24 % больных. В генезе слабости могут играть роль такие факторы, как нарушение нейромышечной проводимости, повышение уровня метаболизма белков, снижение питания и аффективные расстройства (депрессия). В то же время при многовариантном статистическом анализе одним из самых значимых независимых прогностических факторов слабости была анемия. Современные данные свидетельствуют о появлении слабости, снижающей показатели качества жизни, при содержании гемоглобина менее 120 г/л. В контролируемых исследованиях по лечению анемии максимальное снижение слабости и прирост показателей качества жизни наблюдались при повышении содержания гемоглобина до 120 г/л.
Слабость, снижение физической и социальной активности часто недооцениваются врачами, которые не склонны считать эти проблемы важными по сравнению с болью, рвотой или инфекцией. В современных работах по выявлению значимости основных жалоб больных с опухолевыми заболеваниями слабость и социальная дезадаптация занимают лидирующее место. В одном из исследований на вопрос, что следует лечить в первую очередь: слабость или боль, большинство больных выбрали слабость. На тот же самый вопрос 95 % врачей ответили противоположным образом.
Анемия и как следствие тканевая гипоксия могут сказаться на эффективности лекарственного и лучевого противоопухолевого лечения. Противоопухолевый эффект радиации связан с образованием свободных радикалов, которые взаимодействуют с основаниями ДНК в присутствии молекулярного кислорода, что останавливает клеточную пролиферацию и вызывает гибель клеток. Недостаток кислорода замедляет этот процесс. В клетке, находящейся в состоянии гипоксии, свободные радикалы не фиксируются к ДНК и мембранам и, таким образом, смерть клетки может не наступить. Впервые снижение эффекта облучения при гипоксии описал врач из Вены Готвальд Шварц в 1909 г.. Он обратил внимание на то, что при наложении на кожу радиоактивной пластины лучевая реакция непосредственно под ней значительно снижена.
Исследователь объяснил свое наблюдение тем, что сдавление сосудов под тяжестью радиоаппликатора вызывает анемизацию подлежащей области и снижает эффект облучения. В последующем эта гипотеза была подтверждена в эксперименте с облучением культур бактерий, находящихся в гипоксическом состоянии, и в клинических наблюдениях. Так, в исследовании D. М. Brizel непосредственная эффективность радиотерапии и долговременная выживаемость больных с опухолями головы и шеи были в 2 раза ниже при напряжении кислорода в опухоли менее 10 мм рт. ст.. Было отмечено, что гипоксическое состояние опухоли коррелировало с содержанием гемоглобина в крови. В других исследованиях показано, что ткани опухоли находятся в более гипоксическом состоянии, чем окружающие нормальные ткани.
Обычно гипоксия опухоли возникает в тот момент, когда ее рост превышает способность локальной микрососудистой сети доставлять достаточное количество кислорода к опухолевым клеткам.
Оксигенация опухоли в основном определяется объемом кровотока, степенью развитости микроциркуляции и содержанием гемоглобина; таким образом, снижение количества гемоглобина крови может ухудшить оксигенацию опухоли.
Изучали влияние собственно анемии на чувствительность опухоли к радиотерапии. В одном из ретроспективных исследований прослежена долговременная выживаемость 889 больных с чешуйчато-клеточным раком головы и шеи, получавших радиотерапию. Пятилетняя выживаемость мужчин с содержанием гемоглобина более 130 г/л и женщин более 120 г/л составила 58,2 %, что контрастировало с уровнем этого показателя (28,4 %) для больных, у которых содержание гемоглобина оказалось ниже.
На модели фибросаркомы у мышей на опухолевые клетки, находящиеся в состоянии гипо- и нормоксии, воздействовали различными цитотоксичными препаратами. Оказалось, что клетки, находящиеся в состоянии гипоксии, были в 2—6 раз более резистентными к таким цитостатикам, как циклофосфамид, кармустин (BCNU), карбоплатин и мелфалан, чем опухолевые клетки, находящиеся в состоянии нормальной оксигенации. Клиническая значимость этих наблюдений неясна, однако данные, полученные в последние годы у больных раком шейки матки, подтверждают концепцию о способности гипоксии индуцировать селекцию клеток, резистентных к апоптозу, и то, что данный механизм определяет злокачественную прогрессию опухоли.
Далее рекомендуем для ознакомления следующие статьи:

Анемия представляет собой патологическое состояние, для которого характерно снижение эритроцитов и/или концентрации гемоглобина в единице объема крови. Анемия не является самостоятельным заболеванием, это симптом, который характерен для самых разнообразных заболеваний, в том числе и для злокачественных опухолей.
Согласно статистике, данное состояние выявляется у каждого третьего онкологического пациента, а при прохождении химиотерапии — более чем в 90% случаев. Опасность анемии в онкологии заключается в том, что вместе с уменьшением уровня гемоглобина и эритроцитов, уменьшается и кислородная емкость крови. Этот фактор неблагоприятно сказывается на течении ракового процесса, снижает эффективность лечения и ухудшает дальнейший прогноз.
Основные причины развития анемии у онкологических пациентов
Снижение уровня эритроцитов и гемоглобина может развиваться вследствие снижения их образования, ускоренного разрушения или в результате потери. Каждой из этих причин способствуют собственные факторы, которые рассмотрим подробнее:
- Недостаточная выработка форменных элементов крови и гемоглобина может развиваться при поражении костного мозга, недостатке железа в организме или некоторых витаминов (фолиевая кислота, витамин В12). Данные состояния могут быть напрямую связаны с напрямую с онкологическим заболеванием. Например, потеря железа может развиваться в результате постоянной рвоты, отсутствия аппетита и нарушения его всасывания в кишечнике, который поражен опухолевым процессом. Некоторые виды препаратов, которые назначают при злокачественных опухолях, подавляют рост не только раковых клеток, но и клеток крови, которые активно делятся. Также анемия может развиваться при непосредственном поражении костного мозга опухолевым процессом.
- Ускоренное разрушение эритроцитов отмечается при воздействии различных лекарственных препаратов и при аномальной активности иммунной системы. Разрушение эритроцитов непосредственно в сосудах называется внутрисосудистым гемолизом. Этот процесс протекает в норме после завершения жизненного цикла эритроцитов, который составляет 120 дней. Однако при воздействии различных факторов (прием антибиотиков, цитостатиков, присоединение вторичной инфекции и др.), этот срок значительно уменьшается, что и приводит к развитию анемии.
- Кровопотеря у онкологических пациентов может быть как острой, так и хронической. Первый вариант встречается при проведении хирургического лечения рака, а также при развитии внутренних кровотечений, которые являются частым осложнением основного заболевания. Развитие анемии при хронической кровопотере отмечается в тех случаях, когда имеется скрытый источник незначительного кровотечения. Например, при колоректальном раке кровь может выделяться с калом незаметно для пациента.
Установление точной причины анемии играет решающее значение при выборе метода лечения. Кроме того, врач учитывает степень тяжести, тип анемии, общее состояние пациента и другие параметры. Получить эту информацию можно на диагностическом этапе.
Запись
на консультацию
круглосуточно
Как выявить анемию
Обследование традиционно начинается с опроса пациента и сбора анамнеза. Врач должен помнить, что не всегда анемия развивается вследствие основного заболевания. Возможны наследственные или любые другие причины, которые не связаны с опухолевым процессом. Также необходимо установить вид предшествующего противоопухолевого лечения, продолжительность и количество курсов, наименование препаратов, которые применялись. На следующем этапе врач проводит общий осмотр. Анемия может проявляться бледностью кожных покровов, слабостью, потерей аппетита, головокружением и другими симптомами. Очень часто эти проявления отмечаются при различных видах рака, который протекает без анемии, поэтому поставить диагноз исходя только из жалоб пациента невозможно.
Объективную информацию можно получить только при помощи лабораторных исследований. Анемия диагностируется по следующим анализам:
- Количество ретикулоцитов.
- Уровень железа сыворотки крови.
- Уровень белка трансферрина и ферритина.
- Уровень витамина В12 и фолиевой кислоты.
Отдельное внимание уделяется общему анализу крови. В нем определяется уровень гемоглобина, количество эритроцитов и гематокрит (отношение форменных элементов к жидкой составляющей крови). Также определяют средний объем эритроцита, среднее содержание гемоглобина в эритроците и среднее содержание гемоглобина во всей эритроцитарной массе.
При необходимости в программу комплексного обследования при анемии могут включаться и другие лабораторные анализы или специальные методы.
Как классифицируется анемия
В зависимости от значения цветового показателя, степени тяжести и механизма развития, анемия разделяется на несколько категорий. Цветовой показатель крови отражает степень насыщения эритроцитов гемоглобином. Его значение в норме колеблется от 0,85 до 1,05 единиц. Снижение показателя отмечается при гипохромной анемии, а повышение — при гиперхромной. Если цветовой показатель в норме, но уровень гемоглобина все равно низкий, то говорят о нормохромной анемии.
По степени тяжести, анемия разделяется на три группы, в зависимости от концентрации гемоглобина:
- При легкой степени анемии уровень гемоглобина не опускается ниже отметки в 90 г/л.
- При средней степени анемии показатель колеблется в пределах 90-70 г/л.
- Тяжелая анемия характеризуется падением гемоглобина ниже 70 г/л.
Классификация анемии по механизму развития наиболее обширна. Среди распространенных форм отмечаются:
- Железодефицитная анемия. Развивается в результате нарушения всасывания, усиленной потери или недостаточного поступления железа в организм.
- Гемолитическая анемия. Характеризуется разрушением эритроцитов в сосудистом русле или за его пределами. Наиболее частые причины — недостаточность специфических ферментов, аутоиммунные заболевания, воздействие лекарственных препаратов.
- Постгеморрагическая анемия. Данное состояние характерно для острой или хронической кровопотери
- Апластическая анемия. Характеризуется снижением уровня клеток-предшественников эритроцитов в костном мозге. Обычно отмечается снижение и других форменных элементов — тромбоцитов и лейкоцитов.
- В12-дефицитная анемия. При недостатке витамина В12 нарушается процесс образования эритроцитов, снижается их продолжительность жизни. Дефицит витамина может быть связан как с нарушением его всасывания в кишечнике, так и с недостаточным поступлением в организм.
В большинстве случаев определить точный вид анемии можно после нескольких лабораторных тестов, но иногда приходится применять более сложные методы диагностики, например, генетическое исследование. Понимание механизма развития анемии и получение максимально полной информации об изменениях в показателях крови являются важным компонентом эффективной терапии данного симптома.
Методы лечения анемии
Устранить анемию у онкологических пациентов можно тремя способами: переливание эритроцитарной массы, введение эритропоэтина, назначение препаратов, содержащих железо. В отдельных случаях может применяться комбинация этих методов.

Переливание эритроцитарной массы является самым действенным методом, при помощи которого можно быстро восполнить дефицит эритроцитов, восстановить уровень гемоглобина и гематокрита. Однако без устранения причины анемии, этот способ даст лишь временный эффект. Поэтому переливание эритроцитарной массы не является альтернативой другим методикам и применяется только при наличии показаний. Одним из них является снижение уровня гемоглобина ниже 90 г/л. Переливание проводят при развитии у пациента характерных признаков анемии, среди которых отмечаются:
- Головокружение.
- Потеря сознания.
- Тахикардия.
- Быстрая утомляемость.
- Боль в груди.
- Одышка.
Данный метод лечения анемии также может применяться у пациентов, которые прошли курс химиотерапии или лучевой терапии и у которых отмечается быстрое снижение уровня гемоглобина или эритроцитов.
Стимуляторы эритропоэза при анемии увеличивают концентрацию гемоглобина и эритроцитов за счет усиления их образования в костном мозге. При сочетании с гемотрансфузиями, данный метод показывает очень хорошие результаты, но при этом имеет и ряд недостатков, которые касаются осложнений. В частности, применение стимуляторов эритропоэза для лечения анемии повышает риск развития тромботических осложнений, который и так является высоким у онкологических пациентов. По данным, полученным в ходе нескольких научных исследований, этот риск увеличивается в 1.4-1.7 раз.
В последнее время обсуждается вопрос о влиянии стимуляторов эритропоэза на выживаемость онкологических пациентов. В частности, специалисты установили, что применение препаратов данной группы при лечении анемии у пациентов с распространенным опухолевым процессом головы и шеи, шейки матки, молочной железы и других диагнозах снижает продолжительность жизни на 10-17%. В связи с этим специалисты предлагают придерживаться следующих правил:
- Если уровень гемоглобина составляет менее 100 г/л и пациент при этом проходит лечение химиопрепаратами, то стимуляторы эритропоэза могут назначаться с целью коррекции анемии и профилактики дальнейшего снижения показателей.
- Если уровень гемоглобина падает до 100 г/л и ниже, но химиотерапия при этом не проводится, то применять стимуляторы эритропоэза не рекомендуется ввиду повышенного риска развития осложнений и снижения продолжительности жизни.
- Во всех остальных случаях применять стимуляторы эритропоэза для лечения анемии у онкологических пациентов следует с осторожностью.
Также на протяжении всего времени лечения важно контролировать динамику лабораторных показателей и при увеличении уровня гемоглобина постепенно снижать дозировку стимуляторов эритропоэза.
Препараты железа применяются с целью лечения железодефицитных анемий, которые выявляются у 30-60% онкологический больных. При этом снижение уровня железа может быть связано как с самим опухолевым процессом или проводимым лечением, так и с другими факторами. Например, при назначении стимуляторов эритропоэза, существующего запаса железа в организме становится недостаточно для того, чтобы покрыть потребность, которая возникает в результате активного синтеза гемоглобина в костном мозге.

Для лечения анемии могут применяться как внутривенные, так и пероральные препараты. Второй вариант более удобен для пациента, так как таблетки проще принимать, но при этом данная форма действует медленнее и чаще приводит к осложнениям со стороны ЖКТ. Внутривенное введение позволяет добиться быстрого эффекта, что актуально при проведении химиотерапии.
Таким образом, для лечения анемии современная онкология может предложить различные методы, которые воздействуют на механизмы развития данного симптома. Точный план терапии подбирается индивидуально для каждого пациента, с учетом лабораторных показателей крови, особенностей лечения основного заболевания и других параметров.
Лечение анемии народными способами
Некоторые пациенты по разным причинам отказываются от приема описанных выше препаратов и обращаются к народной медицине. Безусловно, некоторые растения или продукты могут оказывать стимулирующее действие на систему кроветворения. Однако, учитывая основной диагноз и тяжесть анемии, этого действия крайне недостаточно для восстановления уровня гемоглобина и кислородной функции крови. В результате снижается эффективность противоопухолевого лечения, ухудшается прогноз и существенно повышается риск неблагоприятного исхода. Устранить выраженную анемию в домашних условиях при помощи народных методов невозможно. Этим должны заниматься врачи соответствующего профиля, в распоряжении которых имеются современные лекарственные препараты.
Запись
на консультацию
круглосуточно
Читайте также:

